Introducción
La disminución de la tasa de fecundidad y la mayor esperanza de vida están alterando el panorama demográfico de los países en todo el mundo, lo que ha traído como consecuencia que la población de más de 60 años sea el segmento que más rápidamente esté creciendo. Además de recomendar la adopción de prácticas de vida saludables, la Organización Mundial de la Salud (OMS) propone como clave ante esta disyuntiva garantizar el acceso a la atención primaria y el “envejecimiento saludable”, definido como el proceso de fomentar y mantener la capacidad funcional que permite el bienestar en la vejez.1,2 Específicamente en Cuba, según su Oficina Nacional de Estadísticas, para los próximos años se prevé un aumento en la población mayor de 60 años que llegará a alcanzar el 30 % en el 2030.3
En los adultos mayores se presentan con frecuencia lesiones del tejido óseo, entre las que se reiteran las enfermedades dentales que conducen a la disfunción masticatoria y los padecimientos crónicos como la osteoporosis, caracterizada por la disminución de la resistencia mecánica del hueso debido a la pérdida de masa ósea, con el consiguiente aumento de la fragilidad y propensión a fractura. Estos problemas, sumados a que el resto de la población no está exenta de sufrir pérdida de tejido óseo por diferentes causas, hacen que aumente la demanda de materiales y tecnologías destinadas a su tratamiento.
En la actualidad son diversos los biomateriales que pueden utilizarse para la reparación o sustitución del tejido óseo. Entendiéndose como biomaterial cualquier substancia (no medicamento) o combinación de sustancias de origen natural o sintético, que puede ser usada por cualquier periodo de tiempo, como un todo o como parte de un sistema que trate, mejore o remplace cualquier tejido, órgano o función del cuerpo.4
Entre los materiales más utilizados para la reparación o sustitución de huesos pueden mencionarse los metales y sus aleaciones (verbi gratia, titanio, tántalo, magnesio, hierro, cinc y sus aleaciones),5,6,7,8,9,10 las cerámicas de fosfatos de calcio, zirconia y alúmina11,12 y los polímeros sintéticos biodegradables, tales como poliácido glicólico, poliácido láctico, poli((-caprolactona) y sus copolímeros.13,14,15 Actualmente se hace mayor énfasis en el desarrollo de biomateriales compuestos (composites) basados en polímeros reforzados con fosfatos de calcio; ortofosfatos de calcio reforzados con vidrios, carbón o metales; concretos; materiales compuestos nanoestructurados, cementos óseos inyectables, con propiedades biológicas y mecánicas muy parecidas a las del órgano natural.16
Por otro lado, el desarrollo de la ingeniería de tejidos, área científica que integra los principios de la ingeniería, la biología celular y la medicina, y que se dedica a la regeneración de tejidos biológicos -con la ayuda de estructuras soportes con células cultivadas (estrategia de cultivo, in vitro o matrices celulares) o como medio para guiar células nativas (estrategia conductiva, in vivo o matrices acelulares)- ha permitido mantener o reparar la función de órganos dañados, incluidos los huesos.17,18
El desarrollo de biomateriales requiere de trabajo multidisciplinario e interdisciplinario y del logro de un vínculo directo entre la investigación, la producción y la aplicación clínica de los productos, de manera que se minimicen las barreras de tipo científico, tecnológico, económico, ético-sociales y normativo que pudieran existir.19
En particular, la gestión tecnológica como proceso para el desarrollo incluye como primeras fases: el inventario y recopilación de la información científica accesible a nivel mundial, estado de alerta sobre la evolución de las nuevas tecnologías, la sistematización de la revisión de las fuentes de información y la identificación del posible impacto de estas en la evolución tecnológica para evaluar la competitividad de la empresa en desarrollo y su potencial.20 En un estudio realizado con anterioridad se determinaron las tendencias que, a modo general, están influyendo o pueden influir en el desarrollo de biomateriales para la reparación ósea21 y se detectó el gran potencial que pueden llegar a ofrecer los métodos basados en el uso del campo electromagnético.a 22,23
El presente trabajo tiene como objetivo analizar la información que se ha generado sobre el desarrollo de biomateriales compuestos para la reparación ósea, con énfasis en la identificación de las tecnologías emergentes basadas en el uso del campo electromagnético, sus aplicaciones y potencialidades.
Métodos
Se consultaron trabajos científicos divulgados en libros, revistas nacionales y extranjeras, patentes, tesis de maestría y doctorado. Se seleccionó la información según su pertinencia y actualidad y, finalmente, se organizó atendiendo al tipo de tecnología utilizada en la obtención de los materiales compuestos. De la documentación seleccionada el 80 % corresponde a la presente década.
En cada caso se hace una breve explicación de la tecnología (fundamentos, ventajas y desventajas), se citan libros y revisiones generales y luego se discuten los resultados de su aplicación a la obtención de los biomateriales compuestos para la reparación ósea, lo cual da fundamento a la clasificación establecida.
Aunque existen numerosos libros y artículos que estudian la interacción del campo electromagnético con los sistemas vivos y la utilización de técnicas basadas en este campo con fines terapéuticos o de diagnóstico,24,25,26 no se debe perder de vista que este trabajo trata de la aplicación de algunas de estas técnicas a la obtención de biomateriales compuestos que se pueden emplear en la restauración ósea.
Análisis e integración de la información
Tecnologías utilizadas para la obtención de biomateriales compuestos
Los métodos identificados dentro de las tendencias actuales van desde la clásica electrodeposición química -ya sea por electrólisis o electroforesis- hasta los métodos menos convencionales y emergentes, como la síntesis electroforética in situ, la electroporación, el electrohilado, el control magnético distal y la bioestimulación. No se tuvieron en cuenta en esta revisión los métodos que se basan en la radiación electromagnética ionizante.
Electroobtención de biomateriales compuestos por deposición y síntesis
El gran interés actual en el desarrollo de las técnicas de electrodeposición: electroquímica (ELD) o electroforética (EPD), se basa en su alta versatilidad, estricto control de los parámetros de síntesis, trabajo a bajas temperaturas, rápidas velocidades de recubrimiento, facultad de utilización de sustratos muy diferentes y de formas complejas, alto potencial de escalado, bajo costo y la posibilidad de formar multicapas simples en muchos sistemas diferentes.27,28
La deposición electrolítica es un proceso mediante el cual se logra la producción de especies químicas en una superficie a través de una reacción electroquímica. Las reacciones catódicas o anódicas pueden estar involucradas en la electrodeposición, aunque la mayoría de procesos prácticos implican reacciones catódicas.29 Basado en este método se han depositado metales, aleaciones, polímeros y actualmente se ha ampliado a materiales compuestos mediante la incorporación de partículas (cerámicas, poliméricas o metálicas) dispersas en la disolución de especies iónicas.
La deposición electroforética, por su parte, es un método en el cual, partículas cargadas, dispersadas o suspendidas en un medio líquido, son atraídas y depositadas sobre un sustrato conductivo de carga opuesta como resultado de la aplicación de un campo eléctrico, y puede ser catódica o anódica dependiendo de la carga de las partículas que se mueven y de cuál sea el electrodo en el que ocurra la deposición.30
La ELD presenta alta conductividad y los recubrimientos son uniformes a escala nanométrica, mientras que la EPD requiere baja conductividad, la uniformidad de los depósitos depende del tamaño de las partículas y la velocidad de deposición es mayor que en el otro método.
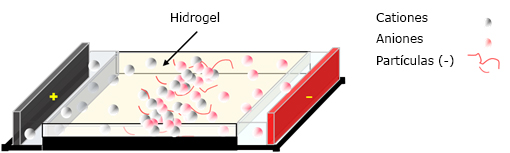
Un tercer mecanismo es el método propiamente electroforético, en el que se realiza una síntesis in situ del material compuesto en el interior del hidrogel situado entre los dos electrodos (Fig. 1).
Un ejemplo de ELD es la obtención de recubrimientos de fosfatos de calcio tipo brushita e hidroxiapatita (HA) sobre acero inoxidable (316L) a partir de una disolución de Ca(NO3)2·4H2O y NH4H2PO4 mediante una reacción de desplazamiento (síntesis) en la que el Zn actúa como ánodo de sacrificio. Se encontró que la temperatura y el tiempo de deposición afecta la morfología, estructura y composición del recubrimiento. En capas de brushita, se obtuvieron cristales de HA a 50 ºC durante todos los tiempos de deposición utilizados. El recubrimiento aumenta la resistencia a la corrosión y biocompatibilidad del biomaterial.31
El magnesio, como biomaterial para la restauración ósea, gana adeptos por sus propiedades físicas y mecánicas y por ser biodegradable, a pesar de que se degrada por corrosión en poco tiempo y el proceso genera hidrógeno. Para disminuir la corrosión se ha realizado la deposición de recubrimientos bioactivos con fosfatos de calcio, usando como electrodo de trabajo un cilindro de magnesio puro y una placa de acero inoxidable como contraelectrodo. La disolución electrolítica fue preparada con Ca(NO3)2·4H2O, NH4H2PO4 y H2O2 y se ajustó el pH a 4,5. Se aplicaron potenciales catódicos de -5 y -3 V. Los resultados mostraron que la variación de potencial llevó a la formación de recubrimientos con la misma composición química, pero con morfologías muy diferentes.32
Recubrimientos de HA se han realizado sobre sustratos poliméricos, en este caso, se obtuvo un andamiob fibroso compuesto a base de poli-(l-ácido láctico) / poli-(ε-caprolactona) (PLLA/PCL) recubierto con HA. Se utilizó un sistema de tres electrodos: el andamio poroso de PLLA/PCL se fijó sobre una placa de acero inoxidable que servía de cátodo, como ánodo un electrodo de platino y uno de calomel saturado se seleccionó como el electrodo de referencia. La disolución electrolítica contenía NH4H2PO4 y Ca(NO3)2 a pH de 4,7.33
Utilizando una disolución electrolítica de HA en polvo y como electrodo de trabajo los sustratos a recubrir que actúan como cátodo (ej. aleaciones de Ti6AL4V y AZ31 a base de magnesio) se obtuvieron recubrimientos diferenciados controlando, la intensidad de la corriente, la diferencia de potencial y el tiempo de trabajo.34
El uso de la EPD ha ido incrementándose en la última década debido a su versatilidad para combinar de manera efectiva diferentes materiales en formas y estructuras únicas. Por ejemplo, el método resulta útil en la obtención de recubrimientos bioactivos de materiales compuestos vidrio/HA/quitosana y vidrio/HA/alginato a temperatura ambiente, donde la estabilización electro-estérica debido a la adición de los polímeros naturales permite la deposición del bio-vidrio y de las partículas de HA.35 También en la fabricación de láminas nano-compuestas de ácido algínico a partir de la codeposición de ácido algínico, hidroxiapatita (HA), dióxido de titanio (TiO2) y quitosana permitiendo la obtención de filmes de composición variable (HA y TiO2) y diferente espesor, en el intervalo de 0,1-3 µm. Las películas de ácido algínico se logran por deposición anódica a partir de disoluciones de alginato de sodio, polisacárido aniónico que puede usarse para la estabilización electroestérica de partículas inorgánicas y la electrodeposición de compuestos orgánicos-inorgánicos.36
Asimismo, la obtención de hidrogeles de fibroína de seda (promisora en la regeneración ósea y cartilaginosa), mediante la aplicación de un campo eléctrico que provoca la migración de la proteína y su coagulación en el ánodo (aleación de aluminio o Ti6Al4V), permite obtener recubrimientos porosos o películas compactas, controlando el voltaje aplicado, la concentración de la disolución, el tiempo de trabajo y la distancia entre los electrodos.37
También se ha logrado la construcción de matrices multicapas de zirconia compuesta por diferentes fases cristalinas (tetragonal y cúbica) las que fueron estabilizadas mediante el dopaje con óxido de itrio en diferentes concentraciones, con lo que se obtuvieron materiales con buena integridad mecánica y propiedades combinadas.38 Materiales compuestos de zirconia/HA pudieron ser obtenidos sobre sustratos de titanio/TiO2 por un proceso de micro oxidación por arco en etanol a pesar de la formación de β-fosfato tricálcico durante la descomposición de HA y la presencia de CaZrO3 como fase indeseable debido al aumento de la concentración de la fase estabilizadora.39
También, se logró recubrir por EPD la superficie de una aleación de Mg (WE43) con el objetivo de disminuir su proceso de corrosión y simultáneamente promover la diferenciación osteogénica. Para el recubrimiento utilizaron quitosana y gelatina, polielectrolitos biocompatibles y biodegradables que en disolución ácida se cargan positivamente y migran hacia el cátodo para depositarse. La gelatina fue utilizada además como matriz portadora de simvastatina que es un medicamento usado clínicamente como antilipídico, pero que, además, es capaz de actuar sobre la osteogénesis con lo que promueve la formación de hueso. Placas de acero inoxidable fueron usadas como ánodo.40
Por su parte, la aplicación del método electroforético (Fig. 1) ha permitido la síntesis in situ de materiales compuestos al mineralizarse geles poliméricos. En este sentido se ha formado HA, utilizando disoluciones acuosas de cloruro de calcio e hidrógeno fosfato de di-sodio, colocadas en los depósitos de un equipo convencional de electroforesis en agarosa. Los iones de calcio y fosfato proporcionados migran hacia el hidrogel de agarosa en su movimiento hacia el electrodo correspondiente. La HA se formó con la colisión de estos iones. El tiempo necesario para alcanzar la formación completa de HA fue de 30 minutos, este procedimiento aceleró la formación de HA, y se demostró que la velocidad lineal era aproximadamente 15 veces mayor que la de la difusión simple.41
Igualmente se logró la formación de carbonato de calcio y fosfato de calcio en gel de agarosa, el tiempo para alcanzar la formación completa de minerales fue de solo tres minutos y demostraron además que podrían transformarse en HA en disolución tampón de fosfato a pH 7,4.42 Por el mismo método, dentro de un gel de agarosa, se consiguió la precipitación de partículas esféricas de fosfato de calcio amorfo (ACP) que precipitan y aumentan su tamaño con el aumento del tiempo de la electroforesis; el tamaño de los gránulos de ACP depende de la concentración de gel y del pH en la electroforesis. La transformación de ACP a HA fue dominada por el proceso de disolución-precipitación durante el tiempo de envejecimiento.43
Electrohilado
La técnica de electrohilado (electrospinning en inglés) se remonta a inicios del siglo XX. Sin embargo, no es hasta hace pocos años que la técnica se ha convertido en un proceso atractivo gracias a la habilidad de transformar una amplia gama de materiales a bajo costo y con relativa simplicidad en estructuras bidimensionales y tridimensionales de fibras ultrafinas (nanométricas o submicrométricas), que permiten su uso específico en ingeniería de tejidos como andamios para crecimiento celular in vitro o cultivos in vivo para regeneración ósea, desarrollo de piel artificial e implantes vasculares, entre otras aplicaciones.44,45
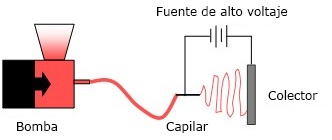
El electrohilado permite la obtención de fibras al aplicar un campo eléctrico (con potencial de 1-30 kV) a un material líquido viscoelástico (en disolución o fundido) contenido en un recipiente del que sólo puede salir a través de un capilar bajo flujo controlado, de manera que las fuerzas eléctricas superan a las de tensión superficial y se expulsan chorros muy finos hasta un colector conectado a tierra y dispuesto a una distancia entre 5 y 30 cm (Fig. 2). En el proceso se obtiene un material ultrafino en dos de sus dimensiones, de gran área superficial, con múltiples poros interconectados y buenas propiedades mecánicas. El resultado final viene determinado por diferentes tipos de parámetros: los del líquido (composición, concentración, peso molecular, viscosidad, tensión superficial y conductividad), los dinámicos (campo eléctrico aplicado, distancia de punta a colector y flujo de salida) y los ambientales (humedad y temperatura).46,47,48
Los materiales así obtenidos se han utilizado como matrices extracelulares para el anclaje, migración y diferenciación de las células responsables de la regeneración de los tejidos óseos. Ejemplo de ello es el estudio del efecto del diámetro y la orientación de las fibras electrohiladas de copolímeros de los ácidos láctico y glicólico en la diferenciación y organización de la matriz extracelular de células estromales de médula ósea. Se constató así que las fibras alineadas de diámetros submicrométricos obtenidas con ayuda de un campo magnético aplicado pueden ser utilizadas como plataformas para la diferenciación de estas células buscando el desarrollo de una membrana periósea.49 Además se han preparado por electrohilado andamios de biomateriales compuestos de nanofibras de estos copolímeros con partículas de HA de alrededor de 266 nm y se ha confirmado la integración de la HA a la estructura así como una gran biomineralización y actividad osteoblástica;50 de igual manera, nanofibras compuestas utilizando PVA con nanopartículas dispersas de alúmina y zirconia51 u óxido de titanio.52
Asimismo, se ha obtenido un andamio multicapa tejiendo hilos de nanofibra de poli-ácido láctico y fibroína de seda salvaje fabricados ambos por electrohilado. Los andamios tejidos basados en una mezcla 9:1 presentaron una distribución de diámetro estrecho, excelentes propiedades mecánicas (módulo de Young de alrededor de 417 MPa y una resistencia a la tracción de aproximadamente 180,36 MPa), apreciablemente superiores a los valores obtenidos para andamios no tejidos. En las referidas estructuras se observó la adhesión y la proliferación de células madre mesenquimales de ratón, por lo que los andamios resultaron potencialmente adecuados para la ingeniería de tejido óseo.53 Por otra parte, al utilizar estos materiales en combinación con moléculas bioactivas, tales como proteínas adhesivas, factores de crecimiento, y fármacos químicos se obtienen materiales artificiales con potenciales respuestas celulares y eficacia terapéutica.54
Electroporación
La electroporación es un método de permeabilización de la membrana celular que hoy en día se usa ampliamente en biotecnología y en la práctica clínica para el suministro de fármacos y genes en células vivas, electroquimioterapia y en ensayos preclínicos. Este fenómeno se puede describir como un aumento espectacular en la permeabilidad de la membrana causada por pulsos eléctricos cortos e intensos aplicados externamente (Fig. 3).55
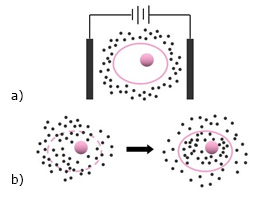
Fig. 3 Electroporación. A. Célula inmersa en el medio seleccionado y dentro del dispositivo de electroporación | B. Formación de poros en la membrana celular con penetración del material seleccionado y restablecimiento de la membrana celular.
Entre varios modelos teóricos, el modelo de poro acuoso transitorio (el más aceptado) predice la formación de poros hidrófilos que tiene lugar en una membrana celular como respuesta a un campo eléctrico inducido. La efectividad de la electroporación está determinada por los parámetros del pulso eléctrico (amplitud, duración, número y frecuencia de repetición), la composición del medio de electroporación y su presión osmótica. La amplitud del pulso es un parámetro crítico ya que, al alcanzar el valor umbral, activa el proceso de electroporación y cuando se exceden sus valores óptimos, la viabilidad celular se ve afectada por una electroporación irreversible. Las moléculas pequeñas se introducen de manera eficiente mediante la aplicación de pulsos eléctricos cortos en el intervalo de decenas a cientos de microsegundos. Mientras que, para macromoléculas, se utilizan pulsos largos de 5-10 µs con amplitudes de pulso relativamente bajas.55
La técnica ha sido empleada en biomateriales. Con esto se ha demostrado su efectividad para permeabilizar liposomas utilizando la reacción de síntesis del AgBr56 y se ha estudiado teóricamente la posibilidad de realizar la electroporación selectiva de liposomas dentro de la célula mientras se mantienen intactos las membranas plasmática y nuclear.57 Recientemente, se ha diseñado un sistema para la electroporación simultánea de liposomas y de la membrana celular que facilita la liberación del fármaco de los liposomas y, al mismo tiempo, su captación por parte de las células.58,59 Estos resultados son potencialmente aplicables en la reparación y la regeneración del tejido óseo.
Control magnético distal
La técnica de control magnético distal o a distancia, se basa en las propiedades especiales de las partículas magnéticas pequeñas. Por debajo de un determinado volumen (generalmente nanométrico), la partícula magnética, no se divide en dominios, la energía de agitación térmica supera a su energía magnética y el momento magnético de la partícula puede fluctuar libremente; de tal manera que se comporta como los materiales paramagnéticos, pero con un valor de momento magnético mucho mayor, por lo que se denomina superparamagnética. Al aplicar un campo magnético externo, el momento magnético se orientará con el campo aplicado; si este se retira, el momento magnético vuelve a fluctuar libremente.60
Para obtener estas nanopartículas superparamagnéticas (NpS) se pueden utilizar métodos físicos (litografía, pulverización catódica), químicos (coprecipitación, sol-gel, hidrotermales, descomposición térmica, electroquímica, microemulsión), o biológicos (bacterias magnetotácticas);60 luego se cubren, generalmente con un polímero, un ligante o un material inorgánico que las protegen y estabilizan, se enlazan con un determinado ente químico o biológico y, opcionalmente, se encapsulan en liposomas o matrices poliméricas, de manera que puedan ser controlados a distancia por un campo magnético y ser utilizadas in vitro o in vivo.61,62
A partir de andamios comerciales hechos de HA y colágeno, se obtuvieron andamios magnéticos, mediante el recubrimiento profundo por inmersión en ferrofluidos acuosos que quedan integrados en los andamios, proporcionando gradientes de campo magnético que posibilitan el control magnético distal en su interior. Los andamios no sufren daño durante el proceso, mantienen su porosidad y forma y no liberan partículas magnéticas bajo un flujo constante de fluido corporal simulado por un periodo de ocho días. Estudios preliminares demostraron la capacidad de los andamios magnéticos para la adhesión y la proliferación de las células madre de la médula ósea humana in vitro y la capacidad potencial, mediante el control magnético distal, de atraer y capturar in vivo factores de crecimiento, células madre u otros agentes biológicos unidos a partículas magnéticas.63
Esta técnica se ha utilizado para dirigir en el espacio la formación de tejidos in vivo y construcciones ex vivo, soportados sobre andamios, para dar lugar a crecimiento celular tridimensional mediante el marcaje de células con NpS (Fig. 4).
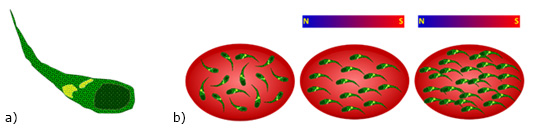
Fig. 4 Control magnético distal de células cargadas. A. Partículas magnéticas (en amarillo). | B. Formación de capa celular ordenada inducida mediante la aplicación de un campo magnético.
Liposomas catiónicos de magnetita (MCL), con carga positiva en su superficie se han utilizado para marcar células para diferentes aplicaciones. Para la construcción de tejidos tridimensionales (3D) se sembraron células estromales de la médula ósea (BMSC) marcadas con MCL en un andamio poroso 3D de HA, y se colocó un imán bajo el andamio. La eficiencia de la siembra de células fue aproximadamente tres veces mayor que la de la convencional (sin imán). Después de un período de cultivo 14 días el nivel de dos marcadores osteogénicos representativos (fosfatasa alcalina y osteocalcina) fueron significativamente más altos, por lo que el método diseñado se presenta como eficaz para la ingeniería de tejidos óseos.64
La reconstrucción in vitro de tejidos 3D sin el uso de andamios se ha desarrollado utilizando los MCL para marcar células madres mesenquimales humanas (MSC) en una superficie de cultivo en la que se colocó un imán en el lado contrario. Las MSC formaron estructuras laminares de varias capas después de un periodo de cultivo de 24 h y mantuvieron capacidad in vitro de diferenciarse en osteoblastos, adipocitos o condrocitos después de un periodo de cultivo de 21 días usando el correspondiente medio de inducción. Utilizando un electroimán, las láminas así construidas se trasplantaron a defectos óseos en cráneos de ratas. La observación histológica reveló que se formó hueso nuevo rodeado de células similares a osteoblastos en el área del defecto 14 días después del trasplante, mientras que no se observó la formación de hueso en ratas de control sin el trasplante.65
Por otra parte, se rellenó un defecto cubital en conejo mediante una cerámica de HA con poros interconectados. Dos semanas después se inyectaron percutáneamente células óseas derivadas de médula de conejo mesenquimales del estroma marcadas con ferumóxido y se utilizó un sistema de focalización magnético externo para atraer estas células a la cerámica. De esta manera se facilitó significativamente la infiltración de las células y se contribuyó a la formación ósea. Este procedimiento pudiera ser clínicamente utilizable para tratar fracturas, defectos, retraso de consolidación ósea y pseudoartrosis.66
En relación con las células MSC, los estudios iniciales confirmaron la inocuidad de varios preparados de nanopartículas magnéticas con respecto a su potencial de diferenciación MSC y la función de los osteoclastos.67
Utilizando una combinación de condensación magnética eficiente de MSC y maduración dinámica en un biorreactor se logró una producción de tejido sin precedentes de cartílago en un andamio de polisacárido poroso. En condiciones óptimas, todas las características de la condrogénesis se mejoraron con un aumento de 50 veces en la expresión de los genes de colágeno II en comparación con el control negativo, una sobreexpresión de agrecano y colágeno XI, y una expresión muy baja de colágeno I y RUNX2. Se observó un gran número de agregados celulares, así como un aumento de la síntesis de proteoglicanos por los condrocitos, condrocitos más grandes y una matriz extracelular más abundante.68
Bioestimulación
La bioestimulación es un proceso que tiene como objetivo restablecer el metabolismo y la función de los tejidos a través de técnicas no invasivas que estimulan la regeneración ósea y logran una óptima unión entre huesos o entre el hueso y el sustituto óseo después de su implantación quirúrgica. Algunas de estas técnicas se basan en el uso del campo electromagnético y comenzaron su desarrollo a partir de que se estableció que el ejercicio que supone la marcha, a través de la producción de impulsos eléctricos endógenos, da lugar al crecimiento del tejido óseo y de que se comprobara que al imponer un campo eléctrico externo también se conseguía el mismo efecto.69 En el desarrollo de la bioestimulación se fueron utilizando de forma independiente o combinada, el campo eléctrico constante, el campo eléctrico pulsado y el campo electromagnético pulsado (PEMF) en el que se aplica un campo magnético pulsado que da origen a corrientes eléctricas también variables.70
En el campo de la ingeniería de tejidos se han obtenido andamios de materiales compuestos y se ha utilizado el campo electromagnético como bioestimulante sobre cultivos celulares. Así, se han sometido cultivos de células óseas MC3T3-E1 a acoplamientos capacitivo, inductivo o combinados, con las intensidades de campo apropiadas, durante diferentes tiempos y en presencia de varios inhibidores de la transducción de señales, con o sin estímulo, y se determinó el contenido de ADN de cada caso. Las tres variantes de campo produjeron un aumento del contenido de ADN en comparación con los controles, pero únicamente el acoplamiento capacitivo tuvo como resultado un aumento constante para tiempos mayores de 30 minutos. El uso de inhibidores metabólicos específicos posibilitó concluir que la transducción de la señal en el caso del acoplamiento capacitivo comienza con la translocación de iones Ca2+ a través de los canales de calcio dependientes del voltaje de la membrana celular, mientras que, para el acoplamiento inductivo y los campos combinados, el evento inicial es la liberación de Ca2+ almacenado dentro de la célula.71
También se han estudiado los efectos del PEMF en la expresión de genes asociados con la degeneración del disco intervertebral humano (IVD) en ambientes normales e inflamatorios. Para ello, las células del anillo fibroso y el núcleo pulposo se encapsularon por separado en perlas de alginato y se expusieron a interleuquina 1α (IL-1α) y al PEMF. Se aisló ARN de cada grupo de tratamiento para evaluar los cambios inducidos por IL-1α y PEMF en la expresión génica. Se encontró que el tratamiento con PEMF disminuyó la regulación positiva inducida por IL-1α de los genes expresados en los IVDs degenerados. Estos resultados demuestran que las células IVD son sensibles a PEMF, lo que pudiera ser utilizado en ingeniería de tejido para el desarrollo de matrices para la interface hueso-cartílago.72
Por otro lado, el campo electromagnético también ha sido utilizado para la conversión de energía eléctrica o magnética en mecánica, mediante la inducción de una deformación reversible longitudinal, volumétrica o por flexión en diferentes dispositivos (Fig. 5), los cuales pudieran ser utilizados como biomateriales para estimular el crecimiento tisular in situ. Así, se han desarrollado materiales compuestos magneto restrictivo de partículas de terfenol-D encapsuladas en resina que al ser expuestas al campo magnético cambian su longitud produciendo una estimulación mecánica e induciendo crecimiento de hueso cortical cuando fueron colocadas en un hueso porcino (Fig. 5a).73
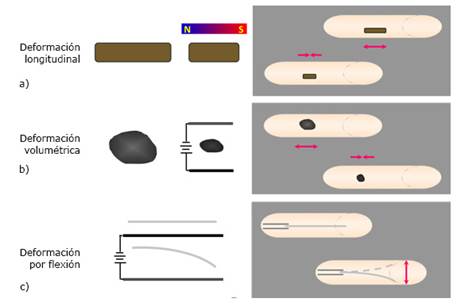
Fig. 5 Diferentes métodos de estimulación para el crecimiento del tejido óseo donde la energía electromagnética es transformada en energía mecánica.
Además, se diseñó un dispositivo implantable basado en un material ferromagnético, 444 316L (acero inoxidable ferrítico, grado biomédico) que promueve la osteointegración a través del crecimiento de osteoblastos fetales y monocitos capaces de deformarse bajo la acción de un campo magnético y producir una deformación mecánica; eliminando así el inconveniente de la inmovilización y ausencia de tensiones después de cualquier operación quirúrgica, que se conoce resultan beneficiosas para la neoformación ósea en el intervalo de 1 millistrain.74
Por otra parte, campos magnéticos uniformes acoplados con nanopartículas magnetizables incrustadas dentro de estructuras de andamios tridimensionales (3D) crean de manera remota fuerzas transitorias que pueden ser transferibles a las células presentes en las proximidades de las nanopartículas. En particular, se investigó la hipótesis de que andamios de alginato magnéticamente sensibles pueden sufrir deformaciones reversibles debido a la alineación de las paredes del andamio en un campo magnético uniforme. Utilizando la configuración de bobina de Helmholtz hecha a la medida adaptada a un microscopio de fuerza atómica, se monitorearon los cambios en las dimensiones de la matriz in situ en función del campo magnético aplicado, la concentración de partículas magnéticas dentro de la estructura de la pared del andamio y la rigidez de la matriz. Los resultados mostraron que los andamios experimentan una deformación de forma reversible. La fuerza mecánica estimada que puede impartirse en las células crecidas en la pared del andamio en condiciones experimentales es del orden de 1 pN, que se correlaciona bien con el umbral informado para inducir efectos de mecanotransducción a nivel celular.75
Diferentes dispositivos construidos a base de electrolitos han sido utilizados en sistemas para la liberación controlada de principios bioactivos76 (Fig. 5b) - y en modelos electrocinemáticos o robots77 (Fig. 5c). En el primer caso se han evaluado geles de PDMAPAA (poli-dimetil amino propil acrilamida), NAPAA (poli-acrilato de sodio), PMAA (poli-metacrilato de sodio). Los modelos o robots en forma de cintas flexibles fueron construidos a base de PAMPS (poli-ácido sulfónico de 2-acril amido-2-metil propano) el cual, en presencia del surfactante cloruro de dodecilpiridinio en una solución conteniendo sulfato de sodio se dobla hacia el ánodo. Controlando la intensidad del campo aplicado se controlan la velocidad y amplitud del movimiento.
Consideraciones finales
Los métodos electromagnéticos identificados fueron clasificados en cinco grupos: electrodeposición química, ya sea por electrólisis, electroforesis o síntesis electroforética in situ; electroporación, electrohilado, control magnético distal y bioestimulación electromagnética de células y tejidos, directamente o por la introducción de dispositivos que convierten la energía electromagnética en energía mecánica. Estos métodos permiten la conformación de matrices celulares y acelulares compuestas y con alto grado de complejidad, además de dispositivos bioestimuladores con control estricto de los parámetros de construcción y operación. Si a esto agregamos su uso combinado, complementario en diferentes fases de los procesos preclínico y clínico del tratamiento, pudiera alcanzarse un alto grado de sinergia, de tal manera, que se lograrían procesos con mayor grado de reproducibilidad y eficiencia. La creatividad en el uso de estos métodos, unido a la diversidad de materiales disponibles y que pueden desarrollarse, hará posible la reparación del tejido óseo a la medida de los requerimientos específicos para cada paciente.