Introducción
Debido a sus propiedades químicas, la estreptozotocina (STZ) es uno de los agentes diabetogénicos más utilizados para generar modelos biológicos de diabetes.1 La 2-desoxi-2-[3-(metil-3-nitrosourea]-D-glucopiranosa (STZ) es un antibiótico sintetizado por Streptomyces achromogenes y estructuralmente es una glucosamina derivada de la nitrosurea, análogo de la glucosa que penetra a la célula ß de los islotes pancreáticos por vía del transportador de membrana Glut-2, y se acumula intracelularmente. Sus propiedades diabetogénicas se caracterizan por la selectiva destrucción de las células ß, deficiencia de insulina, hiperglucemia, polidipsia y poliuria. Además, tiene la capacidad de dañar las células del hígado y del riñón por la presencia de Glut-2 en estas estructuras.2
La STZ se clasifica como un agente alquilante que se une al ácido desoxirribonucleico (ADN), forma enlaces covalentes con grupos alquilos y crea puentes de unión entre las dos cadenas de ADN, lo que produce lesiones estructurales. La STZ se descompone espontáneamente en productos que son responsables de la acción citotóxica. El daño extenso sobre el ADN provoca un agotamiento sustancial del NAD+ y del ATP que depleta de energía las células ß hasta la muerte celular. Dentro de los mecanismos diabetogénicos de la STZ es característico el aumento del estrés oxidativo.2
En los biomodelos, luego de inoculado el fármaco en el animal de experimentación el daño inicial ocurre en las primeras 48 horas.1,2 Durante este periodo ocurren en el organismo varios cambios a nivel celular que tienen repercusión en el metabolismo. El efecto inmediato más descrito en la literatura es el que ocurre en las células ß y sus consecuencias sobre los niveles de insulina y glucosa. No obstante, acontecen modificaciones en órganos vitales como hígado y riñones.2 El desarrollo de la diabetes experimental (moderada o severa) estará en dependencia de la especie animal, cepa, sexo, edad, así como dosis, frecuencia, vía de administración y forma de preparación de la STZ.3,4
En vistas de las múltiples posibilidades que brinda la STZ para generar modelos animales de diabetes se ha publicado una considerable cantidad de literatura científica sobre el tema, fundamentalmente relacionada con la diabetes severa.4,5,6,7 Aunque estudios previos8,9 han demostrado las consecuencias de la diabetes moderada inducida por STZ neonatalmente en parámetros metabólicos, fisiológicos, hormonales, reproductivos, entre otros, poco se conoce acerca de sus efectos a través del tiempo.
Para que un modelo animal de diabetes sea lo más efectivo posible, es importante que este refleje la patogenia y el desarrollo natural de la enfermedad, además de inducir el máximo de complicaciones asociadas. A pesar de que en las últimas décadas se han producido avances en el campo de la diabetes experimental, aún persiste la incertidumbre acerca de cuál modelo es el más adecuado para los objetivos específicos de cada investigación, por lo que se hace necesario comprender los efectos de la STZ en el organismo del animal de laboratorio.
Por tanto, esta investigación se realizó con el objetivo de evaluar, en un periodo de 90 días, los efectos de la inyección neonatal de estreptozotocina en ratas Wistar sobre indicadores bioquímicos y de estrés oxidativo en hígado y riñón.
Métodos
Animales de experimentación
Se realizó un estudio experimental en ratas Wistar, adquiridas en el Centro de Producción de Animales de Laboratorio (CENPALAB), La Habana, Cuba. A partir del apareamiento de ratas adultas hembras y machos, se obtuvieron animales recién nacidos que constituyeron la población de estudio. El día del nacimiento se determinó el sexo a las crías; las hembras se distribuyeron aleatoriamente en dos grupos de experimentación de 30 animales cada uno (STZ y Control). La investigación se desarrolló mediante intervenciones en cinco animales por grupo a los días 5, 10, 20, 30, 60 y 90 de nacidos.
Inducción de la diabetes
La diabetes se indujo en las crías de dos días de nacidas mediante la administración subcutánea de 100 mg/kg p.c. de STZ (Aplichem) en una única dosis. La STZ se disolvió en tampón citrato 0,1 M (pH 4,5) helado para mantener su estabilidad y se inyectó inmediatamente de preparada la solución para evitar la degradación. Al grupo Control se le administró el vehículo tampón citrato en similares condiciones.
Colección y procesamiento de muestras
En cada día de intervención se obtuvieron muestras de sangre para la determinación de glucemia. En las tres primeras extracciones (días 5, 10, 20) la sangre se obtuvo por punción en la vena de la base de la cola; en el resto (días 30, 60, 90), teniendo en cuenta el tamaño del animal, se tomó una gota de sangre de la punta de la cola.
El día correspondiente al sacrificio los animales se pesaron y anestesiaron con tiopental sódico (50-60 mg/kg p.c.), para practicar la eutanasia por exsanguinación. La sangre se extrajo por punción intracardiaca y se procesó, para obtener el suero, mediante centrifugación a 3000 rpm durante 20 min a 4 ºC.
Los hígados y riñones se extrajeron libres de grasa y se lavaron en solución salina. Fragmentos de 200 mg de tejido de cada órgano se homogeneizaron en tampón de homogeneización (PBS 0,1 M pH 7,8 + EDTA 0,1 mM) durante 1,5 min a 30 000 rpm (homogeneizador eléctrico HEIDOLPH®).10 A continuación, se realizaron tres ciclos de congelación en nitrógeno líquido y descongelación a temperatura ambiente garantizando la ruptura celular. Por cada muestra centrifugada durante 20 min a 4400 rpm a 4 oC se recogió el sobrenadante en alícuotas y se añadió 5 µL/mL de hidroxi-tolueno butilado.
Tanto las muestras de suero como de homogeneizados de tejidos se almacenaron a -80 oC para las posteriores determinaciones bioquímicas.
Determinaciones bioquímicas
Todas las determinaciones bioquímicas se realizaron en condiciones de no ayuno; en los primeros 21 días las crías se mantuvieron lactando y en el resto del experimento con dieta libre.
Los niveles de glucosa en sangre se determinaron en cada día de intervención en la totalidad de los animales mediante el método de glucosa oxidasa utilizando glucómetro y biosensores SUMA®.11 La cuantificación de insulina sérica se realizó mediante ensayo inmunorradiométrico (IRMA, kit Insulin RK-400CT, Radiómetro SRN1C-02®).12
Los indicadores de estrés oxidativo se cuantificaron en los homogeneizados de hígado y riñón. En un lector de placas (Sunostik® SPR-960) se determinaron nitratos y nitritos (NO3/NO2) según el método de reducción enzimática de los nitratos presentes en la muestra por acción de la enzima nitrato reductasa. Los nitritos se cuantificaron como azo-compuestos coloreados mediante el reactivo de Griess que absorbe a 540. La concentración se cuantificó utilizando una curva patrón de NaNO3 y NaNO2 y se expresó en nmol/mg de tejido.13
Mediante técnicas espectrofotométricas (espectrofotómetro T60 UV-Visible®) se cuantificaron:
Glutatión reducido (GSH): según el método de formación de un compuesto coloreado que absorbe a 412 nm producto de la reacción del GSH con el colorante DTNB (5,5'-ditiobis [2 ácido nitrobenzoico]). La concentración se cuantificó utilizando una curva patrón de GSH y se expresó en µmol/mg de tejido.14
Malonildialdehido (MDA): según el método de formación de un compuesto coloreado que absorbe a 586 nm producto de la reacción de una molécula de MDA con dos moléculas del reactivo cromogénico N-metil-2-fenil indol en medio ácido a temperatura de incubación 45 °C. La concentración se cuantificó utilizando una curva patrón de 1,1,3,3-tetrametoxipropano y se expresó en nmol/mg de tejido.15
Productos avanzados de oxidación de proteínas (PAOP): según el método de formación de un compuesto coloreado que absorbe a 340 nm producto de la transformación de los iones yoduro a yodo diatómico provocado por los PAOP en condiciones ácidas. La concentración se cuantificó utilizando una curva patrón de cloramina T y se expresó en nmol/mg de tejido.16
Análisis estadístico
El procesamiento estadístico de los datos obtenidos se realizó con el paquete estadístico computacional SPSS Inc. (del inglés, Statistic Package for the Social Science) versión 20 para Windows. En todos los casos se verificaron los supuestos de normalidad (Sapiro-Wilk) y homogeneidad de varianza (Levene). Acorde a la distribución de las diferentes variables se empleó la prueba t de Student. Se consideró significativa la diferencia entre los grupos (*) cuando p < 0,05. Los valores se representaron como la media ± error estándar de la media (EEM).
Aspectos éticos
Tanto los padres como sus crías se mantuvieron en condiciones estrictamente controladas de temperatura (19-25 °C), humedad relativa (45-65 %) y luz (ciclos 12 h luz/oscuridad). Los animales se abastecieron con agua corriente y se alimentaron con dieta completa concentrada convencional todo propósito, producida por el Centro Nacional para la Producción de Animales de Laboratorio (CENPALAB). Los animales de experimentación permanecieron con sus madres por 21 días hasta el destete y posteriormente se colocaron en número de cinco por caja.
Los animales se manipularon según recomienda la guía del Instituto Nacional de Salud para el trabajo con animales de experimentación.17 El Comité de Ética de Investigación de la institución aprobó el estudio mediante el Dictamen 7-2017/UNIB-UCM.VC.
Resultados
En el presente estudio la diabetes experimental fue inducida en 30 crías de ratas Wistar a los dos días de nacidas sin la ocurrencia de muertes por la acción citotóxica del agente diabetogénico. En ambos grupos, STZ y Control, se reportó 100 % de supervivencia.
Los indicadores bioquímicos glucemia e insulina mostraron diferencias significativas en el grupo STZ respecto al grupo Control en todas las intervenciones (Tabla 1). Tres días posteriores a la inducción de la diabetes se observó en el grupo STZ el máximo valor de hiperglucemia de todo el experimento. En el transcurso del tiempo las glucemias mostraron tendencia a la estabilidad sobre los 9,00 mmol/L. En los primeros 30 días del desarrollo, la insulina se mantuvo estable en el grupo STZ, alrededor de 5 µU/mL. A partir del día 60 se observó un aumento de la insulina en ambos grupos de estudio.
Tabla 1 Concentraciones de glucosa e insulina en los en los grupos de experimentación

Los valores se representan como la Media ± EEM. Prueba U de Mann-Whitney (*p < 0,05).
Los indicadores de estrés oxidativo demuestran que el efecto de la STZ sobre hígado y riñones es inmediato; sin embargo, cada órgano respondió al fármaco de manera diferente.
En el hígado se observó una producción mayor de NO3/NO2 en comparación con los cuantificados en el riñón (Fig. 1). En este mismo órgano se cuantificaron niveles significativamente superiores en las ratas tratadas con STZ respecto a los controles en las intervenciones realizadas en los días 10 y 20.
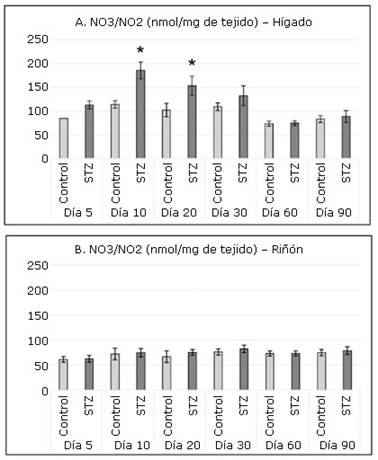
Fig. 1 Concentraciones de nitratos y nitritos (NO3/NO2) en hígado (A) y riñón (B) en los grupos de experimentación.
En todas las intervenciones la figura 2 muestra, en ambos órganos, un consumo de GSH en el grupo STZ respecto al grupo Control. Sin embargo, solo es significativo dicho consumo en el hígado a los 5 días y en el riñón a los 60.
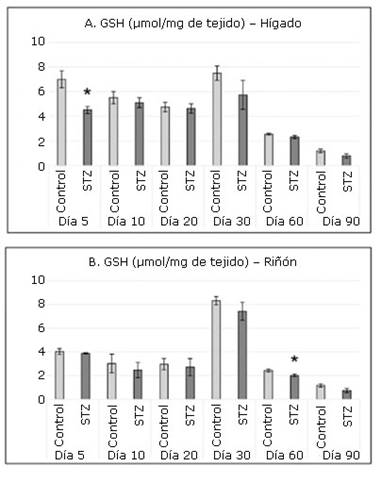
Fig. 2 Concentraciones de glutatión reducido (GSH) en hígado (A) y riñón (B) en los grupos de experimentación.
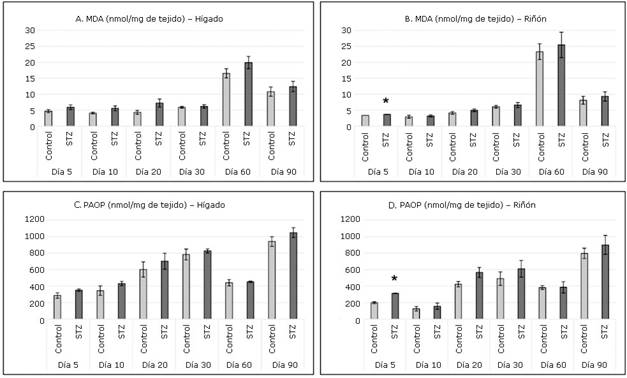
En ambos órganos estudiados se detectaron en todas las intervenciones concentraciones superiores de MDA (Fig. 3 A y B) y PAOP (Fig. 3 C y D) en el grupo STZ respecto al grupo Control. En el hígado de las ratas tratadas con STZ no se demostró daño a lípidos ni proteínas. Sin embargo, en el riñón se detectó en el grupo STZ daño significativo en ambas biomoléculas en la intervención realizada el quinto día.
Discusión
La STZ es un agente diabetogénico que provoca alteraciones metabólicas en los animales de laboratorio que semejan un estado diabético.3 Varios autores 18,19 han inoculado STZ en ratas neonatas con determinadas variaciones, ya sean en dosis o frecuencia, edad o vía de administración. A pesar de dichas diferencias, en todos los casos se observa un pico hiperglucémico y un déficit de insulina fundamentalmente en los primeros 5 días luego de la inducción; a partir de los 10 días, se distingue una meseta en los valores de ambos parámetros, la cual presenta un ligero aumento en el tiempo en el caso de la insulina, mientras que disminuye de forma sutil en la glucosa. Este último indicador bioquímico se encontró superior en el grupo STZ en todas las mediciones realizadas; sin embargo, determinados investigadores han obtenido resultados significativos,18 mientras otros no reportan diferencias estadísticas en fechas similares.19,20
Goyal y otros (2 describen la respuesta trifásica de la glucemia debida a la destrucción de las células β, producto de la acción de la STZ. Esta respuesta se caracteriza por una fase inicial de hiperglucemia e hipoinsulinemia, cuyo máximo ocurre a las dos horas, seguida de una segunda fase (10 h) en la que se invierten los valores de los parámetros por la liberación masiva de insulina, consecuencia de la ruptura de las células β pancreáticas. La tercera y última fase se observa aproximadamente a las 48 h y hasta los 21 días, en la que se establece un aumento casi constante de la glucemia y una disminución de la insulina. Resultados similares se obtuvieron en la presente investigación a partir de las 72 h posteriores a la inducción, momento en el que se comenzó a estudiar el par insulina-glucemia. Estos hallazgos apoyan la hipótesis de que la acción diabetogénica de la STZ radica en la destrucción de células endocrinas del páncreas, las que representan el centro del control de la homeostasia de la glucosa en el organismo.7 La disminución de la producción de insulina y, por tanto, el incremento en los niveles de glucosa, además de otras alteraciones, son características relevantes de la diabetes humana que se representan en este modelo experimental, y lo establecen como apropiado para el estudio de esta enfermedad.3
Al analizar los parámetros estudiados en el transcurso del tiempo, llama la atención que a los 60 días se distinguió un aumento de los valores del par insulina-glucemia, tanto en las ratas controles como en las tratadas con STZ. Bonner-Weir y otros encontraron similar hallazgo en su trabajo.18 Después de las cuatro semanas, las ratas comienzan la etapa puberal con los primeros signos de maduración sexual,21 por lo que una explicación plausible a la variación de la homeostasia de la glucosa a los 60 días es la presencia de estrógenos en ambos grupos. Datos recientes de estudios en roedores demuestran que los estrógenos protegen la producción de insulina probablemente por la habilidad atribuida al estradiol de preservar las células β pancreáticas de la apoptosis inducida por estrés oxidativo en la diabetes experimental.22
En el presente estudio se evidenció afectación inmediata, tanto en hígado como en riñón, de los indicadores de estrés oxidativo cuantificados. Se conoce que la STZ tiene efectos nocivos en ambos órganos, pues los hepatocitos y las células de los túbulos renales expresan el transportador Glut-2 el que permite la entrada del fármaco a la célula. Otros órganos que no poseen dicho transportador están exentos de la toxicidad debido a la naturaleza hidrofílica del compuesto.2,23
El estrés oxidativo desempeña un papel importante en el desarrollo de complicaciones de la diabetes mellitus debido a un exceso de actividad oxidativa. Ocurre un desequilibrio entre la formación excesiva y la eliminación insuficiente de moléculas altamente reactivas, como las especies reactivas de oxígeno y las de nitrógeno, con implicaciones en la homeostasis del organismo por daño a nivel celular, tisular y sistémico.24,25 En este experimento dicho fenómeno debe ser analizado desde dos puntos de vista, pues, puede ser provocado tanto por la acción citotóxica de la STZ, como por las consecuencias de las hiperglucemias (agudas o crónicas) producidas por la destrucción de las células β pancreáticas.
Varios autores reportan estrés oxidativo en plasma y tejidos de pacientes diabéticos 25 y en modelos experimentales de diabetes severa o moderada.2,20 A pesar de existir numerosos trabajos que investigan el tema, los autores no encontramos estudios donde evalúen el estrés oxidativo en etapas tempranas posteriores a la inducción.
En investigaciones realizadas para estudiar la degradación de la STZ se determinó que el 77 % de la STZ inoculada se elimina en un periodo de seis horas luego de la inyección. La mayor parte de los metabolitos son eliminados mediante la orina y el resto por las heces. La otra parte del material se concentra en el hígado y el riñón, la STZ y sus derivados son metabolizados en el hígado y excretados por los riñones.22 De hecho, algunos autores recomiendan estudiar el modelo experimental de diabetes a partir de cuatro o cinco semanas de inoculado el fármaco para evitar interferencias en los resultados por la toxicidad de la STZ.26
El hígado es el mayor órgano de muchos mamíferos, incluidos los roedores. Al momento del nacimiento, este órgano ocupa prácticamente toda la cavidad abdominal y ejecuta funciones metabólicas cruciales para el desarrollo normal del neonato. El hígado es responsable de la detoxificación de compuestos tóxicos (endógenos y exógenos), de la biosíntesis y degradación de la mayoría de las proteínas plasmáticas, además del metabolismo de carbohidratos, lípidos y proteínas.27
Durante el proceso de detoxificación en el hígado se filtra la sangre para eliminar las toxinas más grandes, se sintetiza y secreta la bilis llena de colesterol y toxinas solubles en la grasa y se descomponen enzimáticamente los productos químicos no deseados, ello sucede, por lo general, en dos etapas: fase I y fase II. La fase I neutraliza de forma directa una toxina o aquellos productos químicos que pueden ser tóxicos si se acumulan, como es el caso de la STZ, para convertirlos en formas intermedias, mucho más activas químicamente y, por lo tanto, más tóxicas, que a posteriori son procesados por las enzimas de la fase II. Un efecto secundario significativo de esta fase es la producción de radicales libres durante la neutralización de las toxinas. Sin defensas antioxidantes adecuadas, cada vez que el hígado neutraliza una toxina se produce un daño por estos radicales libres. El GSH participa como antioxidante en la neutralización de los radicales libres al oxidarse a disulfuro de glutatión (GSSG). Las enzimas de la fase II actúan de forma directa sobre algunas toxinas o sobre aquellas que fueron activadas en la fase I. Asimismo, utilizan energía metabólica. Por su parte, el riñón, órgano vital en el proceso de detoxificación, excreta las toxinas que el hígado ha transformado en hidrosoluble, así como fármacos o metales pesados.28
Se ha descrito que la inducción de la diabetes en ratas por STZ desde estadios tempranos se caracteriza por la generación de radicales libres que incluyen especies reactivas del oxígeno y del nitrógeno. A su vez, la hiperglucemia mantenida contribuye al estrés oxidativo a través de varios mecanismos metabólicos como glucolisis, acumulación y acción de productos de glicación avanzada, incremento de la vía del sorbitol, aumento de la vía de las hexoxaminas, activación de diversas isoformas de la proteína cinasa C y la secreción o acción de la insulina.29
Los niveles superiores de NO3/NO2 detectados en el hígado de las ratas del grupo STZ indican incremento en la producción de ON; molécula muy pequeña que se difunde fácilmente a través de las membranas celulares ya que es un gas lipofílico e hidrosoluble. Su formación tiene lugar por diversas isoformas de la enzima NOS.24,30 La expresión de iNOS en particular puede inducirse en un amplio rango de células y tejidos mediante citoquinas y otros compuestos, además, su promotor posee sitios de unión para diversos factores de transcripción. Estas características permiten que su expresión se incremente en diversos procesos patológicos, inflamatorios e infecciosos en muchos tipos celulares incluidos los hepatocitos.30
El ON reacciona espontáneamente con los radicales de oxígeno para formar peroxinitrito, potente agente oxidativo y nitrosativo, que induce daño a proteínas, lípidos y ADN.31 La determinación de NO3/NO2 en el hepatocito, productos estables del ON, es indicador de producción de especies reactivas del oxígeno y del nitrógeno; y, por tanto, de estrés oxidativo a nivel hepático en los primeros 30 días debido tanto a la toxicidad de la STZ como al estado hiperglucémico e inflamatorio que provoca.
El sistema formado por el GSH y las enzimas que intervienen en su ciclo redox forman el principal sistema de defensa a nivel intracelular frente a las agresiones oxidantes. El GSH protege los grupos sulfhidrilos de las proteínas de la acción oxidante de los radicales libres y tiene la capacidad de reaccionar con el peróxido de hidrógeno, el anión superóxido y el radical hidroxilo.29 Probablemente, en este experimento, el consumo significativo inicial del GSH en el hígado se explique por su acción antioxidante en ambas fases de la detoxificación, que comienza a ocurrir inmediatamente a la administración de la STZ.
En el hígado no se observó daño significativo a lípidos y proteínas, a pesar de que los resultados mostraron incremento de MDA y PAOP en el grupo inyectado con STZ durante todo el estudio. Es posible que el acelerado metabolismo de lípidos y proteínas que se lleva a cabo en el hígado no permita la presencia de daño oxidativo a las biomoléculas estudiadas.
Por otra parte, la importancia de los riñones en la eliminación de toxinas es conocida; son órganos complejos cuya función consiste en filtrar los productos residuales de la sangre y producir orina. En el útero, la placenta mantiene la homeostasis y balance hidroelectrolítico, sin embargo, en la vida extrauterina, el riñón es el órgano encargado de la homeostasis orgánica y tiene como funciones principales la de regular la composición y volumen del líquido extracelular, eliminar toxinas derivadas del metabolismo y secretar hormonas.10 La STZ en dosis diabetogénicas muestra una marcada necrosis y toxicidad renal en animales, demostrada por la presencia de cambios como hipertrofia tubular y glomerular, expresión mesangial y lesiones glomerulares similares a las de la enfermedad renal humana.2
En la literatura revisada no se han encontrado referencias a los efectos renales inmediatos de la STZ inyectada en etapa neonatal. Varios autores refieren nefrotoxicidad en ratas adultas tratadas con dosis de STZ iguales o inferiores a 65 mg/kg de peso corporal.2,10 En este experimento la cuantificación de NO3/NO2 de origen renal mostró que en este órgano no ocurre una producción excesiva de ON en el grupo STZ en relación al control. Esto indica que, en este órgano, a diferencia de lo que sucede en el hígado, ni el efecto inmediato de la STZ ni las hiperglucemias agudas o crónicas aumentan la producción de especies reactivas del nitrógeno.
Según los resultados obtenidos, en el riñón de ratas tratadas con STZ no ocurre un consumo de GSH en el periodo estudiado. No obstante, llama la atención que ambos grupos presentaron los valores más elevados de todo el experimento el día 30 de nacidos, similar a lo observado en el hígado. La elevada producción de GSH en ambos órganos puede asociarse con los cambios fisiológicos que ocurren en el organismo en función del crecimiento en esa fecha.
A la inversa de lo ocurrido en el hígado, en los riñones del grupo STZ se apreció daño significativo a lípidos y proteínas a los cinco días, posteriormente, aunque los valores de MDA y PAOP resultaron superiores en todo momento, no llegaron a ser suficientes para plantear daño a biomoléculas en el transcurso del tiempo.
Un blanco reconocido del ataque de los radicales libres son los lípidos de las membranas de las células en general, alterando la fluidez, su estructura y, finalmente, su función, a través de la peroxidación lipídica y ruptura de células e inflamación. En el caso del riñón esta lipoperoxidación compromete la integridad de la membrana basal y del epitelio, originando la pérdida de la función glomerular y tubular. En estudios previos de este equipo de investigación se ha comprobado daño renal incipiente, reflejado en parámetros séricos, urinarios, morfológicos y de estrés oxidativo en ratas adultas de 90 días inyectadas neonatalmente con STZ.32,33,34
A partir de los resultados obtenidos se puede concluir que, tanto la citotoxicidad de la STZ neonatal como las concentraciones de glucosa e insulina inducidas repercutieron negativamente sobre los indicadores de estrés oxidativo estudiados en tejido hepático y renal.
A pesar de ser la acción diabetogénica de la STZ un tema ampliamente estudiado, es escasa la literatura científica que aborda su efecto a través del tiempo y en órganos vitales como hígado y riñón. El presente estudio proporciona un enfoque más generalizado de estos aspectos y aporta nuevos conocimientos sobre el desarrollo del modelo neonatal de hiperglucemias moderadas.
Recomendaciones
Los autores recomendamos realizar estudios morfométricos en los animales de experimentación, así como estudios histológicos en el páncreas, hígado y riñón para detectar las alteraciones que produce la STZ a nivel celular. En estos órganos se comprobó la repercusión negativa del agente diabetogénico sobre indicadores bioquímicos y de estrés oxidativo.