Introducción
En diciembre de 2019 autoridades sanitarias de la ciudad china de Wuhan, provincia Hubei comenzaron a reportar casos de neumonía atípica. Poco después, en enero de 2020 el Centro de Control de Enfermedades del país detectó un nuevo virus denominado Coronavirus del Síndrome Respiratorio Agudo Grave 2 (SARS-CoV-2, por sus siglas en inglés).1 Debido a la rápida expansión del nuevo coronavirus, la Organización Mundial de la Salud (OMS) declaró el 30 de enero del 2020 una emergencia internacional en Salud Pública y nombró a la nueva enfermedad COVID-19.2,3 En relación con los datos publicados hasta el 26 de junio del 2020 en el Reporte 158 de la OMS, la declarada epidemia de COVID-19 ha afectado la mayor parte del mundo, con un total de 9 473 214 casos confirmados y 484 249 muertes a nivel global. Las regiones más afectadas son el continente americano y Europa con 4 709 927 y 2 619 753 casos confirmados, respectivamente.4
El SARS-CoV-2 es un betacoronavirus de la familia Coronaviridae cuyo receptor celular es la enzima convertidora de angiotensina 2 (ACE2).5 La ACE2 normalmente cataliza la conversión de angiotensina 2 en angiotensina 1-7 (mediador químico con efecto vasodilatador). Esta enzima es parte de una compleja cascada de péptidos vasoactivos denominada sistema renina-angiotensina-aldosterona, esta última, responsable de los mecanismos reguladores de la presión arterial.6
La ACE2 se expresa primariamente en los pulmones, corazón y riñones, es el homólogo en la membrana celular de la ACE, y comparten el 42 % de los aminoácidos, pero difieren en la selectividad enzimática y, más importante, en su función. El SARS-CoV-2 entra a la célula al unir la proteína S a la ACE2 anclada en la membrana celular. El virus reduce drásticamente la unión de la ACE2 a las membranas celulares, lo que incrementa la angiotensina 2 y potencia el daño pulmonar y renal.6,7
La falta de conocimiento sobre el curso natural de esta nueva enfermedad permanece como un reto. La comprensión del amplio espectro clínico, las posibles reinfecciones, aparición de complicaciones y la presencia de comorbilidades asociadas, son la fortaleza en el manejo de la COVID-19.8,9 También es importante la identificación de factores de riesgo como enfermedades crónicas no transmisibles, inmunodeficiencia y edad avanzada, por sus efectos agravantes en el curso clínico de la enfermedad.10,11
En particular, la enfermedad renal crónica (ERC) es un factor de riesgo potencial en el contexto de la COVID-19, debido a que se asocia a disfunción del sistema inmunitario, lo que podría implicar un peor pronóstico en comparación a la población general.11 La cadena de sucesos celulares y extracelulares originada por la infección con SARS-CoV-2, con dianas reguladas por la actividad de los riñones, podría implicar una predisposición intrínseca de presentar una infección grave en pacientes con ERC.12) Hasta la fecha se cuenta con una explicación fisiopatológica al respecto, y se han realizado estudios individuales en poblaciones pequeñas, por lo que la literatura relativa a ello se encuentra dispersa y poco sistematizada. En consecuencia, el objetivo de la presente revisión sistemática y metaanálisis es evaluar la asociación entre la enfermedad renal crónica y el peor pronóstico de pacientes con COVID-19.
Métodos
Fuentes de información y selección de los estudios
Se realizó una búsqueda en las bases de datos de información científica biomédica PubMed, Scopus, EBSCOHost, ClinicalKey, Hinari y Cochrane. Los criterios de búsqueda fueron las combinaciones de los descriptores MeSH: [(“SARS-CoV-2” OR “COVID-19” OR “2019-nCoV”) AND “kidney disease” OR “renal disease” OR “renal insufficiency”], y sus equivalentes en español localizados en el DeCS. Se consultaron fuentes adicionales de información localizadas en las listas de referencias bibliográficas de los artículos encontrados y artículos en prepublicación. Se obtuvo información epidemiológica de las páginas web oficiales de la Organización Mundial de la Salud, la Organización Panamericana de la Salud y los Centros para el Control y la Prevención de las Enfermedades.
Se incluyeron todos los artículos originales en español e inglés, publicados o prepublicados hasta el 30 de abril del 2020 y correspondientes a estudios observacionales que aportaran información clínica y epidemiológica de pacientes mayores de 18 años, diagnosticados con COVID-19 mediante pruebas de PCR en tiempo real. Los estudios incluidos debieron registrar la presencia de ERC y un resultado de salud. Se definió como resultado de salud a un efecto reportado como alguno de los siguientes desenlaces: enfermedad grave, ingreso en UCI o muerte.
Fueron excluidos artículos de reportes de caso, series de caso, revisiones o cartas al editor, así como los que contenían información duplicada en estudios con muestras inclusivas. También se excluyeron los artículos con información incompleta o imprecisa. El proceso de revisión e inclusión/exclusión de los artículos fue realizado por dos autores (LI. Cobiellas-Carballo, L. Bonet-Chacón) de manera independiente. Las inconsistencias fueron resueltas por un tercer investigador (LE. Almaguer-Mederos) o por consenso entre los autores.
Recolección de los datos y síntesis de los resultados
Se diseñó una planilla de codificación en la que se incluyeron los valores de todas las variables de interés: autor principal, año de publicación, cantidad de pacientes estudiados, medidas de resumen de la edad, cantidad de pacientes por sexo, cantidad de pacientes con y sin ERC, así como cantidad de pacientes con y sin el resultado de salud.
Se utilizó el modelo de efectos aleatorios cuando la heterogeneidad de los estudios fue moderada o elevada (I2 > 25 %), debido al escaso número de artículos incluidos. Una vez corregida la heterogeneidad mediante la eliminación de estudios con mayor contribución a esta, se aplicó un modelo de efectos fijos para lo que se calculó el Odds Ratio por el método de Mantel-Haenszel. La medida de efecto principal empleada fue OR, con un nivel de confianza del 95 % para evaluar la asociación entre el resultado de salud (enfermedad grave, ingreso en UCI o muerte) y la presencia de ERC. Se utilizaron las pruebas de heterogeneidad I 2 , τ 2 , y ( 2 , y se consideró estadísticamente significativo un valor de p < 0,05. Para la determinación del sesgo de publicación se utilizó la prueba de regresión de Egger y se corroboraron sus resultados con las pruebas N segura de Rosenthal y N segura de Orwin. No se crearon diagramas de embudo debido al escaso número de estudios disponibles. Los cálculos de las medidas de efecto y las representaciones gráficas se realizaron mediante el software Review Manager 5.3.13
Para evaluar la calidad de los artículos incluidos se utilizó la escala Newcastle-Ottawa14 para estudios no aleatorizados. Esta escala evalúa tres dimensiones (selección, comparabilidad y exposición) para un máximo posible de nueve puntos; a cada estudio le puede ser otorgado un máximo de un asterisco por cada ítem en las dimensiones de selección (cuatro ítems) y exposición (tres ítems), y un máximo de dos asteriscos para la dimensión de comparabilidad.
Las limitaciones de este estudio derivan de la dificultad de evaluar varios artículos a texto completo, por haber sido publicados en idioma chino (en estos casos solamente fueron evaluados los resúmenes en inglés).
Resultados
Características de los estudios incluidos
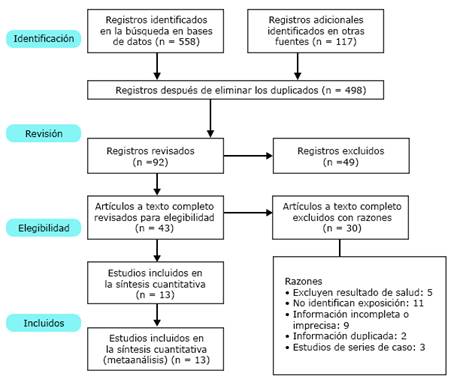
Fueron encontrados, luego de eliminar los duplicados, 498 artículos, la mayoría (68 %) de PubMed, en idioma inglés. Se descartaron 406 artículos luego de la revisión de título y resumen, por no cumplir los criterios de inclusión. Se revisaron 43 artículos a texto completo, de los cuales fueron excluidos 30 por las razones enunciadas en la figura 1.
Finalmente, se incluyeron en el metaanálisis 13 estudios que cumplieron los criterios de selección. La tabla 1 resume las características de los estudios analizados.
Tabla 1 Características de los estudios incluidos en el metaanálisis
| Estudio (Año) | Clasificación | Objetivo | Participantes | Resultados |
|---|---|---|---|---|
|
|
Cohorte retrospectivo | Evaluar el riesgo de resultados adversos serios en pacientes con COVID-19 mediante la estratificación por comorbilidades en 575 hospitales de China | 1590 participantes: 904 masculinos y 686 femeninos (1,3:1); Edad 49 ± 16 años; 50 muertes y 1540 sobrevivientes (1:31) | Con ERC 269 (16,9 %), muertes 5 (1,9 %) y 264 sobrevivientes |
|
|
Cohorte retrospectivo | Investigar las características y los factores pronósticos en pacientes ancianos con COVID-19 | 339 participantes: 166 masculinos y 173 femeninos (1:1) Edad 69 (65-76) años 65 muertes y 274 sobrevivientes (1:4) | Con ERC 13 (3,8 %), muertes 4 (30,8 %) y 9 sobrevivientes ( |
|
|
Cohorte prospectivo | Describir las características clínicas, resultados de laboratorio y evolución a corto plazo de 102 pacientes con COVID-19 en el Hospital Universitario de Zhongnan, en Whan | 102 participantes: 53 masculinos y 49 femeninos (1:1) Edad 54 (37-67) años 17 muertes y 85 sobrevivientes (1:5) | Con ERC 4 (3,9 %), muertes 3 (75 %) y 1 sobreviviente ( |
|
|
Cohorte retrospectivo | Delinear las características clínicas de 113 pacientes con COVID-19 que fallecieron en el Hospital Tongji, en Whan | 274 participantes: 171 masculinos y 103 femeninos (1,6:1) Edad 62 (44-70) años 113 muertes y 161 sobrevivientes (1:1,4) | Con ERC 5 (1,8 %), muertes 4 (80 %) y 1 sobreviviente |
|
|
Cohorte retrospectivo | Caracterizar los resultados epidemiológicos de la COVID-19 en Irán | 2964 participantes: 1955 masculinos y 1009 femeninos (1,9:1); Edad 56 (46-65) años; 239 muertes y 2725 sobrevivientes (1:11) | Con ERC 18 (0,006 %), muertes 3 (16,7 %) y 15 sobrevivientes (1:5) |
|
|
Cohorte retrospectivo | Explorar los factores de riesgo de muerte intrahospitalaria y describir el curso clínico de síntomas durante la hospitalización de pacientes con COVID-19 en el Hospital Jinyintan y Pulmonar de Wuhan | 191 participantes: 119 masculinos y 72 femeninos (1,7:1); Edad 56 (46-67) años; 54 muertes y 137 sobrevivientes (1:2,5) | Con ERC 2 (1,0 %), muertes 2 (100 %) ( |
|
|
Cohorte retrospectivo | Describir las características y factores de riesgo asociados a la severidad de la enfermedad y mortalidad en pacientes con COVID-19 en el Hospital Renmin de la Universidad de Whan | 663 participantes: 321 masculinos y 342 femeninos (1:1); edad 56 (44-69) años; 409 formas graves y 254 formas no graves (1,6:1) | Con ERC 21 (3,2 %), formas graves 16 (76,1 %) y 5 formas no graves ( |
|
|
Cohorte retrospectivo | Describir los resultados de un análisis de las características clínicas de la COVID-19 en una cohorte de pacientes en China | 1099 participantes: 640 masculinos y 459 femeninos (1,4:1) Edad 47 (35-58) años 173 formas graves y 926 formas no graves (1:5) | Con ERC 8 (0,7 %), formas graves 3 (37,5 %) y 5 formas no graves |
|
|
Cohorte retrospectivo | Explorar los efectos de la infección por SARS-CoV-2 en la función renal mediante el análisis de 116 pacientes confirmados con COVID-19 hospitalizados en el Hospital Renmin de la Universidad de Whan | 116 participantes: 67 masculinos y 49 femeninos (1,3:1); Edad 54 (38-59) años; 57 formas graves y 59 formas no graves (1:1) | Con ERC 5 (4,3 %), formas graves 5 (100 %) ( |
|
|
Cohorte retrospectivo | Estudiar las manifestaciones neurológicas de pacientes con COVID-19 en el Hospital Unión de la Universidad Huazhong de Whan | 214 participantes: 87 masculinos y 127 femeninos (1:1,5); Edad 53 ± 16 años; 88 formas graves y 126 formas no graves (1:1,4) | Con ERC 6 (2,8 %), formas graves de la enfermedad 2 (33,3 %) y 4 formas no graves de la enfermedad (1:2) |
|
|
Cohorte retrospectivo | Investigar las características clínicas y la condición alérgica de pacientes infectados con COVID-19 en el Hospital No. 7 de Whan | 140 participantes: 71 masculinos y 69 femeninos (1:1); Edad 57 (25-87) años; 58 formas graves y 82 formas no graves (1:1,4) | Con ERC 2 (1,4 %), formas graves de la enfermedad 2 (100 %) ( |
|
|
Cohorte retrospectivo | Describir las características de adultos hospitalizados con COVID-19 en un Sistema Integrado de Salud en California | 377 participantes: 212 masculinos y 165 femeninos (1,3:1); Edad 61 (50-73) años; 113 pacientes ingresados en UCI y 264 pacientes ingresados en salas de hospitalización (1:2,3) | Con ERC 48 (12,7 %), ingresados en UCI 12 (25 %) y 36 ingresados en salas de hospitalización (1:3) |
|
|
Cohorte retrospectivo | Describir las características clínicas y epidemiológicas de pacientes con neumonía por infección con COVID-19 en el Hospital Zhongnan de la Universidad de Whan | 138 participantes: 75 masculinos y 63 femeninos (1:1,2); Edad 56 (42-68) años; 36 pacientes ingresados en UCI y 102 pacientes ingresados en salas de hospitalización (1:2,8) | Con ERC 4 (2,9 %), pacientes ingresados en UCI 2 (50 %) y 2 pacientes ingresados en salas de hospitalización ( |
Se resume la información de 8207 pacientes con diagnóstico de COVID-19, de los cuales 4866 (84,6 %) son residentes de la ciudad Wuhan, provincia Hubei, China, el epicentro de la pandemia de COVID-19. El 59 % de los pacientes fueron del sexo masculino y la edad media fue de 56 años. En todos los estudios se registró un resultado de salud en la evolución a mediano plazo para los pacientes que padecieron la COVID-19: seis estudios9,12,15,16,17,18 (46,2 %) reportaron muertes o sobrevivientes, cinco estudios19,20,21,22,23 (38,5 %) reportaron casos graves y no graves de la enfermedad y, dos estudios,24,25 (15,3 %) reportaron si los pacientes fueron ingresados en UCI o en salas de hospitalización.
En cuanto a las comorbilidades, diez estudios9,12,15,16,18,19,20,23,24,25 (76,9 %) incluyeron enfermedades sistémicas, cardiovasculares, respiratorias, oncológicas, y gastrointestinales; ocho estudios9,12,15,20,22,23,24,25 (61,5 %) incluyeron además enfermedades neurológicas; cinco estudios9,12,20,23,24 (38,5 %) incluyeron también enfermedades inmunológicas; por último, solo dos estudios23,24 (15,4 %) incluyeron enfermedades endocrinas. En una sola investigación23 se tuvieron en cuenta los trastornos electrolíticos y ácido-básicos que presentaban los pacientes antes de su hospitalización.
Del total de pacientes incluidos en este metaanálisis, 1472 (17,9 %) tuvieron un peor resultado de salud (enfermedad grave, ingreso en UCI o muerte), de los que 63 (4,3 %) presentaban ERC; al tiempo que dicho valor representan el 15,6 % de los 405 pacientes con ERC. En siete estudios15,16,18,19,21,23,25 (53,9 %) más del 50 % de los pacientes con ERC tuvieron un peor resultado de salud.
De manera global, al resumir datos de las 13 investigaciones se asoció la presencia de ERC con un peor resultado de salud en pacientes con la COVID-19, con un OR = 1,99 [IC 95 %: 1,13-3,52; Z = 2,37; p = 0,02] (Fig. 2), lo que se interpreta como una probabilidad casi dos veces superior de desarrollar un peor pronóstico (enfermedad grave, ingreso en UCI o muerte) que la población general.

Fig. 2 Diagrama de bosque del OR para algún efecto (enfermedad grave, ingreso en UCI o muerte) entre los pacientes con y sin enfermedad renal crónica (ERC).
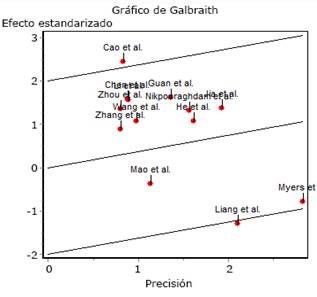
La prueba de heterogeneidad de los 13 estudios mostró resultados para I2 = 47 % y (2 = 22,47 (p = 0,03), lo que se interpreta como una variación interestudios moderada y estadísticamente significativa. La figura 3 muestra el gráfico de Galbraith donde se aprecia la gran precisión del estudio de Myers y otros;24 sin embargo, este y las investigaciones de Cao y otros15, Guan y otros9 y Mao y otros22 tienen una gran contribución a la heterogeneidad.
Para determinar las causas de la heterogeneidad se aplicó un modelo de metarregresión de efectos aleatorizados para las covariables “tamaño muestral” y “proporción de ERC reportada”. El tamaño muestral no mostró asociación con la variabilidad de los resultados en los estudios analizados (Z = -0,79; p = 0,43), por lo que no se puede asegurar que el tamaño muestral sea el elemento responsable de la heterogeneidad interestudios. Sin embargo, la proporción de ERC reportada mostró gran asociación a la variabilidad del efecto medido (Z = -3,70; p = 0,0002), lo que quiere decir que la proporción de ERC reportada en los estudios es la responsable de la heterogeneidad encontrada interestudios (R2 = 1,00). Esto se debe a que la mayoría de las investigaciones tuvieron un reporte selectivo de ERC avanzada, por consiguiente, la proporción de ERC reportada se encuentra muy por debajo de la media mundial (10 %); mientras que solo dos estudios9,24 reportaron una prevalencia alrededor del 10 %. La figura 4 muestra el gráfico de dispersión para la covariable “proporción de ERC reportada”, en este se observa como el incremento de la proporción de ERC (ERC Prop) se asocia a una disminución del efecto medido, con varios estudios con escasa proporción de la ERC reportada fuera del intervalo de confianza.
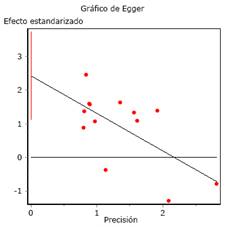
La prueba de regresión de Egger (Fig. 5) demostró la existencia de sesgo de publicación entre los artículos del metaanálisis (t = 4,56; p < 0,1). Para corroborar la existencia de sesgo de publicación se aplicó la prueba N segura de Rosenthal; lo que demostró la necesidad de incluir 28 artículos (2,2 artículos por cada uno de los incluidos) sin significación estadística entre la ERC y el peor pronóstico de los pacientes con COVID-19 para que se pierda la alcanzada en este metaanálisis (Z = 2,37; p = 0,02). En cuanto a la medida de efecto, se aplicó la prueba N segura de Orwin, lo que resultó en la necesidad de incluir ocho artículos con OR ≤ 1,0 para que el efecto logrado en el metaanálisis (OR = 1,99) sea nulo.
Al eliminar del análisis los cuatro estudios9,15,22,24 con mayor contribución a la heterogeneidad, se aplicó un modelo de efectos fijos y se obtuvieron resultados más robustos (Fig. 6). El análisis de estos nueve estudios demostró una mayor asociación entre la ERC y el peor resultado de salud de los pacientes con la COVID-19, con un OR = 3,02 [IC 95 %: 1,79-5,10; Z = 4,15; p < 0,0001]. La prueba de heterogeneidad interestudios resultó I2 = 0 % y (2 = 5,72 (p = 0,88), lo que demuestra ninguna variabilidad. Sin embargo, los resultados de la prueba de regresión de Egger (t = 4,28; p < 0,1) demuestran que se mantiene el sesgo de publicación entre estos nueve estudios.
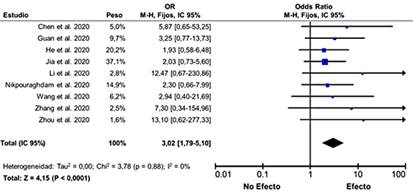
Fig. 6 Diagrama de bosque del OR para algún efecto (enfermedad grave, ingreso en UCI o muerte) entre los pacientes con y sin ERC luego de eliminar estudios responsables de la heterogeneidad.
La aplicación de las pruebas N segura de Rosenthal y N segura de Orwin demostraron la necesidad de incluir 33 y 15 artículos respectivamente para que se pierdan la significación estadística (Z = 4,15; p < 0,0001) y la medida de efecto (OR = 3,02) alcanzadas en el metaanálisis de estos nueve estudios.
Las pruebas anteriores demostraron la existencia de un gran número de artículos “perdidos” por sesgo de publicación que podrían eliminar los efectos determinados en este metaanálisis. Sin embargo, la COVID-19 es una enfermedad nueva y poco conocida, por lo que no existen estudios previos sobre el verdadero efecto de la ERC en el pronóstico. Además, las editoriales han acelerado y priorizado sus procesos de revisión de manuscritos relacionados con el tema. Todo lo anterior reduce la posibilidad de publicación selectiva y, por ende, el sesgo de publicación, esto nos permite tomar los resultados de este metaanálisis como válidos.
La prueba de sensibilidad arrojó robustez a los resultados obtenidos en la presente investigación, debido a que la eliminación de cualquier estudio no provoca una inversión o neutralización del efecto obtenido (OR = 1,99). La medida de efecto calculada al eliminar cualquier estudio se encuentra siempre por encima de 1,71. Lo anterior demuestra la validez de los resultados obtenidos (Fig. 7).

Fig. 7 Análisis de sensibilidad y gráfico de influencia para los estudios incluidos en el metaanálisis.
La aplicación de la escala de Newcastle-Ottawa permitió comprobar la calidad de los artículos incluidos, debido a que todos los estudios obtuvieron 8 puntos en la evaluación.
La interpretación clínica de los resultados de este metaanálisis consiste en la demostración de que los pacientes con ERC afectados por la COVID-19 tienen una probabilidad tres veces mayor de presentar un peor resultado de salud que la población general.
Discusión
Hasta el 26 de junio del 2020 la COVID-19 había provocado el fallecimiento de más de casi medio millón de personas a nivel mundial, con una mortalidad de aproximadamente el 5 %.4 Debido a que en las poblaciones humanas no existe inmunidad natural al SARS-CoV-2, su significativa transmisibilidad, la elevada mortalidad asociada a la COVID-19 y la carencia de tratamiento curativo, esta enfermedad se ha convertido en un serio problema de salud a nivel mundial.26 En este contexto, resulta de interés profundizar en el conocimiento de los determinantes del pronóstico de pacientes con COVID-19. Se ha reconocido que su peor pronóstico se asocia a la edad avanzada,25 al género masculino,27) y a la presencia de comorbilidades.9 En particular, varios estudios15,16,18 han reportado que la ERC es una comorbilidad asociada a la COVID-19 que empeora el pronóstico, aunque estos resultados9,22,24 no han sido del todo consistentes.
La presente revisión sistemática y metaanálisis demuestra que la enfermedad renal crónica se asocia a un peor pronóstico en pacientes con COVID-19. El examen de varios estudios observacionales, en su mayoría retrospectivos, mostró que los pacientes con COVID-19 que padecen de ERC tienen un riesgo de dos a tres veces mayor de padecer una forma grave de la enfermedad, necesidad de ingresar en la UCI, o de fallecer, lo que se traduce en un peor pronóstico. Este resultado es fundamental para el adecuado diseño e implementación de protocolos de tratamiento en pacientes con COVID-19 y ERC, que faciliten la toma de decisiones y el ajuste de los servicios de salud sobre la base de evidencias científicas. Además, los resultados obtenidos sustentan las recomendaciones médicas a los pacientes con ERC y sus cuidadores, de evitar contacto con personas sospechosas de COVID-19, no acudir a áreas epidémicas con transmisión de la enfermedad, y buscar asistencia médica de aparecer cualquier síntoma.28
La asociación entre la ERC y el peor pronóstico de pacientes con COVID-19 pudiera ser mediada por el eje de la enzima convertidora de angiotensina 2 (ACE2), angiotensina 1-7 [Ang(1-7)], y receptor de ensamblaje mitocondrial (MasR): [ACE2/Ang(1-7)/MasR]. Se ha comprobado que este eje es un componente de importancia en el desarrollo y progresión de la ERC.29) En efecto, el eje [ACE2/Ang(1-7)/MasR] promueve la regulación negativa del eje ACE/AngII/ATR1 del SRAA, y su activación tiene efectos renoprotectores en el contexto de enfermedades renales.30,31) Dado que la ACE2 actúa como receptor celular del SARS-CoV-2,5) se ha propuesto que la internalización del SARS-CoV-2 reduce los niveles de ACE2 unida a membrana, lo que pudiera potenciar el daño tisular y agravar la ERC por medio del incremento de los niveles de AngII.32 De hecho, se ha reportado un significativo incremento de AngII en una serie de 12 pacientes chinos con COVID-19,33) aunque el significado clínico de esta observación es confuso, dada la dificultad de medir con precisión los niveles de AngII en humanos y la influencia de las alteraciones hemodinámicas asociadas a enfermedades graves.34
Con base en las observaciones antes discutidas, se ha propuesto que el uso de agentes farmacológicos que actúan como bloqueadores del receptor de la AngII, incrementan los niveles de ACE2.35) Esto pudiera resultar beneficioso para el tratamiento de pacientes con COVID-19, puesto que el incremento farmacológicamente inducido en los niveles de ACE2 contrarrestaría el efecto de la internalización del SARS-CoV-2. Sin embargo, el incremento en los niveles de ACE2 también podría promover la entrada del SARS-CoV-2 en sus células diana. Dado que aún es insuficiente el conocimiento de los efectos de inhibidores de ACE y de bloqueadores del receptor de la AngII sobre ACE2, y sobre el daño tisular mediado por SARS-CoV-2, aún no es posible recomendar el uso de inhibidores de ACE o de bloqueadores del receptor de la AngII para el tratamiento de pacientes con COVID-19.34
Además del eje ACE2/Ang(1-7)/MasR, otras rutas han sido implicadas en el vínculo entre la enfermedad renal y la COVID-19. Básicamente, estas rutas consisten en la producción de factores proinflamatorios, la infiltración de células proinflamatorias en el intersticio renal y la activación de complejos C5b-9. Estos hallazgos tienen significativas implicaciones terapéuticas en el contexto de la COVID-19.36
Por otra parte, aun cuando en la presente revisión sistemática y metaanálisis se obtuvieron evidencias de asociación entre la ERC y un peor pronóstico en pacientes con COVID-19, estudios futuros deberán tomar en consideración la posible influencia de la concurrencia de otras comorbilidades como la hipertensión arterial, enfermedades cardiovasculares y diabetes, como condicionante potencial del pronóstico de pacientes con COVID-19 y ERC.
Conclusiones
La enfermedad renal crónica es un factor de riesgo que empeora el pronóstico de los pacientes con COVID-19. Este hallazgo es de importancia para el adecuado abordaje terapéutico de los pacientes afectados y para el desarrollo de estrategias de salud orientadas a la prevención y tratamiento de complicaciones médicas en el contexto de estas enfermedades.