Introducción
La inactividad física se considera un problema de salud mundial. Los datos recientes indican que un tercio de la población adulta está físicamente inactiva, o sea, que no realiza el mínimo de 150 min semanales de actividad aeróbica recomendada por la Organización Mundial de la Salud (OMS).1)
El ejercicio modula el sistema inmune.1,2 La inmunidad constituye el mecanismo de defensa del organismo encargado de mantener la homeostasis. Elimina antígenos exógenos y endógenos peligrosos, como células tumorales, productos de desecho o células apoptóticas. Cuando la función inmunológica se altera, se incrementa la susceptibilidad a infecciones o hay mayor propensión a desarrollar tumores malignos.2) La actividad física regular y adecuada beneficia la salud humana porque favorece el control del peso, la masa muscular y la función cardiorrespiratoria. También, contribuye a reducir el riesgo de contraer osteoporosis, diabetes, enfermedades cardiovasculares, depresión, ansiedad, deterioro cognitivo y algunos tipos de cánceres. Asimismo, el ejercicio mejora la calidad de vida de las personas mayores.3)
Desde 2010, en el campo de la inmunología, se han demostrado las implicaciones de la actividad física sobre el sistema inmune gracias al avance de la espectrometría de masas y la tecnología de pruebas genéticas.4) Actualmente se presta mayor atención a la metabolómica, la proteómica, la lipidómica, la caracterización del microbioma intestinal y los enfoques genómicos de la inmunología del ejercicio. Estos estudios proporcionan pautas acerca del deporte y la nutrición en la medicina personalizada.
Los cambios inmunitarios, agudos y crónicos, inducidos por cualquier tipo de entrenamiento resultan vías mecánicas importantes para dilucidar la inmunorregulación. La investigación en inmunología del ejercicio (epidemiológica y experimental) se ha desarrollado debido a este avance. El objetivo de este manuscrito fue describir los efectos de la actividad física sobre el sistema inmune innato y adaptativo.4,5)
Métodos
Se realizó la búsqueda en Google Académico y en la base de datos PubMed. Se seleccionaron los 53 artículos de investigación más relevantes acerca del tema, entre 1985 y 2020. Se utilizaron los términos de búsqueda “ejercicios físicos”, “inmunidad”, “macrófago”, “neutrófilos”, “linfocitos”, “inmunoglobulinas”, según los descriptores del DeCS.
Actividad física
La actividad física se define como cualquier movimiento corporal que produce un gasto de energía. Abarca las actividades que se realizan como parte de los momentos de juego o trabajo, formas de transporte activas, tareas domésticas y actividades recreativas.5,6
El ejercicio es un subconjunto de la actividad física planificada, estructurada, repetitiva y dirigida a mejorar o mantener la capacidad corporal. Se distingue entre agudo y crónico. El ejercicio agudo constituye la respuesta fisiológica asociada con los efectos inmediatos de una sola sesión de ejercicio; y el crónico se refiere a sesiones repetidas de ejercicio agudo y se denomina entrenamiento.5
La OMS y el Colegio Americano de Medicina del Deporte recomiendan para la salud un mínimo de 150 min de actividad física por semana.7) El ejercicio moderado beneficia la salud humana: reduce el riesgo de enfermedad cardiovascular o cáncer, tiene un efecto antioxidante y una influencia positiva sobre el sistema inmune. Por otro lado, el ejercicio intenso provoca efectos adversos a la salud y aumenta el riesgo de infecciones del tracto respiratorio superior.8)
Las observaciones sobre la cantidad e intensidad del ejercicio, y el riesgo de enfermedades han llevado a la hipótesis de que su relación se ajusta a una curva en forma de J,9 es decir, una actividad física muy baja y las cargas de entrenamiento muy altas se relacionan con mayor riesgo de enfermedad.9,10 En otras palabras, el ejercicio intensivo mantenido disminuye la funcionalidad y desregula el sistema inmune, lo que hace que el organismo sea más vulnerable a los agentes infecciosos. Esto se conoce como la “teoría de la ventana abierta de la susceptibilidad a las infecciones” y su efecto se observa, principalmente, en el período de recuperación, que puede durar de 3 a 72 h.10,11) La fatiga, la deficiencia nutricional, el estrés psicológico o las exposiciones ambientales se explican a través de la tasa de infecciones del tracto respiratorio superior en los atletas de alto rendimiento en comparación con la población general.12)
Igualmente, las adaptaciones agudas y a largo plazo de la inmunidad dependen del tipo o dosis de ejercicio, teniendo en cuenta parámetros como el volumen máximo de oxígeno (VO2máx) y los equivalentes metabólicos (METs) necesarios para la actividad física: baja intensidad (< 40 % VO2máx o menor 3 METs), moderada (40-69 % VO2máx o de 3 a 5,9 METs), vigorosa (70-90 % VO2máx o mayor 6 METs), o muy alta intensidad (> 90 % VO2máx o mayor 6 METs).11)
El entrenamiento con ejercicios se considera una terapia no farmacológica, tanto profiláctica como terapéutica, y representa una medida muy rentable para mejorar la calidad de vida humana.13
Consideraciones generales del sistema inmune
El sistema inmune se divide en dos componentes: inmunidad innata y adaptativa. La inmunidad innata incluye barreras físicas (piel), químicas (lágrima, sudor), biológicas (microbiota) y células macrófagos, neutrófilos, basófilos, eosinófilos, mastocitos, dendríticas, células T (asesinas naturales NKT), linfocitos T gamma delta (δγ), linfoides innatas (ILC, por sus siglas en inglés) y moléculas microbicidas como el óxido nítrico (NO), anión superóxido (O2 -), péptidos antimicrobianos (defensinas) y el sistema del complemento. El sistema inmune adaptativo involucra principalmente a los linfocitos T CD4+, T CD8+ y B.14
Los linfocitos T CD4+ (auxiliares) pueden diferenciarse en varias subpoblaciones: Th1, Th2, Th9, Th17, Th22, Tfh (folicular helper, por sus siglas del inglés) y linfocitos T reguladores inducidos (iTreg) que producen diferentes patrones de citocinas. La diferenciación de los linfocitos T CD4+ en Th1 se estimula por la interleucina (IL)-12 y el interferón gamma (INF-γ), producido por las células de antígeno (macrófagos, dendríticas y linfocitos B); mientras que la diferenciación en Th2 se induce por la acción IL-4, IL-5 e IL-13.15
Los linfocitos Th1 producen IFN-γ y se relacionan con la respuesta inmune celular en el control de infecciones causadas por microorganismos intracelulares. Los linfocitos Th2 controlan las infecciones de microorganismos extracelulares, por ejemplo, los parásitos (helmintos).15,16 Varios factores polarizan el tipo de respuesta predominante. El microambiente del tejido que induce la respuesta, las citocinas, las moléculas coestimuladoras, el tipo de antígeno y los eventos tempranos durante la respuesta inmune innata involucran las células dendríticas y las células asesinas naturales (NK). Se determina así el tipo de respuesta para la contención de una infección.16
Efectos del ejercicio sobre el sistema inmune y su interconexión
La evidencia científica indica que la activación de los leucocitos resulta más sutil en la actividad física que en el trauma o la sepsis.12 Existen similitudes entre el ejercicio y otras formas de estrés, principalmente a través de la liberación de catecolaminas en la circulación. El entrenamiento constituye una condición fisiológica única que aumenta el gasto cardíaco y las fuerzas de cizallamiento vascular; mejora la circulación de los músculos en funcionamiento; cambia sustancialmente el pH y la temperatura, y los factores que influyen en la función de los leucocitos.15
Los efectos agudos del ejercicio físico benefician la respuesta inmune, y dependen de la intensidad y la duración del esfuerzo. Los ejercicios moderados y vigorosos (150 min de ejercicio a la semana o tres veces por semana) se diferencian mediante un umbral de intensidad moderada.7,11
Una serie aguda de entrenamiento induce no solo las catecolaminas, sino también las moléculas miocinas, derivadas de fibras musculares y liberadas a la circulación durante el ejercicio. Gran cantidad de estas miocinas son citocinas que dirigen los flujos de sustrato de energía y coordinan la respuesta metabólica adaptativa en el músculo.17
Varias de las miocinas inducidas por el ejercicio se reconocen por controlar las células inmunitarias, incluidas IL-15, IL-7 e IL-6.18 Estas miocinas (citocinas) moduladoras proporcionan una base conceptual para comprender cómo los músculos que se contraen, se comunican con las células inmunitarias circulantes, y establecen un eje de diafonía entre el músculo y las células que vinculan la actividad física con la regulación inmune.17
Otros estudios refieren efectos del ejercicio físico agudo sobre la inmunovigilancia. Los aeróbicos de intensidad moderada y vigorosa menor a 60 min mejoran la actividad antimicrobicida de los macrófagos; garantizan un adecuado tráfico de neutrófilos, células NK, linfocitos T citotóxicos, linfocitos B inmaduros e inmunoglobulinas, y estimulan la secreción de citocinas antinflamatorias.19
Efectos de la actividad física sobre el sistema inmune innato
El ejercicio físico agudo moderado activa la respuesta inmune celular y humoral. Se ha demostrado que la actividad física regula la inflamación crónica y sus patologías asociadas, al controlar la producción de citocinas proinflamatorias y antiinflamatorias.20 El entrenamiento impacta directamente en el sistema inmune innato al dirigirse a la señalización de receptor tipo toll (TLR, por sus siglas en inglés). Actualmente se ha evidenciado la regulación de la función de los TLR en la salud y la enfermedad.21 La síntesis de citocinas (IL-6 e IL-10) y la expresión de TLR4 y cinasa 3, asociada al receptor de interleucina-1 (IRAK3, por sus siglas en inglés) en los neutrófilos, sufren una regulación positiva en individuos con resistencia saludable que realizan una única prueba de ejercicio (ciclismo durante 1 h con 105 % de producción de potencia, alrededor de 10 km).22)
Borges y otros20 demostraron que el entrenamiento en danza (4 meses, 60 min/día, dos veces por semana) resulta una estrategia no farmacológica para reducir la inflamación y mejorar la depuración de neutrófilos en pacientes con diabetes mellitus tipo 2 y en los controles. Además, constataron una reducción en los niveles plasmáticos de factor de necrosis tumoral- α (TNF-α, por sus siglas en inglés) y proteína C reactiva (1,4 veces en controles y 3,4 veces en los pacientes diabéticos).
Sureda y otros21 evidenciaron que el ejercicio agudo asociado a una sesión de buceo (50 m de profundidad durante 35 min) aumentó los genes de NF-κB, TLR4, ciclooxigenasa 2 (COX2), IL-6, IL-8, IL-10, IL-1 y óxido nítrico sintetasa inducible (iNOS, por sus siglas en inglés) en neutrófilos. Se demostró que el buceo mejora la respuesta inflamatoria en los neutrófilos.
El recuento de neutrófilos en sangre disminuye después de un ejercicio moderado y favorece los efectos antinflamatorios. Por el contrario, el ejercicio exhaustivo produce una leucocitosis aguda, con movilización de neutrófilos y linfocitos; aunque se han reportado tanto disminuciones como aumentos de la fagocitosis por parte de los neutrófilos y macrófagos.8 El trabajo físico moderado incrementa la actividad fagocítica.22)
Los monocitos se dividen en tres subconjuntos fenotípicos y funcionalmente distintos según la expresión superficial de los receptores CD14 y CD16. En condiciones homeostáticas, los monocitos clásicos (CD14++CD16-) se liberan diariamente de la médula ósea y tienen efecto antiinflamatorio debido a la producción en altos niveles de la citocina (IL-10). Se consideran monocitos proinflamatorios a los subconjuntos intermedios (CD14++CD16+) y no clásicos (CD14LowCD16++), debido que ambos producen citocinas (IL-1β y TNF-α).23,24
Una vez dentro del tejido, los monocitos se diferencian en macrófagos, que se clasifican en dos fenotipos: proinflamatorios o M1 y antinflamatorios o M2. La actividad física, de intensidad moderada a vigorosa, provoca una respuesta inmune transitoria que incluye monocitosis. Esta respuesta aumenta el recambio de monocitos antinflamatorios en circulación y promueve un microambiente que mantiene el equilibrio de macrófagos M1/M2 en el tejido. Los estudios de entrenamiento aeróbico en animales y humanos exponen el impacto beneficioso del ejercicio sobre la polarización de los macrófagos en el músculo esquelético y el tejido adiposo. Los macrófagos M2 se conservan en sujetos con actividad moderada y se reducen en individuos de baja actividad.
Las células dendríticas internalizan antígenos y muestran una gran cantidad de moléculas coestimuladoras, células presentadoras de antígeno muy importantes para los linfocitos T porque los activan y estimulan su expansión clonal.26
Chiang y otros27 observaron, después de cinco semanas de entrenamiento con roedores en cinta rodante, un aumento de las células dendríticas, especialmente las moléculas del complejo principal de histocompatibilidad clase i y la producción de IL-12. Esto sugirió la capacidad de inducir una respuesta inmune celular.
El ejercicio intenso afecta las células del sistema inmune, durante e inmediatamente después del ejercicio. Está demostrado que la carrera de maratón mejora la población de células dendríticas circulantes; mientras que disminuyen las células dendríticas plasmocitoides en los corredores sanos, lo cual indica que los mecanismos inmunomoduladores resultan fundamentales en la respuesta al ejercicio excesivo agudo.28
Las células NK pertenecen a la familia de las ILC. Constituyen un grupo de células inmune innatas con actividad citolítica espontánea contra las células sometidas a estrés, como las tumorales y las infectadas por virus. Después de la activación, las células NK secretan varias citocinas como IFN-γ, TNF-α, factor estimulante de colonias de granulocitos, macrófagos y quimiocinas (CCL1, CCL2, CCL3, CCL4, CCL5 y CXCL8), que modulan la función de otras células inmunes innatas y adaptativas.29)
Se han caracterizado dos subconjuntos de NK en sangre periférica humana en base al nivel de expresión de CD56: CD56bright y CD56dim. La mayoría de las células NK de sangre periférica resultan NK CD56dim, mientras que la proporción se invierte en la mayoría de los órganos, incluidos los tejidos linfoides donde dominan las células NK CD56bright. Estas se describen como la población inmunorreguladora, por su capacidad de secretar citocinas, y se consideran menos citotóxicas. Las células NKCD56dim poseen un fenotipo altamente citotóxico y pueden lisar de manera eficiente células estresadas.30
La epinefrina y la norepinefrina movilizan las células NK en humanos. Una sola sesión de entrenamiento las redistribuye entre la sangre y los tejidos. Esta respuesta aguda se caracteriza por el aumento de células NK circulantes (en su mayoría CD56dim) que disminuyen con la actividad física y vuelven a la línea de base en 24 h, según la duración y la intensidad del ejercicio.29,30)
El incremento de las células NK tiene una elevada capacidad citotóxica durante la recuperación de una serie aguda de entrenamiento. La proliferación de células NK y la producción de IFN-γ resultan mayores durante la recuperación porque la proporción de las células NK CD56bright se eleva 1 hora después de la práctica deportiva.29)
Las células NKT invariantes asociadas a mucosas (MAIT) no convencionales pertenecen a la inmunidad innata. Expresan un TCR semi-invariante Vα7.2-Jα33/20/12 en humanos, emparejados con un número limitado de cadenas Vβ, y reconocen precursores derivados de la biosíntesis de vitamina B2 (riboflavina) de origen microbiano, presentados por la molécula monomórfica relacionada con moléculas MHC clase i. Tras la infección microbiana, las MAIT producen citocinas y efectores citotóxicos, por tanto, se consideran actores importantes en la defensa del organismo; sin embargo, no se han estudiado suficientemente dentro de la inmunología del ejercicio. La actividad aeróbica máxima aumenta el número y la frecuencia de las células MAIT circulantes.31)
Malka y otros32 evidenciaron que el ejercicio agudo de intensidad moderada aumentó el recuento de células MAIT en un 91,5 % y volvió a la línea de base durante la recuperación. El estudio constató que las células MAIT para el receptor de quimiocinas CCR4, CCR5 y CCR6 no se modificaron, pero produjeron más citocinas (IL-2, IL-17, IFN-γ y TNF-α) después del ejercicio.
La microbiota intestinal son los microorganismos bacterianos del tracto digestivo. La variedad de microbios del intestino supera 10 veces las células del cuerpo humano, y el material genético resulta 150 veces mayor. La microbiota intestinal se constituye principalmente por Firmicutes y Bacteroides, que representan entre el 80 y el 90 %, seguidos de Actinobacteria y Proteobacteria.33)
Estos microorganismos poseen funciones protectoras, estructurales y metabólicas. Un estudio en jugadores de rugby de élite demostró que el deporte enriquece la diversidad de la microbiota intestinal, y se asocia positivamente con la ingesta de proteínas y los niveles de creatina cinasa. También se evidenció la diversidad de la phyla Firmicutes (Faecalibacterium prausnitzii) y su contribución a la homeostasis intestinal. Estos resultados indican que la dieta y el ejercicio favorecen la biodiversidad microbiana del intestino.34)
Resultados similares obtuvieron Estaki y otros35 cuando observaron la microbiota fecal en individuos con diferentes niveles de condición física y dieta. Como indicador de la aptitud física utilizaron el consumo máximo de oxígeno. Los resultados demostraron que, independientemente de la dieta, la capacidad cardiorrespiratoria se asocia con una mayor diversidad microbiana intestinal. Los individuos aptos mostraron una microbiota enriquecida en taxones productores de butirato, como Clostridiales, Roseburia, Lachnospiraceae y Erysipelotrichaceae, indicadores de la salud intestinal.
La diversidad de la microbiota indica buena salud intestinal. Un experimento en ratas libres de gérmenes y controles mostró que el músculo y la microbiota se vinculan por dos vías metabólicas.34,35 Por un lado, los niveles de la proteína cinasa se activan por monofosfato de adenosina 5', enzima involucrada en la homeostasis energética, la oxidación de ácidos grasos y la absorción de glucosa. La microbiota suprimió la oxidación de ácidos grasos y la absorción de glucosa en el músculo esquelético de las ratas libres de gérmenes en un 40 % más alto que en las ratas de control.33,35
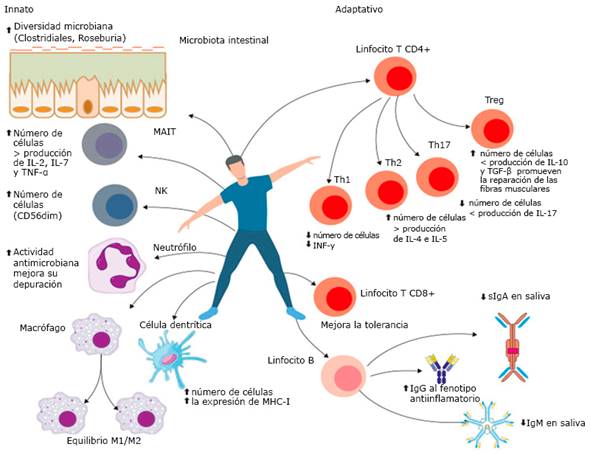
Por otro lado, la ausencia de microbiota provocó un aumento del factor adiposo inducido por ayuno (FIAF, por sus siglas en inglés) en el intestino. Este FIAF inhibe el proliferador peroxisomal de lipoproteína lipasa involucrado en la regulación de genes codificadores de enzimas que se implican en la oxidación de ácidos grasos del músculo. Actualmente, no se comprenden completamente los mecanismos por los cuales el ejercicio causa cambios en la microbiota (fig.).34,35
Efectos de la actividad física sobre la inmunidad adaptativa
Los linfocitos B se originan en la médula ósea y los que sobreviven a los mecanismos de la tolerancia central migran hacia el bazo, órgano donde culmina su maduración. Allí sufren la inducción de la tolerancia periférica y de esta forma los linfocitos B autorreactivos que hayan escapado a la inducción de la tolerancia central no continúan su desarrollo.36 Después de atravesar estos procesos se ubican en los ganglios linfáticos y se activan en presencia de un agente extraño, con la cooperación de los linfocitos T CD4+, aunque bajo ciertas circunstancias pueden hacerlo sin estos. Los linfocitos B se diferencian en plasmoblastos y terminan de distinguirse en células plasmáticas en los órganos linfoides secundarios.37
Las células plasmáticas desempeñan un papel fundamental en la respuesta inmunitaria al producir anticuerpos o inmunoglobulinas (IgM, IgD, IgG, IgE e IgA). Las inmunoglobulinas poseen dos regiones funcionales: la fracción de unión al antígeno (Fab, por sus siglas en inglés) y la fracción constante (Fc).36,37 La Fab se une a una gama de antígenos y a sitios específicos (epítopos) para formar inmunocomplejos (antígeno-anticuerpo) que neutralizan antígenos virales.37)
No obstante, en la mayoría de los procesos infecciosos, la inmunoglobulina per se no neutraliza la patogenia del microorganismo ni promueve su eliminación; necesita de la Fc para activar y mediar la citoxicidad dependiente de anticuerpos y de complemento, la fagocitosis celular dependiente de anticuerpos, la trogocitosis, la secreción de mediadores y la endocitosis de moléculas opsonizadas.36
La inmunoglobulina A secretora (sIgA) produce la resistencia del hospedero. Estudios previos manifiestan que la concentración y la velocidad de flujo de la sIgA disminuyen después de un ejercicio intenso de resistencia. La producción de IgA e IgM se reduce después de un breve ejercicio de intervalo supramáximo y esta disminución se debe, al menos parcialmente, a la merma del flujo de saliva.38,39)
Las concentraciones salivales de IgA bajan después del ejercicio agudo, extenuante y de gran volumen. Por ejemplo, las concentraciones de IgA se redujeron en un 30 % después de tres pruebas de Wingate, un 50 % tras una carrera de maratón y un 75 % al concluir un partido de fútbol de jugadores de élite.39
La IgG se encuentra en mayor concentración en el suero del organismo y es una de las glicoproteínas más estudiadas. Cada molécula de IgG tiene dos sitios de glicosilación conservados para cada una de sus cadenas pesadas en asparagina-297 del dominio constante 2 (CH2). Los glicanos se conservan en la región Fc de la IgG, entre el 15 y el 25 % de la IgG sérica contiene glicanos dentro de los dominios variables.40,41) Los diferentes glicanos, unidos a estos sitios de glicosilación, pueden alterar la conformación, la estabilidad y la vida media de la IgG, y su afinidad por los receptores Fc. Al cambiar esta afinidad, sus efectos se alteran y la vuelven inflamatoria.41
La galactosa reduce el potencial inflamatorio, en su asencia los glicanos activan el complemento y hacen que la IgG sea proinflamatoria. La N-glicosilación de la IgG y las proteínas plasmáticas proporcionan información para aclarar los efectos del ejercicio. Con el fin de comprender la relación entre la actividad física y la inflamación, se examinó el efecto del ejercicio intenso en forma de entrenamiento de velocidad repetida sobre la N-glicosilación de las proteínas plasmáticas totales y de la IgG. Los resultados mostraron un cambio hacia un perfil de IgG menos inflamatorio (N-glicosilación), se manifestó una disminución de N-glicanos agalactosilados y un aumento de N-glicanos digalactosilados y monosialilados.40,41
Alikhazaei y otros42 mostraron que los niveles séricos de inmunoglobulina G, A, M y E en pacientes con diabetes mellitus tipo 2 y grupo controles aumentaron significativamente después de 8 semanas de entrenamiento con ejercicios aeróbicos. Según estos resultados, se puede afirmar que el entrenamiento de fuerza mejora el sistema inmune del paciente diabético y reduce el riesgo de infección. Los ejercicios cortos e intensos no tienen efecto significativo sobre la concentración sérica de la IgM, la IgG y la IgA.
Los linfocitos T citotóxicos (CTL, por sus siglas del inglés) juegan un papel importante en la respuesta inmune celular adaptativa al eliminar las células infectadas por microorganismos intracelulares y las células tumorales. Esto implica la liberación de moléculas citotóxicas a través de exocitosis en un área de contacto de la célula CTL-célula diana; este contacto se le denomina sinapsis inmunológica.43)
Durante el ejercicio aumentan los linfocitos T CD8+ en comparación con los T CD4+. Aunque la concentración de todas las subpoblaciones de linfocitos aumenta, el porcentaje de linfocitos T CD4+ disminuye debido a que las células NK aumentan más que cualquier otra subpoblación.43,44)
La disminución de la concentración de linfocitos T en el período posterior al ejercicio intenso se debe a un mecanismo de apoptosis. El ejercicio intenso reduce la concentración de glutatión (GSH) en los linfocitos e induce al estrés oxidativo; también se activan las caspasas y se incrementa la fragmentación del ADN (ácido desoxirribonucleico). Algunos autores asocian el ejercicio intenso con la apoptosis por los altos niveles de catecolaminas producidos, mientras que otros lo asocian con un aumento del estrés oxidativo.45
El ejercicio de intensidad moderada e intensa afecta el equilibrio Th1/Th2. Suprime la distribución y función de los linfocitos Th1, efecto asociado con la inhibición de IL-12; esta citocina mejora la capacidad de los monocitos antiinflamatorios para inducir la síntesis de IL-4 por linfocitos CD4+ (Th2).44,45)
La poca producción de IL-17 tiene un efecto antiinflamatorio beneficioso, fundamentalmente a nivel de mucosas (intestinal).45,46 El IFN-γ suprime la diferenciación de las células Th17, y el ejercicio moderado afecta la secreción de IFN-γ e IL-17, es decir, incrementa el IFN-γ y disminuye el IL-17.46
Las series de ejercicio prolongado y muy extenuante, una maratón o ultramaratón, por ejemplo, alteran la función inmunológica y cambian el equilibrio hacia un estado inmunosupresor. Esta desregulación inmunológica puede durar varios días después del ejercicio y se caracteriza por una merma de los linfocitos circulantes, la función citolítica deficiente de células NK, la baja secreción de IgA y una respuesta alterada de Th1/Th2.47
El FOXP3 constituye un marcador establecido de los Treg comprometidas. Se regula con mecanismos epigenéticos, entre ellos destacan la actividad física, la nutrición y la contaminación del medio ambiente.48,49 Modelos in vitro han establecido que la desmetilación del promotor FOXP3 resulta fundamental para su estabilidad y la función supresora de Treg. Este efecto ocurre al realizar ejercicios físicos de intensidad moderada.49)
Los cambios relacionados con el envejecimiento que afectan el sistema inmune se definen con el término inmunosenescencia. El deterioro etario del sistema inmunológico se refleja en una mayor frecuencia de infecciones, cáncer, enfermedades cardiovasculares, autoinmunes, neurodegenerativas y la reducida respuesta a las vacunas. Tanto la respuesta inmune innata como la adaptativa se afectan con el proceso de envejecimiento. La respuesta adaptativa sufre mayor daño debido a la involución tímica, senescencia replicativa y la estimulación antigénica crónica.49,50
La involución tímica se considera el factor principal en la inmunosenescencia. Se inicia en la pubertad y se completa en un 90 % entre los 40 y 45 años. Las reducciones de la masa tímica resultan en una disminución de los timocitos y los linfocitos T vírgenes.51)
La senescencia replicativa inicia cuando las células alcanzan el límite de Hayflick. Los linfocitos T CD8+ resultan los más afectados y dejan de dividirse. La pérdida de CD28 en los linfocitos T de adultos mayores tiene un mayor impacto en su actividad funcional y conduce a un predominio de linfocitos de memoria y exhaustos, que se agrava por la estimulación antigénica crónica (acortamiento de los telómeros).52)
Rodrigues y otros53 indican que el ejercicio moderado o intenso puede atenuar los efectos del envejecimiento en la longitud de los telómeros, la supervivencia y composición de las subpoblaciones de linfocitos T. Se estudiaron ancianos entre 65 y 85 años, con estilo de vida de entrenamiento intenso, entrenamiento moderado y que nunca entrenaron. Los tres grupos presentaron la contracción asociada a la edad de los linfocitos T vírgenes (CD4+ y CD8+) y la expansión de los compartimentos de memoria. Los telómeros fueron más largos en los linfocitos T (principalmente en los CD8+) en los grupos con entrenamiento.
Conclusiones
El ejercicio físico regular favorece la salud y la respuesta inmune; pero debe controlarse la intensidad para obtener mejores beneficios. El ejercicio agudo se considera un inmunoestimulante. Cada entrenamiento desarrolla la actividad antimicrobicida de los macrófagos, incrementa la síntesis de citocinas antiinflamatorias, y mejora el tráfico de neutrófilos, células NK, CTL y linfocitos B inmaduros.
Los efectos del entrenamiento físico moderado a vigoroso constituyen una estrategia no farmacológica por los múltiples ventajas que aporta al organismo, entre ellas, la depuración y la respuesta inflamatoria de los neutrófilos; el recambio de los monocitos que los polariza a M2; el incremento de las células dendríticas, NK circulantes y MAIT; y la diversificación de la microbiota intestinal. Para comprender la relación del ejercicio físico y sistema inmune deben realizarse nuevos estudios sobre las implicaciones de las células linfoides innatas, linfocitos T γδ y linfocitos B reguladores.