Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Pastos y Forrajes
versión impresa ISSN 0864-0394
Pastos y Forrajes v.33 n.3 Matanzas jul.-sep. 2010
ARTÍCULO DE INVESTIGACIÓN
Aislamiento e identificación de cepas de Azospirillum sp. en pasto guinea (Panicum maximum Jacq.) del Valle del Cesar
Isolation and identification of Azospirillum sp. in Guinea grass (Panicum maximum Jacq.) of the Valle del Cesar
Diana M. Cárdenas1, María F. Garrido2, Ruth R. Bonilla3 y Vera L. Baldani4
1Departamento de Biología, Universidad Francisco de Paula Santander.
Avenida Gran Colombia No. 12E-96 Barrio Colsag. Cúcuta, Colombia.
E-mail: dicarcaro@hotmail.com
2Corporación Colombiana de Investigación Agropecuaria-CORPOICA. Bogotá, Colombia
3Laboratorio de Microbiología de Suelos Corporación Colombiana de Investigación Agropecuaria-CORPOICA. Bogotá, Colombia
4EMBRAPA Agrobiología. Seropedica-Brasil
RESUMEN
Se evaluó el efecto de factores ambientales del Valle del Cesar y el manejo agronómico del pasto guinea (Panicum maximum Jacq.), sobre la población bacteriana del género Azospirillum en medios de cultivo semisólidos NFb y LGI, para lo cual se utilizó un diseño experimental en parcelas divididas con un arreglo factorial de 2 (épocas climáticas: lluvia y sequía) x 2 (manejos agronómicos: agroecólogico y extractivo) x 3 (muestras analizadas: suelo rizosférico, raíces y hojas). Los resultados no revelaron diferencias estadísticas significativas, lo que indica que esta bacteria puede mantener su población en condiciones de estrés por diferentes mecanismos fisiológicos. A partir de estas muestras se obtuvieron 16 aislamientos pertenecientes al género Azospirillum, a los cuales se les evaluó su actividad de reducción de acetileno como indicador de la fijación biológica de nitrógeno y su capacidad en la producción de compuestos indólicos como promotores del crecimiento vegetal. Se seleccionaron las cepas SRGM2, SRGM3 y SRGM4 obtenidas de muestras de suelo rizosférico de pasto guinea de la Estación Experimental Motilonia de Corpoica, municipio Agustín Codazzi, departamento del Cesar. Estos aislamientos se caracterizaron molecularmente por el gen 16S rRNA y según el análisis BLAST en la base de datos del GenBank y presentaron 93% de similitud con A. lipoferum (SRGM2 y SRGM3) y 94% con A. brasilense (SRGM4).
Palabras clave: Crecimiento, fijación del nitrógeno, Azospirillum sp.
ABSTRACT
The effect of environmental factors of the Valle del Cesar and the agronomic management of Guinea grass (Panicum maximum Jacq.), on the bacterial population of the Azospirillum genus in semisolid NFb and LGI culture media was evaluated, for which an experimental design was used in divided plots with a 2 (climatic seasons: rainy and dry) x 2 (agronomic managements: agroecological and extractive) x 3 (analyzed samples: rhizospheric soil, roots and leaves) factorial arrangement. The results did not reveal significant statistical differences, which indicates that this bacterium can maintain its population under stress conditions by different physiological mechanisms. From these samples 16 isolations were obtained belonging to the Azospirillum genus in which their acetylene-reduction activity was evaluated as indicator of biological nitrogen fixation and their capacity in the production of indolic compounds as plant growth promoters. The strains SRGM2, SRGM3 and SRGM4, obtained from rhizospheric soil samples of Guinea grass of the Experimental Station Motilonia of Corpoica, Agustín Codazzi municipality, Cesar department, were selected. These isolations were molecularly characterized by the gen 16S rRNA and according to the BLAST analysis in the GenBank database and showed 93% similarity with A. lipoferum (SRGM2 and SRGM3) and 94% with A. brasilense (SRGM4).
Key words: Growth, nitrogen fixation, Azospirillum sp.
INTRODUCCIÓN
El Cesar es uno de los principales departamentos ganaderos de la región Caribe colombiana y constituye una importante región productora de leche (Gamarra, 2005). Sus suelos se derivan de materiales sedimentarios bien drenados y el pH es cercano a la neutralidad; tienen bajos niveles de materia orgánica, altos contenidos de Ca y bajos niveles de Mg, K y elementos menores; su textura varía de franco a franco-arcillosa. En ellos se cultivan especies forrajeras, entre las cuales el pasto guinea (Panicum maximum Jacq.) alcanza una alta productividad en materia seca, de alrededor de 12 a 18 t/ha (Cuesta-Muñoz et al., 2005). Sin embargo, estos suelos presentan deterioro físico, químico y biológico, lo que afecta severamente su capacidad productiva y compromete la viabilidad económica de los sistemas ganaderos. Lo anterior es ocasionado, entre otros factores, por el uso indiscriminado de fertilizantes químicos principalmente como fuente de N, el cual desempeña un papel importante (junto con el P y el K) para el crecimiento de las plantas (Osorio, 2007; Cordero et al., 2008). La fjación biológica de nitrógeno realizada únicamente por bacterias es una alternativa viable, ambiental y económicamente, para suplir la inclusión de fuentes de N de origen sintético, ya que el nitrógeno molecular (N2) es la única reserva inagotable en la biosfera.
En la rizosfera de los pastos tropicales y subtropicales están presentes microorganismos fijadores de N2; diversos estudios han demostrado que existe una alta especificidad de los aislamientos obtenidos de diferentes raíces de gramíneas con respecto a la especie de diazotrófico encontrado, es decir que los exudados radicales, el pH del suelo y otras características de la especie vegetal y del suelo podrían influir en la presencia de algunos géneros fijadores biológicos (Reis Junior et al., 2004; Radwan et al., 2005). Estudios de más de 20 años indican que las bacterias del género Azospirillum tienen una especial afinidad por las raíces de las gramíneas (Brasil et al., 2005), como es el caso de los pastos que responden con incrementos en su crecimiento y rendimiento cuando son inoculados con Azospirillum spp. La secreción de sustancias promotoras del crecimiento de las plantas (tales como auxinas, giberelinas y citoquininas) por Azospirillum, parece estar involucrada parcialmente en este efecto (Reis Junior et al., 2004; Radwan et al., 2005; Kuss et al., 2007).
Teniendo en cuenta que en Colombia no existe hasta el momento ningún registro de la evaluación de poblaciones de esta bacteria asociadas a las pasturas, este trabajo tuvo como objetivo iniciar el estudio de cepas nativas de Azospirillum en el pasto guinea en el Valle del Cesar, como el primer paso hacia la búsqueda de aislamientos con potencial biofertilizante.
MATERIALES Y MÉTODOS
Determinación del efecto de las épocas de lluvia y sequía sobre las poblaciones de Azospirillum en el pasto guinea. Se tomaron muestras del suelo rizosférico y de la planta completa de guinea en la época de lluvia en septiembre de 2006 (158,6 mm de precipitación y 28,1ºC de temperatura) y en la seca en febrero de 2007 (0 mm de precipitación y 31ºC de temperatura). Los dos sitios seleccionados presentan condiciones contrastantes respecto al manejo del suelo. En la E.E. Motilonia se desarrollan prácticas agronómicas como la incorporación de materia orgánica al suelo, la planificación de la siembra y el pastoreo racional; en la finca Fernambuco se practica el sobrepastoreo y el laboreo intensivo del suelo.
El suelo rizosférico se obtuvo al removerlo de las raíces, a partir del cual se realizaron diluciones hasta 10-6 en solución salina al 0,85% de NaCl. Se inocularon 0,1 mL de cada dilución en tres viales de medio semisólido NFb y LGI, para el recuento de Azospirillum spp. y Azospirillum amazonense, respectivamente (Döbereiner et al., 1995). Las raíces del pasto se lavaron y se cortaron en fragmentos de 1 cm y se desinfectaron con alcohol de 70º durante 1 min; después se sumergieron en hipoclorito de sodio al 2% por 2 min y se realizaron dos enjuagues sucesivos en agua estéril. Se pesó 1 g de estas raíces y se maceraron en 9 mL de solución salina estéril (0,85% de NaCl). Las hojas y los tallos se lavaron con agua destilada y se secaron. Se pesó 1 g de este material vegetal cortado en fragmentos de 2 cm, se desinfectaron con alcohol de 70º y se maceraron en 9 mL de solución salina estéril (0,85% de NaCl). Se realizaron diluciones seriadas hasta 10-6 a partir de estos macerados y se inocularon de igual forma que la muestra de suelo rizosférico. Los viales inoculados se incubaron durante 5 días a 32ºC hasta la formación de una película subsuperficial como indicador del crecimiento positivo.
Se cuantificó la población mediante el método del Número Más Probable para tres tubos, aplicando la tabla de McCrady (Döbereiner et al., 1995). Se realizaron tres repeticiones y se hizo un análisis de varianza según el diseño experimental en parcelas divididas con un arreglo factorial de 2 (épocas climáticas) x 2 (manejos agronómicos) x 3 (muestras analizadas); se empleó la prueba de comparación de Duncan al 5% de probabilidad, utilizando el programa estadístico SAS versión 9.1.3.
Aislamiento e identificación fenotípica de Azospirillum spp. Se seleccionaron los viales de las diluciones más altas con crecimiento positivo y se replicaron en un nuevo medio semisólido. A partir de esta película se hizo el aislamiento en placas de agar Rojo Congo para seleccionar colonias rojo escarlata (Rodríguez-Cáceres, 1982) y en agar Batata para seleccionar colonias rosadas, pequeñas y estructuradas, después de una semana de incubación a 32°C (Döbereiner et al., 1995). Las células bacterianas se observaron en microscopio con un aumento de 1000x y se realizó un frotis en agua destilada para describir la forma y el movimiento de las células. Las características de movilidad en espiral, crecimiento en agar Batata y Rojo Congo, se compararon con las de las cepas de referencia Azospirillum brasilense (Sp7) y Azospirillum lipoferum (Y2). Sus semejanzas se estimaron por el coeficiente de JACCARD y se agruparon por el método del análisis entre grupos para realizar un dendrograma, utilizando el programa SPSS 10.0 para Windows.
Selección de las cepas de Azospirillum spp. con potencial biofertilizante. Los aislamientos presuntivos para el género Azospirillum se evaluaron según la actividad de la enzima nitrogenasa y la producción de sustancias indólicas promotoras del crecimiento vegetal. Las cepas se replicaron en agar Rojo Congo y se obtuvieron suspensiones celulares ajustadas a una concentración celular de 1*107 UFC/mL. Se inocularon 30 mL de caldo DYGS al 2% y se llevó a incubación durante 48 horas a 32ºC y 120 rpm. La biomasa obtenida se centrifugó a 8 000 rpm durante 10 minutos. El sobrenadante se descartó y las células fueron suspendidas en 30 mL de buffer fosfato estéril 0,06 M y pH 7.0. De esta suspensión celular se tomaron 100 mL y se inocularon en 50 mL de caldo NFb sin azul de Bromotimol y solución de vitaminas, con una concentración de 200 mM de triptófano como precursor del ácido indolacético y 0,2 g/L de NH4Cl como fuente de N. Se incubó en oscuridad por 48 h, 120 rpm y 32ºC (Radwan et al., 2004). Se centrifugaron 10 mL del cultivo a 8 000 rpm por 10 minutos y se tomaron 2 mL del sobrenadante, al cual se le adicionaron 8 mL de reactivo de Salkowsky. Se realizó la lectura de la absorbancia de las muestras a 535 nm en espectrofotómetro Spectronic 601 Milton Roy. La concentración de compuestos indólicos se calculó utilizando la ecuación Y=0,0033X-0,0311 (R2=0,9855) donde, Y=Absorbancia de la muestra a 535 nm y X=µM de ácido indolacético (AIA). Esta ecuación se obtuvo con la regresión lineal de la curva de calibración en diferentes concentraciones de AIA (25, 50, 100,150, 200, 250 y 300 µM) con la adición del reactivo de Salkowsky (Kuss et al., 2007).
Para la cuantificación de la fijación biológica de nitrógeno in vitro se utilizó el método de reducción de acetileno. Los aislamientos se inocularon en frascos de 10 mL con 3 mL de medio semisólido (NFb o LGI) y se incubaron durante 24 horas a 32ºC. Posteriormente se reemplazó el tapón por uno de caucho sellándolo herméticamente, se sustituyó el 10% de su atmósfera por acetileno y se incubó durante 1 hora a 32ºC. El etileno se midió inyectando 1 mL de la atmósfera del frasco de cultivo en un cromatógrafo de gases Perkin Elmer con detector de ionización de llama y una columna Poropak N 200/300 mesh de 6 pies y 3 mm de diámetro. La actividad de reducción de acetileno para cada aislado se calculó según la altura del pico de etileno en el cromatograma, extrapolando en la ecuación Log10Y = 0,808 Log10X + 9,7 (R2 = 0,997), obtenida de la regresión lineal de una curva de calibración en concentraciones de etileno de 1, 1:10, 1:100, 1:1000 y 1:10 000, en las mismas condiciones del cromatógrafo (Corpoica, 2006). Se comparó la producción de compuestos indólicos y la fijación biológica de nitrógeno, y sus similitudes se estimaron según la distancia euclidiana. Después se agruparon por el método de las medianas y se representaron gráficamente en un dendrograma, utilizando el programa SPSS 10.0 para Windows.
Identificación de los aislamientos de Azospirillum spp. por medio del análisis del gen 16S rrna. Las cepas seleccionadas fueron cultivadas en caldo LB por 14 h a 150 rpm y 30ºC. Se tomaron 25µL y se mantuvieron en baño termostatado durante 15 minutos. Después se centrifugó a 13 000 rpm por 1 min. El sobrenadante se descartó y el precipitado se resuspendió en 1 mL de agua Milli-Q estéril. La amplificación de la región 16S rRNA se realizó en 25µL de una mezcla de reacción de Buffer (1x), MgSO4 (1,5 mM), dNTP (0,2 mM), Primer 27F (Edwards et al., 1989) y 1492R (0,2 mM) (Weisburg et al., 1991), 0,25µL de Taq DNA Polimerasa y 1,5µL de DNA molde (muestra del aislamiento). Las condiciones del termociclador fueron: un ciclo inicial de denaturación (94ºC por 5 min), 50 ciclos de denaturación (94ºC por 30 seg), anillaje (66ºC por 30 seg) y extensión (72ºC por 1 min) y tres ciclos de extensión final (72ºC por 10 min). Los fragmentos amplificados se observaron mediante electroforesis en gel de agarosa al 0,8% en TAE acondicionado con 0,5 µg/mL de bromuro de etidio, para visualizar las bandas resultantes. El ADN amplificado se purificó utilizando QIAquick PCP Purification Kit Protocol de QIAquick® Spin Handbook de QUIAGEN, se cuantificó en un NanoDrop Spectrophotometer ND-1000 y se analizó en el programa ND-1000 V.3.3.0. a una longitud de onda de 260 nm. El producto amplificado se secuenció en un equipo ABI PRISM Genetic Analyzer, que realiza la secuenciación automática de fragmentos de DNA marcados con fluorocromos. El resultado se analizó a través de BLAST (Basic Local Alignment Search Tool) en www.ncbi.nlm.nih.gov/BLAST/Blast.cgi.
RESULTADOS Y DISCUSIÓN
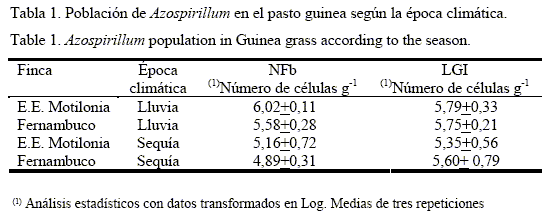
Efecto de la época climática y el manejo agronómico del pasto guinea en las poblaciones de Azospirillum. Según el análisis de varianza, el recuento de la población de Azospirillum no presentó diferencias significativas según la época climática y el manejo agronómico de la guinea. Sin embargo, esta población tendió a ser mayor en la época de lluvia bajo un manejo agroecológico del pasto guinea en la E.E. Motilonia con respecto a la época de sequía en las dos localidades, lo que demuestra la influencia de los factores ambientales en la población bacteriana (tabla 1).
Brasil et al. (2005) reportaron una disminución del número de bacterias diazotróficas en las raíces y en el suelo de las gramíneas Axonopus purusii, Elyonurus muticus y Brachiaria humidicola, en la época seca. Por su parte, Reis Junior et al. (2004) obtuvieron poblaciones de A. amazonense de 5,81 unidades log en raíces de Brachiaria spp. en invierno, estadísticamente diferente a 3,67 unidades log en la época seca en una zona tropical con estación seca en el invierno. Sin embargo, cuando evaluaron la población de A. amazonense en una zona tropical sin estación seca no encontraron diferencias significativas.
Aunque se evidenció una disminución en la población de Azospirillum spp. en la época de sequía, estas bacterias pueden sobrevivir debido a sus características fisiológicas, ya que presentan una alta capacidad para cambiar su actividad metabólica, cuando varían las condiciones ambientales en el suelo, principalmente la disponibilidad de agua, carbono y nitrógeno y la tensión de oxígeno. De esta forma, las especies de Azospirillum pueden utilizar amonio, nitrato, nitrito, aminoácidos y nitrógeno molecular como fuente de nitrógeno (Steenhoudt y Vanderleyden, 2000) y, en condiciones desfavorables como la sequía y limitación de nutrientes, pueden experimentar ciertos cambios morfológicos y bioquímicos para formar estructuras similares a quistes que les permiten sobrevivir en condiciones físicas adversas, particularmente la desecación (Sadasivan y Neyra, citados por Joe et al., 2009).
Por otro lado, cuando se compararon las poblaciones de Azospirillum spp. en el suelo rizosférico, las raíces y las hojas del pasto guinea en medio NFb y LGI, se registraron diferencias significativas (P<0,05) con respecto a estas tres muestras estudiadas. Se observó que el recuento de células en las hojas presentó el valor de población más alto, seguido de las raíces y el suelo rizosférico (tabla 2).
Estos resultados son similares a los reportados por Brasil et al. (2005) en tres gramíneas, quienes observaron un número mayor de bacterias en las hojas, en el medio NFb, y valores similares estadísticamente en medio LGI. La presencia de las bacterias en todas las estructuras de la planta ha sido descrita en diversas investigaciones, pues a pesar de que es considerada una rizobacteria y coloniza principalmente la zona de elongación de los pelos radiculares, también se ha encontrado en el interior de las raíces y en la parte aérea de varias especies vegetales (Brasil et al., 2005; Brasil et al., 2006; Kuss, 2006). Probablemente, todas las especies de Azospirillum puedan desarrollar este mecanismo de colonización y es por esto que se han encontrado en mayor número colonizando las raíces, ubicadas en las capas de mucigel o penetrando las células corticales de la raíz de diferentes plantas. Sin embargo, las especies de Azospirillum tienen mecanismos específicos para interactuar con las raíces y colonizar su interior, e incluso ir penetrando el tejido foliar, a través de la actividad enzimática celulolítica y pecnitolítica, invadiendo los espacios intercelulares e incluso traslocándose a través de los vasos vasculares hacia el tallo y las hojas (Steenhoudt y Vanderleyden, 2000).
Caracterización fenotípica de los aislamientos obtenidos. Se seleccionaron 16 aislamientos del género Azospirillum según las características fenotípicas, los cuales se obtuvieron de las muestras de suelo rizosférico, las raíces y las hojas del pasto cultivado en la E.E. Motilonia de Corpoica y la finca Fernambuco (tabla 3).
En la figura 1 se observa el dendrograma según la matriz de similitud y un análisis entre grupos de los 16 aislamientos, con las cepas de referencia Sp7 (A. lipoferum) y Y2 (A. brasilense). Se obtuvieron tres grupos con diferentes valores de distancia entre ellos. El grupo I presentó cuatro aislamientos muy cercanos a las cepas Sp7 y Y2. El grupo II mostró cuatro aislamientos, pero resultó distante un 20% del grupo I. Por último, el número III incluyó ocho aislamientos y conformó un grupo independiente con 25% de distancia de los primeros (I y II).
Este primer agrupamiento permitió seleccionar ocho aislamientos con un máximo de 20% de distancia con respecto a las cepas Sp7 y Y2. Los aislamientos seleccionados fueron HGF3, SRGM4, SRGM3, SRGM2, RGM1, RGM3, RGM6 y HGF1, los cuales se analizaron según su actividad fijadora de nitrógeno y síntesis de ácido indolacético.
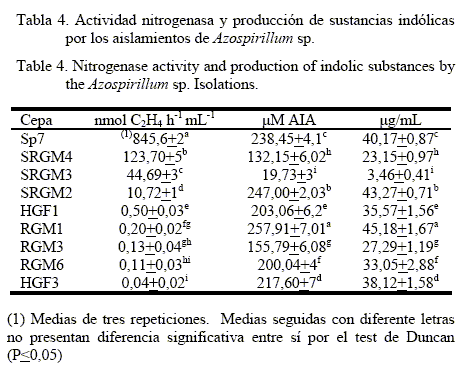
Selección de aislamientos de Azospirillum con potencial biofertilizante. Aunque originalmente se sugirió que el mecanismo de acción de Azospirillum para promover el crecimiento de las plantas era su habilidad para fijar el nitrógeno atmosférico, en la actualidad se han propuesto mecanismos alternativos, como la producción de reguladores de crecimiento vegetal o fitohormonas (Carcaño-Montiel et al., 2006). Por esta razón, la selección de cepas de Azospirillum se realizó teniendo en cuenta su actividad fijadora de nitrógeno y la capacidad de producción de compuestos indólicos, entre las cuales se observaron diferencias estadísticas para todos los aislamientos evaluados (tabla 4).
Actividad nitrogenasa de los diferentes aislamientos. La cepa Sp7 (A. brasilense) registró el mayor valor de reducción de acetileno, con 845,6 nmol C2H4 h-1 mL-1. Con respecto a los aislamientos nativos, la cepa SRGM2 presentó una actividad de reducción de acetileno de 10,72 nmol C2H4 h-1 mL-1, similar a lo reportado por los aislamientos de A. lipoferum N7 y A. brasilense N8 con una actividad nitrogenasa de 6,6 y 7,95 nmol C2H4 h-1 mL-1, respectivamente (Mehnaz y Lazarovits, 2006). SRGM3, según su actividad reductora de acetileno de 44,69 nmol C2H4 h-1 mL-1, fue similar a las cepas de Azospirillum aisladas de maíz silvestre (Teocintle) con actividad nitrogenasa hasta de 46,44 nmol C2H4 h-1 mL-1 (Carcaño-Montiel et al., 2006). Por su parte, SRGM4 fue más eficiente con un valor de 123,70 nmol C2H4 h-1 mL-1, similar a lo reportado para la cepa Azospirillum doebereinerae aislada de Miscanthus sinensis cv. Giganteus, que presentó un valor de 100 nmol C2H4 h-1 mL-1 para la reducción de acetileno (Eckert et al., 2001). Los demás aislamientos presentaron valores de ARA inferiores a 1 nmol C2H4 h-1 mL-1, similar a las cepas de A. brasilense Cd y Az39 con 0,162 y 0,1 nmol C2H4 h-1 mL-1, respectivamente (Perrig et al., 2007).
Aunque se observó una variación en la actividad enzimática de la fijación biológica de nitrógeno, pudo demostrarse que Azospirillum es un género importante asociado a las gramíneas tropicales, capaz de reducir el nitrógeno atmosférico en amonio bajo condiciones microaerofílicas, a través de la actividad del complejo nitrogenasa, la cual contiene un cofactor hierro-molibdeno, que es el sitio de reducción de N2, y de la proteína reductasa dinitrogenasa que transfiere electrones desde un donador de electrones hasta la proteína nitrogenasa (Steenhoudt y Vanderleyden, 2000).
Producción de hormonas indólicas. Cuando se cuantificó la producción de compuestos indólicos por los aislamientos estudiados, se encontró que la cepa RGM1 tuvo una producción de 45,18 µg/mL de AIA, seguida por SRGM2 con 43,27 µg/mL de AIA, los cuales representan los mayores valores y Sp7 (A. brasilense) que registró 40,170 µg/mL de AIA. Los aislamientos SRGM4, RGM3, RGM6, HGF1 y HGF3 produjeron entre 38,12 y 23,15 µg/mL de AIA, y la cepa SRGM3 presentó el menor valor, 3,46 µg/mL de AIA (tabla 4). La producción de compuestos indólicos de SRGM3 es comparable con las reportadas por Perrig et al. (2007), quienes registraron 2,9 µg/mL de AIA, por la cepa Az39 (recomendada para maíz y trigo en Argentina), lo cual indica que esta es una concentración que permite la promoción del crecimiento de las plantas, teniendo en cuenta que estas cepas han sido evaluadas en gramíneas y seleccionadas por sus óptimos resultados. Las demás cepas presentaron valores entre 23,15 y 45,18 µg/mL de AIA, los cuales oscilan entre aquellos que han registrado diferentes cepas de A. amazonense aisladas de raíces de Brachiaria spp. en Brasil, con 6,13 a 19,27 µg/mL de AIA (Reis Junior et al. 2004), A. brasilense (Cd) y A. lipoferum (Br17) productoras de 58,71 y 63,49 µg/mL de AIA (Radwan et al. 2005), y aislamientos de Azospirillum spp. de plantas de maíz en Méjico con valores de hasta de 49,65 ìg/mL de AIA (Carcaño-Montiel et al. 2006).
Algunos estudios han demostrado la variación cuantitativa de esta actividad biofertilizante en cada cepa evaluada, teniendo en cuenta la diversidad genética que presentan en cuanto a su capacidad de utilizar algunas fuentes de C y N, la presencia de triptófano como precursor de los compuestos indólicos, de sus rutas metabólicas y la actividad enzimática reguladas por diferentes genes que pueden expresarse por las condiciones de su ambiente natural (Radwan et al., 2004; Carcaño-Montiel et al., 2006), las cuales variaron de acuerdo con la zona muestreada, el estrato de la planta y la época climática.
En muchos reportes, Azospirillum es considerado el género bacteriano más importante para el mejoramiento del crecimiento de las plantas o el rendimiento de los cultivos en diferentes países (Perrig et al., 2007), especialmente por su alta producción de reguladores de crecimiento vegetal (Radwan et al., 2004) como las auxinas, varias giberelinas y citoquininas (Bashan et al., citados por Perrig et al., 2007), y el ácido 3-indolacético (AIA) es la principal fitohormona producida por Azospirillum (Radwan et al., 2004). El AIA es una auxina conocida por estimular respuestas rápidas en el crecimiento, el incremento en la elongación celular, la división celular y su diferenciación (Cassán et al., 2008).
Análisis de los agrupamientos para la selección de las cepas con potencial biofertilizante. El dendograma de la interacción de las medianas de producción de compuestos indólicos y la actividad fijadora de nitrógeno, mostró dos grupos separados por más del 25% de distancia (fig. 2). Las cepas Sp7, SRGM3 y SRGM4 formaron el grupo I, con un 7% de distancia entre sus medianas. En el grupo II se formaron dos subgrupos, donde HGF1, HGF3, RGM1, RGM3 y RGM6 presentaron 2% de distancia y, a su vez, este mismo subgrupo (IIA) presentó 7% de distancia de la cepa SRGM2, conformando el subgrupo IIB. Este análisis de clasificación jerárquica permitió seleccionar los aislamientos del grupo I como las cepas con mayor actividad biofertilizante en condiciones in vitro. Por esta razón, se seleccionaron las cepas SRGM3, SRGM4 y la cepa SRGM2 por su cercanía al grupo I, donde se agrupó Sp7 (A. brasilense).
Identificación genética de los aislamientos de Azospirillum spp. El análisis primario de la similitud entre las secuencias de los nucleótidos obtenidos y los depositados en la base de datos del GenBank utilizando el análisis BLAST, mostró que los aislamientos pertenecen a la subclase alfa proteobacterias de la familia Rhodospirillacea y están fuertemente relacionados con el género Azospirillum por presentar hasta un 94% de similitud (tabla 5).
Las cepas SRGM2 y SRGM3 presentaron un 93% de similitud con A. lipoferum y la SRGM4 un 94% de similitud con A. brasilense.
Conclusiones
No se encontraron variaciones en el tamaño de la población de Azospirillum por efecto de las épocas climáticas, lo que permite inferir que tolera condiciones de estrés hídrico.
Se obtuvieron 184 aislamientos de las muestras de suelo, las raíces, las hojas y los tallos del pasto guinea, de los cuales 16 fueron caracterizados fenotípicamente como del género Azospirillum y se seleccionaron ocho por su similitud con el género en estudio.
Se seleccionaron tres cepas promisorias para ser utilizadas como biofertilizante, por su alta fijación de nitrógeno y producción de ácido indolácetico, se identificaron molecularmente y se encontraron semejanzas con A. lipoferum y A. brasilense, según la base de datos del GenBank.
Agradecimientos
Al Laboratorio de Microbiología de Suelos y a la Estación Experimental Motilonia de CORPOICA, por su colaboración y apoyo económico a través del proyecto financiado por el Ministerio de Agricultura y Desarrollo Rural de la República de Colombia, la Federación Colombiana de Ganaderos FEDEGAN- y la Gobernación del Departamento del Cesar.
REFERENCIAS BIBLIOGRÁFICAS
1. Brasil, M.S. et al. Ocorrencia e diversidade de bactérias diazotróficas associadas a gramíneas forrageiras do pantanal sul matogrossense. R. Bras. Ci. Solo. 29:179. 2005
2. Brasil, M.S. et al. Efeitos da inoculação de bactérias diazotróficas em gramíneas forrageiras do Pantanal. Bolsista de Pós-Graduacao da UFRRJ, em Seropédica-RJ. 2006
3. Carcaño-Montiel, M.G. et al. Actividad nitrogenasa, producción de fitohormonas, sideróforos y antibiosis en cepas de Azospirillum y Klebsiella aisladas de maíz y teocintle. Terra Latinoamericana. 24 (4):493. 2006
4. Cassán, R. et al. Producción de fitohormonas por Azospirillum sp. Aspectos fisiológicos y tecnológicos de la promoción del crecimiento vegetal. In: Azospirillum sp.: Cell physiology, plant interations and agronomic research in Argentina. (F.F. Cassán and I. García de Salamone, Eds.). Asociación Argentina de Microbiología, Buenos Aires, Argentina. p. 61. 2008
5. Cordero, J. et al. La inoculación de plantas con Pantoea sp. bacteria solubilizadora de fosfatos, incrementa la concentración de P en los tejidos foliares. Rev. Colomb. Biotecnol. 10 (1):111. 2008
6. Corporación Colombiana de Investigación Agropecuaria, Corpoica. Manual de procedimientos técnicos. Laboratorio de control de calidad de inoculantes. Versión 02, p. 14. 2006
7. Cuesta-Muñoz, P.A. et al. Estrategias de manejo de praderas para mejorar la productividad de la ganadería en las regiones Caribe y Valles Interandinos. Manual técnico: Producción y utilización de recursos forrajeros en sistemas de producción bovina de las regiones Caribe y Valles interandinos. Corpoica, Colombia. 24 p. 2005
8. Döbereiner, J. et al. Como isolar e identificar bactérias diazotróficas de plantas ñao leguminosas. EMBRAPA-SPI, Brazil. 1995
9. Eckert, B. et al. Azospirillum doebereinerae sp. nov., a nitrogen-fixing bacterium associated with the C4-grass Miscanthus. International Journal of Systematic and Evolutionary Mcrobiology. 51:17. 2001
10. Edwards, U. et al. Isolation and direct complete nucleotide determination of entire genes. Characterization of a gene coding for 16S ribosomal RNA. Nucleic Acids Res. 17:7843. 1989
11. Gamarra, J.R. La economía del Cesar después del algodón. En: Documentos de trabajo sobre economía regional. No. 59. Banco de la República, Centro de Estudios Regionales (CEER). Cartagena, Colombia. 116 p. 2005
12. Joe, M.M. et al. Co-aggregation in Azospirillum brasilense MTCC-125 with other PGPR strains: Effect of physical and chemical factors and stress endurance ability. Journal of the Taiwan Institute of Chemical Engineers. 40:491. 2009
13. Kuss, A.V. Fixação de nitrogênio por bácterias diazotróficas em cultivares de arroz irrigado. Tese de Doutorado. Programa de Pós-Graduação em Ciência do Solo. Universidade Federal de Santa Maria, Centro de Ciências Rurais, Brazil. 2006
14. Kuss, A.V. et al. Fixação de nitrogênio e produção de ácido indolacético in vitro por bactérias diazotróficas endofíticas. Pesq. Agropec. Brás. 42 (10):1459. 2007
15. Mehnaz, S. & Lazarovits, G. Inoculation effects of Pseudomonas putida, Gluconacetobacter azotocaptans, and Azospirillum lipoferum on corn plant growth under greenhouse conditions. Microbial Ecology. 51:326. 2006
16. Osorio, N.W. A review on beneficial effects of rhizosphere bacteria on soil nutrient availability and plant nutrient uptake. Rev. Fac. Nal. Agr. Medellín. 60 (1):3621. 2007
17. Perrig, D. et al. Plant-growth-promoting compounds produced by two agronomically important strains of Azospirillum brasilense, and implications for inoculant formulation. Appl. Microbiol. Biotechnol. 75 (5):955. 2007
18. Radwan, T.E.E. et al. Efeito da inoculação de Azospirillum e Herbaspirillum na produção de compostos indólicos em plântulas de milho e arroz. Pesq. Agropec. Brás. 39 (10):987. 2004
19. Radwan, T.E.E. et al. Aeração e adição de sais na produção de ácido indol acético por bactérias diazotróficas. Pesq. Agropec. Bras. 40 (10):997. 2005
20. Reis Junior, R.B. et al. Identificação de isolados de Azospirillum amazonense associados a Brachiaria spp., em diferentes épocas e condições de cultivo e produção de fitormonio pela bactéria. R. Bras. Ci. Solo. 28:103. 2004
21. Rodríguez-Cáceres, E.A. Improved medium for isolation of Azospirillum spp. Applied and Environmental Microbiology. 44:990. 1982
22. Steenhoudt, O. & Vanderleyden, J. Azospirillum, a free-living nitrogen-fixing bacterium closely associated with grasses: genetic, biochemical and ecological aspects. FEMS Microbiology Reviews. 24:487. 2000
23. Weisburg, W.G. et al. 16S ribosomal DNA amplification for phylogenetic study. J Bacteriol. 173:697. 1991
Recibido el 16 de marzo del 2009
Aceptado el 15 de marzo del 2010