Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Pastos y Forrajes
versión impresa ISSN 0864-0394
Pastos y Forrajes v.33 n.3 Matanzas jul.-sep. 2010
ARTICULO DE INVESIGACION
Determinación de antioxidantes enzimáticos en variedades e híbridos de Morus alba
Determination of enzymatic antioxidants in Morus alba varieties and hybrids
Maykelis Díaz1, Y. Pérez2, Yanet Cazaña2, Marlene Prieto1, Hilda Wencomo1 y Yudit Lugo1
1Estación Experimental de Pastos y Forrajes "Indio Hatuey"Central España Republicana CP 44280, Matanzas, Cuba
2CETENZ-Universidad de Matanzas "Camilo Cienfuegos", Cuba
RESUMEN
En el presente trabajo se evaluó la actividad específica de las enzimas antioxidantes catalasa y guaiacol peroxidasa en extractos frescos de variedades e híbridos de morera (Morus alba), obtenidos a partir de las raíces, los tallos y las hojas. Las muestras de los diferentes órganos en estudio fueron colectadas aleatoriamente, maceradas en nitrógeno líquido, resuspendidas en tampón fosfato de sodio y centrifugadas. El sobrenadante se utilizó para las determinaciones enzimáticas. Se empleó el ANOVA de clasificación simple y la prueba de rangos múltiples de Duncan para la comparación de medias (P<0,05). Los mayores valores de actividad específica catalasa y peroxidasa se hallaron en general en las hojas, seguido de los tallos y las raíces. Las variedades e híbridos con mayor actividad específica para ambas enzimas fueron: Tigreada, Criolla, IZ 15-9 e IZ 64. Los resultados demostraron el papel protector antioxidante de los extractos, principalmente de hojas, a partir de las funciones importantes que desempeñan estos sistemas enzimáticos en la eliminación de las especies reactivas del oxígeno. Se corrobora las potencialidades de esta especie para la nutrición y la salud animal, lo que le proporciona más valor como planta forrajera multipropósito. Se recomienda continuar realizando otras determinaciones de compuestos con actividad antioxidante y estudiar los sistemas enzimáticos catalasa y peroxidasa en especies multipropósitos, como M. alba, utilizada en la alimentación animal y en la medicina tradicional.
Palabras clave: Catalasa, estrés, Morus alba, peroxidasas
ABSTRACT
In this work the specific activity of the antioxidant enzymes catalase and guaiacol peroxidase was evaluated in fresh extracts of mulberry (Morus alba) varieties and hybrids, obtained from the roots, stems and leaves. The samples of the different organs under study were randomly collected, macerated in liquid nitrogen, resuspended in sodium phosphate buffer and centrifuged. The supernatant was used for the enzymatic determinations. The simple classification ANOVA and Duncan´s multiple range test were used for mean comparison (P<0,05). The highest values of specific catalase and peroxidase activity were found, in general, in the leaves, followed by stems and roots. The varieties and hybrids with higher specific activity for both enzymes were: Tigreada, Criolla, IZ 15-9 and IZ 64. The results showed the protective antioxidant role of the extracts, mainly from leaves, from the important functions played by these enzymatic systems in the elimination of reactive oxygen species. The potential of this species for animal nutrition and health is corroborated, which gives it more value as a multipurpose forage plant. It is recommended to continue making other determinations of compounds with antioxidant activities and studying the catalase and peroxidase enzymatic systems in multipurpose species, such as M. alba, used in animal feeding and traditional medicine.
Key words: Catalase, Morus alba, stress, peroxidase
Contenido
INTRODUCCIÓN
En la actualidad, existe un marcado interés a nivel mundial por la identificación de compuestos antioxidantes en las plantas, las cuales constituyen fármacos potenciales de uso en la medicina preventiva y en la alimentación animal y humana (Shahin Sharif et al., 2008).
Entre las enfermedades con potencialidades para ser tratadas con plantas medicinales se encuentra un grupo numeroso de patologías asociadas al estrés oxidativo, tales como: trastornos cardiovasculares y gastrointestinales, procesos inflamatorios, enfermedades neurodegenerativas, cáncer, desórdenes de la fertilidad y diabetes, entre otras (Patel et al., 2006; Küpeli et al., 2007; Ronald et al., 2007; Bucciarelli y Skliar, 2007). El estrés oxidativo ocurre debido al desequilibrio entre la producción de especies reactivas del oxígeno (ERO) y la capacidad del organismo de mantener las ERO en niveles no tóxicos.
El sistema antioxidante de las plantas incluye un conjunto amplio de compuestos de naturaleza proteínica, entre las que se encuentran las enzimas antioxidantes; así como compuestos no proteínicos como la vitamina E, el ácido ascórbico, el á-tocoferol, el glutatión y los pigmentos carotenoides (González et al., 2000). Entre las enzimas más importantes se encuentran la catalasa y las peroxidasas (Arora et al., 2002; Shahin Sharif et al., 2008), por la capacidad de transformar el compuesto prooxidante peróxido de hidrógeno en agua y en oxígeno molecular (Pascale et al., 2005).
Entre las numerosas especies de árboles y arbustos con buenas características forrajeras, Morus alba sobresale como fuente de forraje en Cuba, y además por su excelente capacidad de producción de biomasa, composición química, alta degradabilidad, adaptabilidad a diversas condiciones de clima y suelo, perennidad ante el corte y disponibilidad.
Considerando el creciente interés en la búsqueda de fuentes antioxidantes naturales, el presente trabajo tuvo como objetivo la determinación de la actividad específica de antioxidantes enzimáticos (catalasa y guiacol peroxidasa) a partir de extractos frescos de hojas, tallos y raíces de variedades e híbridos del género Morus.
MATERIALES Y MÉTODOS
Material vegetal
Para los ensayos de las actividades enzimáticas se utilizaron 10 variedades e híbridos del género Morus existentes en la Estación Experimental de Pastos y Forrajes "Indio Hatuey", de la provincia de Matanzas. Las cinco variedades fueron: M. alba Indonesia, Acorazonada, Criolla, Tigreada y Cubana, y los híbridos: IZ 56-4, IZ 64, IZ 40, IZ 15-9, IZ 13-6. La colecta de hojas, tallos y raíces para todas las plantas se realizó en el mismo momento, seleccionando los órganos con semejante desarrollo vegetativo y condiciones de sanidad. Las raíces fueron lavadas con agua destilada y secadas para su maceración.
Procesamiento del material vegetal
Se seleccionaron aleatoriamente 10 muestras de hojas, tallos y raíces de plantas diferentes de las variedades e híbridos en estudio para la determinación de la actividad enzimática. El material vegetal fresco se homogenizó y se extrajeron 3 g por triplicado de cada órgano. Dichas muestras fueron pesadas, maceradas en nitrógeno líquido y homogenizadas en una solución tampón fosfato de sodio, 100 mM, pH 7,0 en frío y con una relación masa/volumen 1:1. Posteriormente las muestras se centrifugaron a 12 000 rpm durante 15 minutos y se colectó el sobrenadante para los ensayos de actividad enzimática, los cuales se realizaron de inmediato.
Determinación de la actividad catalasa
La actividad catalasa se determinó según Chance y Machley (1955); se midió espectrofotocolorimétricamente la descomposición del peróxido de hidrógeno a 240 nm, 37ºC en una solución tampón de fosfato de sodio, 20 mM, pH 7,0.
Determinación de la actividad guaiacol peroxidasa
La actividad guaiacol peroxidasa se determinó espectrofotométricamente; se midió la descomposición del peróxido de hidrógeno a 436 nm y a 25ºC, utilizando guaiacol como agente donor de hidrógeno, preparado en una solución de concentración 0,018 molL-1 (Bergmeyer, 1974).
Cálculo de la concentración de proteínas
La concentración de proteínas se determinó por el método descrito por Lowry et al. (1951), utilizando albúmina de suero bovino como patrón.
Cálculo de la actividad específica
El cálculo de la actividad específica (mg/mL) se realizó utilizando la siguiente expresión:
Actividad específica (mg/mL)=Actividad (U/mL)/Concentración de proteínas (mg/mL)
Todas las mediciones espectrofotométricas descritas en el presente trabajo se realizaron en un espectrofotómetro UV/VIS Ultrospec 2000 (Pharmacia Biotech, Suecia).
Procesamiento estadístico
Para el ensayo se utilizó un diseño completamente aleatorizado con la variedad como factor en estudio. Se empleó el ANOVA de clasificación simple para la determinación de diferencias de la actividad específica de las diferentes variedades o híbridos de morera. Las desigualdades entre medias se determinaron mediante la prueba de comparación de rangos múltiples de Duncan considerándose significativo todo valor de P<0,05. Los datos fueron procesados según el paquete Statgraphic plus versión 5.1 para Windows®. Previo al análisis de varianza se evaluó el ajuste a una distribución normal mediante la prueba de bondad de ajuste Kolmogorov-Smirnov y la homogeneidad de la varianza mediante las pruebas de Bartlett (Sigarroa, 1985).
RESULTADOS Y DISCUSIÓN
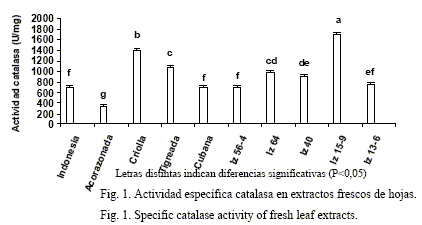
Como se observa en la figura 1, las distintas variedades e híbridos mostraron diferencias significativas para la actividad enzimática catalasa en las hojas (P<0,05). La mayor actividad correspondió al híbrido IZ-15-9, seguido de la variedad Criolla y la Tigreada en orden decreciente; mientras que los valores más bajos se encontraron en la variedad Acorazonada.
La catalasa (EC 1.11.1.6) es una oxidorreductasa esencial en el sistema antioxidante de las plantas, la cual se halla en los distintos órganos aunque de manera localizada, como sucede en las hojas, donde ha sido reportada solamente en los peroxisomas (Arora et al., 2002).
En investigaciones realizadas con anterioridad, se ha informado que los extractos de Morus sp. presentan actividad antioxidante (Bokang et al., 1999). Los estudios de actividad enzimática realizados por Poontaringa et al. (2003) en hojas de plántulas de Morus sp. cv. Pei, obtenidas en condiciones in vitro, mostraron valores de actividad específica inferiores que los de las variedades e híbridos evaluados en esta investigación.
Las investigaciones de Telesinski et al. (2008) en hojas y partes verdes de Phaseolus vulgaris L., indicaron valores de dicha actividad enzimática inferiores a los de la variedad Criolla y a la IZ 15-9, y similares a los de la Tigreada.
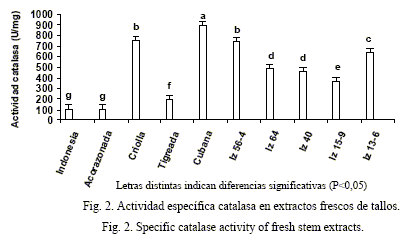
En los estudios realizados en los extractos frescos de tallos (fig. 2) la variedad Cubana presentó la mayor actividad específica catalasa (P<0,05). Es de destacar que las variedades IZ 56-4 y Criolla se comportaron de manera similar, con buenos niveles enzimáticos; mientras que las variedades Indonesia y Acorazonada mostraron los valores más bajos para la actividad catalasa.
En las raíces (fig. 3), aunque con valores inferiores a los niveles de actividad enzimática alcanzados en hojas y tallos, pudo apreciarse que la variedad IZ 64 expresó la mayor actividad catalasa (P<0,05), seguida de Indonesia e IZ 40. Los menores valores de actividad se observaron en las variedades IZ 56-4 y Criolla.
La guaiacol peroxidasa (EC 1.11.1.7) y la ascorbato peroxidasa (EC 1.11.1.11) desempeñan una función catalítica importante al reducir los niveles de H2O2 en los tejidos vegetales, evitando con ello que este compuesto se difunda entre las membranas biológicas para reaccionar con iones libres como el Fe2+ y generar el potente radical hidroxilo, a través de la reacción de Fenton (Vogiatzi et al., 2009).
La figura 4 muestra los valores de la actividad específica guaiacol peroxidasa en hojas. Entre las variedades, la Tigreada presentó los valores más altos; mientras que el híbrido IZ-56-4 mostró la menor actividad (P<0,05). Por su parte, las variedades Indonesia, Criolla, Cubana y los híbridos IZ 64 e IZ 15-9 tuvieron un comportamiento similar entre ellas.
Resultados similares de actividad específica guaiacol peroxidasa fueron informados por Poontaringa et al. (2003) en hojas de plántulas de Morus sp. cv. Pei. Asimismo, en callos provenientes de hojas verdaderas de Stylosanthes guianensis cv. CIAT-184 (leguminosa forrajera) se reportó una actividad enzimática similar en término de los valores obtenidos para la variedad Acorazonada y los híbridos, IZ 40 e IZ 13-6; superior al híbrido IZ 56-4 e inferior al resto de las variedades e híbridos evaluados (Fuentes et al., 2008).
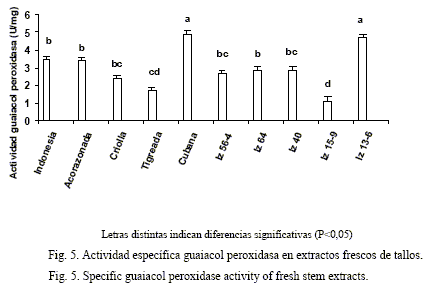
La variedad Cubana y el híbrido IZ 13-6 presentaron la mayor actividad guaiacol peroxidasa en los extractos frescos de tallos (fig. 5); la menor actividad se detectó en el híbrido IZ 15-9. Además, Indonesia y Acorazonada tuvieron valores similares para dicha actividad enzimática; mientras que la variedad Criolla y los híbridos IZ 56-4 e IZ 40 presentaron similitud entre ellos.
Cuando se analizó la actividad específica guaiacol peroxidasa en los extractos de raíces (fig. 6), se observó que la variedad Indonesia mostró los valores más altos, que se diferenciaron significativamente del resto (P<0,05); mientras que en los híbridos IZ 15-9 e IZ 13-6 se detectó la menor actividad.
De manera general, se encontró en las hojas la mayor actividad enzimática específica, tanto para catalasa como para la guaiacol peroxidasa; mientras que en las raíces se hallaron los niveles más bajos.
Por otra parte, al comparar la actividad enzimática de ambas enzimas en las hojas y entre las distintas variedades e híbridos, los mayores valores correspondieron a las variedades Tigreada y Criolla y a los híbridos IZ 15-9 e IZ 64. Sin embargo, es importante tener presente que la actividad enzimática puede variar por distintas causas, como el estadio fisiológico de la planta u órgano en el momento de la colecta y procesamiento de las muestras (independientemente de los requisitos tomados en consideración), y además por los factores ambientales como la temperatura, el pH y el estado hídrico de la planta; así como estreses bióticos. A ello se debe añadir el método empleado para la extracción y cuantificación.
La selección de las variedades de mayor actividad antioxidante también está limitada porque a ello contribuyen otras enzimas del mismo grupo, como la superóxido dismutasa, además de otros compuestos de naturaleza no proteínica como los fenoles, que eliminan las especies reactivas del oxígeno (Xiong y Zhu, 2002; Basile et al., 2005). No obstante, los niveles encontrados en la actividad catalasa y peroxidasa en las hojas pueden constituir un dato importante cuando se relacione esta especie con algunas propiedades medicinales vinculadas con el estrés oxidativo.
Los estudios realizados por Shylesh y Padikkala (1999) con extractos frescos de Emilia sonchifolia (Asteraceae), mostraron un potente efecto inhibidor de la formación de radical hidroxilo y superóxido in vitro. El mecanismo antioxidante que se ha utilizado para explicar estos resultados se basa en la eliminación del exceso de especies reactivas del oxígeno, formadas en los organismos vivos, lo cual se atribuye a la acción eficiente de enzimas tales como la catalasa y las peroxidasas, entre otras, y/o la presencia de otros compuestos químicos con capacidad secuestradora de radicales libres.
Otro aspecto a tener en cuenta en la actividad antioxidante de esta especie, está relacionado con el hecho de que en las hojas de la morera los compuestos antioxidantes naturales actúan de modo sinérgico, es decir, que el efecto antioxidante, en su conjunto, resulta superior a la suma de los efectos de cada tipo de compuesto por separado (Bokang et al., 1999).
CONCLUSIONES
Los mayores valores de las actividades específicas de las enzimas antioxidantes catalasa y peroxidasa se encontraron en las hojas, seguido de los tallos y las raíces. Las variedades e híbridos con mayor actividad específica para ambas enzimas fueron: Tigreada, Criolla, IZ 15-9 e IZ 64. Los resultados demostraron el papel protector antioxidante de los extractos de hojas, a partir de las funciones importantes que desempeñan estos sistemas enzimáticos en la eliminación de las especies reactivas del oxígeno.
RECOMENDACIONES
Continuar realizando otras determinaciones de compuestos con actividad antioxidante, con el objetivo de obtener un criterio general del poder antioxidante de estas variedades e híbridos, debido a la relevancia de esta especie y sus híbridos en la alimentación animal.
Realizar estudios de los sistemas enzimáticos catalasa y peroxidasa en especies multipropósitos, como M. alba, utilizada en la alimentación animal y en la medicina tradicional.
REFERENCIAS BIBLIOGRÁFICAS
1. Arora, A. et al. Oxidative stress and antioxidative system in plants. Review article. Current Science. 82:1227. 2002
2. Basile, A. et al. Antibacterial and antioxidant activities of ethanol extract from Paullinia cupana Mart. J. Ethnopharmacol. 102:32. 2005
3. Bergmeyer, H.U. Methods of enzymatic Analysis 1. Academic Press, New York. 2nd ed. p. 495. 1974
4. Bokang, l. et al. Antioxidant activity of the methanolic extract from various traditional edible plant. Journal of the Chinese Agricultural Chemical Society. 37 (1):105. 1999
5. Bucciarelli, A. & Skliar, M.I. Plantas medicinales de Argentina con actividad gastroprotectora. Ars Pharm. 48 (4):361. 2007
6. Chance, B. & Machley, A. Assay of catalases and peroxidases. Methods Enzymol. 2:764. 1995
7. Fuentes, Leticia et al. Influencia del NaCl en indicadores bioquímicos evaluados en callos de Stylosanthes guianensis CIAT-184. Pastos y Forrajes. 31 (1): 35. 2008
8. González, M.C. et al. Daño oxidativo y antioxidantes. Bioquimia. 25:1. 2000
9. Küpeli, E. et al. Evaluation of anti-inflammatory and antinocicptive activity of five Anatolian Achillea species. Turkish J. Pharm. Sci. 4 (2):89. 2007
10. Lowry, O.H. et al. Protein measurements with the Folin phenol reagent. J. Biol. Chem. 193:225. 1951
11. Pascale, G. et al. Differential regulation of Cu, Zn- and Mn-superoxide dismutases by retinoic acid in normal and psoriatic human fibroblasts. Journal Autoimmunity. 24 (1):69. 2005
12. Patel, S. et al. Status of antioxidant defense system and expression of toxicant responsive genes in striatum of maneb- and paraquat-induced Parkinson's disease phenotype in mouse: Mechanism of neurodegeneration. Brain Res. 1081: 9. 2006
13. Poontaringa, H. et al. Salinity effects on antioxidant enzymes in mulberry cultivar. ScienceAsia. 29:109. 2003
14. Ronald, A. et al. Efecto protector del Aloe vera (sábila) en lesiones gástricas inducidas con etanol en ratas. CIMEL. 12 (2):71. 2007
15. Shahin Sharif, A. et al. Indian medicinal herbs as sources of antioxidants. Food Research International. 41:1. 2008
16. Shylesh, B.S. & Padikkala, J. Antioxidant and anti-inflammatory activity of Emilia sonchifolia. Fitoterapia. 70 (3):275. 1999
17. Sigarroa, A. Biometría y diseño experimental. Editorial Pueblo y Educación. La Habana. p. 743. 1985
18. Telesinski, A. et al. Effect of soil salinity on activity of antioxidant enzymes and content of ascorbic acid and phenols in bean (Phaseolus vulgaris L.) plants. J. Elementol. 13 (3): 401. 2008
19. Vogiatzi, G. et al. The role of oxidative stress in atherosclerosis hellenic. J. Cardiol. 50:402. 2009
20. Xiong, L. & Zhu, J.K. Molecular and genetic aspects of plant responses to osmotic stress. Plant, Cell and Environment. 25:131. 2002
Recibido el 27 de noviembre del 2009
Aceptado el 21 de mayo del 2010