Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Pastos y Forrajes
versión impresa ISSN 0864-0394
Pastos y Forrajes vol.35 no.4 Matanzas sep.-dic. 2012
ARTÍCULO DE INVESTIGACIÓN
Efecto del tipo de explante y la concentración de ácido 2,4-diclorofenoxiacético en la formación de callos en Morus alba L.
Effect of explant type and concentration of 2,4-dichlorophenoxyacetic acid on callus formation in Morus alba L.
A. Espinosa1, J. Silva1, Sandra Sariego1, L. Cholo Masapanta2 y Hugo Delgado2
1Centro de Estudios de Biotecnología Vegetal, Facultad de Ciencias Agrícolas. Universidad de Granma, Carretera a Manzanillo km 17½, Bayamo, Cuba. CP 85100
2Universidad Técnica de Cotopaxi. La Maná, Ecuador
E-mail: aespinosar@udg.co.cu
RESUMEN
El objetivo del trabajo fue evaluar el efecto del tipo de explante y la concentración de 2,4-D en la formación de callos, en Morus alba L. Como fuentes de explantes se utilizaron limbos foliares, tallos y pecíolos, obtenidos a partir de estacas que brotaron en condiciones de laboratorio. El medio de cultivo basal estuvo constituido por las sales y vitaminas MS (1962), con diferentes concentraciones de 2,4-D (0; 0,5; 1,0 y 2,0 mg.L-1). Se utilizó un diseño experimental completamente aleatorizado. La formación de callos en todos los tipos de explantes se inició en los primeros 15 días posteriores al establecimiento in vitro. La callogénesis solo ocurrió en los medios de cultivo con 2,4-D. La zona de formación del callo, su color y textura dependieron del tipo de explante utilizado. El aumento de la concentración de 2,4-D en el medio de cultivo incrementó el tamaño de los callos, con los mejores resultados en las concentraciones de 1,0 y 2,0 mg.L-1.
Palabras clave: cultivo de tejidos, explantes, Morus alba.
ABSTRACT
The objective of the work was to evaluate the effect of explant type and concentration of 2,4-dichlorophenoxyacetic acid on callus formation, in Morus alba L. As explant sources leaf blades, stems and petioles were used , obtained from cuttings which produced growths under laboratory conditions. The basal culture medium was constituted by MS salts and vitamins (1962), with different concentrations of 2,4-D (0; 0,5; 1,0 and 2,0 mg.L-1). A completely randomized experimental design was used. Callus formation in all explant types started in the first 15 days after the in vitro establishment. Callogenesis only occurred in the culture media with 2,4-D. The callus formation zone, callus color and texture depended on the explant type used. The increase of 2,4-D concentration in the culture medium increased callus size, with the best results in the concentrations 1,0 and 2,0 mg.L-1.
Key words: tissue culture, explants, Morus alba.
INTRODUCCIÓN
La morera (Morus alba L.) es un árbol forrajero de origen asiático, perfectamente adaptado a las condiciones del trópico. Pertenece a la familia Moraceae y tiene 24 especies agrupadas en el género Morus. De ellas, la especie diploide Morus alba es la más extendida (Machii, Koyama y Yamanouchi, 2000).
El principal uso de la morera a nivel mundial es como alimento del gusano de seda (Milera, 2010). En dependencia de la localidad también es apreciada por su fruta, que puede ser consumida fresca, en jugo o en conserva. En algunos países se utilizan como alimento sus hojas y tallos tiernos, y es reconocida además por sus propiedades medicinales y como forraje animal (Cepeda, 1991).
La morera, que es utilizada como planta arbustiva desde la década del 80, constituye una alternativa en la alimentación para rumiantes en países de América Central, y se recomienda por la calidad de su follaje (Medero, Montoya y Osa, 1999). Sus hojas pueden tener más del 46% de aminoácidos esenciales (Machii, 1992), más del 20% de proteína cruda, y entre el 70 y el 80% de digestibilidad in vitro de la materia seca (Benavides, Lachaux y Fuentes, 1994); además, tiene un alto contenido de minerales (hasta 17% de cenizas), con valores elevados de calcio y fósforo (Sánchez, 1999).
Es sorprendente, sin embargo, que una planta que se ha utilizado y mejorado para alimentar a un animal con altos requerimientos nutricionales, como es el gusano de seda, haya recibido una atención limitada por parte de los ganaderos, los técnicos y los investigadores pecuarios (Tikader y Roy, 1999).
Los reportes iniciales sobre la micropropa-gación de la morera fueron realizados por el científico japonés Ohyama (1970), quien obtuvo las primeras plántulas completas a partir de brotes axilares; desde entonces, se han elaborado numerosos informes acerca del cultivo de tejido en morera con la utilización de diferentes explantes (Lu, 2002; Thomas, 2003; Kavyashree, 2007; Vijayan, 2010). La inducción de callogénesis in vitro se ha estudiado en diferentes cultivos, con el fin de establecer protocolos para la propagación por organogénesis indirecta y embriogénesis somática, que pueden ser utilizadas con fines de mejora genética o propagación masiva. En el proceso de callogénesis in vitro influyen muchos factores, entre los cuales se destaca el tipo de explante y la composición hormonal del medio de cultivo. En este trabajo se evaluó el efecto del tipo de explante y la concentración de 2,4-D en la formación de callos durante el proceso de embriogénesis somática en M. alba L.
MATERIALES Y MÉTODOS
La investigación se desarrolló en el Centro de Estudios de Biotecnología Vegetal (CEBVEG), perteneciente a la Facultad de Ciencias Agrícolas de la Universidad de Granma, Cuba. Se utilizó, como material vegetal, estacas de morera de la variedad Acorazonada, con un tamaño de 10-12 cm; estas se colocaron en frascos con agua, en condiciones semicontroladas de laboratorio, para propiciar la brotación de las yemas axilares. Cuando los brotes alcanzaron un tamaño de 8-10 cm se cortaron, y de ellos se seleccionaron los limbos foliares, los tallos y los pecíolos como fuentes de explantes para la formación de callos.
Para su desinfección, los explantes se lavaron cuidadosamente y por separado con agua y detergente; después se mantuvieron durante 30 minutos en agitación continua, en una disolución de agua con detergente al 3%, y se enjuagaron cuatro veces con agua destilada estéril. Posteriormente, en la cabina de flujo laminar, se sumergieron en una disolución de hipoclorito de sodio al 1% de cloro activo, durante 15 minutos, y se enjuagaron cuatro veces con agua destilada estéril.
Los limbos foliares se seccionaron en porciones de 0,5 cm2 y se seleccionó la zona central para colocarla en el medio de cultivo. Los pecíolos y los tallos se cortaron en segmentos de 1,0 cm de longitud y se eliminaron las partes que sufrieron daños durante la desinfección.
El medio de cultivo basal estuvo compuesto por sales y vitaminas de Murashige y Skoog (1962), mioinositol (100 mg.L-1), tiamina (1,0 mg.L-1) y sacarosa (30 g.L-1). El pH se ajustó a 5,7 con un medidor de pH (CRISON) antes del autoclaveado, y se solidificó con agar 6 g.L-1. Se evaluaron diferentes concentraciones de 2,4-D en el medio de cultivo, con lo que se formaron los siguientes tratamientos:
- Tratamiento 1. Medio de cultivo sin 2,4-D
- Tratamiento 2. Medio de cultivo con 0,5 mg.L-1 de 2,4-D
- Tratamiento 3. Medio de cultivo con 1,0 mg.L-1 de 2,4-D
- Tratamiento 4. Medio de cultivo con 2,0 mg.L-1 de 2,4-D
Se añadieron 10 mL de medio de cultivo en cada tubo de ensayo y se esterilizaron en autoclave vertical, a 121°C de temperatura y 1,2 kg cm-2 de presión, durante 20 minutos. La combinación del tipo de explante y el medio de cultivo con diferentes concentraciones de 2,4-D sumó un total de 12 tratamientos.
El diseño fue completamente aleatorizado. Se utilizaron 20 tubos de ensayo por cada tratamiento, cada tubo se consideró como una repetición y en cada uno de ellos se cultivó un explante. La incubación se hizo en condiciones de oscuridad, a temperatura de 25°C y humedad relativa de 60 a 65%.
A los 15 y a los 30 días se evaluaron las variables: desinfección (%), inicio de la formación de los callos (días), porcentaje de callos formados (%), formación de raíces (%), y coloración y textura de los callos.
Análisis estadístico.A todos los datos se les aplicó un análisis de comparación de proporciones, a través del programa estadístico STATISTICA versión 6.0 para Windows®, con un 5% de probabilidad de error.
RESULTADOS Y DISCUSIÓN
En todos los tratamientos se logró el 100% de explantes desinfectados. Estos resultados indican que el uso de hipoclorito de sodio al 1% de cloro activo, combinado con el empleo de explantes procedentes de estacas que brotaron en condiciones semicontroladas de laboratorio, resultó un método de desinfección eficiente, ya que permitió lograr altos valores de explantes libres de contaminación, durante el establecimiento in vitro de la morera.
Los estudios realizados por Salas et al. (2004) mostraron valores superiores al 80% de desinfección de explantes obtenidos de hojas de morera con el uso de hipoclorito de sodio al 1%, durante 20 minutos, lo que coincide con lo obtenido en esta investigación. García et al. (citados por Salas et al., 2004) utilizaron una mezcla de bicloruro de mercurio con bajas concentraciones de hipoclorito de sodio para la desinfección de explantes de M. alba L., con buenos resultados.
A los 15 días posteriores al establecimiento in vitro, se inició la formación de los callos en todos los tipos de explantes cultivados en medios que contenían 2,4-D, independientemente de su concentración, lo que se evidenció por cambios en la coloración y la estructura de los explantes, así como por el desarrollo de pequeñas protuberancias de tejido no diferenciado.
En la tabla 1 se muestran los porcentajes de callos en los diferentes tipos de explantes, a los 30 días posteriores al establecimiento in vitro. En el tratamiento sin 2,4-D no se formaron callos; mientras que los tratamientos en los que se utilizó el 2,4-D no mostraron diferencias significativas entre sí ya que se formaron callos en el 100% de los explantes. Estos resultados confirmaron el importante papel del 2,4-D en la formación de callos, y se demostró la fuerte actividad auxínica de este regulador del crecimiento, así como su capacidad de producir un crecimiento desordenado en las células del explante.
El 2,4-D es una potente auxina que se usa en el cultivo in vitro para la formación de callos y la inducción de embriones somáticos (Rivero et al., 2008). Se ha utilizado como regulador del crecimiento para este primer propósito en diversas especies de plantas, con buenos resultados (Silva, 2006; Medero, 2006; Paneque, 2006) en el cultivo de cacao, de yuca y de boniato.
En los explantes de hojas, el inicio de la formación de los callos se hizo evidente cuando estos comenzaron a arrugarse, se separaron del medio de cultivo y se tornaron de color verde claro; asimismo se pudo observar la formación de pequeñas protuberancias en los bordes y sobre la nervadura principal.
La formación de los callos en la zona donde se hizo el corte y sobre la nervadura principal pudiera asociarse a que en esta última se encuentran células menos diferenciadas, en comparación con las del resto del explante, las que responden más rápidamente al efecto de los reguladores del crecimiento y favorecen que se formen los callos (Michaux- Ferriere y Carron, 1989).
El tejido calloso se evidenció como agrupamientos de tejido no diferenciado, de color crema, con una consistencia friable. El tamaño de los callos aumentó a medida que se incrementó la concentración de 2,4-D, y cubrieron prácticamente todo el explante en los tratamientos donde se emplearon las mayores concentraciones (1,0 y 2,0 mg.L-1 de 2,4-D).
Santana (1993), al emplear segmentos de hojas en el cultivo del café para inducir la formación de callos, informó que estos se iniciaron en las zonas donde se seccionaron las hojas y a continuación se produjo un engrosamiento de las células perivasculares del haz, con un posterior crecimiento en todas las direcciones; esto propició que el callo se hiciera notable y se proyectara al exterior a través de la epidermis, resultados que coinciden con los obtenidos en este trabajo.
En los explantes de pecíolos, la formación de callos se inició con el engrosamiento de la parte central y la aparición de tejido no diferenciado en la zona donde se realizaron los cortes. Posteriormente, el crecimiento de los callos se extendió por toda la superficie y en los extremos del explante. La masa callosa fue mayor a medida que se incrementó la concentración de 2,4-D, y cubrió todo el explante en los tratamientos en que se utilizaron concentraciones de 1,0 y 2,0 mg.L-1. Los callos mostraron una coloración pardo-clara y una consistencia esponjosa.
La formación de los callos en los explantes de tallos se inició en la zona en que se hicieron los cortes, es decir, a partir del tejido de cicatrización. Los callos fueron de color pardo oscuro y de consistencia esponjosa. En los tratamientos en que se usó 0,5 y 1,0 mg.L-1 de 2,4-D, se obtuvieron callos de tamaño pequeño; mientras que al emplear 2,0 mg.L-1 de 2,4-D, estos alcanzaron un mayor tamaño y cubrieron prácticamente todo el explante.
Sanginés et al. (1999) estudiaron la formación de callos a partir de los pecíolos, los limbos y las yemas axilares de M. alba L., en un medio de cultivo en el que se combinó 5,0 mg.L-1 de 6-BAP con 0,25 mg.L-1 de 2,4-D. Los callos formados mostraron buena apariencia, con características embriogénicas.
Por su parte, Bhau y Wakhju (2001) demostraron que la formación de callos en M. alba dependió del genotipo, el tipo de explante y los reguladores del crecimiento utilizados. Las hojas fueron los mejores explantes, y con la combinación de 1,0 mg.L-1 de 2,4-D y 0,5 mg.L-1 de BA se obtuvieron los mayores porcentajes de callos formados (95-100%).
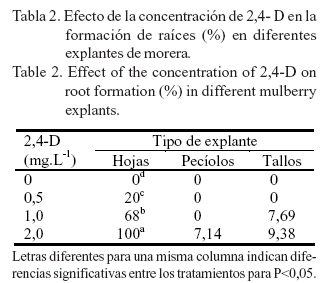
La formación de raíces estuvo directamente relacionada con la concentración de 2,4-D (tabla 2). En los explantes de hojas el crecimiento de las raíces se inició a partir de los callos, lo que indica que ocurrió una organogénesis indirecta. La formación de estas aumentó a medida que se incrementó la concentración de la auxina, con diferencias significativas entre las concentraciones evaluadas. Los mayores valores (100%) se alcanzaron al utilizar 2,0 mg.L-1 de 2,4-D, seguidos por un 68% de explantes con raíces en el tratamiento de 1,0 mg.L-1 de 2,4-D. El número de raíces por explante fue abundante.
En los explantes de pecíolos y tallos, la formación de raíces fue menor en comparación con las hojas y se alcanzaron valores inferiores al 10% de explantes con raíces. En los pecíolos se formaron raíces en el 7,14% de los explantes, cuando se utilizó el medio de cultivo con 2,0 mg.L-1 de 2,4-D. Las raíces se originaron a partir del callo, y fueron finas y de pequeña longitud. El número de raíces por explante fue bajo.
En los tallos, al utilizar 1,0 y 2,0 mg.L-1 de 2,4-D, se formaron raíces (una o dos por explante) en el 7,69 y el 9,38% de los explantes, respectivamente. Estas eran gruesas y largas, y aparentemente no salían del callo.
Los resultados de la investigación demostraron que el empleo de explantes de hojas, pecíolos y tallos en el cultivo in vitro de la morera permitió altos valores de formación de callos, y que el 2,4-D en el medio de cultivo resultó imprescindible.
González, Morejón y Portilla (2007) plantearon que las diferencias en la respuesta al cultivo in vitro, al emplear diferentes tipos de explantes, pueden deberse a variaciones en el contenido endógeno de las hormonas y a sus características anatómicas.
Por otra parte, Suksa-Ard et al. (1999) consideraron que la formación y las características de los callos dependen, considerablemente, del órgano usado como explante. Shu, Ying-Cri y Hong-Hui (2005) mostraron los mejores resultados en la obtención de callos embriogénicos, al utilizar como explante segmentos de tallos de Dioscorea zingiberensis e incluir en el medio de cultivo 0,5 mg.L-1 de bencilaminopurina y 2,0 mg.L-1 de 2,4- D, con lo que lograron una frecuencia de formación de callos del 87%.
CONCLUSIONES
El empleo de concentraciones de 2,4-D en el medio de cultivo, iguales o mayores a 0,5 mg.L-1, propició la formación de callos en explantes de hojas (100%), pecíolos (100%) y tallos (100%) en el cultivo de la morera, y se obtuvieron callos de mayor tamaño a medida que se incrementó la concentración.
En los explantes de hojas se formaron raíces en todas las concentraciones de 2,4-D, y se alcanzó el 100% de explantes enraizados al utilizar 2,0 mg.L-1 de 2,4-D. En los explantes de pecíolos y tallos se formaron raíces al emplear concentraciones de 2,0 mg.L-1 de 2,4-D, con valores de 7,14 y 9,38%, respectivamente.
AGRADECIMIENTOS
Los autores agradecen a la diputación foral de Álava del País Vasco y a la Asociación Euskadi-Cuba, por el financiamiento otorgado para efectuar esta investigación.
REFERENCIAS BIBLIOGRÁFICAS
1. Benavides, J.E.; Lachaux, M. & Fuentes, M. Efecto de la aplicación de estiércol de cabra en el suelo sobre la calidad y producción de biomasa de morera (Morus sp.). En: Árboles y arbustos forrajeros en América Central (Ed. J.E. Benavides). CATIE, Turrialba, Costa Rica. Serie Técnica, Informe Técnico No. 236, vol. II. p. 495. 1994
2. Bhau, B.S. & Wakhju, A.K. Effect of genotype, explant type and growth regulators on organogenesis in Morus alba. Plant Cell Tissue and Organ Culture. 66 (1):25. 2001
3. Cepeda, J. El árbol de oro. Los mil usos de la morera. Medio Ambiente Perú. 47:28. 1991
4. González, M.C.; Morejón, R. & Portilla, M. Establecimiento de las concentraciones óptimas de hormonas para el cultivo in vitro de especies de Coffea arabica L. Programa y Resúmenes del XII Congreso Científico del INCA, La Habana, Cuba. 2002
5. Kavyashree, R. A repeatable protocol for in vitro micropropagation of mulberry variety S54. Indian Journal of Biotechnology. 6:385. 2007
6. Lu, M. Micropropagation of Morus latifolia Poilet using axillary buds from mature trees. Scientia Horticulturae. 96:329. 2002
7. Machii, H. Organogenesis from immature leaf cultures in mulberry (Morus alba L.). Journal Sericulture Science of Japan. 61:512. 1992
8. Machii, H.; Koyama, A & Yamanouchi, H. Mulberry for animal production. FAO electronic conference. [Disponible en:] http://www.fao.org/livestock/agap//mulberry. [18/06/2012]. 2000
9. Medero, María L.; Montoya, M. & Osa, J. Uso de forraje de morera (Morus alba L) en la ceba cunícula. Memorias del I Taller internacional de morera «La morera (Morus alba L), oportunidades y posibilidades de uso para la alimentación animal». EEPF «Indio Hatuey», Matanzas, Cuba. [Disponible en:] http://www.fao.org/ag/AGa/AGAP/FRG/AFRIS/espanol/Document/Morera/morera4.htm. [18/06/2012]. 1999
10. Medero, V.R. Embriogénesis somática en yuca (Manihot esculenta, Crantz.). Tesis en opción al grado científico de Doctor en Ciencias Agrícolas. Centro de Bioplantas, Universidad de Ciego de Ávila, Cuba. 100 p. 2006
11. Michaux-Ferriere, N. & Carron, M.P. Histology of early somatic embryogenesis in Hevea brasiliensis. The importance of the timing of subculturing. Plant Cell Tissue and Organ Culture. 19:157. 1989
12. Milera, Milagros. Morera: un nuevo forraje para la alimentación del ganado. EEPF «Indio Hatuey». Matanzas, Cuba. 346 p. [Disponible en:] http://biblioteca.ihatuey.cu/links/pdf/morera.pdf. [18/06/2012]. 2010
13. Murashige, T. & Skoog, F. A revised medium for rapid growth and bioassays with tobacco tissue cultures. Physiol. Plant. 15:473. 1962
14. Ohyama, K. Tissue culture in mulberry tree. JARQ. 5:30. [Disponible en:] http://www.cabdirect.org/abstracts/19710303314.html. [18/06/2012]. 1970
15. Paneque, O.S. Establecimiento de una metodología de micropropagación mediante la embriogénesis somática en el cultivo del boniato (Ipomoea batatas L.). Tesis presentada en opción al grado de Doctor en Ciencias Agrícolas. Universidad de Granma/Instituto Nacional de Ciencias Agrícolas, La Habana. 120 p. 2006
16. Rivero, N. et al. Embriogénesis somática en Anthurium andraeanum Lind variedad Lambada. Ra Ximhai. 4 (1):135. 2008
17. Salas, B.J. et al. Establecimiento in vitro de morera. Biotecnología Vegetal. 4 (2):15. 2004
18. Sánchez, M.D. Mulberry: an exceptional forage available almost worldwide. World Animal Review. 93 (2):36. 1999
19. Sanginés, G.J. et al. Avances en los programas de investigación en morera (Morus alba. L) en Yucatán. I Taller internacional de morera «La morera (Morus alba L), oportunidades y posibilidades de uso para la alimentación animal». EEPF «Indio Hatuey», Matanzas, Cuba. [Disponible en:] http://www.fao.org/ag/AGa/AGAP/FRG/AFRIS/espanol/Document/Morera/MORERA20.HTM. [18/06/2012]. 1999
20. Santana, Nancy. Embriogénesis somática en el cultivo del cafeto (Coffea spp). Tesis en opción al grado científico de Doctor en Ciencias Agrícolas. Instituto Nacional de Ciencias Agrícolas, La Habana. 124 p. 1993
21. Shu, Y.; Ying-Cai, Y. & Hong-Hui, L. Plant regeneration through somatic embryogenesis from callus cultures of Dioscorea zingiberencis. Plant Cell Tissue and Organ Culture. 80:157. 2005
22. Silva, J.J. Establecimiento de una metodología para la embriogénesis somática en el cultivo del cacao (Theobroma cacao, L.). Tesis presentada en opción al grado científico de Doctor en Ciencias Agrícolas. Universidad de Granma, Cuba. 2006
23. Suksa-Ard, P. et al. Requirement of 2,4-D and sucrose for somatic embryogenesis of papaya. JARQ. 43 (1):1. 1999
24. Thomas, V. Thidiazuron induced multiples shoots and plant regeneration from cotyledonary explants of mulberry. Biologia Plantarum. 46 (4):529. 2003
25. Tikader, A. & Roy, B.N. Growth potential in different mulberry germplasm accessions (Morus species). Indian Journal of Forestry. 22:362. 1999
26. Vijayan, K. The emerging role of genomic tool in mulberry (Morus) genetic improvement. Tree Genetics & Genomes. 6 (4):613. 2010
Recibido el 20 de julio del 2012
Aceptado el 19 de octubre del 2012