Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Pastos y Forrajes
versión impresa ISSN 0864-0394
Pastos y Forrajes vol.36 no.4 Matanzas oct.-dic. 2013
ARTÍCULO DE INVESTIGACIÓN
Validación del método FAMACHA© en la detección de anemia en ovejas Pelibuey en Cuba
Validation of the FAMACHA© method for detecting anemia in Cuban Pelibuey sheep
J. Arece y Y. López
Estación Experimental de Pastos y Forrajes Indio Hatuey, Universidad de Matanzas Camilo Cienfuegos, Ministerio de Educación Superior Central España Republicana. CP 44280. Matanzas
E-mail: javier.arece@ihatuey.cu
RESUMEN
Durante un periodo de tres años se evaluó, en un rebaño ovino Pelibuey de 75 reproductoras, la fiabilidad del método FAMACHA© en la identificación de animales anémicos como resultado de infestación parasitaria por Haemonchus spp. Con una frecuencia mensual, se realizó el conteo fecal de huevos (CFH) y el hematocrito (VCA); y se monitoreó la condición corporal (CC) y la coloración de la mucosa ocular (CMO), a través de la carta de colores FAMACHA©. Además, se determinó la sensibilidad, la especificidad y el valor predictivo para animales positivos y negativos; así como el índice de correspondencia (Kappa) para establecer la concordancia entre la CMO y el VCA. Adicionalmente, se estudió la correlación entre las variables. Se demostró que existe una concordancia moderada (0,25-0,31) entre la identificación de los animales anémicos y la coloración de la mucosa ocular mediante la carta FAMACHA©. Los indicadores de fiabilidad mostraron valores discretos y se relacionaron con el valor del hematocrito seleccionado como gold standard (VCA d» 17%). Se encontró una relación inversa (r = -0,437, p < 0,01) entre el CFH y el VCA. Se concluye que el método FAMACHA© constituye una herramienta útil y práctica para la identificación de reproductoras ovinas anémicas como consecuencia de una elevada infestación por Haemonchus spp.
Palabras clave: anemia,FAMACHA©, Haemonchus, ovinos.
ABSTRACT
During a period of three years, the reliability of the FAMACHA© method in the identification of anemic animals as a result of parasite infestation by Haemonchus spp. was studied in a Pelibuey sheep flock of 75 dams. With a monthly frequency, the fecal egg count (FEC) and the hematocrit (PCV) were evaluated; and the body condition (BC) and color of the ocular mucosa (COM) were monitored through the FAMACHA© color chart. In addition, the sensitivity, specificity and predictive value for positive and negative animals were determined; as well as the agreement index (Kappa) to establish the agreement between COM and PCV. The correlation among the variables was also studied. It was proven that there is moderate agreement (0,25-0,31) between the identification of anemic animals and the color of the ocular mucosa through the FAMACHA© chart. The reliability indicators showed discreet values and were related to the hematocrit value selected as gold standard (PCV d» 17 %). An inverse ratio was found (r = -0,437, p < 0,01) between the FEC and PCV. The FAMACHA© method is concluded to constitute a useful and practical tool for the identification of anemic sheep dams as a consequence of a high infestation by Haemonchus spp.
Key words: anemia, FAMACHA©, Haemonchus, sheep.
INTRODUCCIÓN
En Cuba, durante varias décadas, el control parasitario ha consistido en el tratamiento de los animales según los criterios subjetivos de infestación parasitaria. Por lo general, los rebaños son tratados íntegramente sobre la base de signos clínicos de infestación o en épocas prefijadas, las que posiblemente estén relacionadas con los momentos de mayor riesgo. Esta situación ha conllevado la aparición de resistencia, en muchos lugares, a los medicamentos de mayor uso (Arece et al., 2004).
Dentro de los principios de mayor aceptación en el contexto actual se encuentra la aplicación de tratamientos selectivos, ya que se ha demostrado que apenas el 30 % del rebaño posee más del 90 % de la carga parasitaria (Barger, 1985). Ello explica la importancia de la adecuada y precisa identificación de los animales que poseen una mayor infestación parasitaria, sobre todo en condiciones de campo.
El método FAMACHA© desarrollado originalmente en Sudáfrica se basa en la identificación de los animales con anemia clínica, mediante la inspección de la mucosa ocular (Bath et al., 1996). Se basa en la presencia de Haemonchus spp. como principio básico, situación que ha sido ampliamente documentada en Cuba (García et al., 1999; Arece et al., 2007), y este constituye el parásito de mayor prevalencia e incidencia en el trópico y en el país.
Este método se ha validado en disímiles condiciones en varios países; sin embargo, para extender su práctica productiva se requiere demostrar su eficacia en la identificación de animales anémicos como consecuencia de la infestación parasitaria por Haemonchus spp., lo que constituyó el objetivo de la presente investigación.
MATERIALES Y MÉTODOS
El estudio se desarrolló en un rebaño ovino Pelibuey del módulo de investigación-producción de la Estación Experimental de Pastos y Forrajes Indio Hatuey, Matanzas, Cuba. Dicho rebaño estuvo sometido, durante tres años, a una estrategia de control parasitario sobre la base de tratamientos selectivos, en función de la coloración de la mucosa ocular método FAMACHA© (Bath et al., 1996).
Durante este período se examinó, con una frecuencia mensual, la coloración de la mucosa ocular (CMO) de cada reproductora, y se clasificó en una de las cinco categorías de la carta de colores FAMACHA© (Van Wyk et al., 2006), en la que 1 corresponde a un animal con coloración roja intensa, y 5, a uno con mucosas pálidas. También se monitoreó la condición corporal (CC) (Russel et al., 1969) y se extrajo sangre mediante la punción de la vena yugular, para la realización de microhematocritos (VCA) por centrifugación (Hansen y Perry, 1994). Adicionalmente, se extrajeron las heces de cada animal directamente del recto para la determinación del conteo fecal de huevos de estrongílidos (CFH) como criterio de infestación parasitaria mediante la técnica de McMaster modificada (Arece et al., 2002), con una sensibilidad de 50 huevos por gramo de heces (HPG) y la realización de coprocultivos (Roberts y O´Sullivan, 1952) y la identificación de las especies de nematodos presentes.
Los animales pastorearon en una asociación de leguminosas arbustivas (Leucaena leucocephala, Albizia lebbeck y Gliricidia sepium) y gramíneas (Panicum maximum y complejo Dichantium-Botriochloa), con una carga global de 25 animales/ha y una rotación en 12 cuartones. Además, recibieron una dieta adicional que consistía en ensilaje de cítrico, follaje de L. leucocephala y pulpa de cítrico fresca, en tres momentos del ciclo reproductivo.
La información obtenida a partir de las variables estudiadas durante los tres años se empleó para validar la fiabilidad del método en la detección de anemia. La concordancia entre el VCA y las estimaciones realizadas con la carta de colores se determinó a través del índice de concordancia (Kappa); mediante este índice se estableció la magnitud de la concordancia o relación entre dos pruebas (por ejemplo: el hematocrito de un animal y los valores asignados según la carta de colores FAMACHA©). Las divisiones convencionales para la interpretación de Kappa indican que es insignificante si es menor que 0,2; moderada, si se encuentra entre 0,2-0,4; aceptable, si está entre 0,4-0,6; buena, si se haya entre 0,6 y 0,8; y excelente, si es mayor que 0,8 (Mahieu et al., 2007). Esta se calculó para diferentes niveles de hematocrito considerados como anémicos, ya que no se conoce con precisión el valor indicador de anemia en ovejas Pelibuey en Cuba; por ello se emplearon cuatro valores, menores que: 17, 19, 21 y 23 %.
Asimismo, se calculó la sensibilidad [(verdaderos positivos + falsos negativos)/verdaderos positivos x 100)], la especificidad [(verdaderos negativos + falsos positivos)/verdaderos negativos x 100)] y los valores predictivos de un positivo y un negativo (Vatta et al., 2001). Se consideró como animal positivo aquel que tuviera un VCA inferior o igual que 17, 19, 21 y 23 %; con respecto a la carta de colores FAMACHA©, se tuvieron en cuenta las categorías 4 o 5. Por otra parte, un animal negativo debía presentar un VCA superior a los valores previamente fijados, y la coloración de la mucosa debía fluctuar entre las categorías 1 y 3 de la carta de colores.
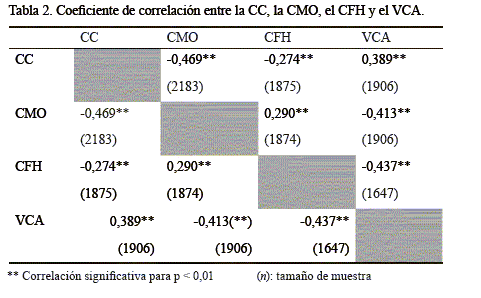
La determinación de los indicadores epizootiológicos antes mencionados se realizó con el empleo del software WinEpiscope 2.0 para Microsoft Windows®. Además, se calcularon las correlaciones no lineales (coeficiente de correlación Spearman) entre la CC, la CMO, el CFH y el VCA, con el paquete estadístico SPSS® versión 18.0 para Microsoft Windows®.
RESULTADOS Y DISCUSIÓN
El manejo de la haemonchosis en un rebaño con el empleo de la carta de colores FAMACHA© depende de la identificación precisa y del tratamiento apropiado de los animales más expulsores de huevecillos, así como de que el resto se quede sin tratar. De esa forma se incrementaría la resiliencia general del rebaño y se mantendría en un nivel apropiado la población parasitaria en refugio.
En la tabla 1 se muestra la fiabilidad de la carta de colores FAMACHA© en la detección de ovejas anémicas. Los mejores resultados en cuanto al índice de concordancia se obtuvieron cuando se consideró todo animal anémico con VCA inferior a 23 % (Kappa = 0,31). Estos valores son similares a los obtenidos en cabras, en el Caribe oriental (Guadalupe) (Mahieu et al., 2007). Desde el punto de vista práctico, este valor indica que la identificación de animales anémicos, a partir de la coloración de la mucosa ocular, es posible con un nivel moderado de confiabilidad.
Por otra parte, la sensibilidad (capacidad del método de detectar los animales realmente anémicos) presentó valores moderados y la especificidad (capacidad de detectar los animales no anémicos) tuvo resultados por encima de 84 %. Ello dependió del valor de hematocrito seleccionado para la evaluación de la prueba diagnóstica; en este sentido, se encontró un mejor ajuste cuando se consideró como anémico aquel animal con el hematocrito inferior a 17 %.
En este tipo de ensayo, una alta sensibilidad es más importante que una elevada especificidad (Scheuerle et al., 2010). Ello implica que si un animal se clasifica como falso positivo y, por ende, es tratado, solo repercutiría en un gasto innecesario del medicamento antiparasitario. Sin embargo, si un animal considerado como falso negativo no es tratado pudiera morir en el peor de los casos, en dependencia de la frecuencia de revisión de los animales.
Arece (2007), en condiciones similares a las del presente estudio, obtuvo una sensibilidad de 75 % y una especificidad de 100 %. Probablemente, dichos resultados se relacionen con el tamaño de la muestra empleada, lo cual pudo sesgar el alcance de estos.
En la provincia de Matanzas, en investigaciones con cabras lecheras, se halló una sensibilidad de 91 %. Sin embargo, la especificidad del método fue más baja (62,4 %) que la obtenida en el presente estudio.
Si se realiza un análisis de los resultados alcanzados en otros países, se aprecia que los valores de fiabilidad oscilan de 19-85 % para la sensibilidad, y de 52-100 % para la especificidad (Vatta et al., 2001; Kaplan et al., 2004; Burke et al., 2007; Mahieu et al., 2007). Según Reynecke et al. (2011), el empleo de la carta de colores para el tratamiento selectivo de los animales teniendo en cuenta los indicadores de fiabilidad constituye una herramienta práctica para los productores, sin que sea necesaria la intervención rutinaria de los laboratorios.
En la tabla 2 se muestra la correlación estadísticamente significativa entre el CFH y el VCA, debido a la presencia predominante de Haemonchus spp., del cual se conoce su alta patogenicidad, virulencia y capacidad hematófaga (Hansen y Perry, 1994). Además, se observa la correlación negativa y significativa entre la CMO y la CC de las reproductoras, la cual indica que el estado corporal de la reproductora pudiera constituir un elemento para la desparasitación selectiva, cuando existan dudas en la coloración de la mucosa ocular. Esta variable fisiopatológica se ha correlacionado significativamente con la CMO, las categorías FAMACHA©, el peso vivo y el hematocrito, lo que revela la posibilidad de su empleo como criterio de desparasitación ante una haemonchosis (Bisset et al., 2001). Sin embargo, Bath y Van Wyk (2009) señalan que esta debe ser tratada con precaución dentro de un programa sustentable, holístico e integral para el control parasitario.
Los resultados de la relación del hematocrito y las categorías según la carta de colores FAMACHA© se muestran en la figura 1. Las categorías 4 y 5 solo fueron asignadas al 3,35 % de los casos, lo cual indica una baja tasa de tratamientos antiparasitarios, de acuerdo con el método selectivo de estos; y confirma la teoría de que la menor parte de un rebaño alberga las mayores cargas parasitarias.
Por otra parte, se encontró que solo el 2,3 % de los casos presentó un hematocrito igual o inferior a 15; mientras que en el 5,4; 9,5; 15,2 y 24,9 % este indicador fue menor o igual que 17, 19, 21 y 23, respectivamente. Durante los tres años, el 96,6 % fueron clasificados en las categorías 1, 2 y 3, lo cual se corresponde con ovejas no anémicas. El empleo de este método de identificación de los animales más susceptibles en el rebaño pudiera contribuir a la implementación de estrategias integrales para el control parasitario, con énfasis en la selección de aquellos resilientes o resistentes al parasitismo gastrointestinal (Bisset et al., 2001; Riley et al., 2009; Vilela et al., 2012).
Se concluye que el método FAMACHA© constituye una herramienta viable para la detección de anemia en ovejas Pelibuey, y que pudiera ser aplicado en Cuba dentro de un programa integral de control parasitario.
AGRADECIMIENTOS
Las investigaciones fueron financiadas por la International Foundation for Science (proyecto B-4610) y por el Ministerio de la Agricultura de la República de Cuba.
REFERENCIAS BIBLIOGRÁFICAS
1. Arece, J. La metodología FAMACHA©: una estrategia para el control de estrongílidos gastrointestinales de ovinos. Estudios preliminares. Rev Salud Anim. 29 (2):91. 2007
2. Arece, J.; González, E. & Cáceres, O. Eficacia de LABIOMEC® en el parasitismo en ovinos, terneros y equinos en condiciones de producción. Pastos y Forrajes. 25 (3):223. 2002
3. Arece, J.; Mahieu, M.; Archimède, H.; Aumont, G.; Fernández, M.; González, E.; Cáceres, O. & Menéndez-Buxadera, A. Comparative efficacy of six anthelmintics for the control of nematodes in sheep in Matanzas, Cuba. Small Rum. Res. 5 (1-2):61. 2004
4. Arece, J.; Rodríguez-Diego, J.G.; Torres-Hernández, G.; Mahieu, M.; García, E. & González-Garduño, R. The epizootiology of ovine gastrointestinal strongyles in the province of Matanzas. Cuba. Small Rum Res. 72 (2-3):119. 2007
5. Barger, I. The statistical distribution of trichostrongylid nematodes in grazing lambs. Int. J. for Parasitol. 15 (6):645. 1985
6. Bath, G.F.; Malan, F.S. & van Wyk, J.A. The «FAMACHA©» Ovine Anemia Guide to assist with the control of haemonchosis. In: Proceedings of the 7th Annual Congress of the Livestock Health and Production Group of the South African Veterinary Association. Port Elizabeth, South Africa. p. 5. 1996
7. Bath, G.F. & van Wyk, J.A. The Five Point Check© for targeted selective treatment of internal parasites in small ruminants. Small Rum Res. 86 (1):6. 2009
8. Bisset, S.A.; van Wyk, J.A.; Bath, G.F.; Morris, C.A.; Stenson, M.O. & Malan FS. Phenotypic and genetic relationships amongst FAMACHA© score, faecal egg count and performance data in Merino sheep exposed to Haemonchus contortus infection in South Africa. In: Proceedings of the 5th International Sheep Veterinary Congress. Stellenbosch, South Africa. 19 p. 2001
9. Burke, J.M.; Kaplan, R.M.; Miller, J.E.; Terrill, T.H.; Getz, W.R. & Mobini S. et al. Accuracy of the FAMACHA© system for on-farm use by sheep and goat producers in the southeastern United States. Vet Parasitol. 147:89. 2007
10. García, Amelia; Benítez, D.; La O, M.; Vega, A. & San Martín, C. Parásitos gastrointestinales de hembras ovinas en diferentes estados reproductivos. Revista de Producción Animal. 1:59. 1999
11. Hansen, J. & Perry, B. The epidemiology, diagnosis and control of helminth parasites of ruminants. ILRAD, Nairobi. 171 p. 1994
12. Kaplan, R.J.; Burke, M.; Terrill, T.H.; Miller, J.E.; Getz, W.R. & Mobini, S. et al. Validation of the FAMACHA© eye colour chart for detecting clinical anaemia in sheep and goats on farms in the southern United States. Vet Parasitol. 123:105. 2004
13. Mahieu, M.; Arquet, R.; Kandassamy, T.; Mandonnet, Natalie & Hoste, H. Evaluation of targeted drenching using FAMACHA© method in Creole goat: reduction of anthelmintic use, and effects on kid production and pasture contamination. Vet Parasitol. 146:135. 2007
14. Reynecke, D.P.; van Wyk, J.A.; Gummow, B.; Dorny, P. & Boomker, J. Validation of the FAMACHA© eye colour chart using sensitivity/specificity analysis on two South African sheep farms. Vet Parasitol. 177:203. 2011
15. Riley, D.G. & van Wyk, J.A. Genetic parameters for FAMACHA© score and related traits for host resistance/resilience and production at differing severities of worm challenge in a Merino flock in South Africa. Vet Parasitol. 164:44. 2009
16. Roberts, F.H.S. & O´Sullivan, J.P. Methods for egg counts and larval cultures for strongyles infesting the gastrointestinal tract of cattle. Australian Agricultural Research. 1:99. 1952
17. Russel, A.J.F.; Doney, J.M. & Gunn, R.G. Subjective assessment of body fat in live sheep. Journal of Agricultural Sciences. 72:451. 1969
18. Scheuerle, Miriam; Mahling, Monia; Muntwyler, Jeannette & Pfister, K. The accuracy of the FAMACHA-method in detecting anaemia and haemonchosis in goat flocks in Switzerland under field conditions. Vet Parasitol. 170:71. 2010
19. Van Wyk, J.A.; Hoste, H.; Kaplan, R.M. & Besier, R.B. Targeted selective treatment for worm management-how do we sell rational programs to farmers? Vet. Parasitol.139:336. 2006
20. Vatta, A.F.; Letty, B.A.; van der Linde, M.J.; van Wijk, E.F.; Hansen. J.W. & Krecek R.C. Testing for clinical anaemia caused by Haemonchus spp. in goats farmed under resource-poor conditions in South Africa using an eye colour chart developed for sheep. Vet. Parasitol. 99:1. 2001
21. Vilela, V.L.; Feitosa, T.F.; Linhares, E.F.; Athayde, A.C.; Molento, M.B. & Azevedo, S.S. FAMACHA© method as an auxiliary strategy in the control of gastrointestinal helminthiasis of dairy goats under semiarid conditions of Northeastern Brazil. Vet Parasitol. 190:281. 2012
Recibido el 6 de mayo del 2013
Aceptado el 25 de septiembre del 2013