Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Pastos y Forrajes
versión impresa ISSN 0864-0394
Pastos y Forrajes vol.37 no.4 Matanzas oct.-dic. 2014
ARTÍCULO DE INVESTIGACIÓN
Efecto de la suplementación con concentrado en la fermentación in vitro de dietas para vacas lecheras en silvopastoreo
Effect of the supplementation with concentrate feed on the in vitro fermentation of diets for cows under silvopastoral system conditions
O. López1, Yuseika Olivera1, L. Lamela1, Tania Sánchez1, I. L. Montejo1, M. Ronquillo2 y R. Rojo-Rubio3
1Estación Experimental de Pastos y Forrajes Indio Hatuey, Universidad de Matanzas Camilo Cienfuegos, Ministerio de Educación Superior. Central España Republicana, CP 44280, Matanzas, Cuba
2Facultad de Medicina Veterinaria y Zootecnia, Universidad Autónoma del Estado de México, México
3Centro Universitario UAEM-Temascaltepec, Universidad Autónoma del Estado de México, México
Correo electrónico: olopez@ihatuey.cu
RESUMEN
Se evaluó el efecto de la suplementación con concentrado (C0: control; C5: 5 % de los requerimientos de EM; C10: 10 % de los requerimientos de EM) en la degradabilidad ruminal de dietas para vacas lecheras basadas en Panicum maximum y Leucaena leucocephala, mediante la técnica de producción de gas (PG) in vitro. Para formular las dietas se asumió que los animales pesaban 480 kg, que estaban en su tercera lactancia y producían 10 kg de leche diarios, lo cual es representativo de la vaquería donde se tomaron las muestras de alimento. Se estimó la PG in vitro, los parámetros de la producción de gas (b, c, L), la digestibilidad in vitro de la materia seca (DIVMS), la energía metabolizable (EM) y los ácidos grasos de cadena corta (AGCC), los cuales se compararon mediante un análisis de varianza, en un diseño completamente aleatorizado con tres tratamientos y tres repeticiones. Las dietas se incubaron in vitro, y para ello se utilizó inóculo ruminal de vacas Limousine, clínicamente sanas. La suplementación con concentrado incrementó linealmente (p < 0,01) la producción de gas a las 24 h y a las 48 h; mientras que a las 96 h el efecto fue cuadrático (p < 0,05), con el menor valor para C5. La DIVMS y la EM (p < 0,001), así como los AGCC (p < 0,05), se incrementaron linealmente con el aumento del concentrado, aunque en C10 la DIVMS fue menor; sin embargo, se incrementó la EM y los AGCC. Se concluye que en dietas basadas en P. maximum y L. leucocephala la adición de concentrado en un 5 % no tuvo efecto en la EM ni en la producción de AGCC, por lo que es necesario adicionar al menos un 10 % de este suplemento a la dieta, con base en los requerimientos de EM de los animales.
Palabras clave: Panicum maximum, Leucaena leucocephala, gases, producción lechera.
ABSTRACT
The effect of the supplementation with concentrate feed (C0: control; C5: 5 % of the ME requirements; C10: 10 % of the ME requirements) on the ruminal degradability of diets for dairy cows based on Panicum maximum and Leucaena leucocephala, was evaluated through the in vitro gas production (GP) technique. To formulate the diets it was assumed that the animals weighed 480 kg, that they were in their third lactation and produced 10 kg of milk per day, which is representative of the dairy farm where the feed samples were taken. The in vitro GP, the gas production parameters (b, c, L), the in vitro dry matter digestibility (IVDMD), the metabolizable energy (ME) and the short-chain fatty acids (SCFA) were estimated, which were compared through a variance analysis, in a completely randomized design with three treatments and three repetitions. The diets were incubated in vitro, and for such purpose ruminal inoculum from clinically healthy Limousine cows was used. The supplementation with concentrate feed linearly increased (p < 0,01) the gas production at 24 h and 48 h; while at 96 h the effect was quadratic (p < 0,05), with the lowest value for C5. The IVDMD and ME (p < 0,001), as well as the SCFA (p < 0,05), increased linearly with the increase of the concentrate feed, although in C10 the IVDMD was lower; nevertheless, the ME and SCFA increased. It is concluded that in diets based on P. maximum and L. leucocephala the addition of concentrate feed in 5 % did not have effect on the ME or on the production of SCFA, for which it is necessary to add at least 10 % of this supplement to the diet, based on the ME requirements of the animals.
Key words: Panicum maximum, Leucaena leucocephala, gasses, milk production.
INTRODUCCIÓN
La alimentación de los rumiantes se basa principalmente en el pastoreo, sobre todo de gramíneas (Bakhashwain et al., 2010). Sin embargo, en el área tropical la producción y la calidad de estas no son suficientes para cubrir los requerimientos nutricionales de las vacas lecheras de mediano potencial. Por ello, la utilización de las asociaciones de leguminosas arbóreas con gramíneas mejoradas en un sistema de manejo integrado y racional constituye una opción viable y sostenible, para incrementar la producción y mejorar la calidad de los alimentos que consumen los animales (Iglesias y Hernández, 2005).
No obstante, en estos sistemas silvopastoriles se ha constatado un exceso de proteína bruta en la dieta de las vacas, debido al incremento del contenido de proteína en el pasto asociado y al aporte del follaje de la leguminosa a la ración, así como un déficit de energía (Iglesias, 2003; López, 2003), lo que constituye el factor limitante para la producción de adecuados niveles de leche en estos sistemas.
Por otra parte, la suplementación de las vacas con grandes cantidades de concentrado no constituye una práctica ventajosa, debido al incremento de los costos por concepto de alimentación (Benavides, 1994). Sin embargo, se conoce que las dietas con concentrado permiten incrementar el consumo de materia seca (MS) y la producción de los ácidos grasos de cadena corta (AGCC) en el rumen (Van Ackeren et al., 2009), por lo que el uso de una pequeña cantidad de concentrado pudiera mejorar el balance y la utilización de la energía de la dieta.
La técnica de producción de gas in vitro es una práctica útil para evaluar los alimentos (Tedeschi et al., 2009; Maheri-Sis et al., 2011), ya que permite determinar la extensión y la cinética de degradación de estos, a través del volumen de gas producido durante el proceso fermentativo (Salamat-Azar et al., 2012). Una de las ventajas de este procedimiento es que se puede cuantificar el curso de la fermentación y el papel de los componentes solubles del sustrato (Pell et al., 1997). Además, permite predecir el consumo, la digestibilidad, el aporte de nitrógeno microbiano y las cantidades de AGCC y EM de los alimentos para los rumiantes (Maheri-Sis et al., 2008).
Por último, se ha demostrado que a través de la técnica de producción de gas in vitro se puede estudiar el efecto asociativo entre distintos alimentos (Bakhashwain et al., 2009). Por ello, el objetivo del presente estudio fue evaluar el efecto de la suplementación con concentrado en la degradabilidad ruminal in vitro de dietas para vacas lecheras, basadas en el pastoreo de guinea (Panicum maximum) y leucaena (Leucaena leucocephala), en sistemas silvopastoriles asociados.
MATERIALES Y MÉTODOS
Área para la colecta de las muestras. Las muestras de guinea y leucaena se tomaron en los meses de julio y agosto del área de silvopastoreo de la Vaquería 66, perteneciente a la Empresa Pecuaria Genética de Matanzas, la cual se ubica geográficamente en los 23° de latitud Norte y los 80° de longitud Oeste, a 70 msnm (Academia de Ciencias de Cuba, 1989). El suelo se clasifica como Pardo con carbonatos (Hernández et al., 2006) y el clima es cálido tropical (Centro del Clima-Instituto de Meteorología, 2013), con temperatura y precipitación promedio anual de 24,4 °C y 1 300 mm, respectivamente.
Método para la colecta de las muestras. Para la colecta de la muestra de pasto (≈3,0 kg) se simuló la selección que hacen los animales al pastar, según la metodología propuesta por Herrera (2006). En el caso de la leñosa, las hojas y los tallos tiernos comestibles (≈ 2,0 kg) se recolectaron manualmente, simulando el ramoneo que realizan los animales, en 10 de los árboles establecidos en el cuartón hasta una altura de 2 m, de acuerdo con lo recomendado por Lamela (1998).
Preparación de las muestras. Después de la colecta, las muestras fueron trasladadas al laboratorio de análisis químico de la Estación Experimental de Pastos y Forrajes Indio Hatuey, donde se secaron en una estufa de ventilación forzada a 65 °C durante 72 h, para estimar el contenido de MS. Posteriormente, se molieron en un molino estacionario de cuchillas (con criba de 1 mm de diámetro); se envasaron en bolsas de nailon, hasta 50 (± 1) g por muestra; y se sellaron. En el caso del concentrado, el contenido de MS se determinó mediante el secado en estufa a 60 °C durante 48 h.
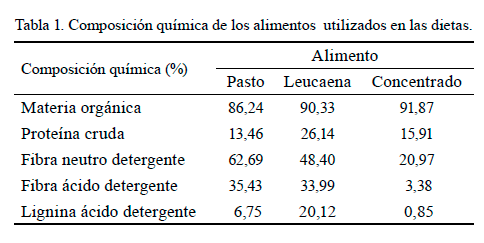
Procedimientos analíticos. El contenido de MS del alimento se determinó mediante el secado en estufa a 60 °C durante 48 h, y la materia orgánica (MO) de los alimentos procesados se estimó después de la incineración en horno-mufla a 550 °C por 4 h. La proteína cruda (PC, N x 6,25) se determinó por el método Kjeldahl (AOAC, 1990). El contenido en fibra neutro detergente (FND), fibra ácido detergente (FAD) y lignina (Lig) se analizó de acuerdo con el procedimiento de Van Soest et al. (1991), sin corrección por cenizas, con la utilización de bolsas de filtro ANKOM F-57 en un analizador de fibras ANKOM200 (ANKOM Technology Corporation, Fairport, NY, USA). Los contenidos de MS de los alimentos fueron de 30,68; 31,14 y 89,52 % para la guinea, la leucaena y el pienso, respectivamente. En la tabla 1 aparece la composición química en base seca de dichos componentes de las dietas.
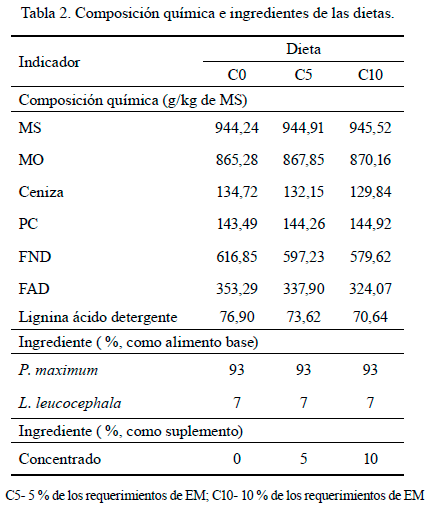
Dietas experimentales. Se formularon tres raciones para incluir la suplementación con concentrado (C0: control; C5: 5 % de los requerimientos de EM; C10: 10 % de los requerimientos de EM). Las raciones se ajustaron para suplir los requerimientos nutricionales de vacas lecheras (480 kg PV) de tercera lactancia con una producción de 10 kg/vaca/día. Los datos correspondientes a la composición química de las dietas y sus ingredientes aparecen en la tabla 2.
Producción ruminal de gas in vitro
1. Características, manejo y alimentación de los animales donantes
Para las incubaciones in vitro se usaron como donantes del inóculo ruminal dos vacas de la raza Limousin, clínicamente sanas, canuladas en el saco dorsal del rumen. Estas se encontraban en estabulación, alimentadas ad libitum con una dieta constituida por: 35,8 % de heno de alfalfa (Medicago sativa); 47,2 % de paja de avena (Avena sativa); 14,0 % de maíz (Zea mays) molido y 3,0 % de harina de soya (Glycine max). El alimento se suministró dos veces al día (8:00 a. m. y 4:00 p. m.), y los animales tuvieron libre acceso al agua potable.
2. Obtención del inóculo ruminal
El fluido ruminal se extrajo de múltiples sitios del rumen (igual cantidad de cada bovino), a las 6:30 a. m., antes de la oferta del alimento matutino. Para ello se retiró manualmente el contenido del rumen, y se exprimió en envases térmicos previamente calentados en agua, a 40 °C que fueron trasladados al laboratorio de nutrición animal. Este fluido se filtró en una triple capa de gasa y lana de vidrio; después se mantuvo a 39 °C, durante 30 minutos, y fue saturado continuamente con CO2.
3. Incubaciones in vitro
El ensayo de producción de gas in vitro se realizó de acuerdo con la técnica de Theodorou et al. (1994). Se emplearon frascos ámpula de 125 mL, a los cuales se les introdujo 800 (± 0,002) mg de MS de P. maximum y de L. leucocephala (en las proporciones descritas en la tabla 2), más un 5 % (40 ± 0,001 mg) o un 10 % (80 ± 0,001 mg) de concentrado.
La solución para la incubación estuvo constituida por una mezcla de macro y microminerales, una solución tampón de bicarbonato, agua destilada, una solución reductora y resazurina como indicador de reducción. Se gaseó con CO2, según la técnica de Menke y Steingass (1988), y se agregaron 90 mL a cada frasco, así como 10 mL de fluido ruminal.
Se realizaron tres series de incubación, en las que se incluyeron tres frascos por muestra y tres controles negativos (blanco) solo con el inóculo. En estas series de incubación se utilizó paja de avena como estándar.
El contenido de los frascos se homogenizó y estos se incubaron para iniciar el registro de la producción acumulada de gas a las 3, 6, 9, 12, 24, 36, 48, 72 y 96 horas de incubación. Al finalizar la incubación, el contenido de cada botella se filtró a través de crisoles de vidrio porcelana de porosidad 1 (100 a 160 µm de tamaño de poro, Pyrex, Stone, UK), bajo presión. Los residuos de la fermentación se secaron a 60 °C, durante 48 h, para estimar la DIVMS.
4. Cálculos
La presión generada por el gas que se acumula en la parte superior de los frascos se midió mediante un transductor de presión (marca Delta OHM, Modelo HD 8804) conectado a un lector digital. La transformación de los valores de presión a volumen de gas se realizó con una ecuación obtenida mediante un análisis de regresión:
Y = (2,7 384*X) 0,0243
Donde:
Y: volumen de gas (mL)
X: presión (psi); R2 = 0,99
Los datos de la producción de gas (mL/g de MS) se analizaron por medio de la opción NLIN del paquete estadístico SAS (2002), mediante el modelo de France et al. (2000):
A = b x [1-e-c (t-L)]
Donde:
A : volumen de producción de gas (PG) en el tiempo t
b : asíntota de la producción de gas (mL/g de MS)
c: tasa de producción de gas (/h): tiempo Lag
t: tiempo (h)
Los parámetros REL1 (la proporción de la fermentación que se desarrolla en las primeras 48 h) y REL2 (representa cuán próxima es la PG96 del potencial de producción b) se calcularon a partir de la relación entre la PG48 y la PG96, y la relación entre la PG96 y b, respectivamente (Bueno et al., 2005).
La EM (Mj/kg de MS) se estimó de acuerdo con el procedimiento de Menke y Steingass (1988), por medio de la siguiente ecuación:
EM = 2,20 + 0,136 PG24 (mL/200 mg de MS) + 0,057 PC
Donde:
PG24: volumen de gas a las 24 h
PC (%): contenido en proteína cruda del alimento en base seca
Los AGCC se calcularon de acuerdo con la ecuación de Getachew et al. (2002):
AGCC (mmol/200 mg de MS) = 0,0222 PG24 0,00425
Donde:
PG24: producción neta de gas a las 24 h (mL/200 mg de MS)
Diseño experimental y análisis estadístico. El diseño fue completamente aleatorizado, con tres tratamientos y tres repeticiones. Los datos de la producción de gas in vitro, los parámetros de la producción de gas (b, c, L), la DIVMS, la EM y los AGCC se compararon mediante un análisis de varianza. Las diferencias entre las medias se determinaron a través del test de comparación de rangos múltiples de Duncan (Steel y Torrie, 1980). Además, se realizó un análisis de contraste lineal y cuadrático del nivel de concentrado. La información se analizó con el paquete estadístico SPSS® versión 15.0 para Windows®.
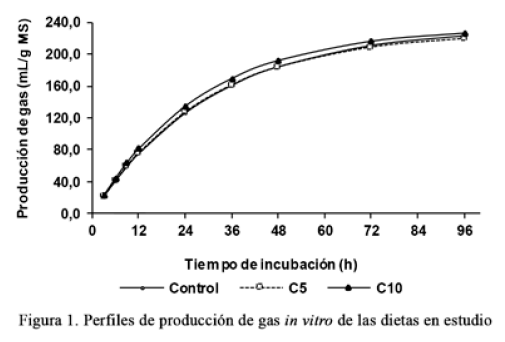
RESULTADOS Y DISCUSIÓN El contenido de PC (tablas 1 y 2), tanto el de los alimentos que componen las dietas (entre 13,5 y 26,1 %) como el de las propias dietas (14,4 % como promedio), fue superior al mínimo que se requiere (7 %) para una adecuada actividad microbiana en el rumen (Phelps, 1990). En la figura 1 se presenta el perfil de producción de gas acumulada (mL/g de MS) en las tres dietas, durante 96 horas de incubación. La producción de gas aumentó rápidamente en las primeras 12 horas de la fermentación, con valores superiores para la dieta C10. A partir de ese momento, el incremento fue proporcionalmente menor en las tres dietas y la diferencia entre C5 y C10 mantuvo la misma tendencia entre las 12 y las 96 horas de incubación. Sin embargo, a partir de las 48 horas la dieta control incrementó ligeramente la producción de gas con respecto a C5 (p < 0,05), de tal forma que a las 96 horas tuvo un comportamiento intermedio entre las dietas C5 y C10. La mayor PG acumulada en los tres momentos (p < 0,05) correspondió a la dieta C10. En la tabla 3 se muestran las características de la fermentación in vitro de las dietas. La producción de gas y la tasa de producción de gas en las primeras 24 horas de incubación estuvieron relacionadas con los carbohidratos solubles (almidón y azúcar) de la dieta (Menke y Staingass, 1988). La mayor producción de gas de la dieta C10 en ese intervalo se debió, probablemente, al incremento de la fracción de carbohidratos solubles (especialmente el almidón) provenientes del concentrado y a su elevada fermentación, ya que puso a disposición de los microorganismos la suficiente energía en forma de ATP para su adecuado crecimiento (Hamid et al., 2007). En tal sentido, Opatpatanakit et al. (1994) encontraron una alta correlación entre la producción de gas in vitro y la disponibilidad de almidón en los granos de cereales. El incremento de la producción de gas a las 24 horas en la dieta C10 indica que el nitrógeno degradable tampoco limitó la actividad microbiana, lo que permitió que la fracción de carbohidratos fuera degradada de acuerdo con su potencial (Hamid et al., 2007). Por tanto, la sincronización entre la degradación de los carbohidratos y su aporte en energía, así como la degradación de las proteínas y su contribución en nitrógeno, son esenciales para lograr una adecuada eficiencia en la fermentación ruminal. La dieta C5 tuvo la menor producción asintótica de gas (p < 0,05), mientras que C10 mostró un comportamiento similar al control (efecto cuadrático, p < 0,01). Varios autores han informado que el volumen de gas es un buen indicador para predecir la digestibilidad (Sommart et al., 2000), los productos finales de la fermentación y la síntesis de proteína microbiana que realizan los microorganismos del rumen a partir del sustrato en el sistema in vitro (Maheri-Sis et al., 2008; Mirzaei-Aghsaghali y Maheri-Sis, 2008). La tasa fraccional de producción de gas (c) aumentó linealmente (p < 0,001) con el incremento del concentrado, lo que se debió al aumento de los carbohidratos no estructurales, con la consecuente disminución de los valores de FND y lignina. Al respecto, Al-Masri (2010) informó que el ritmo fraccional de producción de gas mostró una correlación negativa con el contenido de FND y la lignina. El tiempo de inicio para la fermentación de la fracción insoluble pero potencialmente fermentable (fase lag, L) en la dieta C5 fue similar al del control; sin embargo, se redujo significativamente en la dieta C10 (p < 0,05), y manifestó un efecto lineal (p < 0,001). Un menor valor en la fase lag sugiere que hubo un aumento en la densidad energética de la ración, lo que favoreció el crecimiento microbiano y la rápida colonización de la fracción insoluble pero potencialmente degradable (Noguera et al., 2006). El REL1, que sugiere la proporción de la fermentación que se desarrolla en las primeras 48 h, presentó valores entre 0,83 y 0,85; mientras que el REL2, que representa cuán próxima es la PG96 del potencial de producción (b), estuvo entre 0,96 y 0,97. Ambos aumentaron sus valores con el incremento del concentrado. Al calcular los parámetros REL1 y REL2, como un nuevo enfoque para evaluar los alimentos, Sallam et al. (2007) encontraron una tendencia a su incremento con el aumento del concentrado en la dieta, por lo que este acelera la velocidad de la fermentación. Asumiendo un tiempo promedio de retención ruminal de 48 h (tasa de flujo de 0,021 h-1), sería deseable que la mayor parte de los nutrientes digestibles fermentaran en este intervalo de tiempo. De ahí que mientras más próxima esté la PG96 de b (mayor REL2), la calidad del alimento mejor será y/o el tiempo de incubación, lo suficientemente largo como para expresar su potencial de fermentación (Bueno et al., 2005).
En este sentido, Sánchez et al. (2008) refirieron que sería deseable que los alimentos y/o las dietas manifestaran adecuados valores de estos indicadores, ya que aquellos que se degradan con más velocidad promueven una mayor velocidad de pasaje, y, por ende, un mayor consumo por los animales, si no existen otros factores limitantes
La DIVMS fue superior (p < 0,05) en las dietas control y C5 con respecto a la dieta C10, por lo que la adición de concentrado disminuyó linealmente (p < 0,001) este indicador.
La producción de gas, que es generalmente un buen indicador de la digestibilidad (Sommart et al., 2000), no mostró el mismo comportamiento que la DIVMS. Ello coincide con los resultados obtenidos por Zicarelli et al. (2008), pero contrasta con los de otros autores (Blümmel y Ørskov, 1993; Datt y Singh, 1995) que informaron una correlación positiva entre la PG y la digestibilidad de la MS. Sin embargo, se debe señalar que no toda la MO que se degrada es fermentada y produce gas. Los productos principales de la fermentación de la MO de los alimentos en los rumiantes son los ácidos grasos volátiles (AGV), la biomasa microbiana (principalmente la proteína) y los gases (Alexander et al., 2008).
En experimentos realizados con ganado ovino (Ramanzin et al., 1997), vacuno (Jaakola y Huhtanen, 1993) y caprino (Ramanzin et al., 1997), se ha observado que a medida que aumenta la proporción de concentrado en la ración se produce un incremento paralelo en la digestibilidad in vivo de la MS y de la MO, así como una disminución en la digestibilidad de los componentes de la pared celular.
En la dieta C10 la proporción de concentrado se considera aun relativamente baja; por tanto, a pesar de haber ocurrido una elevada fermentación del almidón en las primeras 24 h de incubación, ello no se reflejó en un incremento en la DIVMS de la dieta. Por el contrario, la acumulación de los productos finales de la fermentación pudo, en alguna medida, disminuir la subsiguiente degradación de la FDN y afectar la DIVMS en ese tratamiento.
Por otra parte, el incremento de la DIVMS y de la FDN en las dietas control y C5 no fue suficiente para compensar el balance en la utilización de la energía, el cual se logró a partir de la fermentación de los carbohidratos no estructurales en la dieta C10.
El contenido de EM y la concentración de AGCC fueron superiores (p < 0,05) en la dieta C10 respecto a las otras, y ambos indicadores aumentaron linealmente (p < 0,01) con la adición de C.
Los valores de EM en todos los tratamientos (6,45-6,70 MJ/kg de MS) fueron inferiores a los informados por Hernández et al. (2012) en dietas basadas en Cenchrus ciliaris (45-60 %), harina de grano de soya y distintos niveles de grano de sorgo y pulpa de cítrico deshidratada (7,83-8,98 MJ/kg de MS).
No obstante, este indicador, que representa aquella porción de la energía del alimento que puede ser utilizada por el animal (Alderman, 1993), mostró valores aceptables en las tres dietas, sobre todo teniendo en cuenta que se trata de raciones con un elevado porcentaje de P. maximum (85-93 %) en su composición.
El comportamiento de estos indicadores sugiere que cuando la dieta es de buena calidad nutricional (silvopastoreo), la adición de concentrado en un 5 % no tiene efecto en la EM ni en la producción de AGCC. Por ello, para mejorar el balance de energía es necesario adicionar a la dieta, al menos, un 10 % de este suplemento sobre la base de los requerimientos de EM de los animales.
CONCLUSIONES
La suplementación con 5 % de concentrado en dietas para vacas lecheras basadas en P. maximum y L. leucocephala no mejoró los indicadores de la fermentación ruminal in vitro. Sin embargo, cuando se suplementó con el 10 % hubo un efecto positivo en la EM y en la producción de AGCC, por lo que se mejoró el metabolismo energético de la dieta.
AGRADECIMIENTOS
Se agradece a la Secretaría de Educación Pública de Los Estados Unidos Mexicanos, por brindar el financiamiento para una beca de estudios de investigación; y a La Facultad de Medicina Veterinaria y Zootecnia de la Universidad Autónoma del Estado de México, en cuyos laboratorios se realizaron estas investigaciones.
REFERENCIAS BIBLIOGRÁFICAS
1. Academia de Ciencias de Cuba. Nuevo Atlas Nacional de Cuba. La Habana: Instituto Cubano de Geodesia y Cartografía, 1989.
2. Alderman, G. Energy and protein requirements of ruminants. Agricultural and Food Research Council (AFRC). Wallingford, England: CAB International, 1993.
3. Alexander, G.; Singh, B.; Sahoo, A. & Bhat, T. K. In vitro screening of plant extracts to enhance the efficiency of utilization of energy and nitrogen in ruminant diets. Anim. Feed Sci. Technol. 145:229-244, 2008.
4. Al-Masri, M. R. In vitro rumen fermentation kinetics and nutritional evaluation of Kochia indica as affected by harvest time and cutting regimen. Anim. Feed Sci. Technol. 157:55-63, 2010.
5. AOAC. Official methods of analysis. 15th ed. Arlington, USA: Association of Official Analytical Chemist, 1990.
6. Bakhashwain, A. A.; Sallam, S. M. A. & Allam, A. M. Nutritive value assessment of some Saudi Arabian foliages by gas production technique in vitro. Met. Env. & Arid Land Agric. Sci. 21:65-80, 2010.
7. Bakhashwain, A. A.; Sallam, S. M. A. & Allam, A. M. The use of in vitro gas production technique to investigate the associative effect of a desert plant with high quality forage. Alex. J. Agric. Res. 54:25-32, 2009.
8. Benavides, J. E. La investigación en árboles forrajeros. En: J. E. Benavides, comp. Árboles y arbustos forrajeros en América Central. Turrialba, Costa Rica: CATIE. vol. 1. p. 3-28, 1994.
9. Blümmel, M. & Ørskov, E. R. Comparison of in vitro gas production and nylon bag degradability of roughages in predicting feed intake in cattle. Anim. Feed Sci. Technol. 40:109-119, 1993.
10. Bueno, I. C. S.; Cabral, S. L. S. Filho; Gobbo, Sarita P.; Louvandini, H.; Vitti, D. M. S. S. & Abdalla, A. L. Influence of inoculum source in a gas production method. Anim. Feed Sci. Technol. 123-124:95-105, 2005.
11. Centro del Clima-Instituto de Meteorología. El clima de Cuba. Características generales. La Habana, 2013. http://www.insmet.cu/asp/genesis.asp?TB0=PLANTILLAS&TB1=CLIMAC&TB2=/clima/ClimaCuba.htm. [30/09/2013].
12. Datt, C. & Singh, G. Effect of protein supplementation on in vitro digestibility and gas production of wheat straw. Indian J. Dairy Sci. 48:357-361, 1995.
13. France, J.; Dijkstra, J.; Dhanoa, M. S.; López, S. & Bannink, A. Estimating the extent of degradation of ruminant feeds from a description of their gas production profiles observed in vitro: derivation of models and other mathematical considerations. Brit. J. Nutr. 83:143-150, 2000.
14. Getachew, G.; Makkar, H. P. S. & Becker, K. Tropical browses: contents of phenolics compounds, /in vitro/ gas production and stoichiometric relationship between short chain fatty acid and in vitro gas production. J. Agric. Sci. 139:341-352, 2002.
15. Getachew, G.; Robinson, P. H.; DePeters, E. J. & Taylor, S. J. Relationships between chemical compositions, dry matter degradation and in vitro gas production of several ruminant feeds. Anim. Feed Sci. Technol. 111:57-71, 2004.
16. Hamid, P.; Akbar, T.; Hossein, J. & Gholan-Ali, M. Nutrient digestibility and gas production of some tropical feeds used in ruminant diets estimated by the in vivo and in vitro gas production techniques. Am. J. Anim. Vet. Sci. 2:108-113, 2007.
17. Hernández, A.; Ascanio, M.; Morales, Marisol & León, A. Diferentes etapas en la clasificación de suelos en Cuba. En: A. Hernández y M.O. Ascanio, coords. La historia de la clasificación de los suelos en Cuba. La Habana: Editorial Félix Varela. p. 11-56, 2006.
18. Hernández, J.; Rojo, R.; Salem, A. Z. M.; Mirzaei, F.; González, A.; Vázquez, J. F. et al. Influence of different levels of dried citrus pulp on in vitro ruminal fermentation kinetics of total mixed ration in goat rumen inocula. J. Anim. Feed Sci. 21:458-467, 2012.
19. Herrera, R. S. Métodos de muestreo en pastos y suelo. En: Fisiología, producción de biomasa y sistemas silvopastoriles en pastos tropicales. Abono orgánico y biogás. La Habana: Instituto de Ciencia Animal. p. 89-108, 2006.
20. Iglesias, J. M. Los sistemas silvopastoriles, una alternativa para la crianza de bovinos jóvenes en condiciones de bajos insumos. Tesis presentada en opción al grado científico de Doctor en Ciencias Veterinarias. La Habana: Instituto de Ciencia Animal, 2003.
21. Iglesias, J. M. & Hernández, D. Sistemas silvopastoriles para la producción bovina en Cuba. En: L. Simón, ed. El silvopastoreo: un nuevo concepto de pastizal. Matanzas, Cuba: EEPF Indio Hatuey. p. 147, 2005.
22. Jaakola, S. & Huhtanen, P. The effects of forage preservation method and proportion of concentrate on nitrogen digestion and rumen fermentation in cattle. Grass Forage Sci. 48:146-154, 1993.
23. Lamela, L. Técnica de muestreo. Conferencia del curso de posgrado «Manejo de los pastos y forrajes para la producción animal». Maestría en Pastos y Forrajes. Matanzas, Cuba: EEPF Indio Hatuey, 1998.
24. López, O. Caracterización del comportamiento productivo y reproductivo de vacas Mambí de Cuba de primera lactancia en un sistema silvopastoril. Tesis presentada en opción al título académico de Master en Reproducción Animal. La Habana: CENSA, Universidad Agraria de La Habana, 2003.
25. Maheri-Sis, N.; Chamani, M.; Sadeghi, A. A.; Mirza-Aghazadeh, A. & Aghajanzadeh-Golshani, A. Nutritional evaluation of kabuli and desi type chickpeas (Cicer arietinum L.) for ruminants using in vitro gas production technique. Afr. J. Biotechnol. 7:2946-2951, 2008.
26. Maheri-Sis, N.; Eghbali-Vaighan, M.; Mirza-Aghazadeh, A.; Ahmadzadeh, A.; Aghajanzadeh-Golshani, A.; Mirzaei-Aghsaghali, A. et al. Effects of microwave irradiation on ruminal dry matter degradation of tomato pomace. Curr. Res. J. Biol. Sci. 3:268-272, 2011.
27. Menke, K. H. & Steingass, H. 1988. Estimation of the energetic feed value obtained from chemical analysis and in vitro gas production using rumen fluid. Anim. Res. Dev. 28:7-45, 1988.
28. Mirzaei-Aghsaghali, A. & Maheri-Sis, N. Nutritive value of some agro-industrial by-products for ruminants. A review. World J. Zool. 3:40-46, 2008.
29. Noguera, R. R.; Ramírez, C. I. & Bolivar, M. D. Efecto de la inclusión de papa (Solanum tuberosum) en la cinética de fermentación in vitro del pasto kikuyo (Pennisetum clandestinum). Liv. Res. Rural Dev. 18:1-13, 2006.
30. Opatpatanakit, Y.; Kellaway, R. C.; Lean, I. J.; Annison, G. & Kirby, A. Microbial fermentation of cereal grains in vitro. Aust. J. Agric. Res. 45:1247-1263, 1994.
31. Pell, A. N.; Doane, P. H. & Schofield, P. In vitro digestibility and gas production. In: Simpósio sobre Tópicos Especiais em Zootecnia, Lavras, Brasil. p. 109-132, 1997.
32. Phelps, A. Nitrógeno no proteico. Agricultura de las Américas. 90:11-17, 1990.
33. Ramanzin, M.; Bailoni, L. & Schiavon, S. Effect of forage to concentrate ratio on comparative digestion in sheep, goats and fallon deer. Anim. Sci. 64:163-170, 1997.
34. Salamat-Azar, M.; Doust-Nober, R. S.; Maheri-Sis, N.; Aghdam-Shahryar, H. & Asadi, Y. Effects of Zataria multiflora extract as rumen modifiers using in vitro gas production technique. Curr. Res. J. Biol. Sci. 4:350-354, 2012.
35. Sallam, S. M. A.; Nasser, M. E. A.; El-Waziry, A. M.; Bueno, I. S. C. & Abdalla, A. L. Use of an in vitro rumen gas production technique to evaluate some ruminant feedstuffs. J. Appl. Sci. Res. 3:34-41, 2007.
36. Sánchez, Tania; Ørskov, E. R.; Lamela, L.; Pedraza, R. & López, O. Valor nutritivo de los componentes forrajeros de una asociación de gramíneas mejoradas y Leucaena leucocephala. Pastos y Forrajes. 31 (3):271-281, 2008.
37. SAS. SAS User's guide: Statistics. Ver 9.0. Cary, NC, USA: SAS Institute, 2002.
38. Sommart, K.; Parker, D. S.; Rowlinson, P. & Wanapat, M. Fermentation characteristics and microbial protein synthesis in an in vitro system using cassava, rice straw and dried ruzi grass as substrates. Asian-Aust. J. Anim. Sci. 13:1084-1093, 2000.
39. Steel, R. G. D. & Torrie, J. H. 1980. Principles and procedures of statistics. A biometrical approach. 2nd ed. New York: McGraw-Hill International, 1980.
40. Tedeschi, L. O.; Kononoff, P. J.; Karges, K. & Gibson, M. L. Effects of chemical composition variation on the dynamics of ruminal fermentation and biological value of corn milling (co)products. J. Dairy Sci. 92:401-413, 2009.
41. Theodorou, M. K.; Williams, B. A.; Dhanoa, M. S.; McAllan, A. B. & France, J. A simple gas production method using a pressure transducer to determine the fermentation kinetics of ruminant feeds. Anim. Feed Sci. Tech. 48:185-197, 1994.
42. Van Ackeren, Caroline; Steingass, H.; Hartung, K.; Funk, R. & Drochner, W. Effect of roughage level in a total mixed ration on feed intake, ruminal fermentation patterns and chewing activity of early-weaned calves with ad libitum access to grass hay. Anim. Feed Sci. Tech. 153:48-59, 2009.
43. Van Soest, P. J.; Robertson, J. B. & Lewis, B. A. Methods for dietary fiber, neutral detergent fiber and nonstarch polysaccharides in relation to animal nutrition. J. Dairy Sci. 74:3583-3597, 1991.
44. Zicarelli, F.; Calabró, S.; Piccolo, V.; D'Urso, S.; Tudisco, R.; Bovera, F. et al. Diets with different forage/concentrate ratios for the mediterranean Italian buffalo: in vivo and in vitro digestibility. Asian-Aust. J. Anim. Sci. 21:75-82, 2008.
Recibido el 10 de diciembre del 2013
Aceptado el 20 de julio de 2014