Introducción
En la actualidad, la producción de biodiésel desempeña un papel importante en la economía mundial. En este contexto existen diferentes plantas, tales como Jatropha curcas L., Moringa oleifera Lam., Ricinus communis L. y Reutealis trisperma (= Aleurites trisperma) Airy Shaw, entre otras, que constituyen una alternativa viable para la producción de biocombustible, pues son cultivos que no se utilizan en el consumo animal ni humano.
Uno de estos cultivos, el piñón manso (J. curcas), se diferencia del resto por ser una planta nativa de Mesoamérica (Ureña-Padilla et al., 2012), que presenta un contenido elevado de aceite en sus semillas. Además, esta no compite por las áreas de producción de alimentos y presenta resistencia a la sequía y a la salinidad (Campuzano-Duque et al., 2016).
Por otra parte, la productividad de las especies vegetales se encuentra limitada por los factores bióticos y abióticos que provocan estrés en las plantas. Para contrarrestar la influencia de estas alteraciones en la productividad, se debe garantizar un uso eficiente del agua y de la capacidad fotosintética de las plantas en condiciones adversas.
En este sentido, la enzima nitrato reductasa (NR EC 1.6.6.1) es una molibdoenzima que cataliza la reducción del nitrato (NO3 -) a nitrito (-NO2 -); su función en las plantas superiores aún no está muy clara, aunque Raigón et al. (2006) señalaron que la existencia de nitrógeno en forma abundante colabora en la formación de clorofila, que aumenta la actividad fotosintética y, por tanto, el desarrollo vegetal. Una gran cantidad de nitrógeno hace que las células de las plantas lleguen más tarde a la senectud y se mantengan turgentes. Por otra parte, retrasa la lignificación y el endurecimiento de los tejidos. En general, el nitrógeno acelera y mantiene un gran desarrollo en la planta cultivada.
Por ello, el objetivo de este estudio fue determinar la influencia de diferentes porcentajes de sombra sobre la actividad de la enzima nitrato reductasa en las hojas y raíces de plántulas de J. curcas.
Materiales y Métodos
La investigación se realizó en el invernadero del sector de Fisiología Vegetal, del departamento de Biología de la Universidade Federal de Lavras -UFLA- (Lavras, Minas Gerais, Brasil), la cual se localiza a 918 m de altitud, 21º 14ʹ S de latitud y 45º 00ʹ W de longitud.
Se sembraron tres semillas de piñón manso (J. curcas procedencia Cabo Verde) en bolsas de polietileno, con capacidad para tres litros de sustrato y con arena lavada, sin previo tratamiento pregerminativo. Estas semillas provenían de frutos secos y se mantuvieron en estufa con circulación forzada de aire, a una temperatura de 38 ºC durante 24 h.
El experimento se regó diariamente por aspersión automática durante tres minutos, desde las 8 a.m. hasta las 5 p.m., para evitar el estrés hídrico. A los 15 días después de germinadas las semillas, se realizó una labor de raleo para uniformar la altura y el número de hojas, y se dejó una sola planta por bolsa.
Se aplicaron 40 mL por planta a través de dos soluciones nutritivas de Hoagland y Arnon (1938): una contenía NO3 - (solución 1) y otra no (solución 2), con una frecuencia de dos veces por semana, a partir de los 21 días después de la siembra.
Solución 1: Ca(NO3) 24H2O (50mM); KNO3 (50mM); MgSO4 7H2O (20mM); KH2PO4 (10mM); H3BO3 (0,46mM); MnCl2 4H2O (0,091mM), ZnSO47H2O (7,65μM); CuSO4 5 H2O (3,2μM); H2MoO4 (0,56μM).
Solución 2: MgSO4 7H2O (2mM); KH2PO4 (1mM); CaSO4 2H2O (2mM); K2SO4 (2mM); H3BO3 (0,46mM); MnCl2 4H2O (0,091mM), ZnSO4 7H2O (7,65μM); CuSO4 5 H2O (3,2 μM); H2MoO4 (0,56μM).
Las dos soluciones se prepararon con micronutrientes y macronutrientes, excepto el hierro, que cual fue añadido en el momento de la aplicación, suministrado por la solución Fe-EDTA (33,2 g L-1 Na2-EDTA; 26 g L-1 Fe SO4 7 H2O; y 3,65 g L-1 NaOH).
Diseño experimental y tratamientos. Se utilizó un diseño completamente aleatorizado. Los tratamientos consistieron en tres porcentajes de sombra (30, 50 y 70 %), proporcionados por medio de una tela de polietileno, y uno a pleno sol, para un total de 12 tratamientos con tres repeticiones.
Descripción de las variables evaluadas. Las determinaciones que se describen a continuación se realizaron en el laboratorio de nutrición de fisiología vegetal de la UFLA, con una frecuencia de 30, 60, 90 y 120 días después del inicio de los tratamientos; para ello se usaron cuatro plantas por cada uno, y se tuvieron en cuenta las hojas y las raíces. En el caso de las hojas, se muestrearon la primera y la segunda (hojas verdaderas) de la base hacia el ápice.
Cuantificación de las proteínas solubles. Las proteínas solubles se extrajeron de acuerdo con el método descrito por Bieleski y Turner (1966). Para 0,1 g de material fresco, se añadió 1 mL de solución MCW (60 mL de metanol, 25 mL de cloroformo y 15 mL de H2O destilada). El material (hojas y raíces) se maceró a temperatura ambiente y se centrifugó durante 15 minutos a 3 000 rpm (en centrífuga refrigerada). Después de la centrifugación y separación del sobrenadante, se añadió 1 mL más de cloroformo y 1,5 mL de H2O destilada por cada 4 mL de extracto, el cual permaneció en reposo durante 24 h en la nevera. Con posterioridad, el precipitado fue resuspendido en solución NaOH 0,1 g mol-1, para una relación de 10 mL de solución por cada gramo de tejido fresco, y se centrifugó nuevamente durante 15 minutos a 3 000 rpm; el sobrenadante se utilizó para la cuantificación de las proteínas.
Determinación del contenido de proteína total soluble. El contenido de proteína total soluble (PTS) se determinó a través de la metodología propuesta por Bradford (1976) y con el extracto descrito con anterioridad. Se usó 100 μL de extracto de las raíces y 50 μL del foliar, diluido en 50 μL de NaOH 0,1 g mol-1 y 5 mL de reactivo; este fue preparado con 200 mg de Comassie Brilliant Blue + 50 mL de etanol 95 %, el cual se agitó durante dos horas, seguido de la adición de 100 mL de ácido ortofosfórico (H3PO4) al 85 %, y se conservó durante dos horas más en agitación. Pasado este tiempo, la solución se mantuvo en reposo por 24 h y se completó hasta 1 000 mL con H2O desionizada; después se filtró y se almacenó en un recipiente oscuro a 4 ºC.
La reacción colorimétrica se leyó en el espectrofotómetro UV-visible marca Genesys 20® Thermo Scientific® a 595 nm. Los valores se expresaron en miligramos de proteína por gramo de materia fresca (MF). El patrón que se usó para la proteína fue de 10 a 100 mg de albúmina de suero bovino (BSA).
Determinación de la actividad de nitrato reductasa. Para la determinación de la actividad de la enzima nitrato reductasa (NR), se empleó un ensayo in vivo, descrito por Radin (1973), tanto en las hojas como en las raíces, con algunas modificaciones (en cuanto a concentraciones, por la presencia de metabolitos secundarios) para la especie en estudio. Las muestras se colectaron a las 7 a.m. en días calientes y soleados, y se almacenaron en cajas de polietileno con hielo; después se transportaron hasta el laboratorio y se lavaron con H2O desionizada.
Se pesaron 0,5 g de hojas frescas y 1 g de raíces de cuatro plantas al azar, cortadas en pedazos de aproximadamente 5 x 5 mm, y se inocularon en tubos de ensayo que contenían 5 mL de tampón fosfato 0,1M + KNO3 0,1M, pH 7,5. Los tubos de ensayo se revistieron con papel de aluminio, con el fin de evitar daños oxidativos provocados por la luz. Las muestras fueron infiltradas al vacío tres veces durante dos minutos, para facilitar y aumentar la penetración de la solución en los tejidos, seguido de la introducción de aire. Posteriormente el ensayo se incubó en baño de María a 30 ºC durante una hora.
Para el caso de las hojas se retiró una alícuota de 100 μL. El medio de reacción se preparó con 2,9 mL de agua destilada + 1 mL de la mezcla (v:v) de dicloruro de N-naftiletileno 0,02 %, la cual detiene la reacción; y sulfanilamida al 1 % preparada en HCl 1,5 N, que reacciona y da coloración. Para las raíces se retiró una alícuota de 500 μL y el medio de reacción se preparó con 0,5 mL de agua destilada + 1 mL de mezcla de N-naftiletileno y sulfanilamida.
Pasados 15 minutos (reacción colorimétrica), se realizó la lectura en el espectrofotómetro UV-visible marca Genesys 20® Thermo Scientific® a 540 nm, y los valores de la actividad de NR se expresaron en μmol NO2 - g MF-1 h-1, determinada por la cantidad producida de nitrito; se usó una curva patrón de solución de nitrito de sodio (de 0 a 200 μmoles).
Análisis estadístico. Los datos se sometieron a análisis de varianza, según modelo lineal de clasificación simple, considerando los niveles de sombra; las medias se compararon mediante la dócima de Duncan para un 5 % de significación, después de verificarse que cumplían con el ajuste de distribución normal y de homogeneidad de varianza. También se realizó un análisis de regresión; para seleccionar la ecuación de mejor ajuste se tomaron en consideración los criterios de Guerra et al. (2003) relacionados con el nivel de significación, el coeficiente de determinación R2 mayor que 0,70, la varianza residual V(e), el análisis de residuos (e1) y el error estándar de los parámetros estimados ES (βi). Todo ello, con el empleo del programa estadístico SPSS® versión 22.0 para Microsoft Windows®.
Resultados y Discusión
En la tabla 1 se muestra la actividad de la enzima nitrato reductasa en las hojas y las raíces, en relación con los porcentajes de sombra en los cuatro momentos evaluados.
Tabla 1 Actividad de la enzima nitrato reductasa en relación con los niveles de sombra (μmoles NO2- g MF-1 h-1).
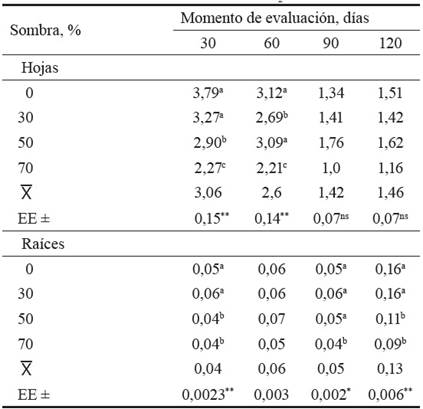
Letras diferentes en una misma columna difieren para p > 0,05
** p > 0,01; *p > 0,05
La actividad de la NR fue mayor en las hojas que en las raíces. Según refieren Hernández-Cruz et al. (2015), el nitrato absorbido por las plantas, en su gran mayoría, puede ser asimilado por las raíces o por las hojas. Estos mismos autores señalan que en muchas plantas, cuando se reciben pequeñas cantidades de nitrato, se reduce su absorción en las raíces; por ello, a medida que el aporte de nitrato aumenta se incrementa su absorción por este órgano y, por ende, una mayor proporción es transportada al tallo y de ahí hacia las hojas, en las cuales la actividad de la mencionada enzima es más alta, sobre todo cuando estas están totalmente extendidas y fisiológicamente maduras. El aprovechamiento del nitrato por la planta varía en función de la especie, la diferenciación morfológica, la edad o crecimiento de la raíz y las condiciones ambientales, tal y como indica la actividad de la NR en cada uno de los órganos.
Asimismo, Taiz y Zeiger (2013) aseguran que en algunas plantas, como el cadillo (Xanthium strumarium L.), el nitrato se absorbe en las hojas; mientras que en otras, como el lupino blanco (Lupinus albus L.), la mayoría del nitrato se asimila en las raíces. En general, las especies nativas de regiones templadas realizan un mayor aprovechamiento del nitrato por las raíces que las originarias de climas tropicales y subtropicales.
En ese sentido, las especies herbáceas, entre las que se incluyen los cultivos de interés económico, reducen las concentraciones de nitrato tanto en las raíces como en las hojas; al respecto, Rodríguez-Larramendi et al. (2016) plantearon que su asimilación depende de dos factores: la actividad de la NR y la disponibilidad de nitrato (NO3 -) en el medio.
Una mayor actividad de la NR en las hojas se debe a la asimilación del nitrato, que ocurre en mayor cuantía en este tejido, que aportan la energía (ATP) y los agentes reductores (proveedores de electrones) necesarios para dicho proceso. Además, en las hojas es donde hay mayor actividad fotosintética. En este sentido, la cantidad de clorofila se relaciona con una mayor acción de la NR (Taiz y Zeiger, 2013).
Similar comportamiento al de este estudio fue reportado por Hernández-Cruz et al. (2015) en algodón (Gossypium hirsutum L.); sin embargo, en otras especies como el girasol (Helianthus annuus L.), el rábano (Raphanus raphanistrum subsp. sativus) y la seringueira o árbol del caucho (Hevea spp.), esta última de la misma familia que J. curcas (Euphorbiaceae), las raíces presentaron una actividad NR mayor que en las hojas (Hiraki, 2011).
En las hojas, las medias de la actividad de la NR disminuyeron de forma gradual en cada período evaluado. Este comportamiento fue descrito en G. hirsutum (Hernández-Cruz et al., 2015) y en otras investigaciones realizadas por Min et al. (2014) y Palacios (2017); lo que puede ser atribuido a la fertilización que se realizó al inicio del periodo y al riego durante la etapa experimental.
Por ello, la reducción en los promedios generales de la actividad de la NR en las hojas de J. curcas podría explicarse por la senescencia natural de los tejidos, ya que las hojas muestreadas estaban siempre en la misma posición de las plantas (primera y segunda hojas verdaderas de la base hacia el ápice).
En este sentido, Duursma et al. (2014) refirieron que en las hojas de Pueraria phaseoloides (Roxb.) Benth. ocurrió una reducción de la actividad de la enzima mencionada en el sentido ápice-base; resultados similares se verificaron también en soya (Glycine max L.). Según estos autores, la mayor actividad de la enzima en las hojas jóvenes se debe a la mayor concentración de nitrato y de fotoasimilados y a la mayor capacidad de síntesis de proteína en esas hojas; también se debió al autosombreado de las hojas de la capa basal, provocado por el aumento en el número medio de hojas.
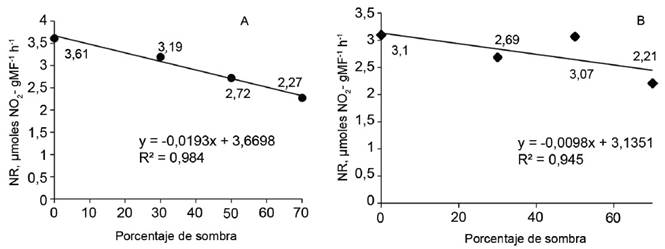
Se observaron diferencias en la actividad de la NR en las hojas en relación con los porcentajes de sombra (tabla 1). En los períodos de 30 y 60 días (fig. 1), el modelo que explicó con mayor bondad de ajuste esta relación (R2 = 0,984 y R2 = 0,945, respectivamente) fue el lineal, donde se observó un decrecimiento de la actividad enzimática a medida que aumento del porcentaje de sombra.
En el caso de las raíces se halló diferencia en la actividad a los 30, 60 y 90 días, pero no a los 120 días (tabla 1). El modelo que explicó con mayor bondad de ajuste esta relación (R2 = 0,953, R2 = 0,939 y R2 = 0,911, respectivamente) fue el cuadrático (fig. 2), donde se observó un ligero aumento de actividad con el 30 % de sombra y una reducción después de ese valor. A los 120 días la actividad de la NR disminuyó de forma lineal con el aumento del porcentaje de sombra (fig. 2C), como sucedió en las hojas.

Figura 2 Actividad de la enzima nitrato reductasa (NR) en las raíces a los 30 (A), 90 (B) y 120 (C) días.
La influencia de la luz sobre la actividad de la NR fue observada en plántulas de cacao (Theobroma cacao L.) por Acheampong et al. (2013), y en palmas aceiteras por Rivera et al. (2013). Estos autores refirieron que los diferentes regímenes de irradiación (20, 50 y 100 % de la luz solar) influyeron en la partición de la enzima entre las hojas y las raíces; y que con altos niveles de irradiación y nitrato, la reducción de este último ocurre más en las hojas que en las raíces y viceversa.
Según referencias de Taiz y Zeiger (2013), en condiciones óptimas de crecimiento la capacidad de reducción del nitrato es, aproximadamente, el doble de la necesidad de la planta. La actividad de la NR varía durante el día y presenta baja actividad en la oscuridad para la mayoría de las especies. En condiciones normales de activación y en presencia de luz, su acción sería del orden del 70 al 90 %, con una reducción del 10 a 30 % en la oscuridad. Sin embargo, la luz no es una señal directa para la activación de esa enzima, pues incluso bajo intensa y continua luminosidad esta es inactiva cuando falta gas carbónico; ello indica que se requiere la fotosíntesis para su activación y que, probablemente, los fotoasimilados exportados fuera del cloroplasto son los indicadores para ello (Arboleda y Piña, 2010).
Es válido mencionar que la cantidad de carbohidratos presentes, la luminosidad disponible y otros factores ambientales, como la disponibilidad de agua, activan la fosfatasa, enzima responsable de la desfosforilación de varios residuos de serina en la proteína NR, lo cual favorece su actividad; mientras que la ausencia de luz y de magnesio estimulan la fosforilación de los residuos de serina que interactúan con una proteína inhibidora que actúa en la inactivación de la nitrato reductasa (Farfán-Valencia y Mestre-Mestre, 2004).
Se observó diferencia en los contenidos de proteína total soluble, tanto para las hojas como para las raíces de J. curcas, en relación con los tratamientos. De la misma forma que fue informado para las hojas en Hevea brasiliensis por Lemos et al. (1999), los promedios de proteína total soluble fueron siempre superiores a las medias de las raíces.
En cada uno de los periodos analizados, el aumento en el porcentaje de sombra ocasionó disminuciones lineales en los contenidos de proteína soluble foliar (fig. 3), comportamiento acompañado por la actividad de la enzima NR en los mismos tejidos; ello sugiere que existe una estrecha relación entre la actividad de esta enzima y la producción de proteína en los tejidos. En el caso de las raíces, el modelo que explicó con mayor bondad de ajuste a los 30 y 120 días fue el lineal, y a los 60 días, el cuadrático (fig. 4).
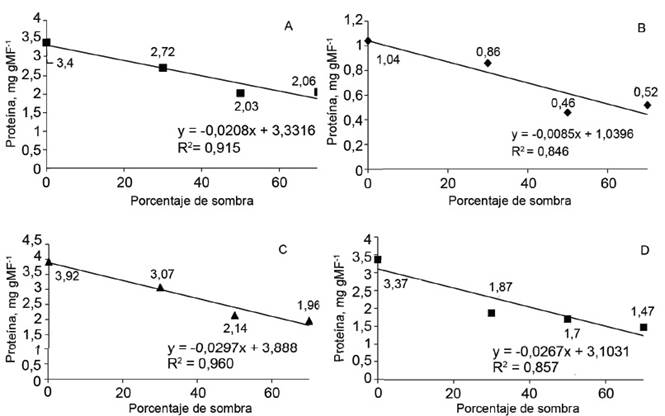
Figura 3 Contenido de proteína total soluble en las hojas de plántulas de J. curcas a los 30 (A), 60 (B), 90 (C) y 120 (D) días.
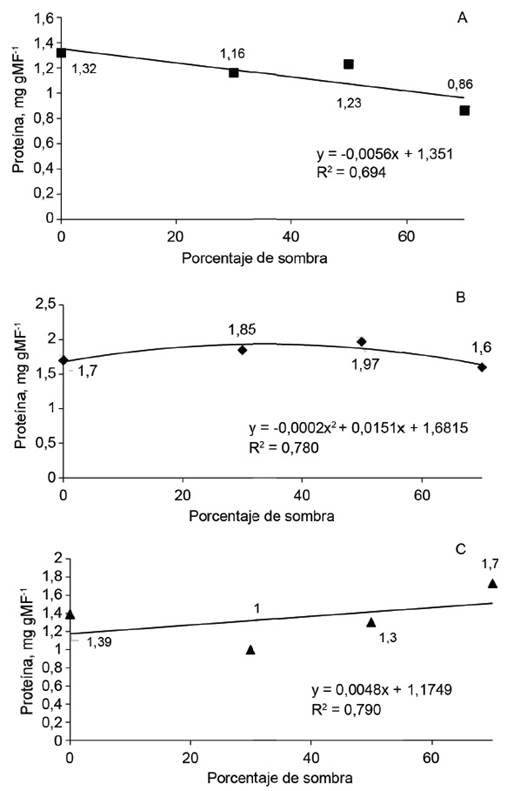
Figura 4 Contenido de proteína total soluble en las raíces de plántulas de J. curcas, a los 30 (A), 60 (B) y 120 (C) días.
De acuerdo con las investigaciones realizadas por Duursma et al. (2014) y Felicito-Alberca (2016), la capacidad fotosintética de las plantas depende del suministro de nitratos. Una considerable fracción de ese elemento se encuentra en las hojas, en las proteínas involucradas en el proceso fotosintético. Asimismo, se pudo demostrar que el contenido de proteína total soluble disminuyó con el aumento del porcentaje de sombra.
Los resultados demostraron que la actividad de la enzima NR y el contenido de proteína soluble disminuyeron de forma lineal con el aumento de los niveles de sombra, lo cual indica la importancia de los altos índices de radiación luminosa para la asimilación de los nitratos en J. curcas.