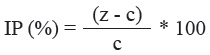Introducción
En la agricultura moderna se utilizan cantidades elevadas de agroquímicos para maximizar las producciones agrícolas. Aunque el efecto de estas sustancias es inmediato, constituyen un riesgo para la salud humana y animal debido a la entrada de metales pesados a la cadena trófica, que provocan la muerte de la biota y la degradación del suelo, debido a alteraciones y daños a la estructura del mismo (Zahid et al., 2015). La aplicación de fertilizantes químicos durante períodos largos de tiempo, con frecuencia reducen el pH del suelo y las bases intercambiadoras, lo cual convierte a los suelos en improductivos para numerosos cultivos y en consecuencia disminuyen los rendimientos agrícolas (Gupta et al., 2015).
Entre las estrategias para resolver estos problemas está el desarrollo de nuevos productos a base de microorganismos provenientes de la rizosfera, que tienen efectos beneficiosos directos e indirectos sobre las plantas (Thakur et al., 2017). Los mecanismos que presentan estos microorganismos promotores del crecimiento vegetal se relacionan con la producción de sustancias reguladoras del crecimiento como auxinas, giberelinas y citoquininas (Jha y Saraf, 2015), la solubilización de fosfatos (Thanh y Tram, 2018), la producción de sideróforos (Rayavarapu y Padmavathi, 2016), así como la secreción de antibióticos y enzimas líticas que tienen un efecto antagónico y biocontrolador de patógenos (Yamamoto et al., 2015).
Uno de los géneros bacterianos más estudiados con este propósito es Bacillus, debido a su fácil crecimiento en medios de cultivos, la capacidad de producir endosporas resistentes a diversas condiciones desfavorables, lo cual facilita la obtención de bioproductos con formulaciones estables. Además, las propiedades de este género como bacterias promotoras del crecimiento vegetal en condiciones normales y de estrés ambiental, se informan en numerosos trabajos (Hauka et al., 2016; Robledo-Buriticá et al., 2018; Singh, 2018), en especial como agentes biocontroladores de fitopatógenos que afectan los cultivos agrícolas (Méndez-Bravo et al., 2018; Sabaté et al., 2018). Por otra parte, un grupo amplio de investigaciones avalan la capacidad de estos microorganismos para producir diferentes tipos de enzimas hidrolíticas como mananasas, celulasas y amilasas, las que se utilizan en el desarrollo de distintas industrias como la alimentaria, la farmacéutica, la textil, así como en la producción de papel, bioetanol y detergentes, entre otras (Singh et al., 2015).
En Cuba, existen varios productos a base de microorganismos beneficiosos que promueven el crecimiento vegetal. Entre estos, IHPLUS® desarrollado por la Estación Experimental de Pastos y Forrajes Indio Hatuey, constituye un complejo microbiano con amplias perspectivas de uso tanto en la rama agrícola como en la alimentación y la salud animal. Estudios recientes demostraron su efecto beneficioso en la germinación y el crecimiento temprano de Sorghum bicolor L. (Moench) (Díaz-Solares et al., 2019). El objetivo de la presente investigación fue determinar las potencialidades de aislados de Bacillus spp. obtenidos a partir del producto IHPLUS®, como promotores del crecimiento vegetal y con fines industriales.
Materiales y Métodos
Los experimentos se realizaron con el lote 31 de inóculo líquido del IHPLUS® caracterizado según el procedimiento normalizado de operación (PNO-LB-M-008/2014) de la Estación Experimental de Pastos y Forrajes Indio Hatuey del municipio Perico, provincia de Matanzas, Cuba.
Procedimiento para el aislamiento de Bacillus spp.
El aislamiento se realizó en el Laboratorio de Microbiología, del Centro de Estudios Biotecnológicos de la Universidad de Matanzas. Con el objetivo primario de incrementar las poblaciones bacterianas se inocularon 10 mL del producto IHPLUS® en 90 mL de medio caldo nutriente, contenidos en erlenmeyers de 250 mL. Las muestras se incubaron en agitación (130 r.p.m.) a 37 °C durante 72 h (Johnson y Bishop, 1996). Posteriormente, los medios de cultivo se colocaron en baño María a 80 ºC durante 12 minutos para eliminar todas las formas vegetativas y comenzar el proceso de aislamiento a partir de endosporas resistentes a estas condiciones (Lobo et al., 2018).
Se realizaron diluciones seriadas (10-1 y 10-5) a las suspensiones microbianas en solución salina (NaCl 0,9 %). Se tomaron alícuotas de 100 μL de las diluciones entre 10-1 y 10-5 y se transfirieron a placas Petri con medio agar nutriente. Cada dilución de las diferentes muestras se sembró por triplicado. Las placas se colocaron en una incubadora (Boxun®) a 37 ºC durante 48 h. Se tomaron muestras de colonias con morfologías diferentes y se sembraron en tubos de cultivo con medio agar nutriente en forma de cuña. Los aislados se identificaron numéricamente y se colocaron en las mismas condiciones de crecimiento durante 24 h. Se realizó la tinción de Gram a todas las colonias aisladas y se identificaron los aislados con morfología bacilar y Gram positivos (Ashish et al., 2008). A las colonias que mostraron estas características se le realizó una tinción verde malaquita a las 72 h de sembradas para la observación de endosporas. Los aislados que cumplieron estos requisitos se purificaron en placas Petri con medio agar nutriente, mediante la técnica de siembra por estrías o agotamiento.
Se inocularon 10 mL del producto IHPLUS® en 90 mL de medio caldo nutriente, contenidos en erlenmeyers de 250 mL. Las muestras se incubaron en agitación (130 r.p.m.) a 37 ºC durante 72 h. Posteriormente, los medios de cultivo se colocaron en baño María a 80 ºC durante 12 minutos para eliminar todas las formas vegetativas y comenzar el proceso de aislamiento a partir de endosporas resistentes a estas condiciones.
Se realizaron diluciones seriadas (10-1 y 10-5) a las suspensiones microbianas en solución salina (NaCl 0,9 %). Se tomaron alícuotas de 100 μL de las diluciones entre 10-1 y 10-5 y se transfirieron a placas Petri con medio agar nutriente. Cada dilución de las diferentes muestras se sembró por triplicado. Las placas se colocaron en una incubadora marca Boxun a 37 ºC durante 48 h. Se tomaron muestras de colonias con morfologías diferentes y se sembraron en tubos de cultivo con medio agar nutriente en forma de cuña. Los aislados se identificaron numéricamente y se colocaron en las mismas condiciones de crecimiento durante 24 h. Se realizó la tinción de Gram a todas las colonias aisladas y se identificaron los aislados con morfología bacilar y Gram positivos. A las colonias que mostraron estas características se le realizó una tinción verde malaquita a las 72 h de sembradas para la observación de endosporas. Los aislados que cumplieron estos requisitos se purificaron en placas Petri con medio agar nutriente, mediante la técnica de siembra por estrías o agotamiento.
Determinaciones bioquímicas
Producción de ácido 3-indolacético (AIA). La producción de ácido indolacético se determinó con el método de Brick et al. (1991). Los aislados bacterianos (100 µL 10-8 UFC) se inocularon en Erlenmenyer de 25 mL de volumen con 10 mL de Caldo Nutriente suplementado con L-triptófano (1 mg mL-1). Los medios de cultivo se colocaron en condiciones de agitación (130 r.p.m.), oscuridad y 37 ºC durante 48 h. Posteriormente, las suspensiones celulares se centrifugaron a 6 000 rpm durante 10 minutos. El sobrenadante se colectó para la determinación cuantitativa de ácido 3-indolacético. Se utilizó como control negativo el medio de cultivo sin inóculo. Primeramente, se realizó una curva de calibración a partir de una solución de 100 µg mL-1 de AIA con concentraciones de 5, 10, 20, 40, 60 y 80 µg mL-1. Se mezclaron 0,5 mL de cada una de las soluciones patrón y de los sobrenadantes bacterianos, con 0,5 mL del reactivo de Salkowski (50 mL de ácido perclórico al 35 %, 1 mL de una solución de FeCl3 al 0,5 mol L-1). Las mezclas se dejaron reposar por 30 minutos a temperatura ambiente y se realizaron las lecturas de la absorbancia a 530 nm en un espectrofotómetro UV/VIS (ULTROSPEC, 2000). Con los valores de la curva patrón se obtuvo la ecuación que relaciona la concentración de AIA en función de la absorbancia. Las mediciones se realizaron por triplicado (Sánchez-García, 2013).
Solubilización de fosfatos. La capacidad de solubilizar fosfatos inorgánicos por los aislados bacterianos se determinó en medio Pikovskaya (Pikovskaya y Pikovskaya, 1948) compuesto por: glucosa (10,0 g L-1), Ca3 (PO4)2 (5,0 g L-1), (NH4)2SO4 (0,5 g L-1), KCl (0,2 g L-1), MgSO4.7H2O (0,1 g L-1), MnSO4 (0,002 g L-1), FeSO4 (0,002 g L-1), extracto de levadura (0,5 g L-1) y agar (15,0 g L-1). Los aislados se sembraron en placas Petri con el medio de cultivo y se incubaron a 37 ºC durante siete días. La eficiencia de los aislados para solubilizar fosfatos se determinó mediante el cálculo del índice de potencia (IP) (Nguyen et al., 1992), el cual se utilizó también para caracterizar la producción de varias enzimas hidrolíticas que se describen a continuación.
Donde:
z-diámetro del halo de hidrólisis
c-diámetro de la colonia bacteriana
Actividad lipídica. La actividad lipídica se determinó con la siembra de los aislados en un medio de cultivo compuesto por peptona (10 g L-1), cloruro de calcio (0,1 g L-1), cloruro de sodio (5 g L-1), agar (15 g L-1) y 10 mL de Tween 80 (Omidvari, 2008). La peptona y las sales se disolvieron en 990 mL de agua destilada. Posteriormente se esterilizaron por separado el Tween 80 y el medio de cultivo a 121 ºC durante 20 minutos. Previo a verter el medio de cultivo en las placas Petri se mezclaron y homogenizaron el Tween 80 y el resto de los componentes del medio. Las placas con los aislados sembrados se incubaron a 37 ºC durante 48 horas. Las deposiciones alrededor de las colonias bacterianas indicaron la actividad de la enzima lipasa.
Actividad quitinolítica y/o β-1,3-glucanolítica. La producción de β-1,3-glucanasa y/o quitinasa por los aislados bacterianos se determinó mediante el crecimiento de los mismos en un medio de cultivo con levadura panadera (Saccharomyces cerevisiae) (Swift, 2016). Se disolvieron 4,0 g L-1 de levadura y 16 g L-1 de agar en agua destilada y el medio se esterilizó a 121 °C durante 20 minutos. Los aislados se sembraron en placas Petri con el medio de cultivo, las cuales se incubaron a 37 ºC durante 48 horas.
Actividad proteolítica. Se determinó según el método de Chaiharn et al. (2008), con modificaciones. Los aislados se sembraron en placas Petri con medio de cultivo compuesto por de leche descremada (15 g L-1) como inductor, extracto de levadura (0,5 g L-1) y agar (15 g L-1). Las placas se incubaron a 37 ºC durante 24 h. Los diámetros de los halos claros alrededor de las colonias se midieron con una regla milimetrada para determinar el índice de potencia (%) mediante la fórmula indicada anteriormente.
Actividad amilolítica. Se determinó según el método de Bhojia (2011). Los aislados bacterianos se sembraron en un medio compuesto por: NaCl (0,1 %), KH2PO4 (0,3 %), K2HPO4 (0,6 %), MgSO4 (0,12 %), peptona (0,5 %), extracto de levadura (0,3 %), almidón soluble (1,0 %) y agar (15 g L-1). Las placas se incubaron a 37 ºC durante 48 horas. La actividad amilolítica se observó mediante la tinción del medio de cultivo con la solución yodada de Gram (yodo 2 % y yoduro de potasio 0,2 %). La presencia de un halo de hidrólisis alrededor de la colonia indicó la producción de enzimas amilasas. La capacidad de producir estas enzimas se evaluó cualitativamente como: negativo (-), positivo (+).
Actividad celulolítica. Los aislados bacterianos se sembraron en medio de cultivo compuesto por: NaCl (0,1 %), KH2PO4 (0,3 %), K2HPO4 (0,6 %), MgSO4 (0,12 %), peptona (0,5 %), extracto de levadura (0,3 %), carboximetil celulosa (1,0 %) y agar (15 g L-1). Las placas se incubaron a 37 ºC durante 48 horas y la actividad celulolítica se determinó mediante el revelado con una solución de rojo Congo al 0,5 % (Apun et al., 2000). La presencia de un halo de hidrólisis alrededor de la colonia indicó la producción de enzimas celulolíticas. Se determinó el índice de potencia (%).
Actividad mananolítica. Se determinó mediante la siembra de los aislados bacterianos en el medio de cultivo compuesto por: NaCl (0,1 %), KH2PO4 (0,3 %), K2HPO4 (0,6 %), MgSO4 (0,12 %), peptona (0,5 %), extracto de levadura (0,3 %), suplementado con goma de algarrobo (LBG, por las siglas en inglés de Locust Beans Gum) (0,5 %) y agar (15 g L-1). Las placas se incubaron a 37 ºC durante 48 h y la actividad mananolítica se observó mediante la aplicación de rojo Congo al medio de cultivo (0,5 %). La presencia de un halo de hidrólisis alrededor de la colonia indicó producción de mananasas (Carder, 1986). Se determinó el índice de potencia (%).
Producción de cianuro de hidrógeno (HCN). Se utilizó el método de Lorck (1948) para determinar la capacidad de producción de cianuro de hidrógeno de los aislados bacterianos. El medio agar nutriente se suplementó con 4,4 g L-1 de glicina y se colocó en la autoclave a 121 ºC durante 20 min. Los aislados se sembraron por estrías en placas Petri con la ayuda de un asa de siembra. Posteriormente se humedeció una capa de papel de filtro (Whatman No. 1), en una solución compuesta por carbonato de sodio (Na2CO3) al 2% y ácido pícrico 0,5 %. El papel humedecido se colocó en la tapa superior de la placa Petri y posteriormente se selló con parafina. Las placas Petri se incubaron a 37 ºC durante cuatro días. El cambio de coloración de amarillo a naranja-rojizo indicó la producción de cianuro de hidrógeno. Se utilizó como control una placa Petri con medio de cultivo sin inocular.
Procesamiento estadístico. Se determinó el ajuste de los datos a una distribución normal mediante la prueba de Kolmogorov-Smirnov y la Homogeneidad de varianza mediante la prueba de Bartlett. Los datos se procesaron mediante la prueba no paramétrica de Kruskal-Wallis y las diferencias entre los rangos promedios de las variables, en cada uno de los tratamientos establecidos, se determinó mediante la prueba U de Mann Whitney (Sigarroa, 1985). Todas las determinaciones bioquímicas se realizaron por triplicado. Los datos se procesaron con el programa SPSS® versión 18.
Resultados y Discusión
Aislamiento de las colonias bacterianas. Los resultados del proceso de aislamiento de colonias de bacilos se muestran en la tabla 1. Se obtuvo un total de 20 aislados entre bacilos esporulados (BE), bacilos no esporulados (BNE), cocos (C) con diferentes agrupaciones (diplococos, tetracocos, sarcinas, entre otras), así como otras formas, como actinomicetos. Se observaron cuatro aislados bacilares con capacidad de esporular (IH4, IH5, IH7 e IH9), lo que representó un 20,0 % con respecto al total de formas aisladas. El hecho de que se obtuvieron pocos aislados en número y diversidad, puede relacionarse con el pH ácido del producto IHPLUS® (3,87), que afecta el crecimiento de Bacillus spp. Los aislados con capacidad de formar endosporas se seleccionaron para los ensayos bioquímicos.
Tabla 1 Resultados del aislamiento de Bacillus spp a partir del producto IHPLUS®.

BNE: bacilos no esporulados, BE: bacilos esporulados
Producción de ácido indolacético (AIA). El ácido indolacético constituye una auxina natural producida por las plantas y una amplia gama de microrganismos del suelo. En la figura 1 se muestra la producción de AIA por los aislados bacterianos. IH7 mostró los valores más elevados con una concentración de 23,58 μg mL-1, mientras que IH4, IH5 e IH9 produjeron contenidos menores y sin diferencias significativas entre ellos.
Estos resultados concuerdan con lo referido por otros autores quienes observaron la producción de esta auxina por aislados de Bacillus spp., obtenidos de la rizosfera de diferentes especies vegetales como Aloe vera L. (Thakur et al., 2017), Arachis hipogea L. (Thakur y Parikh, 2018) y Piper nigrum L. (Thanh y Tram, 2018). El aislado IH7, en particular, puede constituir un candidato potencial como bioestimulador del crecimiento vegetal, ya que en diversos estudios con cepas de Bacillus spp. productoras de AIA, se observó un aumento del desarrollo radical en especies como Zea mays L. (Mike-Anosike et al., 2018), así como de la germinación y el crecimiento de plántulas de trigo (Triticum aestivum L.) y fabas [Vicia faba L.] (Yousef, 2018). Sin embargo, es necesario comprobar el efecto de este aislado sobre el proceso de la germinación y crecimiento de cultivos de importancia agrícola; ya que la respuesta de las plantas depende de la concentración de este regulador en el medio y del genotipo vegetal, entre otros factores (Vrbničanin et al., 2011).
Solubilización de fosfatos. El aislado IH4 fue el único que mostró la capacidad de solubilizar Ca3(PO4)2, con un índice potencia de 48,25 % (figura 2). Esto coincide con otros autores quienes obtuvieron aislados rizosféricos de Bacillus spp. con eficiencias similares a las observadas en IH4 (Thanh y Tram, 2018). Por lo cual IH4 pudiera contribuir a elevar el crecimiento y desarrollo de cultivos. El empleo de bacterias solubilizadoras de fosfatos insolubles incrementa la disponibilidad del fósforo para los cultivos, que tiene funciones celulares vitales, al ser un componente estructural de ácidos nucleicos, fosfolípidos y moléculas de ATP, además de incrementar la producción de semillas y frutos y estimular el crecimiento de las raíces (Ranjbar-Moghaddam y Aminpanah, 2015).
Producción de cianuro de hidrógeno. La producción de cianuro de hidrógeno forma parte del sistema de defensa de algunos microorganismos. El estudio de la capacidad de producción de este metabolito gaseoso mostró que solo el aislado IH7 es capaz de sintetizar este compuesto en bajas proporciones, lo cual se evidenció por el cambio de coloración del papel de filtro de amarillo a pardo. En estudios similares, varios autores refirieron la producción de cianuro de hidrógeno por aislados rizosféricos (Thakur y Parikh, 2018). El efecto biocontrolador del HCN fue asociado a la capacidad de este compuesto de unirse al hierro, lo que afecta la cantidad disponible de este elemento para los fitopatógenos. Sin embargo, estudios recientes sugieren que la principal contribución del HCN biogénico es el atrapamiento de metales y en consecuencia el aumento directo de la disponibilidad de nutrientes que provoca el aumento del crecimiento de las plantas (Rijavec y Lapanje, 2016). La función del HCN se comparó con otras actividades similares como la solubilización de fosfatos y la función de los sideróforos, que permiten elevar la disponibilidad de elementos minerales para las plantas (Sagar et al., 2018). El uso de cepas bacterianas que producen HCN en suelos deficientes de nutrientes, puede constituir una alternativa para el desarrollo de una agricultura sostenible en el futuro.
Producción de enzimas. La tabla 2 muestra las actividades β-1,3-glucanolítica y/o quitinolítica, lipídica y proteolítica de los aislados. Los aislados IH4 e IH7 mostraron actividad β-1,3-glucanolítica y/o quitinolítica. Este último tuvo una efectividad mayor (95,55 %) que el IH4 (43,98 %). No se evidenció actividad lipídica en ninguno de los aislados, mientras que solamente IH7 expresó actividad proteolítica, con un índice de potencia de 43,98 %.
Tabla 2 Actividades β-1,3-glucanolítica y/o quitinolítica, lipídica y proteolítica de los aislados.

Letras distintas indican diferencias entre aislados para una misma actividad, según prueba de Kruskal-Wallis (p ≤ 0,05). ± EE: error estándar. NE: negativo para la prueba bioquímica.
Las actividades enzimáticas proteasas y quitinasas se refirieron previamente en cepas de Bacillus spp. por diferentes autores (Majumdar y Chakraborty, 2017; Dar et al., 2018). La actividad proteolítica obtenida con IH7 fue superior a la observada en otros aislados de Bacillus spp. extraídos de la rizosfera de Aloe vera L., con valores índice de potencia entre 11,3 y 21,8 % (Thakur et al., 2017).
Estos resultados sugieren un posible uso de IH7 e IH4 como biocontroladores de fitopatógenos, ya que la producción de estas enzimas provoca la lisis o alteran los componentes de las paredes celulares de los hongos (Haldar y Sengupta, 2015) y disminuyen la incidencia de patógenos fungosos como Macrophomina phaseolina (Hernández et al., 2017) y Pythium myriotylum (Jimtha et al., 2016). Además, la actividad proteolítica de IH7 puede contribuir con el ciclo del nitrógeno en la rizosfera, al acelerar los procesos degradativos de la materia orgánica, lo cual incrementa la fertilidad del suelo (Singh et al., 2018).
En importante señalar que en el caso de los aislados obtenidos del producto IHPLUS®, estos también tienen la capacidad de tolerar pH ácidos inferiores a valores de 4, por lo cual es posible que posean enzimas tolerantes a altas concentraciones de iones hidronio, lo que sugiere un posible uso de los aislados identificados en suelos ácidos.
La actividad amilolítica, celulolítica y mananolítica de los aislados se muestra en la tabla 3 y en la figura 3. Los aislados IH5 e IH7 expresaron enzimas amilasas. En el caso de IH4 no se pudo determinar la actividad amilolítica debido a que este aislado secretó sustancias cerosas de naturaleza hidrofóbicas que cubrieron el medio de cultivo, por lo cual no fue posible revelar la actividad mediante la tinción del medio de cultivo. Con relación a la producción de celulasas y mananasas, IH7 mostró una actividad celulolítica notable (132,06 %) e IH5 fue eficiente en la actividad mananolítica con un índice de potencia igual a 94,44 %.
Tabla 3 Actividad amilolítica, celulolítica y mananolítica de los aislados evaluados.

EE: error estándar. +: prueba positiva, NE: negativo para el ensayo bioquímico. ND: indeterminada.
Estos resultados son congruentes con otros trabajos que refieren actividades amilolíticas, celulolíticas y mananolíticas en Bacillus spp. (Singh et al., 2016). Varias especies de este género se utilizan ampliamente para la obtención de α-amilasas para fines industriales, como, por ejemplo, B. subtilis, B. stearothermophilus, B. licheniformis y B. amyloliquefaciens (Saini et al., 2017).
La actividad celulolítica de IH7 evidencia posibles aplicaciones en diferentes áreas agrícolas en el biocontrol de hongos fitopatógenos (como Phytophthora) (Naing et al., 2014) y en la descomposición de la materia orgánica celulósica presente en la rizosfera, lo que aumenta la disponibilidad de nutrientes para las plantas. Las celulasas también tienen diferentes aplicaciones en las industrias alimentarias, textiles y en la producción de papel y detergente (Singh et al., 2016).
La actividad mananolítica elevada del aislado IH5 también indica su uso potencial en las industrias del papel y el detergente (Singh et al., 2016). Además, en el sector agropecuario se puede utilizar para mejorar la digestibilidad y la absorción de nutrientes en animales que se alimentan de desechos fibrosos de plantas, como el bagazo de la caña de azúcar y la paja de maíz (Matos et al., 2018). El empleo de IH5 en procesos fermentativos con estos materiales vegetales, pudiera contribuir a la digestión parcial de diferentes componentes de las paredes celulares, ya que las mananasas hidrolizan los enlaces β-1,4-mananosídicos presentes en esqueletos carbonados de mananos, galactomananos, glucomananos y galactoglucomananos (Song et al., 2017). Los productos liberados constituyen mayoritariamente oligosacáridos, que elevan la disponibilidad y la asimilación de nutrientes energéticos en animales monogástricos; pueden presentar actividad prebiótica o emplearse como aditivos nutricionales (Scapini et al., 2018).
Conclusiones
El bioproducto IHPLUS® constituye una fuente potencial para el aislamiento de bacilos con diferentes actividades biológicas y posibles aplicaciones en los sectores agropecuario e industrial.
Los aislados IH7 e IH5 mostraron propiedades bioestimuladoras y biofertilizantes, al producir ácido indolacético (23,55 μg mL-1) y solubilizar fosfato tricálcico, respectivamente. IH7 evidenció también potencialidades como agente antagónico de fitopatógenos, ya que produjo cianuro de hidrógeno y actividades β-1,3-glucanolítica y/o quitinolítica y proteolítica; mientras que el aislado IH5 constituye un candidato promisorio para su uso con diferentes fines industriales, dado la producción eficiente de mananasas.