Introducción
El género Morus se ha distribuido en casi todo el mundo, en áreas templadas como tropicales. El desarrollo de proyectos de sericultura en diferentes regiones hace que hoy en día la morera (Morus alba L.) esté presente en China, India, Brasil, Japón y otros países (Gahukar, 2015).
Tradicionalmente, la propagación de la especie se realiza por estacas o semillas botánicas. Esto constituye una limitación, pues reduce aún más su disponibilidad para el alimento animal, debido a su ciclo de crecimiento (Desai et al., 2018).
En Cuba se investiga M. alba con el propósito de su utilización en la producción de forraje por sus cualidades como alimento animal (Noda y Martín, 2017). Con este fin, el país posee un germoplasma de 21 variedades, introducidas desde Costa Rica, Etiopía, Brasil, Corea del Sur, China y España (Martín-Martín et al., 2015).
El proceso de introducción y generalización de M. alba en Cuba ha conllevado al desarrollo de diversos estudios de evaluación y/o caracterización de variedades, entre las que se destaca la acorazonada (Martín-Martín et al., 2015).
El cultivo de tejido vegetal es una técnica para el cultivo, multiplicación y mantenimiento de células vegetales, tejidos u órganos aislados de la planta madre, en condiciones controladas y asépticas (Viquez-Pancho, 2018).
En la morera, el cultivo de tejido se ha aplicado de manera eficiente para mejorar el potencial de rendimiento, la resistencia a plagas y enfermedades, la tolerancia a los estreses abióticos y la resistencia a los herbicidas del cultivo. También se ha utilizado con buenos resultados para la micropropagación de genotipos difíciles, la regeneración vegetal de las hojas jóvenes, los cotiledones, las zonas del hipocótilo y los segmentos de tallo. Se refiere, además, su uso en técnicas in vitro, con el propósito de desarrollar tetraploides mediante el empleo de colchicina (Tikader y Vijayan, 2017) y en marcadores moleculares para la caracterización del germoplasma en morera (Vijayan et al., 2019).
La base para desarrollar técnicas del cultivo de tejidos vegetales en la morera requiere establecer un protocolo para el cultivo de callos. Agarwal (2002) utilizó como explantes hipocótilos y cotiledones para la obtención de callos mediante el uso de diferentes concentraciones de BAP y 2,4-D. Yew et al. (2011) emplearon segmentos de hojas y de diferentes combinaciones de BAP, AIA y 2,4-D. Para la obtención de callos, también Espinosa et al. (2012) usaron como explantes limbos foliares, tallos y pecíolos con diferentes concentraciones de 2,4-D.
Este trabajo tuvo como objetivo evaluar el efecto de diferentes concentraciones de reguladores del crecimiento y tipos de explantes en la formación de callos de M. alba, variedad acorazonada.
Materiales y Métodos
Localización. Esta investigación se desarrolló en el Centro de Estudios de Biotecnología Vegetal (CEBVEG) de la Universidad de Granma, Cuba.
Material vegetal. Se cortaron estacas de M. alba (morera), variedad acorazonada, de 20 cm de longitud, colectadas en el banco de germoplasma perteneciente al CEBVEG.
Las estacas se colocaron en agua destilada durante 15 días para la obtención de brotes. Cuando estos alcanzaron tamaño de 10-12 cm, se tomaron las hojas, tallos y pecíolos como fuentes de explantes para la formación de callos. La desinfección se realizó en condiciones asépticas de cabina de flujo laminar, con hipoclorito de sodio al 1% durante 20 min. Posteriormente, se lavaron cuatro veces con agua destilada estéril.
Medio de cultivo basal. El medio de cultivo basal estuvo compuesto por sales, vitaminas y solución Murashige y Skoog (Murashige y Skoog, 1962) a concentración de 4,32 g L-1. Además, se le adicionó al medio de cultivo sacarosa (30 g L-1) y agar (6,0 g L-1) con pH de 5,8. Los reguladores del crecimiento se utilizaron según lo indicado por Espinosa et al. (2012), quienes emplearon ácido 2,4-diclorofenoxiacético (2,4-D). También se siguieron los criterios de Agarwal (2002), que hacen referencia a las combinaciones de 6-bencilaminopurina (6-BAP) + ácido naftalenacético (ANA) y 6-bencilaminopurina (6-BAP) + ácido 2,4-diclorofenoxiacético (2,4-D).
Tratamiento y diseño experimental. Los tratamientos se formaron al combinar los tres medios de cultivo con los cinco tipos y posiciones de los explantes para 15 tratamientos en total (tabla 1). Los explantes se colocaron a razón de cinco explantes por placa de Petri para cada uno de los medios de cultivo. Se aplicó un diseño completamente aleatorizado con arreglo factorial.
Tabla 1 Combinaciones de diferentes medios de cultivo con el tipo y posición de los explantes en la formación de callos de M. alba.

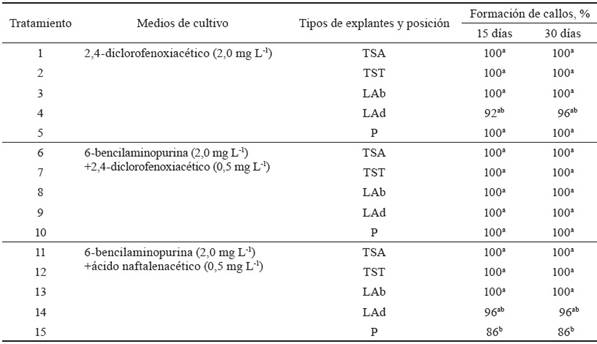
TSA: tallos de 0,5 cm de largo, seccionados longitudinalmente con el corte hacia arriba.
TST: tallos seccionados de manera transversal, de 2-3 mm de grosor y capas finas de células sobre el medio de cultivo.
LAb: limbos foliares en posición abaxial, de 1 cm2, con el envés sobre el medio de cultivo.
LAd: limbos foliares en posición adaxial, de 1 cm2, con el haz sobre el medio de cultivo.
P: pecíolo de 0,5 cm de largo colocado longitudinalmente sobre el medio de cultivo.
A los 15 y 30 días, se evaluó el inicio de la formación de callos, zona en que se formaron, porcentaje de formación, coloración, consistencia y porcentaje de formación de las raíces. Se incubaron los callos en condiciones de oscuridad, a temperatura de 25 ± 2 °C y humedad relativa entre 60 y 65 %.
Análisis estadístico. Datos como la formación de callos y de raíces se expresaron en porcentajes. Se aplicó el análisis de comparación de proporciones con la utilización del paquete estadístico CompraPro, según lo indicado por Castillo y Miranda (2014).
Resultados y Discusión
Los resultados que se muestran en la tabla 2, relacionados con el porcentaje de formación de callos con respecto al medio de cultivo y tipo de explante, demuestran que en todos los tratamientos hubo formación de callos a los 15 y 30 días, con valores superiores a 86 %. Esto se puede considerar como una respuesta fisiológica adecuada de los explantes a los diferentes reguladores del crecimiento, según indicaron los porcentajes alcanzados en todos los tratamientos.
Tabla 2 Efecto de diferentes medios de cultivo y tipos de explantes en la formación de callos de morera, a los 15 y 30 días de cultivo.
TSA: tallos de 0,5 cm de largo, seccionados longitudinalmente con el corte hacia arriba.
TST: tallos seccionados transversalmente, de 2-3 mm de grosor, con capas finas de células sobre el medio de cultivo.
LAb: limbos foliares en posición abaxial, de 1 cm2, con el envés sobre el medio de cultivo.
LAd: limbos foliares en posición adaxial, de 1 cm2, con el haz sobre el medio de cultivo.
P: Pecíolos de 0,5 cm de largo, colocados longitudinalmente sobre el medio de cultivo.
Letras diferentes en una misma columna difieren significativamente (p < 0,05); *p < 0,05
Un comportamiento similar refirieron Bhau y Wakhlu (2001), al formar callos de M. alba variedad Chinese White y Kokuso-27 (100 %) y en Ichinose (95 %) en medio de cultivo basal Murashige y Skoog suplementado con 2,4-D (1,0 mg L-1) + BAP (0,5 mg L-1).
La formación de callos se considera un mecanismo de defensa de la planta para evitar la penetración de agentes extraños ante los cortes que se producen en sus tejidos (Silva et al., 2018). A los 15 días de cultivo, se observó el inicio de la formación de los callos en los diferentes explantes evaluados. En las hojas se hizo evidente cuando se comenzaron a engrosar y se separaron del medio del cultivo. En los explantes de tallos se pudo ver la formación de pequeñas protuberancias en los bordes en los que se produjeron los cortes y en la nervadura principal. En los pecíolos, se mostró el inicio de la formación de tejido indiferenciado en las zonas de cicatrización.
Estos resultados son similares a los informados por Espinosa et al. (2012) en el cultivo de la morera, variedad acorazonada en el medio MS, con diferentes concentraciones de 2,4-D (0,5; 1,0 y 2,0 mg L-1), al utilizar como explantes limbos foliares, tallos y pecíolos.
Los resultados de este estudio son superiores a los de Agarwal (2002), quien obtuvo 65 % de formación de callos en explantes internodales, en una combinación de BAP (2,0 mg L-1) + ANA (0,5 mg L-1). Mientras, en explantes de hojas, el mayor porcentaje (44,05 %) se logró con BAP (2,0 mg L-1) + ANA (0,5 mg L-1) a las cinco semanas de cultivo. La diferencia observada con respecto al presente estudio se puede relacionar con la variedad empleada, que en el trabajo de Agarwal (2002) fue la M5.
A los 30 días de cultivo, se pudo ver que los callos en los explantes de hojas estaban poco desarrollados, con coloración parda y consistencia dura. En el explante pecíolo, los callos tomaron coloración crema, y fueron más evidentes en los medios de cultivo que contenían 2,4-D (2,0 mg L-1) y 6-BAP (2,0 mg L-1) + ANA (0,5 mg L-1).
La formación de callos en los explantes de tallos seccionados longitudinalmente, a los 30 días de cultivo en el medio MS con 6-BAP (2,0 mg L-1) + 2,4-D (0,5 mg L-1), mostró las mejores características morfológicas (figura 1). La masa amorfa de células llegó a ocupar toda la superficie del explante, al mostrar coloración crema claro con consistencia friable.
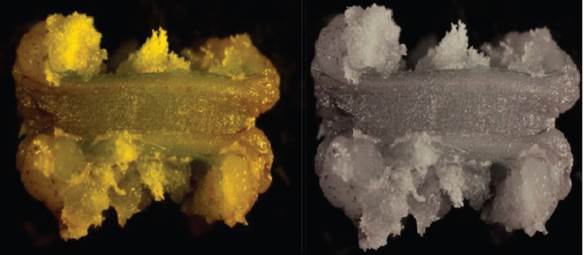
Figura 1 Formación de callos en explantes de tallos seccionados longitudinalmente en medio Murashige y Skoog con 6-bencilaminopurina (2,0 mg L-1) + 2,4-diclorofenoxiacético (0,5 mg L-1), a los 30 días de cultivo.
Agarwal (2002), al evaluar el efecto de diferentes combinaciones de 6-BAP con 2,4-D en hojas y explantes internodales a las cinco semanas de cultivo, informó que el mejor tratamiento fue 6-BAP 2,0 mg L-1+ 2,4-D 0,5 mg L-1, con 52,6 % en explantes internodales y 33,7 % en hojas. Esos resultados fueron inferiores a los de esta investigación, con la variedad acorazonada, lo que puede estar relacionado con el uso de la variedad M5 por parte de Agarwal (2002). Con respecto a esta última, no se tienen referencias en Cuba.
Deo et al. (2010) indicaron que entre cultivares de una misma especie se pueden presentar diferencias en cuanto a la inducción de tejidos embriogénicos. De esta forma, algunos genotipos se inducen con relativa facilidad, mientras que otros no presentan respuestas favorables en las mismas condiciones de cultivo. En este caso, se deben modificar las condiciones de cultivo o la composición del medio.
De acuerdo con Martínez et al. (2017), el 6-BAP refuerza bioquímicamente la acción del 2,4-D al incrementar la actividad de las auxinas. Estas se encargan de estimular el crecimiento y la división celular, al aumentar la velocidad de formación de células de manera organizada a partir de las células del explante. Estos reguladores del crecimiento tienen una función fundamental en la formación y el crecimiento de brotes (Liu et al., 2019).
Las características que presentaron los callos coinciden con las observaciones de Espinosa et al. (2012). En el cultivo de la morera, estos autores obtuvieron callos de color crema claro en todos los tratamientos en los que emplearon el 2,4-D en los diferentes tipos de explantes (limbos foliares, pecíolo y tallo). También Agarwal (2002) obtuvo callos de consistencia friable y de color marrón en explantes de hipocótilos en el cultivo de la morera, variedad M5.
Silva et al. (2018), al utilizar diferentes tipos de explantes (hojas, tallos y pecíolo) de M. alba, variedad acorazonada, obtuvieron callos de color marrón amarillento y consistencia friable. Los callos se incubaron en condiciones de oscuridad. Todos los trabajos revisados en la literatura coinciden en que la formación de callos en morera tiene lugar en la oscuridad. Esto se explica porque en esas condiciones se reduce la oxidación de auxinas, que desempeñan una función importante en la formación de callos (Sarkar et al., 2018).
En correspondencia con los resultados de este estudio, se puede afirmar que el empleo de hojas, pecíolos y tallos, como explantes en el cultivo de la morera, permite la obtención de callos de forma eficiente y el logro de altos valores para cada uno de los tipos de explantes.
En la tabla 3 se muestran los resultados del efecto de diferentes medios de cultivo y tipos de explantes en el porcentaje de formación de raíces, a los 30 días de cultivo. Se observó el mayor porcentaje de enraizamiento (75 %) en el tratamiento 2, en el que se usaron explantes de tallos seccionados transversalmente en el medio Murashige y Skoog (MS) con 2,4-D (2,0 mg L-1). Este tratamiento mostró diferencias significativas con respecto al resto. Los resultados demuestran que el 2,4-D ejerce un efecto favorable, no sólo en la formación de callos, sino en la inducción de raíces en el cultivo in vitro de segmentos longitudinales en tallos jóvenes de morera.
Tabla 3 Efecto de diferentes medios de cultivo y tipos de explantes en el porcentaje de formación de raíces a los 30 días de cultivo.
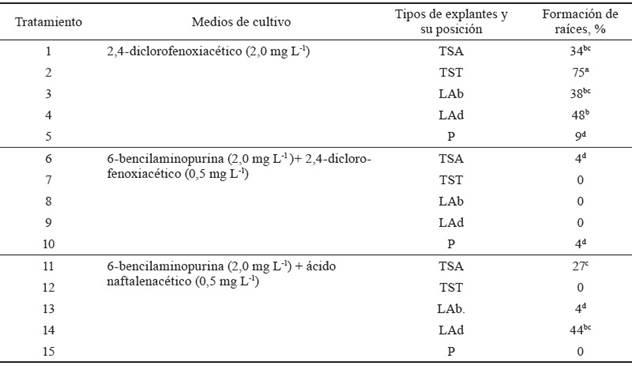
TSA: tallos de 0,5 cm de largo seccionados longitudinalmente con el corte hacia arriba.
TST: tallos seccionados transversalmente, de 2-3 mm de grosor, con capas finas de células sobre el medio de cultivo.
LAb: limbos foliares dispuestos en posición abaxial, de 1 cm2, con el envés sobre el medio de cultivo.
LAd: limbos foliares ubicados en posición adaxial, de 1 cm2, con el haz sobre medio de cultivo.
P: pecíolo de 0,5 cm de largo, colocado longitudinalmente sobre el medio de cultivo.
Letras diferentes en una misma columna difieren significativamente (p < 0,05); *p < 0,05
El valor más bajo en la formación de raíces se observó en el medio de cultivo con 6-BAP (2,0 mg L-1) + 2,4-D (0,5 mg L-1). Esto se puede asociar a que los niveles de la citoquinina BAP fueron superiores al 2,4-D, relación que puede disminuir la formación de raíces (Gil et al., 2019).
En el medio de cultivo 6-BAP (2,0 mg L-1) + ANA (0,5 mg L-1) los resultados fueron variables, ya que se obtuvieron valores de 44 y 27 % para las posiciones y tipos de explantes LAD y TSA, respectivamente. En cambio, para los tres tratamientos restantes, los valores fueron de 0 y 4 %, lo que sugiere un efecto más dependiente del tipo de explante y su posición en el medio de cultivo.
El 2,4-D es una auxina potente, que se usa en el cultivo in vitro para la formación de callos y la inducción de embriones somáticos. Ejerce un efecto enraizante, y en la actualidad se utiliza ampliamente, debido a su bajo costo y fácil acceso. En diversas especies de plantas se ha empleado como regulador del crecimiento (De-la-Cruz et al., 2016).
La plasticidad que tienen varios de los explantes indica las posibilidades de utilización de estos sistemas radicales para la producción de metabolitos secundarios, y para el posible cultivo de hongos micorrizicos vesículo arbusculares (HMA) que necesitan una simbiosis obligada. Estos HMA no se pueden obtener en medios de cultivos artificiales.
La figura 2 muestra la formación de raíces en explantes de tallos seccionados transversalmente a los 30 días, en medio MS con 2,4-D (2,0 mg L-1). El crecimiento de las raíces se produjo a partir de los callos y directamente del explante, lo que indica la ocurrencia de una organogénesis indirecta y directa, respectivamente (figura 2). Las raíces que se formaron son gruesas y largas y están cubiertas densamente por pelos radiculares.

Figura 2 Formación de raíces en explantes de tallos seccionados transversalmente en el medio Murashige y Skoog con 2,4-diclorofenoxiacético (2,0 mg L-1), a los 30 días de cultivo.
Espinosa et al. (2012) en la especie M. alba obtuvieron callos que formaron raíces a partir de pecíolos y hojas. Estos autores informaron que en este último explante el número de raíces fue superior en los tratamientos donde se emplearon las mayores concentraciones de 2,4-D (1,0 y 2,0 mg L-1).
La formación de raíces o brotes en los callos depende de la relación auxina/citoquininas en el medio. Se induce así la rizogénes en presencia elevada de AIA o ANA. Mientras, al combinar 2,4-D con auxinas o citoquininas, se favorece la formación de callos con capacidad regenerativa con brotes o embriones (Rodríguez-Beraud et al., 2014)
Rodríguez-Beraud et al. (2014), al utilizar explantes de cotiledón, hipocótilo y hoja de murta (Ugnimolinae Turcz) evaluaron la inducción in vitro de callogénesis y organogénesis indirecta. Los callos se cultivaron en un medio de diferenciación con distintas concentraciones de ANA + 6-BAP. Estos autores obtuvieron la mayor respuesta rizogénica en callos de hojas con ANA (0,1 mg L-1) + 6-BAP (1,0 mg L-1).
Para la obtención de raíces se recomienda el uso de los tallos seccionados transversalmente en el medio de cultivo utilizado por Espinosa et al. (2012).
En esta investigación, se alcanzaron valores superiores a 86 % en la formación de callos. Las mejores características morfológicas se obtuvieron en los explantes de tallos seccionados longitudinalmente en medio de cultivo con BAP (2,0 mg L-1) + 2,4-D (0,5 mg L-1).
Conclusiones
Se obtuvo la formación de callos en los diferentes medios de cultivo y tipos de explante de M. alba, variedad acorazonada, con valores superiores a 86 %. Los callos formados a partir de tallos que se seccionaron longitudinalmente en medio de cultivo complementado con 6-bencilaminopurina + ácido 2,4-diclorofenoxiacético mostraron mejores características morfogénicas.
El mayor porcentaje de explantes con formación de raíces se obtuvo a partir tallos seccionados transversalmente en el medio de cultivo con 2,0 mg L-1 de ácido 2,4-diclorofenoxiacético, al alcanzar valores del 75 %.















