Introducción
La salinización de los suelos es uno de los problemas más graves a los que se enfrenta la agricultura en el mundo (Zhang et al., 2019). Los suelos afectados se caracterizan por la acumulación de cantidades excesivas de sales solubles, sodio intercambiable o ambos, y como consecuencia, se pierde la fertilidad y la biodiversidad y se genera la desertificación (Saier, 2010). En este contexto, el abandono de los suelos y el deterioro de la estructura y estabilidad de las comunidades agrícolas genera la migración de los trabajadores rurales (Wicke et al., 2011).
En la rizósfera de las plantas en general, incluso en las que son tolerantes a la salinidad, se encuentran rizobacterias promotoras de crecimiento en plantas (PGPR, del inglés: plant growth promotion rhizobacteria). Estas bacterias sintetizan reguladores de crecimiento, solubilizadores de fosfatos y fijadores de nitrógeno atmosférico, estimulan el sistema de absorción de iones, además de disminuir el ataque de fitopatógenos mediante la competencia, el parasitismo, la lisis enzimática y la antibiosis e inducción de resistencia (Nadeem et al., 2014). Las PGPR constituyen una alternativa para disminuir el uso de los fertilizantes químicos. La eficiencia de recuperación (porcentaje del nutriente aplicado en el fertilizante absorbido por la planta) es diferente y resulta, como promedio, 50, 30 y 60 % para el N, P y K aplicado, respectivamente (Navarro-García y Navarro-García, 2014).
La especie Portulaca oleracea L. prolifera en suelos con salinidad, debido a sus mecanismos propios, como la tolerancia al ion sodio y el ajuste osmótico, aunque también en este comportamiento desempeñan una función muy importante los microorganismos asociados a la rizósfera, que se adaptan a las condiciones adversas del entorno y, como consecuencia, maximizan sus capacidades como PGPR (Paul y Nair, 2008). Entre estos microorganismos, las bacterias rizosféricas, después de su inoculación en los cultivos, pueden tener un efecto benéfico en ellos y hacer exitoso su establecimiento.
La región Lambayeque-Perú tiene problemas de baja producción y de salinidad, derivados de la degradación de los suelos. Sin embargo, en la actualidad, las bacterias rizosféricas y endófitas de P. oleracea no se han aislado para su caracterización, y uso posterior como biofertilizantes en cultivos sembrados en suelos con salinidad elevada. A partir de estas consideraciones, el objetivo de este trabajo fue determinar el potencial de bacterias rizosféricas y endófitas de P. oleracea como promotoras del crecimiento vegetal en suelos con salinidad.
Materiales y Métodos
Material vegetal. Se colectaron las plantas de P. oleracea (verdolaga), del distrito de Reque y Humedales de Eten en la región Lambayeque, Perú, durante febrero-abril de 2016. A partir de ellas, se realizaron aislamientos de bacterias rizosféricas y endófitas fijadoras de nitrógeno.
Aislamiento, identificación y caracterización de bacterias. Se seleccionaron suelos que presentan problemas de salinidad, reconocidos por su dureza y costras blancas en su superficie. Se colectaron 54 muestras de raíces de verdolaga con suelo adherido. Las plantas se extrajeron con una pala y se seleccionaron, aproximadamente, 50 g de raíces y suelo adherido. Se depositaron en bolsas de polietileno y se transportaron en una caja térmica (10 ± 1 °C) hacia el Laboratorio de Microbiología y Parasitología de la Universidad Nacional Pedro Ruiz Gallo de Perú.
Simultáneamente al muestreo, para el aislamiento de bacterias, se colectó una muestra compuesta de 1 kg de suelo radicular para su análisis físicoquímico (tabla 1). El suelo es fuertemente alcalino, con textura arenosa, niveles bajos de materia orgánica y nitrógeno, así como nivel medio de fósforo disponible y potasio.
Las bacterias rizosféricas fijadoras de nitrógeno, aerobias y microaerófilas, se aislaron de las raíces con suelo rizosférico, las que previamente se deshidrataron bajo sombra durante 72 h. Las raíces se fragmentaron (5 cm) y se tomaron aleatoriamente 10 g de raíces con suelo adherido. Posteriormente, se depositaron en frascos con 90 mL de solución salina esterilizada (NaCl 0,7 % m/v). Después de agitar el contenido manualmente, durante 10 minutos, se tomaron alícuotas. Con el propósito de aislar bacterias aerobias, se inocularon las alícuotas mediante la técnica de aislamiento por agotamiento por estría sobre la superficie de medios de cultivo sólidos, sin nitrógeno. La técnica de puntura se utilizó en medios de cultivo semisólidos, sin nitrógeno, (una gota por tubo) para el aislamiento de las bacterias microaerófilas.
Las bacterias aerobias se aislaron en los medios de cultivo sólidos LG (Azotobacter), LGD (Derxia) y BEIJ (Beijerinckia spp), según lo indicado por Frontera (1983). Después de la incubación a 30 ± 2 °C durante dos días, con los morfotipos de las bacterias representativas, se obtuvieron suspensiones en solución salina esterilizada y se subcultivaron para su purificación en sus respectivos medios de cultivo sólidos.
Para bacterias microaerófilas, los medios de cultivo semisólidos fueron NFb y LGI (Azospirillum spp), JNFb (Herbaspirillum spp), LGI-P (Gluconacetobacter spp) y JMV (Burkholderia spp), de acuerdo con Silva-Froufe et al. (2009). Después de la incubación a 30 ± 2 °C durante siete días, se seleccionaron los medios en los que se observó una película blanquecina bajo la superficie y el viraje del indicador. En similares medios de cultivo, por dos veces consecutivas, se realizaron subcultivos.
Para el aislamiento de bacterias microaerófilas con la película bacteriana, se obtuvo una suspensión en solución salina estéril y se inoculó en los medios sólidos respectivos. Luego, se incubaron a 30 ± 2 °C durante 48 h. Los diversos morfotipos de las bacterias aisladas se cultivaron nuevamente en el medio semisólido (tercer subcultivo), y después en el medio sólido correspondiente. Con las colonias de las bacterias aerobias y microaerófilas se realizaron tinciones de Gram y se cultivaron en agar nutritivo y medios sólidos y semisólidos, sin nitrógeno. Se constituyeron así los cultivos puros de bacterias rizosféricas fijadoras de nitrógeno, que se guardaron en refrigeración (8 °C).
Las bacterias endófitas, fijadoras de nitrógeno microaerófilas, se aislaron de las raíces desinfectadas superficialmente. Las raíces se lavaron con agua potable para retirar el suelo adherido y se cortaron en fragmentos de 5 cm. Se pesaron 5 g y se depositaron en frascos con tapa, de 500 mL de capacidad, previamente esterilizados, con el propósito de lavarlas después con 50 mL de agua destilada más detergente neutro 0,005 % m/v durante un minuto. Posteriormente, se enjuagaron por cuatro veces consecutivas con agua destilada estéril, a razón de un minuto por enjuague. Después, se agitaron por 15 minutos en solución tampón de fosfato de potasio (0,05 mol L-1, pH 7,0). Se sometieron a inmersión en alcohol (70 % v/v) por un minuto, y se agitaron durante cinco minutos en solución de hipoclorito de sodio (NaClO) al 5 %, a la que se le agregó unas gotas de Tween 80. El tejido se llevó a frascos previamente esterilizados para su inmersión por un minuto en alcohol al 70 %, seguida de agitación en solución tampón durante 15 min. Finalmente, se lavaron por cuatro veces con agua destilada esterilizada.
El tejido vegetal desinfectado se depositó en papel secante para eliminar el exceso de humedad, y luego se llevó a bolsas de polietileno de 16 x 15 cm, donde se trituró resuspendido en 0,5 mL-1 de solución salina estéril (NaCl 0,87 % p/v). Con una jeringa se extrajo 1 mL del macerado, y se inoculó inmediatamente una gota por doble puntura en los medios de cultivo semisólidos sin nitrógeno: NFb, LGI, JNFb, LGI-P y JMV (Garrido-Rubiano, 2007). Después de la inoculación, se procedió de manera similar a lo antes descrito en bacterias rizosféricas fijadoras de nitrógeno microaerófilas.
La identificación del género de las bacterias rizosféricas y endófitas fijadoras de nitrógeno se realizó en función de las características morfológicas y fisiológicas, según la bacteriología sistemática (Argüello-Navarro et al., 2016). Con todas las bacterias se realizaron pruebas de catalasa, oxidasa y motilidad. Para bacterias aerobias del género Azotobacter, se realizaron las pruebas de reducción de nitratos y acidificación de glucosa, sacarosa, maltosa y fructuosa. Para los géneros Derxia y Beijerinckia, las pruebas fueron producción de indol, utilización del citrato como fuente de carbono, crecimiento en 1 % de peptona y acidificación de glucosa, sacarosa y manitol.
La cuantificación del amonio producto de la fijación de nitrógeno in vitro se realizó con el método colorimétrico de Berthelot, la del fósforo producto de la solubilización de fosfato in vitro mediante el método colorimétrico de molibdato, y la cuantificación de indoles producidos in vitro según la reacción colorimétrica de Salkowski (Lara-Mantilla et al., 2007). Las bacterias rizosféricas y endófitas se cultivaron en caldo nutritivo con 5 % NaCl (m/v) a 30 °C, durante 24 h. El crecimiento bacteriano se manifestó por turbidez o película superficial, y se procedió inmediatamente al cultivo en caldo nutritivo con 10 % de NaCl (m/v). Se consideraron las bacterias tolerantes por el crecimiento que se observó. Este criterio, unido a los mayores valores en la concentración de amonio, fósforo soluble e índoles, se consideró para la selección de las bacterias rizosféricas (ocho aerobias, ocho microaerófilas y ocho endófitas).
Análisis estadístico. Se aplicó la estadística descriptiva y se utilizó el programa estadístico SPSS®, versión 15.0 y Minitab® 15.
Resultados
Aislamiento, identificación y caracterización de bacterias. En los tres medios de cultivo sólidos sin nitrógeno (LG, LGD y BEIJ) se aislaron bacterias fijadoras de nitrógeno aerobias, cuya presencia se evidenció por las colonias desarrolladas y el viraje del indicador al amarillo (tabla 2). La frecuencia de muestras de raíces, que se calculó del total de los aislamientos con suelo rizosférico y bacterias fijadoras de nitrógeno aerobias, fue de 62,9, 33,3 y 14,8 % en LG, BEIJ y GD, respectivamente. A su vez, en el aislamiento se obtuvieron 73 cultivos puros de bacterias fijadoras de nitrógeno aerobias, cuya procedencia correspondió a 47,9, 32,8 y 19,17 % en LG, BEIJ y GD, respectivamente.
En cinco medios de cultivo semisólidos sin nitrógeno, se aislaron bacterias rizosféricas y endófitas fijadoras de nitrógeno microaerófilas, cuya presencia se evidenció por una película blanquecina formada bajo la superficie del medio de cultivo y por el viraje del indicador (tabla 3). La frecuencia de muestras de raíces con suelo rizosférico, que se calculó del total de los aislamientos de bacterias rizosféricas fijadoras de nitrógeno microaerófilas, después de tres subcultivos, fue de 48,1; 38,8; 29,6; 27,7 y 6,6 % en JNFb; LGI; NFb; JMV y LGI-P, respectivamente. Se obtuvieron 91 cultivos puros de bacterias fijadoras de nitrógeno, cuya procedencia correspondió a 29,6, 24,1; 18,6; 17,5 y 9,8 % en JNFb; LGI; NFb; JMV y LGI-P, respectivamente (figura 1).
Tabla 3 Características diferenciales de las bacterias fijadoras de nitrógeno microaerófilas.
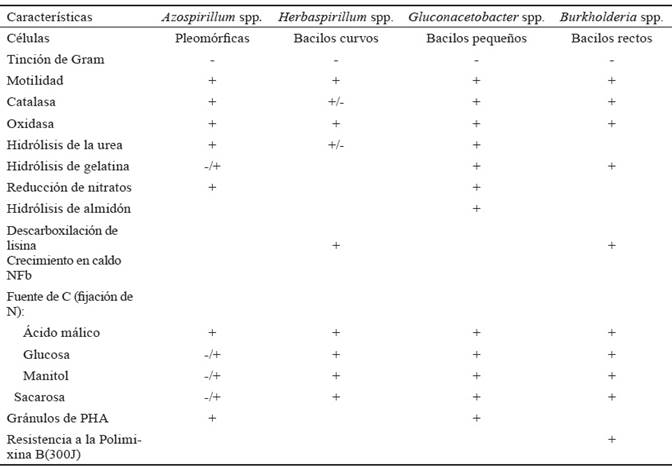
* (+) positivo; (-) negativo.
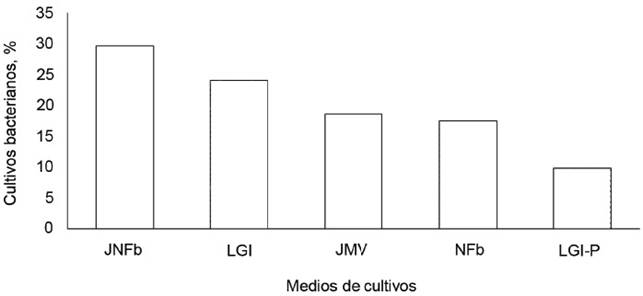
Figura 1 Porcentaje de bacterias rizosféricas fijadoras de nitrógeno microaerófilas, aisladas en cinco medios semisólidos.
La frecuencia de muestras de raíces, calculada del total de los aislamientos con bacterias endófitas fijadoras de nitrógeno después de tres subcultivos, fue 44,1; 29,6; 25,9; 20,4 y 20,3 %, en JNFb, LGI, NFb, JMV y LGI-P, respectivamente. En el aislamiento se obtuvieron 83 cultivos puros de bacterias fijadoras de nitrógeno (figura 2).

Figura 2 Frecuencia de raíces de P. oleracea con bacterias endófitas fijadoras de nitrógeno, aisladas en cinco medios semisólidos después de tres subcultivos.
En las bacterias rizosféricas fijadoras de nitrógeno se identificaron Azospirillum (23,1 %), Azotobacter (18,2 %), Herbaspirillum (15,8 %), Beijerinckia (12,1 %), Burkholderia (9,1 %), Derxia (6,09 %) y Gluconacetobacter (4,2 %). En las endófitas fijadoras de nitrógeno se encontraron Azospirillum (43,3 %), Herbaspirillum (16,8 %), Burkholderia (14,4 %), y Gluconacetobacter (12,04 %). Todo esto del total de las cepas aisladas (figura 3).
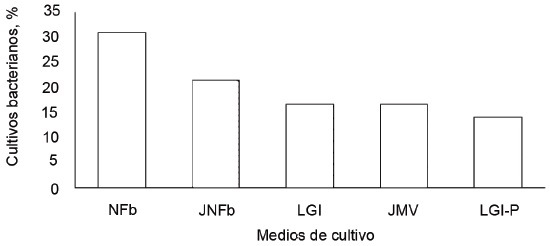
Figura 3 Porcentaje de bacterias endófitas fijadoras de nitrógeno, aisladas en cinco medios semisólidos.
En cuanto a los aislamientos de bacterias rizosféricas, entre las del medio LG se identificó Azotobacter (85,7 %); entre las BEIJ, Beijerinckia (83,3 %); y entre las del LGD, Derxia (71,4 %). Entre las bacterias aisladas en NFb y LGI, se reconoció Azospirillum (100 %), y entre las que se aislaron en JNFb se halló Herbaspirillum (96,2 %). Con respecto a las del medio JMV, se identificó Burkholderia (88,2 %); mientras que entre las del LGI-P se encontró Gluconacetobacter (77,7 %).
De las endófitas aisladas en los medios NFb y LGI se identificó Azospirillum (90 %), y entre las del medio JNFb se halló Herbaspirillum (82,6 %). De las correspondientes al JMV, se identificó Burkholderia (85,7 %) y de las aisladas en LGIP, Gluconacetobacter (83,3 %).
El 88,9 % de los cultivos de bacterias rizosféricas fijaron nitrógeno in vitro. Fueron aerobias 36,5 % de las bacterias, y 52,4 % microaerófilas. En los cultivos de bacterias aisladas, 86,7 % de las bacterias fueron endófitas.
En la tabla 4 se muestran las concentraciones máximas de amonio por cada género: 64 ppm (Azospirillum sp. NFb19R); 27,2 ppm (Azotobacter sp. LG11A); 25,6 ppm (Burkholderia sp. JMV22bR); 20,8 ppm (Herbaspirillum sp. JNFb20R); 16 ppm (Beijerinckia sp. 9AR) y 8 ppm (Derxia sp. LGD5B y Gluconacetobacter sp. LGI-P45). Para las bacterias endófitas, las concentraciones máximas fueron 23,2 ppm (Burkholderia sp. JMV1E); 21,6 ppm (Azospirillum sp. LGI34AE); 13,6 ppm (Herbaspirillum sp. JNFb15E) y 8 ppm (Gluconacetobacter sp. LGI-P2BE).
Tabla 4 Características de bacterias rizosféricas y endófitas, aisladas de P. oleracea.
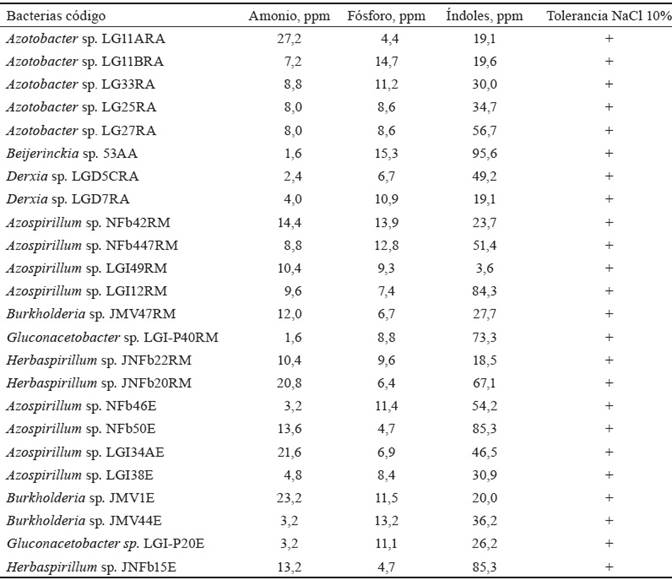
RA= Rizosféricas aerobias, RM= Rizosféricas microaerófilas, E= Endófitas
El 96 % de cultivos de bacterias rizosféricas solubilizó fosfato in vitro. De las bacterias aisladas, el 54 % correspondió a aerobias, y 42 % a microaerófilas; mientras que, en los cultivos de bacterias aisladas, 95 % de las bacterias fueron endófitas (tabla 4).
Las concentraciones máximas de fósforo soluble fueron: 64,9 ppm (Burkholderia sp. JMV53bR); 51,4 ppm (Gluconacetobacter sp. LGI-P33R); 19,2 ppm (Herbaspirillum sp. JNFb49R); 16,9 ppm (Azospirillum sp. LGI38R); 49,2 ppm (Derxia sp. LGD5C); 14,4 ppm (Azotobacter sp. LG11B) y 14,3 ppm (Beijerinckia sp. 4R). Con las bacterias endófitas, las concentraciones máximas correspondieron a los siguientes valores: 16,02 ppm (Azospirillum sp. LGI54E); 11,89 ppm (Gluconacetobacter sp. LGI-P12E); 11,86 ppm (Burkholderia sp. JMV19E) y 11,39 ppm (Herbaspirillum sp. JNFb15E).
El 99,3 % (162) de los cultivos de bacterias rizosféricas (43, 0 y 56.3 %, aerobias y microaerófilas, respectivamente) y 100 % (80) de las bacterias endófitas produjeron indoles in vitro (tabla 4). Las concentraciones máximas de indoles fueron: 142,2 ppm (Azospirillum sp. LGI18R); 92,2 ppm (Herbaspirillum sp. JNFb13R); 80,8 ppm (Burkholderia sp. JMV53bR); 64,9 ppm (Gluconacetobacter sp. LGI-P45R); 56,7 ppm (Azotobacter sp. LG27); 51,4ppm (Beijerinckia sp. 1R) y 49,2 ppm (Derxia sp. LGD 5C). Con las bacterias endófitas, las concentraciones máximas correspondieron a los valores siguientes: 85,3 ppm (Herbaspirillum sp. JNFb15E); 64,9 ppm (Gluconacetobacter sp. LGI-P45E); 60 ppm (Azospirillum sp. NFb 33E) y 49,6 ppm (Burkholderia sp. JMV21E).
El 73,3 % de los cultivos de bacterias rizosféricas toleró 5 % de cloruro de sodio. Fueron aerobias y microaerófilas el 26,8 y 46,9 %, respectivamente.
En los cultivos de bacterias aisladas, 78,5 % de las bacterias fueron endófitas.
Por otra parte, el 30,4 % de los cultivos de bacterias rizosféricas toleró 10 % de cloruro de sodio. De ellas, 12,19 % fueron aerobias y 18,29 % microaerófilas.
Las bacterias que toleraron 10 % de cloruro de sodio, y alcanzaron los mayores valores en la concentración de amonio, fósforo soluble e indoles, se estudiaron para determinar su efecto en el desarrollo vegetativo del tomate. Para ello, se consideraron 16 cultivos de bacterias rizosféricas (ocho de aerobias y ocho de microaerófilas), y ocho de endófitas.
Los géneros del resto de las bacterias se identificaron con la utilización de glucosa, manitol y sacarosa, como fuentes de carbono para la fijación de nitrógeno. Se recurrió, además, al crecimiento en caldo NFb, para Herbaspirillum; a la hidrólisis de urea, gelatina y reducción de nitratos para Gluconacetobacter; y a la hidrólisis de la gelatina, descarboxilación de lisina y resistencia a 300 UI de Polimixina B, en el caso de Burkholderia.
En 85,7 % (30) de las bacterias rizosféricas aisladas en el medio LG, se identificó el género Azotobacter. En 83,3% (20) de las que se aislaron en BEIJ, se reconoció el género Beijerinckia, y en 71,4 % (10) de las aisladas en el medio LGD, el Derxia. En 100 % (38) de las bacterias que se aislaron en NFb y LGI se identificó el Azospirillum; en 6,2 % (26) de las aisladas en JNFb, se pudo ver el Herbaspirillum. De las que estuvieron en el medio JMV, en 88,2 % (15) se registró el Burkholderia, y 77,7 % (7) de las que se encontraban aisladas en LGI-P, se identificó como del género Gluconacetobacter.
En 90 % (36) de las bacterias endófitas, aisladas en los medios NFb y LGI, se reconoció el género Azospirillum; en 82,6 % (14) de las que se hallaron en el medio JNFb se reconoció el Herbaspirillum. En tanto, en 85,7 % (12) de las bacterias que estuvieron en el medio JMV, se identificó el Burkholderia; y en 83,3 % (10) de las aisladas en LGIP, se registró el género Gluconacetobacter.
Discusión
Debido a la aplicación constante de productos químicos en los campos de cultivo, el costo de producción de las cosechas, la calidad ambiental del suelo y el agua se han afectado (Solomon et al., 2000). Las bacterias rizosféricas, que habitan el suelo de la superficie de las raíces, establecen una relación con las plantas, aunque no de manera obligatoria. Se consideran endófitas porque viven en los tejidos (Aguado-Santacruz, 2012) durante una etapa (facultativas) o durante todo su ciclo de vida (obligadas), por lo que se aislaron de las raíces previamente desinfectadas.
Las rizobacterias son capaces de estimular el crecimiento de las plantas mediante variados mecanismos, que incluyen la mejora de la nutrición, la producción y la regulación de las fitohormonas, así como la supresión de los organismos que causan enfermedades (Martínez-Viveros et al., 2010).
En las bacterias endófitas, se identificaron los géneros Azospirillum, Herbaspirillum, Burkholderia y Gluconacetobacter, referidos previamente en Zea mays L.. Se han aislado bacterias endófitas de plantas monocotiledóneas y dicotiledóneas, que incluyen desde especies arbóreas leñosas (Brooks et al., 1994) hasta plantas herbáceas, como la remolacha azucarera (Jacobs et al., 1985) y Z. mays (Gutiérrez-Zamora y Martínez-Romero, 2001).
En las rizosféricas, se reconocieron Azospirillum, Azotobacter, Beijerinckia, Burkholderia, Herbaspirillum, Gluconacetobacter y Derxia spp. Estos géneros bacterianos han sido informados antes en la rizósfera de diversos cultivos agrícolas: Gluconacetobacter en Z. mays (Mehnaz et al., 2006), Azospirillum, Azotobacter, Beijerinckia y Burkholderia en Oryza sativa L. (Ahmadi-Rad et al., 2016), Herbaspirillum, Burkholderia, Gluconacetobacter, Azospirillum, Azotobacter, Beijerinckia y Derxia en Megathyrsus maximus (Jacq.) B.K.Simon & Jacobs, Dichanthium aristatum (Poir.) C.E. Hubb y Brachiaria sp. (Garrido-Rubiano, 2007; Garrido et al., 2010).
Los PGPR a menudo tienen más de un mecanismo para mejorar el crecimiento de las plantas. La evidencia experimental sugiere que su estimulación es el resultado neto de múltiples procesos que se activan simultáneamente (Martínez-Viveros et al., 2010). Las bacterias aisladas en este estudio fijaron nitrógeno, solubilizaron fosfato y sintetizaron índoles. Estos microorganismos solubilizadores muestran efectos en el crecimiento vegetal, entre los que se incluyen la producción de ácido indol acético, giberélico, citoquininas y etileno; así como en la fijación de nitrógeno, características necesarias para que un microorganismo se considere promotor del crecimiento (Banerjee et al., 2010; Souza et al., 2015). Asimismo, se plantea que estos microorganismos incrementan la altura, la biomasa radicular y el aérea de las plantas, lo que sucede a la liberación de productos químicos que favorecen el crecimiento (González y Fuentes, 2017). En experimentos de inoculación también mostraron aumento significativo en el peso seco del brote en condiciones controladas, un incremento en la capacidad de solubilización de P y una mejora en la eficiencia de asimilación del N (Montañez et al., 2012).
















