Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Nucleus
versión impresa ISSN 0864-084X
Nucleus n.45 Ciudad de La Habana ene.-jun. 2009
CIENCIAS NUCLEARES
Exposición radiológica de los trabajadores y el público en la primera fase del ensayo clínico del Nimotuzumab marcado con ![]() para el tratamiento de tumores cerebrales en Cuba
para el tratamiento de tumores cerebrales en Cuba
Occupational and public exposures in RIT of brain tumors in Cuba
Zayda Haydeé Amador Balbona, Fernando Enrique Ayra Pardo, Mirta Bárbara Torres Berdeguez
Centro de Isótopos (CENTIS) Ave. Monumental y Carretera La Rada, Guanabacoa, Ciudad de La Habana, Cuba
RESUMEN
La primera fase del ensayo clínico del anticuerpo monoclonal humanizado h-R3 (Nimotuzumab) marcado con ![]() , para la radioinmunoterapia de tumores cerebrales malignos fue ejecutada durante el período 2002-2005 en Cuba. El objetivo del trabajo fue analizar los datos de la vigilancia radiológica realizada durante el estudio, con respecto a las dosis estimadas inicialmente. Estas últimas se calcularon para cada nivel de actividad, operación y cantidad total de pacientes, considerando el decaimiento radiactivo del
, para la radioinmunoterapia de tumores cerebrales malignos fue ejecutada durante el período 2002-2005 en Cuba. El objetivo del trabajo fue analizar los datos de la vigilancia radiológica realizada durante el estudio, con respecto a las dosis estimadas inicialmente. Estas últimas se calcularon para cada nivel de actividad, operación y cantidad total de pacientes, considerando el decaimiento radiactivo del ![]() y que una misma persona realizaba todas las operaciones. Se demostró que el riesgo radiológico de la práctica es aceptable. Las hipótesis conservadoras empleadas para los cálculos y el cumplimiento de los procedimientos de seguridad establecidos, determinaron que la exposición medida fuera inferior a la estimada. La realización de este trabajo constituye una referencia para la introducción y desarrollo de la radioinmunoterapia en Cuba.
y que una misma persona realizaba todas las operaciones. Se demostró que el riesgo radiológico de la práctica es aceptable. Las hipótesis conservadoras empleadas para los cálculos y el cumplimiento de los procedimientos de seguridad establecidos, determinaron que la exposición medida fuera inferior a la estimada. La realización de este trabajo constituye una referencia para la introducción y desarrollo de la radioinmunoterapia en Cuba.
ABSTRACT
The first phase of the clinical trial using the humanized monoclonal antibody h-R3 (Nimotuzumab) labelled with ![]() , for radioimmunotherapy of brain malignant was performed during the period 2002-2005 in Cuba. The aim of this work was to analyze data from the radiological surveillance of this research compared to initially estimated doses. These latter were calculated for each activity level, operation and total quantity of patients, considering the radioactive decay of
, for radioimmunotherapy of brain malignant was performed during the period 2002-2005 in Cuba. The aim of this work was to analyze data from the radiological surveillance of this research compared to initially estimated doses. These latter were calculated for each activity level, operation and total quantity of patients, considering the radioactive decay of ![]() and taking into account that only one person carries out all of the operations. It was demonstrated that the radiation risk of the practice is acceptable. The conservative hypotheses for dose assessment and the compliance with established safety procedures during this trial showed that the measured exposure was lower than that estimated. This paper is a reference useful to introduce and develop the RIT in Cuba.
and taking into account that only one person carries out all of the operations. It was demonstrated that the radiation risk of the practice is acceptable. The conservative hypotheses for dose assessment and the compliance with established safety procedures during this trial showed that the measured exposure was lower than that estimated. This paper is a reference useful to introduce and develop the RIT in Cuba.
Key words: radioimmunotherapy, rhenium 188, occupational exposure, brain neoplasms, radiation doses, radiation monitoring, clinical trials
INTRODUCCIÓN
A partir de la aprobación por los comités de ética de las instituciones participantes y las autoridades reguladoras competentes, se realizó en nuestro país desde el 2002 y hasta el 2005, la primera fase del ensayo clínico del anticuerpo monoclonal humanizado (![]() ) h-R3 marcado con
) h-R3 marcado con ![]() , para la radioinmunoterapia (RIT) de tumores cerebrales malignos de origen epitelial.
, para la radioinmunoterapia (RIT) de tumores cerebrales malignos de origen epitelial.
El propósito de esta primera fase fue evaluar la toxicidad y efectos clínicos del radioinmunoconjugado, aprovechando las excelentes propiedades físicas y químicas del ![]() para la terapia [1]. Su efecto terapéutico proviene de la energía máxima de su radiación beta igual a 2,1 MeV y su corto período de semidesintegración (16,9 horas). Además, resulta útil para la evaluación dosimétrica de los pacientes y la captación de imágenes por la energía de su radiación gamma de mayor probabilidad (155 keV).
para la terapia [1]. Su efecto terapéutico proviene de la energía máxima de su radiación beta igual a 2,1 MeV y su corto período de semidesintegración (16,9 horas). Además, resulta útil para la evaluación dosimétrica de los pacientes y la captación de imágenes por la energía de su radiación gamma de mayor probabilidad (155 keV).
Se concibió inicialmente un total de 15 pacientes y cinco niveles de actividad de ![]() en el intervalo de (0,37-1,1) GBq y la administración directa en la cavidad del lecho tumoral post-operatoria a través de una cámara Ommaya implantada previamente [2]. Además se incluyeron los estudios de biodistribución, farmacocinética y dosimetría con el empleo de la tomografía de emisión de fotón simple (TEFS), luego de transcurrido un tiempo de 10 min, 1 h, 3 h, 5 h, 24 h, 48 h y 72 h. La toma de muestras de sangre se planificó a los 30 min, 1h, 2 h, 4 h, 6 h, 8 h, 12 h, 24 h, 36 h, 48 h, 72 h y 96 h. Los requisitos de seguridad radiológica para la medicina nuclear fueron incluidos según [3-5], por lo que se postuló que durante el ensayo no se superarían las restricciones de dosis efectivas anuales para los trabajadores ocupacionalmente expuestos (TOES) y el público.
en el intervalo de (0,37-1,1) GBq y la administración directa en la cavidad del lecho tumoral post-operatoria a través de una cámara Ommaya implantada previamente [2]. Además se incluyeron los estudios de biodistribución, farmacocinética y dosimetría con el empleo de la tomografía de emisión de fotón simple (TEFS), luego de transcurrido un tiempo de 10 min, 1 h, 3 h, 5 h, 24 h, 48 h y 72 h. La toma de muestras de sangre se planificó a los 30 min, 1h, 2 h, 4 h, 6 h, 8 h, 12 h, 24 h, 36 h, 48 h, 72 h y 96 h. Los requisitos de seguridad radiológica para la medicina nuclear fueron incluidos según [3-5], por lo que se postuló que durante el ensayo no se superarían las restricciones de dosis efectivas anuales para los trabajadores ocupacionalmente expuestos (TOES) y el público.
En el trabajo se estima la exposición radiológica para todas las operaciones planificadas en el protocolo aprobado [2]. Ya en la ejecución del ensayo se ejecuta la medición de la exposición de los TOES y el público, empleando una dosimetría personal certificada y dosímetros electrónicos de lectura directa. Se consideró como público al personal médico y paramédico participante en el ensayo, y el familiar de cada paciente. Al comparar los valores estimados y medidos de las magnitudes dosimétricas consideradas se observó una adecuada correspondencia por el conservadurismo de las hipótesis asumidas.
Materiales y Método
Evaluación de la exposición
Debido a que todos los compuestos con ![]() tienen una baja volatilidad (k = 0,01) [6], es posible despreciar su contribución a la exposición interna.
tienen una baja volatilidad (k = 0,01) [6], es posible despreciar su contribución a la exposición interna.
La evaluación de la exposición externa se realizó para fotones y con el empleo del código Microshield versión 5.03 [7]. A partir de este se determinaron las tasas de dosis efectiva y las tasas de dosis equivalente en manos. Luego se calculó el producto del tiempo estimado para cada operación y la tasa de dosis correspondiente. La exposición para todo el ensayo clínico se determinó asumiendo que una sola persona realiza todas las operaciones. Por ello, se sumaron los valores de dosis efectiva (E) y dosis equivalente en manos (Hp (0.07)), por nivel de actividad, operación y total de pacientes previstos en el protocolo [1].
Los modelos adoptados para las corridas del Microshield versión 5.03 tuvieron los aspectos comunes siguientes:
o Contribución de todas las emisiones de fotones del ![]() .
.
o Factor de acumulación en el blindaje.
o Densidad de la fuente igual a la del agua (1 g/cm 3 ).
o Ley del decaimiento radiactivo (cálculo de la actividad real del ![]() para las operaciones posteriores a la administración al paciente.
para las operaciones posteriores a la administración al paciente.
Para las operaciones de carga de la jeringuilla y la administración se consideró una fuente puntual a una distancia de 30 cm (longitud promedio del antebrazo [6]) y una duración de 2 min y 5 min, respectivamente y el empleo de un contenedor de 0,8 cm de plomo para la fuente, delantal plomado con 0,05 cm de espesor equivalente y un blindaje de 0,4 cm de tungsteno para la jeringuilla [8]. Se decidió emplear estos medios de protección a partir de un análisis costo-beneficio cualitativo [4], pues aunque estos estaban disponibles y no se requería de gastos para su compra, su empleo reduce la exposición, sobre todo el delantal, que no incrementa el tiempo de las operaciones ni las limita, al estar fabricado con materiales de poco peso. Es así que se estimó la utilidad del blindaje, para poder reducir el aporte de la radiación de frenado producida.
Para la TEFS se adoptó un tiempo de exposición de 5 min, utilizado en la ubicación del paciente, ya que una vez ejecutada esta operación, el trabajador permanece detrás de un blindaje (pared de hormigón) y a una distancia superior a un metro.
La contribución del muestreo de sangre a la dosis efectiva es también calculada para una fuente puntual, pero a una distancia de 45 cm y a una altura de 30 cm.
Cada paciente es transportado para su hospitalización después de 6 horas de la administración. Se modeló una fuente puntual a una distancia de 30 cm entre el paciente y el acompañante. Cada operación de transporte duró 20 min aproximadamente.
Se evaluó la exposición del personal paramédico en el hospital considerando una fuente puntual a 30 cm de distancia e igual valor de altura y una permanencia de 30 min en esas condiciones por siete ocasiones.
La dosis equivalente en manos se determina de igual forma que para E, pero sólo para las operaciones de carga de la jeringuilla y la administración.
Para la carga de la jeringuilla, la fuente se representa como un cilindro de 2,3 cm de diámetro y 2,5 cm de altura (bulbo tipo «para penicilina» [5]), introducido en un contenedor de 0,8 cm espesor de plomo. Se estimó que la exposición duró 2 min.
Para la administración se consideró la misma geometría, pero un blindaje para la jeringuilla de 0,4 cm de tungsteno [8] y una duración de la operación de 5 min.
Vigilancia Radiológica
En el ensayo sólo se trataron 12 pacientes del total de 15 planificados. Cinco trabajadores y cuatro miembros del público fueron controlados. Se emplearon los dosímetros electrónicos de lectura directa DOSICARD de la firma Eurisys Mesures junto con la dosimetría certificada (TLD) del Centro de Protección e Higiene de las Radiaciones (CPHR). Los DOSICARD registran la dosis equivalente personal profunda (Hp(10)) en un intervalo de 1 µSv a 10 mSv y tasas de dosis hasta 1Sv/h. El nivel de registro de los dosímetros TLD es 100 µSv hasta 10 Sv. En ambos casos se mide Hp(10) por radiación fotónica con energías desde 50 Kev en el primer caso y 15 Kev en el segundo, hasta 2 MeV. Sin embargo, con los DOSICARD se puede disponer de la distribución temporal de las dosis y tasas de dosis, facilitando el estudio de las operaciones de mayor aporte. La dosis equivalente en manos se midió por TLD, también del CPHR.
Se considera que Hp(10) es igual a E para el tipo de radiación y nivel de energías de las emisiones del ![]() [9].
[9].
Comparación de los resultados
Para poder comparar los resultados de la exposición total debida al ensayo clínico, se sumaron los valores medidos de E y Hp(0.07) por cada paciente tratado, como si todas las operaciones se hubieran ejecutado por la misma persona.
Resultados y discusión
Los resultados de los cálculos de la exposición estimada se muestran para cada operación por paciente y para el total de pacientes planificado, y en lo adelante se nombran como «dosis proyectadas».
La tabla 1 refleja las dosis efectivas proyectadas para cada operación. Se identificó que la transportación y hospitalización de los pacientes administrados tendrían la mayor contribución a la dosis efectiva.
Los valores de Hp(0.07) se muestran en las tablas 2 y 3. Se corroboró que la administración a los pacientes es la operación más significativa para las dosis equivalentes en manos.
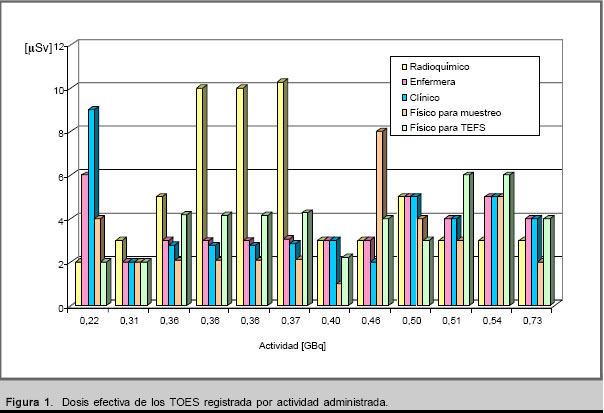
Los datos aportados por la vigilancia radiológica durante el ensayo se presentan gráficamente. La figura 1 muestra las dosis efectivas registradas para los TOES por nivel de actividad administrada a los pacientes.
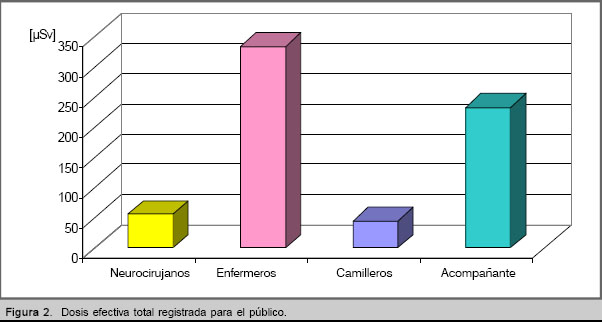
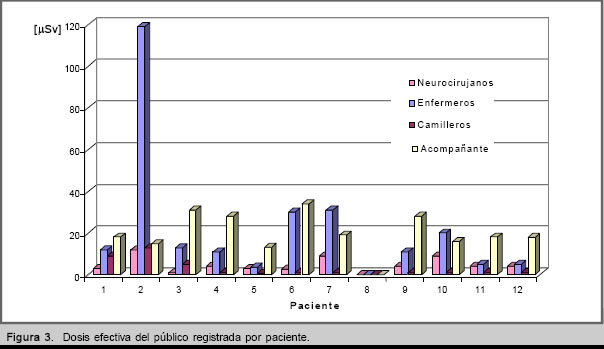
Los resultados para el público se reflejan en las figuras 2-3. En los casos de la enfermera del hospital y del camillero de la ambulancia, se mide una dosis colectiva, ya que dos enfermeras trabajan por día y para cada operación de transportación labora un trabajador diferente. Los valores máximos de E se registraron para el segundo paciente, los cuales se aprecian en la figura 2. En este caso la actividad administrada (0,5 GBq) no es la máxima para el ensayo; pero el estado clínico del paciente implicó el incremento del tiempo de exposición del personal de la salud.
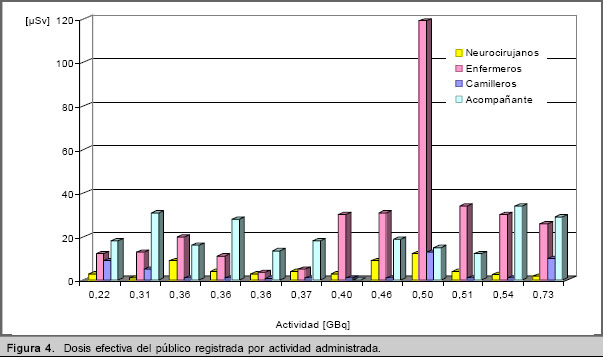
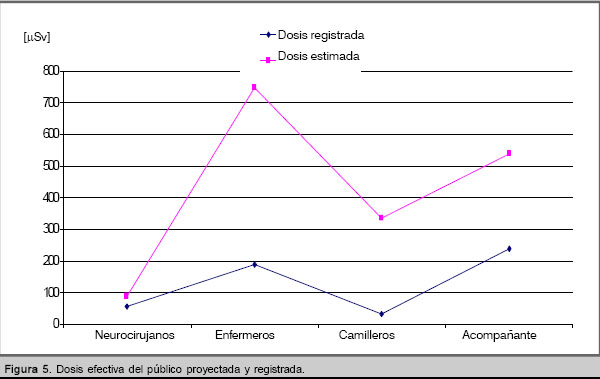
La dosis efectiva total proyectada para el ensayo es igual a 1,71 mSv, sin embargo la E total medida es 0,75 mSv. En la figura 4 se reflejan los valores de E proyectada y E medida para cada miembro del público. Al comparar los resultados de la figura 1 con los valores correspondientes de la tabla 1, se aprecia que los trabajadores también recibieron una dosis efectiva inferior a la proyectada.
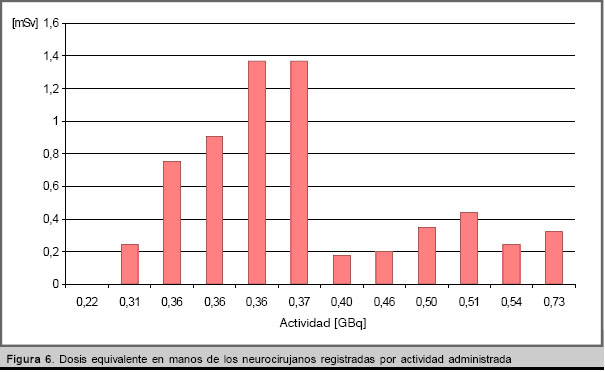
La dosis equivalente en manos total medida para el ensayo y obtenida a partir de la suma de las de los tres neurocirujanos, es 6,37 mSv. Este valor es superior a la Hp(0.07) total estimada (4,31 mSv). La distribución de Hp(0.07), según la actividad manipulada se presenta en la figura 6. Las desviaciones con respecto al volumen a administrar (valor promedio igual a 3,8 mL) y el empleo del dosímetro para extremidades en otras operaciones con el paciente, determinan la diferencia de las mediciones con respecto a los valores calculados.
El ajuste de las variables vinculadas con la obtención del radioinmunoconjugado y la decisión de mantener el nivel de actividad para que la respuesta al tratamiento presente mejores resultados [10], determinan las desviaciones que se observan con respecto a la planificación de la actividad a admi nistrar durante el ensayo. Es así que se tratan seis pacientes con el primer nivel previsto (se considera ± 20% de desviación), cuatro en el segundo y uno en el tercero, siendo la actividad máxima administrada igual a 0,73 GBq. El primer paciente recibe una actividad inferior a la mínima programada.
Si bien este comportamiento determina que la exposición del personal sea inferior a la estimada inicialmente para todo el estudio, se puede afirmar que el cumplimiento de los procedimientos de seguridad [11] es un factor que también se debe considerar. Las dosis medidas para los TOES son como mínimo 50% inferiores a las estimadas (se toma como referencia al radioquímico, por ser el más expuesto). Para el público se obtiene igual comportamiento, pero 37% por debajo de lo proyectado, con respecto al neurocirujano.
A diferencia de lo que se podía esperar por la dependencia lineal entre la exposición y la actividad manipulada, el paciente que mayor aporte tiene en los valores registrados fue el que conllevó una mayor atención y proximidad del personal.
En el protocolo [2] se adopta una restricción de dosis efectiva anual de 6 mSv para los TOES y 0,2 mSv para el público. Los resultados permiten afirmar que si la RIT con ![]() se llegara a establecer como una práctica, este objetivo se puede cumplir, pues aún cuando se considere que todas las operaciones las realice la misma persona en un año, lo cual sobrestima la exposición, se podría ejecutar este tratamiento a 45 pacientes en ese período.
se llegara a establecer como una práctica, este objetivo se puede cumplir, pues aún cuando se considere que todas las operaciones las realice la misma persona en un año, lo cual sobrestima la exposición, se podría ejecutar este tratamiento a 45 pacientes en ese período.
Los valores de Hp(0.07) no presentan una distribución semejante a E. Se obtiene el valor máximo (1,37 mSv) para pacientes con la actividad empleada en la mayoría de los casos (0,36 GBq) y que no requirieron manipulaciones adicionales del personal.
Conclusiones
Se demostró que la dosis efectiva total deTOES y público registrada para la primera fase del ensayo clínico del ![]() h-R3 marcado con
h-R3 marcado con ![]() es sólo 44% de la exposición total proyectada.
es sólo 44% de la exposición total proyectada.
Aunque se consideró que todas las operaciones del ensayo fueron realizadas por una sola persona, la exposición aportada por el estudio es aceptablemente baja.
Las dosis efectivas máximas registradas fueron recibidas por el personal paramédico del hospital donde se internaron los pacientes. La actividad administrada y el estado clínico de estos últimos determinaron la exposición del personal.
Referencias Bibliográficas
[1] JEONG JM, CHENG JK. Therapy with 188 Re-Labeled Radiopharmaceuticals: An Overview of Promising Results from Initial Clinical Trials. Cancer Biother. Radiopharm. 2003; 18(5): 707-17.
[2] CASACÓ A, IZNAGA N. Protocolo de la Primera Fase del Ensayo Clínico del Anticuerpo Monoclonal Humanizado h-R3 Marcado con 188 Re. La Habana: Centro de Inmunología Molecular, 2001.
[3] Organismo Internacional de Energía Atómica. Evaluación de la exposición ocupacional debida a fuentes externas de radiación. Colección de Normas de Seguridad. Guía de Seguridad No. RS-G-1.3. Viena: IAEA, 2004.
[4] Organismo Internacional de Energía Atómica. Optimización de la Protección Radiológica en el Control de la Exposición Ocupacional. Colección de Informes de Seguridad No. 21. Viena: IAEA, 2004.
[5] Centro Nacional de Seguridad Nuclear. Resolución 33/ 2001: Guía para la Implementación de los Reglamentos de Seguridad en la Práctica de la Medicina Nuclear. La Habana: CNSN, 2001.
[6] DELACROIX D, GUERRE JP, LEBLANC P, HICKMAN C. Radionuclide and Radiation Protection Data Handbook 2002. Radiat. Protect. Dosim. 2002; 98: 1-168.
[7] A FTI Company. Grove Engineering [software]. Microshield Versión 5.03. 1998.
[8] Pinestar Technology Catalogue. PRO-TEC PET, Inc. PA, 16125. 2002. p. 44. Available from: http://www.pinesta.com[ STANDARDIZEDENDPARAG]
[9] CHRISTENSEN P, JULIUS HW, MARSHALL TO. Technical Recommendations For Monitoring Individuals Occupationally Exposed To External Radiation. Radiation Protection 73, Report EUR-14852. Luxembourg: European Comision, 1994.
[10] CASACÓ A, LÓPEZ G, GARCÍA I, et. al. Clinical study. Phase I single-dose study of intracavitary-administered Nimotuzumab labeled with 188Re in adult recurrent high-grade glioma. Cancer Biol Ther. 2008; 7(3): 1-6.
[11] Centro de Isótopos. Departamento de Seguridad Radiológica. Código de Prácticas Radiológicas para las Operaciones con 188 Re en el Centro de Investigaciones Médico Quirúrgicas. La Habana: CENTIS, 2002.
Recibido: 3 de septiembre de 2008. Aceptado: 14 de mayo de 2009.