Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Nucleus
versión impresa ISSN 0864-084X
Nucleus n.45 Ciudad de La Habana ene.-jun. 2009
CIENCIAS NUCLEARES
Caracterización de la formulación de ![]() -Macroagregados de albúmina
-Macroagregados de albúmina
Characterization of ![]() - macroaggregates formulation
- macroaggregates formulation
Alejandro Rivero Santamaría 1 , Yumisley Alfonso Marín 2 , Francisco Zayas Crespo 2 , Niurka Mesa Dueñas 2 , Rolando Rodríguez Fernandez 2
1 Instituto Superior de Tecnologías y Ciencias Aplicadas (InSTEC) Ave. Salvador Allende, esq. Luaces, Plaza, Ciudad de La Habana, Cuba
2 Instituto de Nefrología (INEF) "Abelardo Buch López"
RESUMEN
En este trabajo se realizó la caracterización del proceso de formación y marcaje de los macroagregados de albúmina (MAA) con ![]() . Con este fin se efectuaron estudios comparativos para establecer el papel de la desnaturalización en presencia del
. Con este fin se efectuaron estudios comparativos para establecer el papel de la desnaturalización en presencia del ![]() durante la formulación de
durante la formulación de ![]() -Sn-MAA, para ello se utilizaron tres formulaciones. Se realizó un análisis estructural cualitativo de la albúmina sérica humana para describir el sistema a través de un modelo gráfico. Los resultados mostraron diferencias importantes en el comportamiento radioquímico de las tres formulaciones. La formulación de
-Sn-MAA, para ello se utilizaron tres formulaciones. Se realizó un análisis estructural cualitativo de la albúmina sérica humana para describir el sistema a través de un modelo gráfico. Los resultados mostraron diferencias importantes en el comportamiento radioquímico de las tres formulaciones. La formulación de ![]() -Sn-MAA (A) mostró un comportamiento superior, con purezas radioquímicas cercanas a 95% en los tiempos estudiados y una disociación inferior al 20% en 24 h.El modelo gráfico permitió explicar, a través de sencillas representaciones, los procesos involucrados en el sistema estudiado, permitiendo una mejor comprensión de este.
-Sn-MAA (A) mostró un comportamiento superior, con purezas radioquímicas cercanas a 95% en los tiempos estudiados y una disociación inferior al 20% en 24 h.El modelo gráfico permitió explicar, a través de sencillas representaciones, los procesos involucrados en el sistema estudiado, permitiendo una mejor comprensión de este.
ABSTRACT
The aim of this paper was to study the formation and radiolabelling of 99m Tcalbumin macroaggregates. Comparatives studies of three formulations to establish the role of denaturalization and ![]() in the formulation of
in the formulation of ![]() -Sn-MAA were carried out. A qualitative structural analysis of human serum albumin was performed in order to give a description of the studied system using a graph model. The results showed important differences in the radiochemical behavior of the three formulations.
-Sn-MAA were carried out. A qualitative structural analysis of human serum albumin was performed in order to give a description of the studied system using a graph model. The results showed important differences in the radiochemical behavior of the three formulations. ![]() -Sn-MAA (A) formulation had the best behavior, with radiochemical purity close to 95% and dissociation below 20% after 24 h of being radiolabeled. The graph model explained with simple representations the process involved in the studied system;thus allowing a better knowledge of it.
-Sn-MAA (A) formulation had the best behavior, with radiochemical purity close to 95% and dissociation below 20% after 24 h of being radiolabeled. The graph model explained with simple representations the process involved in the studied system;thus allowing a better knowledge of it.
Key words: albumins, technetium 99, labelling, tin, comparative evaluations, centrifugation, chromatography, protein denaturation
1. Introducción
El uso de radiofármacos basados en la albúmina sérica humana (ASH) para evaluar la perfusión pulmonar se remonta a 1963. En ese año Taplin y col. [1] utilizaron la ASH como materia prima y desarrollaron macroagregados de albúmina (MAA) marcados con ![]() (
( ![]() -MAA). Tres años después en 1966, Paoli y cols. [2] formularon por primera vez el
-MAA). Tres años después en 1966, Paoli y cols. [2] formularon por primera vez el ![]() -MAA, que en corto tiempo se establecería como el radiofármaco de elección para evaluar la perfusión pulmonar.
-MAA, que en corto tiempo se establecería como el radiofármaco de elección para evaluar la perfusión pulmonar.
En la actualidad y a pesar del desarrollo de técnicas como la Tomografía Axial Computarizada (TAC) y la Resonancia Magnética Nuclear (RMN), se continúa utilizando la gammagrafía pulmonar en el diagnóstico del tromboembolismo pulmonar [3].
La producción y marcaje de los MAA se realiza desde el siglo pasado y su aplicación médica es muy conocida. Las premisas en su formulación parten de la obtención de una suspensión de partículas marcadas con el tamaño apropiado que permitan la visualización mediante gammagrafía de la perfusión pulmonar. Sin embargo, muchos de los factores que intervienen en el mecanismo de formación de los MAA a partir de la ASH y que pueden condicionar su comportamiento ante el marcaje con ![]() no han sido estudiados o dilucidados.
no han sido estudiados o dilucidados.
Este trabajo tiene como objetivo estudiar el sistema ASH- ![]() -MAA con el fin de demostrar que el proceso de desnaturalización en presencia de
-MAA con el fin de demostrar que el proceso de desnaturalización en presencia de ![]() de la ASH es determinante en el comportamiento radioquímico de los
de la ASH es determinante en el comportamiento radioquímico de los ![]() -MAA.
-MAA.
2. Materiales y métodos
2.1 Materiales
Los experimentos realizados se llevaron a cabo con solución de ASH al 20%, suministrada por el Centro de Hemoderivados de Ciudad de La Habana. La solución de ![]() -pertecnectato de sodio fue suministrada por el Centro de Isotopos (CENTIS). Los demás reactivos utilizados fueron de calidad analítica.
-pertecnectato de sodio fue suministrada por el Centro de Isotopos (CENTIS). Los demás reactivos utilizados fueron de calidad analítica.
2.2 Preparación
Se prepararon tres soluciones de concentraciones 2 mg/mL de ASH y 20 mg/mL de acetato de sodio en 25 mL de volumen final. Dos de ellas contenían 0,14 mg/ml de ![]() (solución A y solución C). La otra no contenía
(solución A y solución C). La otra no contenía ![]() . (solución B). En todos los casos el pH final fue 5,5.
. (solución B). En todos los casos el pH final fue 5,5.
Las tres soluciones se filtraron a través de un filtro 0,22 µm a frascos estériles de 30 mL. Los frascos que contenían las soluciones A y B se sometieron a un proceso de desnaturalización controlada en un baño de agua a 78°C y agitación circular de 200 rpm durante 8 min.
La mezcla obtenida tras la desnaturalización térmica fue centrifugada a 800 rpm durante 15 min. Concluida la centrifugación se extrajo el sobrenadante y se enrasó a 25 mL con SSFE. Por último, se dispensó 1 mL de la suspensión de MAA en frascos estériles y se almacenaron a 4°C.
El frasco que contenía C fue agitado durante 8 min a 200 rpm, concluida la centrifugación se dispensaron frascos estériles que contenían 1 mL de la mezcla y se almacenaron a 4°C
2.3 Radiomarcación
La radiomarcación se realizó añadiendo 370 MBq de ![]() , a los frascos que contenían 1 mL de las mezclas A (
, a los frascos que contenían 1 mL de las mezclas A ( ![]() -Sn-MAA), B (
-Sn-MAA), B ( ![]() -MAA) y C (
-MAA) y C ( ![]() -Sn- ASH).
-Sn- ASH).
2.4 Controles de calidad
2.4.1 Control de la pureza radioquímica ![]() -Sn-MAA
-Sn-MAA
La determinación de la pureza radioquímica se realizó combinando la cromatografía de papel ascendente (CPA) para la determinación del ![]() libre y la centrifugación para la determinación de
libre y la centrifugación para la determinación de ![]() - MAA,
- MAA, ![]() -Sn-coloidal,
-Sn-coloidal, ![]() -MiA [4] [5].
-MiA [4] [5].
Se aplicó 1 µL de ![]() -Sn-MAA sobre tiras de papel (0,5 x 5
-Sn-MAA sobre tiras de papel (0,5 x 5 ![]() ) Whatman N°1 y se desarrollaron utilizando SSFE y acetona como solventes. Terminado el desarrollo del cromatograma se secaron las tiras en una estufa a 80°C. A continuación se cortaron por el punto medio y se contó la radiactividad de cada fracción de papel en un contador gamma automático (Clinigamma 1272, LKB-Wallac). Los resultados se expresaron como porcentaje de la radiactividad asociada al punto de aplicación.
) Whatman N°1 y se desarrollaron utilizando SSFE y acetona como solventes. Terminado el desarrollo del cromatograma se secaron las tiras en una estufa a 80°C. A continuación se cortaron por el punto medio y se contó la radiactividad de cada fracción de papel en un contador gamma automático (Clinigamma 1272, LKB-Wallac). Los resultados se expresaron como porcentaje de la radiactividad asociada al punto de aplicación.
Se mezclaron 200 µL de ![]() -Sn-MAA con 1,5 mL de SSFE en un vial, se agitó y centrifugó a 800 rpm por 15 min, se midió la radiactividad total del vial, se extrajo el sobrenadante y se volvió a medir en ambos casos utilizando un calibrador de dosis (CAPINTEC). Los resultados se expresaron como porcentaje de la radiactividad asociada al centrifugado.
-Sn-MAA con 1,5 mL de SSFE en un vial, se agitó y centrifugó a 800 rpm por 15 min, se midió la radiactividad total del vial, se extrajo el sobrenadante y se volvió a medir en ambos casos utilizando un calibrador de dosis (CAPINTEC). Los resultados se expresaron como porcentaje de la radiactividad asociada al centrifugado.
Se realizó un estudio de cinética de marcaje y estabilidad en el tiempo. Para esto se determinó la pureza radioquímica transcurridos 15 seg, 2, 5, 10, 20 y 30 minutos, 3 horas y 24 horas.
2.4.2 Control de la pureza radioquímica ![]() -Sn-ASH
-Sn-ASH
La determinación de la pureza radioquímica se realizó combinando la cromatografía de papel ascendente (CPA) utilizando Whatman N° 1 y la cromatografía en columna con geles de Sephadex [6] [7].
Se aplicó 1 µL de ![]() -Sn-ASH sobre tiras de papel (0,5 x 5 cm 2 ) Whatman N° 1 y se desarrollaron utilizando SSFE y acetona como solventes. A continuación se siguió el procedimiento descrito en el epígrafe 2.4.1.
-Sn-ASH sobre tiras de papel (0,5 x 5 cm 2 ) Whatman N° 1 y se desarrollaron utilizando SSFE y acetona como solventes. A continuación se siguió el procedimiento descrito en el epígrafe 2.4.1.
La determinación de la fracción de radiocoloides presente en la formulación se efectuó por medio de cromatografía en columna en gel de Sephadex G-25 M. Con este fin se utilizó una columna comercial PD-10 (Pharmacia) o su equivalente hecha en el propio laboratorio. Se aplicó sobre la columna cerrada un volumen de radiofármaco que contenía 5,5-7,4 MBq y se midió la radiactividad en un activímetro. Seguidamente se quitó el tapón del fondo de la columna y se lavó con 20 mL de SSFE. Terminado el lavado y con la columna seca, se tapó nuevamente esta, y se determinó la radiactividad residual, la que se expresó en porcentaje de la radiactividad inicial.
Se realizó un estudio de cinética de marcaje y estabilidad en el tiempo según lo descrito en el epígrafe 2.4.1.
2.4.3 Estudio de la fortaleza del enlace ![]() -Sn-MAA y
-Sn-MAA y ![]() -ASH
-ASH
Se tomaron alícuotas de 0,1 mL de cada radiofármaco equivalentes a 300 µg de proteína y se pusieron en contacto con 0,9 mL de sangre total. Las mezclas se agitaron y a continuación se incubaron durante 24 horas a 37°C. Transcurridas las primeras 3 horas se tomaron muestras para desarrollar CPA en SSFE, seguidamente se determinó el porcentaje de radiactividad asociado al frente del cromatograma, al cual correspondió el porcentaje de disociación del producto en el medio. Este procedimiento se repitió a las 24 horas.
3. Resultados y Discusión
3.1 Papel de la desnaturalización en el marcaje con ![]() . Comparación A y C
. Comparación A y C
Los resultados del estudio de la cinética y estabilidad del marcaje mostraron que existen apreciables diferencias en el comportamiento ante el marcaje con ![]() de ambas formulaciones.
de ambas formulaciones.
La figura 1 muestra que a los 15 segundos, aproximadamente 95% de la actividad está enlazada a la formulación A ( ![]() -Sn-MAA), y este valor se mantiene estable durante 24 h. Este resultado demuestra que el proceso de marcaje de los MAA con
-Sn-MAA), y este valor se mantiene estable durante 24 h. Este resultado demuestra que el proceso de marcaje de los MAA con ![]() es extremadamente rápido y su estabilidad en el tiempo es elevada. La literatura existente no reporta estudios de este tipo para tiempos como los mostrados. Sin embargo, los resultados a 30 min, 3 y 24 h coinciden con los reportados por numerosos autores [8] [4] [9], teniendo en cuenta que en nuestro estudio la pureza radioquímica considera para su cálculo los porcentajes de
es extremadamente rápido y su estabilidad en el tiempo es elevada. La literatura existente no reporta estudios de este tipo para tiempos como los mostrados. Sin embargo, los resultados a 30 min, 3 y 24 h coinciden con los reportados por numerosos autores [8] [4] [9], teniendo en cuenta que en nuestro estudio la pureza radioquímica considera para su cálculo los porcentajes de ![]() -Sn-coloidal y
-Sn-coloidal y ![]() - Microagregados además del
- Microagregados además del ![]() libre, ya que los dos primeros no se tuvieron en cuenta en la generalidad de los reportes, pues se aplican procedimientos de control de calidad que no separan a estas impurezas radioquímicas del
libre, ya que los dos primeros no se tuvieron en cuenta en la generalidad de los reportes, pues se aplican procedimientos de control de calidad que no separan a estas impurezas radioquímicas del ![]() -Sn-MAA
-Sn-MAA
El valor de la pureza radioquímica de la formulación C ( ![]() -Sn-ASH) a los 15 segundos es aproxima- damente 59%, que aumenta progresivamente hasta alcanzar un máximo de 77% a los 30 min y posteriormente disminuye lentamente en un periodo de 20 horas manteniéndose a las 24 horas 70% de proteína marcada.
-Sn-ASH) a los 15 segundos es aproxima- damente 59%, que aumenta progresivamente hasta alcanzar un máximo de 77% a los 30 min y posteriormente disminuye lentamente en un periodo de 20 horas manteniéndose a las 24 horas 70% de proteína marcada.
Estos resultados indican que el proceso de desnaturalización al que se somete la ASH para la producción de MAA es determinante en el comportamiento de estos una vez marcados con ![]() . La expresión de nuevos sitios de coordinación debido al desplegamiento irreversible de la proteína a 78°C [10], influye significativamente en que se produzca una rápida incorporación del
. La expresión de nuevos sitios de coordinación debido al desplegamiento irreversible de la proteína a 78°C [10], influye significativamente en que se produzca una rápida incorporación del ![]() reducido a la proteína desnaturalizada.
reducido a la proteína desnaturalizada.
El comportamiento de la proteína en su estado nativo es completamente diferente debido a la existencia de menos sitios disponibles para enlazar al ![]() reducido lo que provoca un marcaje más lento y favorece la generación de impurezas radioquímicas como el
reducido lo que provoca un marcaje más lento y favorece la generación de impurezas radioquímicas como el ![]() y el
y el ![]() -Sn-coloidal.
-Sn-coloidal.
3.1.2 Fortaleza de enlace
Los estudios de incubación «in vitro» con sangre total de las formulaciones marcadas reafirmaron los resultados del estudio cinético.
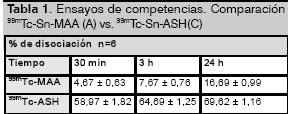
La tabla 1 muestra que a los 30 min el porcentaje de disociación de la formulación de ![]() -Sn-MAA es muy pequeño y solo equivale aproximadamente al 5% de la actividad enlazada, a las 24 h la disociación alcanzó un valor de 17%, en ambos casos los valores coincidieron con los reportados por Hunt y cols. [4] los cuales refieren una disociación de 4% y 17% a los 30 min y 24 h respectivamente después de marcados los MAA.
-Sn-MAA es muy pequeño y solo equivale aproximadamente al 5% de la actividad enlazada, a las 24 h la disociación alcanzó un valor de 17%, en ambos casos los valores coincidieron con los reportados por Hunt y cols. [4] los cuales refieren una disociación de 4% y 17% a los 30 min y 24 h respectivamente después de marcados los MAA.
El comportamiento de la ASH marcada mostró una disociación elevada de la formulación a los 30 min después de incubadas las muestras. Este resultado indica que el enlace ![]() -reducido-ASH es más débil y por ello se favorece en una mayor magnitud la transquelación hacia los agentes quelatantes presentes en la sangre humana.
-reducido-ASH es más débil y por ello se favorece en una mayor magnitud la transquelación hacia los agentes quelatantes presentes en la sangre humana.
En cambio para el ![]() -Sn-MAA, los pequeños valores de disociación señalan que los enlaces
-Sn-MAA, los pequeños valores de disociación señalan que los enlaces ![]() - reducido-Sn-MAA poseen una fortaleza mayor, debido posiblemente a que se involucran una mayor diversidad de sitios de coordinación fuertes, originados durante el proceso de desnaturalización a través de la exposición de nuevos sitios potenciales para el enlace del radisótopo, confiriéndole al enlace 99m Tc-MAA mayor fortaleza y estabilidad.
- reducido-Sn-MAA poseen una fortaleza mayor, debido posiblemente a que se involucran una mayor diversidad de sitios de coordinación fuertes, originados durante el proceso de desnaturalización a través de la exposición de nuevos sitios potenciales para el enlace del radisótopo, confiriéndole al enlace 99m Tc-MAA mayor fortaleza y estabilidad.
3.2 Papel del estaño en la formulación de ![]() -Sn-MAA. Comparación A y B
-Sn-MAA. Comparación A y B
3.2.1 Cinética de marcaje
El estudio comparativo realizado para evaluar la importancia de la presencia del ![]() durante el proceso de desnaturalización de la HSA y el marcaje de los MAA, indicó que existían diferencias apreciables en el comportamiento de las dos formulaciones estudiadas.
durante el proceso de desnaturalización de la HSA y el marcaje de los MAA, indicó que existían diferencias apreciables en el comportamiento de las dos formulaciones estudiadas.
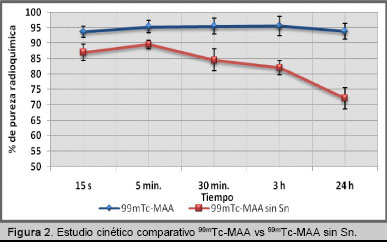
La figura 2 muestra que la formulación que no incluyó el Sn inicialmente en el proceso de desnaturalización alcanzó a los 15 s una pureza radioquímica de 87%, valor que resultó diferente al obtenido con la otra formulación la cual alcanzó un valor de 94% en el mismo tiempo. En el intervalo de 0-5 min se observa un crecimiento similar de la pureza radioquímica de ambas formulaciones, sin embargo, en el intervalo de 5-30 min se produce un decrecimiento apreciable de este parámetro para la formulación ![]() - MAA sin Sn, comportamiento que se mantiene hasta alcanzar a las 24 h un valor de 72%. La otra formulación mostró una estabilidad elevada en el tiempo, manteniéndose esta durante las 24 h, oscilando entre 93-96%.
- MAA sin Sn, comportamiento que se mantiene hasta alcanzar a las 24 h un valor de 72%. La otra formulación mostró una estabilidad elevada en el tiempo, manteniéndose esta durante las 24 h, oscilando entre 93-96%.
Estos resultados demuestran que la presencia de ![]() en el proceso de desnaturalización de la ASH es fundamental para la obtención de formulaciones con elevada pureza radioquímica y estables en el tiempo. Además indican que la cantidad de sitios disponibles para coordinar el
en el proceso de desnaturalización de la ASH es fundamental para la obtención de formulaciones con elevada pureza radioquímica y estables en el tiempo. Además indican que la cantidad de sitios disponibles para coordinar el ![]() es menor cuando el
es menor cuando el ![]() no participa en la desnaturalización por lo que la cantidad de impurezas coloidales y
no participa en la desnaturalización por lo que la cantidad de impurezas coloidales y ![]() aumenta considerablemente generando un radiofármaco de inferior calidad.
aumenta considerablemente generando un radiofármaco de inferior calidad.
A este hecho se refieren en la patente norteamericana 6730286 «Manufacturing process to control particle size» [5], donde los autores plantean que la presencia de ![]() en el proceso previo a la desnaturalización debe disminuir las posibilidades de que este ion se oxide, además de permitir que el
en el proceso previo a la desnaturalización debe disminuir las posibilidades de que este ion se oxide, además de permitir que el ![]() se incorpore dentro de la estructura interna y externa del MAA, permitiendo la obtención de un radiofármaco de mayor calidad.
se incorpore dentro de la estructura interna y externa del MAA, permitiendo la obtención de un radiofármaco de mayor calidad.
3.2.2. Fortaleza de enlace
Los resultados de esta comparación reafirmaron los datos obtenidos en el estudio cinético.
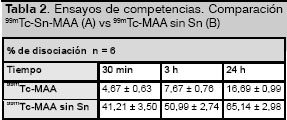
La tabla 2 muestra las diferencias notables que existen en el comportamiento de una y otra formulación. La disociación de la formulación donde no se incluyó el ![]() en el proceso de desnatu ralización mostró una disociación de 41% a los 30 min, valor apreciablemente diferente al obtenido con la otra formulación que solo se disoció en 5% en el mismo tiempo. Ambas formulaciones continuaron disociándose en el transcurso del tiempo pero la formulación
en el proceso de desnatu ralización mostró una disociación de 41% a los 30 min, valor apreciablemente diferente al obtenido con la otra formulación que solo se disoció en 5% en el mismo tiempo. Ambas formulaciones continuaron disociándose en el transcurso del tiempo pero la formulación ![]() -MAA sin
-MAA sin ![]() presentó un crecimiento mucho más acelerado llegando a 65% a las 24 h de comenzado el experimento, valor que contrasta con 17% obtenido en la formulación
presentó un crecimiento mucho más acelerado llegando a 65% a las 24 h de comenzado el experimento, valor que contrasta con 17% obtenido en la formulación ![]() -MAA.
-MAA.
Este resultado confirma que el enlace del ![]() reducido a los sitios de coordinación en los MAA está menos favorecido cuando el
reducido a los sitios de coordinación en los MAA está menos favorecido cuando el ![]() no se incluye en el proceso de desnaturalización, además, que este es más débil y menos estable, lo que implica que en presencia de agentes quelatantes la disociación se produce fácilmente.
no se incluye en el proceso de desnaturalización, además, que este es más débil y menos estable, lo que implica que en presencia de agentes quelatantes la disociación se produce fácilmente.
3.3 Análisis estructural molecular cualitativo de la ASH
La ASH es una proteína cuya estructura es mayormente helicoidal por lo que un análisis de su estructura primaria (secuencia lineal de aminoácidos) puede proveer datos bastante cercanos sobre la distribución de los sitios cargados en la molécula nativa.
Aunque el proceso de desnaturalización de proteínas ocurre de forma compleja, generándose múltiples arreglos de la proteína desnaturalizada, para la ASH el proceso transcurre a través de un desplegamiento progresivo de los dominios de la proteína nativa a medida que aumenta la temperatura alcanzándose el desplegamiento irreversible a T>75°C.
Es por esta causa que la distribución de los cluster cargados en la estructura primaria de aminoácidos de la proteína, antes de la desnaturalización, debiera ser bastante cercana a la distribución tras la desnaturalización, ya que el desplegamiento no separaría a la gran mayoría de estos cluster.
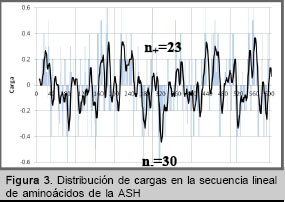
Partiendo de este hecho se construyó un gráfico de distribución de cargas según la posición en la secuencia lineal de aminoácidos de la proteína nativa.
La figura 3 muestra una prevalencia de sitios de coordinación negativos en la proteína, la cual se debe acentuar a un pH por encima del punto isoeléctrico. Este hecho explicaría por qué cuando el ![]() está presente en la solución inicial de ASH disminuye la posibilidad de que este se oxide [5] pues se produciría un enlazamiento temprano del
está presente en la solución inicial de ASH disminuye la posibilidad de que este se oxide [5] pues se produciría un enlazamiento temprano del ![]() a los sitios de coordinación negativos presentes en la proteína, a través de un proceso que implicaría el traspaso del
a los sitios de coordinación negativos presentes en la proteína, a través de un proceso que implicaría el traspaso del ![]() enlazado al acetato presente en el medio hacia los sitios de coordinación de la ASH, garantizando que la mayoría del Sn se conserve en su estado reductor en esta primera etapa.
enlazado al acetato presente en el medio hacia los sitios de coordinación de la ASH, garantizando que la mayoría del Sn se conserve en su estado reductor en esta primera etapa.
La ASH posee,además, 17 puentes disulfuros. Esta cantidad de puentes favorece el proceso de agregación, ya que tras el sometimiento de la proteína a T = 78° C estos se rompen, dando lugar a la formación de grupos –SH libres los cuales interaccionan generando nuevos enlaces S-S entre proteínas desnaturalizadas y de esta manera forman los agregados moleculares.
La presencia de ![]() en este proceso debe favorecer la formación de los grupos -SH debido al carácter reductor del
en este proceso debe favorecer la formación de los grupos -SH debido al carácter reductor del ![]() , acentuado este efecto a la temperatura en la que se trabaja, así como su coordinación en algunos de estos grupos –SH libres que no participan directamente en el proceso de agregación molecular.
, acentuado este efecto a la temperatura en la que se trabaja, así como su coordinación en algunos de estos grupos –SH libres que no participan directamente en el proceso de agregación molecular.
3.4 Modelo propuesto
3.4.1 Primera etapa. Preparación de la solución
La ASH en su estado nativo en solución de acetato de sodio y ![]() a un pH = 5,5, es capaz de coordinar átomos de
a un pH = 5,5, es capaz de coordinar átomos de ![]() utilizando los sitios nucleofílicos presentes en su superficie molecular.
utilizando los sitios nucleofílicos presentes en su superficie molecular.
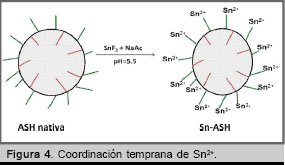
El proceso debe transcurrir por la transferencia del Sn en su forma reducida (![]() ) del complejo Sn-Acetato hacia complejos de forma
) del complejo Sn-Acetato hacia complejos de forma ![]() -
-![]() o
o ![]() + -COO - ,
+ -COO - , ![]() -SH y
-SH y ![]() + -OH en la superficie de la proteína.
+ -OH en la superficie de la proteína.
3.4.2 Segunda etapa. Desnaturalización
La temperatura utilizada para la formulación T = 78°C garantiza que la proteína desarrolle un desplegamiento irreversible, de modo que se expresan nuevos sitios de coordinación que anteriormente no existían, ya que se encontraban en su estructura interna (sitios hidrofóbicos). Estos nuevos sitios de coordinación pueden completar el acomplejamiento del ![]() presente en la solución que se encuentra aún en forma de complejo
presente en la solución que se encuentra aún en forma de complejo ![]() -Acetato.
-Acetato.
Esta etapa sería determinante en el posterior comportamiento de los MAA frente al ![]() , pues la presencia del
, pues la presencia del ![]() garantiza que este se acompleje en todos los sitios de coordinación disponibles de la estructura de los MAA, es decir, tanto en los sitios inicialmente internos como en los sitios de coordinación en la superficie. Si el
garantiza que este se acompleje en todos los sitios de coordinación disponibles de la estructura de los MAA, es decir, tanto en los sitios inicialmente internos como en los sitios de coordinación en la superficie. Si el ![]() no está presente durante el proceso de desnaturalización, el enlazamiento posterior de este al MAA estará limitado a los sitios de coordinación en la superficie de estos últimos, debido a los impedimentos que pueden surgir causados por la estructura extremadamente compleja del MAA.
no está presente durante el proceso de desnaturalización, el enlazamiento posterior de este al MAA estará limitado a los sitios de coordinación en la superficie de estos últimos, debido a los impedimentos que pueden surgir causados por la estructura extremadamente compleja del MAA.

También hay que señalar que en esta etapa el ![]() juega un papel importante en el rompimiento de algunos de los puentes disulfuros, generando sitios adicionales para la agregación de las proteínas y para la coordinación de otros átomos de
juega un papel importante en el rompimiento de algunos de los puentes disulfuros, generando sitios adicionales para la agregación de las proteínas y para la coordinación de otros átomos de ![]() en forma de
en forma de ![]() -S.
-S.
3.4.3 Tercera etapa. Marcaje
Una vez incorporado el ![]() al kit formulado, el
al kit formulado, el ![]() coordinado en los MAA reduce rápidamente al
coordinado en los MAA reduce rápidamente al ![]() a estados positivos según la siguiente ecuación:
a estados positivos según la siguiente ecuación:
![]()
Después de esta reducción, el ![]() en su forma de ion positivo ocuparía los sitios de coordinación que el Sn después de oxidado puede dejar libre. Sin embargo, también podría suceder una competencia entre el
en su forma de ion positivo ocuparía los sitios de coordinación que el Sn después de oxidado puede dejar libre. Sin embargo, también podría suceder una competencia entre el ![]() y el Tc-reducido por los centros disponibles para la coordinación e incluso podrían subsistir ambos metales en el complejo como plantean algunos autores [11] [12].
y el Tc-reducido por los centros disponibles para la coordinación e incluso podrían subsistir ambos metales en el complejo como plantean algunos autores [11] [12].
Nuestros resultados nos llevan a afirmar que de cualquier forma que suceda este proceso, la presencia de ![]() coordinado a los sitios nucleofílicos de la proteína disminuye notablemente la posibilidad de que aparezcan impurezas coloidales de
coordinado a los sitios nucleofílicos de la proteína disminuye notablemente la posibilidad de que aparezcan impurezas coloidales de ![]() o que subsista alguna cantidad
o que subsista alguna cantidad ![]() reoxidado. Al parecer, en el mismo lugar que se reduce el
reoxidado. Al parecer, en el mismo lugar que se reduce el ![]() se produce la coordinación del
se produce la coordinación del ![]() reducido a los MAA, lográndose un marcaje rápido y estable.
reducido a los MAA, lográndose un marcaje rápido y estable.

Además la presencia del ![]() en toda la estructura del MAA garantiza que los enlaces con el
en toda la estructura del MAA garantiza que los enlaces con el ![]() sean fuertes debido a que muchos de estos se encontrarán en el interior de la estructura del MAA, disminuyendo de esta forma la posibilidad de interacción con agentes quelatantes que pudieran competir por el
sean fuertes debido a que muchos de estos se encontrarán en el interior de la estructura del MAA, disminuyendo de esta forma la posibilidad de interacción con agentes quelatantes que pudieran competir por el ![]() reducido.
reducido.
4. Conclusiones
A partir de nuestros resultados y el análisis realizado podemos concluir que los cambios que se producen en el proceso de desnaturalización controlada de la ASH le confieren al MAA propiedades que favorecen su marcaje con ![]() . Además, que la presencia del
. Además, que la presencia del ![]() desde el inicio del proceso de formulación de los MAA propicia que el marcaje de estos sea de una elevada calidad.
desde el inicio del proceso de formulación de los MAA propicia que el marcaje de estos sea de una elevada calidad.
En este trabajo también se propuso un modelo teniendo en cuenta las características estructurales de la ASH que facilita la comprensión de los procesos involucrados en este sistema complejo y explica de forma sencilla los resultados de los estudios experimentales realizados.
Referencias Bibliográficas
[1] TAPLIN GV, et. al. Studies of radioalbumin aggregates for photoscanning the liver, spleen, lung and other organs. J. Nucl. Med. 1964; 5: 259.
[2] DE PAOLI T, HAGER A, NICOLINI JO. Albumin macroaggregates labelled with Tc 99. Appl Radiat. Isot. 1966; 17(9): 551-4.
[3] TUNARIU N, GIBBS SJR, et. al. Ventilation-Perfusion Scintigraphy Is More Sensitive than Multidetector CTPA in Detecting Chronic Thromboembolic Pulmonary Disease as a Treatable Cause of Pulmonary Hypertension. Nucl. Med. 2007; 48(5): 680-684.
[4] HUNT AP, FRIERA M, JOHNSONB RA, et. al. Preparation of Tc-99m-macroaggregated albumin from recombinant human albumin for lung perfusion imaging. Eur. J. Pharm. and Biopharm. 2006; 62: 26- 31.
[5] Manufacturing process to control particle size. United States Patent 6730286. 2004?
[6] LIN MS, KRUSE Sl, GOODWIN DA, et. al. Albumin loading effect: A pitfall in saline paper analysis of 99mTc albumin. Nucl. Med. 1974; 15:1018-1020.
[7] DELIGNY CL, GELSEMA WJ, BEUNIS MH. The influence of experimental conditions on the efficiency of labeling human serum albumin with 99mTc,using Sn(II) as the reductant. Appl. Radiat. Isot. 1976; 20: 241- 248.
[8] LYSTER DM, SCOFF JR, MINCEY EK, et. al. Preparation of a 99mTc-Sn-MAA kit for use in nuclear medicine. J. Nucl. Med. 1973; 15: 3.
[9] DJOKI D, JANKOVI D, MAKSIN T. Radiochemical purity and particles number determinations of modified 99mTc-macroaggregated albumin. J. Serb. Chem. Soc. 2002; 67(8-9): 573-579.
[10] REZAIE-TAVIRANI M, et. al. Conformational Study of HSA in Pre-denaturation Temperatures by Differential Scanning Calorimetry, Circular Dichroism and UV Spectroscopy. Biochem and Molec. Biol. 2006; 39(5): 530-536.
[11] DEUSTH E, ELDER R, LANGE B. Structural characteri- zation of a bridged 99-Tc-Sn-dimethylglyoxime complex: implications for the chemestry of 99m-Tc- radiopharmaceuticals prepared by Sn(II) reduction pertechnetate. Proc. Natl. Acad. Sci. USA . 1976; 73: 4287.
[12] STEIGMAN J, MEIKEN G, RICHARDS P. The reduction of pertechnetate-99 by stannous chloride-I. The stechiometry of reaction in HCl, in citrate buffer and in a DTPA. Appl. Radiat. Isot. 1978; 29: 653.
Recibido: 17 de febrero de 2009
Aceptado: 14 de mayo de 2009