Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Nucleus
versión impresa ISSN 0864-084X
Nucleus n.46 Ciudad de La Habana jul.-dic. 2009
CIENCIAS NUCLEARES
Determinación del contenido de zinc en arroz y otros agroproductos por fluorescencia de rayos X
ZINC content determination in rice and other agriproducts by x-ray fluorescence
Otoniel Denis Alpízar, Oscar Díaz Rizo
Instituto Superior de Tecnologías y Ciencias Aplicadas (InSTEC)
Ave. Salvador Allende y Luaces, POB 6163, Habana 10600, Cuba
odrizo@instec.cu
RESUMEN
Se reporta el contenido de zinc en alimentos de consumo regular en Cuba (arroz, algunos vegetales y raíces comestibles). Las concentraciones se determinan por fluorescencia de rayos X empleando un juego de patrones de matriz orgánica dopados con zinc. La validación de la metodología analítica se realiza con los materiales de referencia certificados AIEA 393 y MAB3/ TM. Los resultados muestran al arroz como el producto agrícola de mayor bioacumulación de zinc, siendo la principal fuente de Zn en la dieta de la población cubana.
ABSTRACT
The Zn content in foodstuffs (rice, some vegetables and roots) regularly consumed in Cuba is reported. Concentrations are determined by X-Ray Fluorescence analysis using a set of organic standards doped with Zn. The accuracy of the analytical procedure was validated using the Certified Reference Materials AIEA 393 and MAB3/ TM. The obtained results show rice as the major Zn bioaccumulator of the studied agriproducts and the main Zn source of human consumption in Cuba.
Key words: zinc, food, X-ray fluorescence analysis, diet, Cuba
Introducción
La determinación de zinc en muestras de dieta humana tiene gran importancia para resolver diferentes problemas, especialmente de carácter nutricional. Las funciones básicas del zinc en el organismo se pueden clasificar en catalítica, estructural y de regulación [1]. Ejerce acción antioxidante y mantiene la estabilización de las membranas biológicas de la piel y mucosas; se reconoce su función inmunológica y previene algunos tipos de cáncer. Por otra parte, la deficiencia de zinc se asocia con una grave y a veces mortal enfermedad, la acrodermitis enteropática, y se ha observado que en países subdesarrollados con dietas basadas en el consumo de cereales con baja concentración de Zn biodisponible se presenta retardo en el crecimiento, anemia y disminución del desarrollo intelectual [2]. De los metales considerados esenciales, la deficiencia de zinc es la más frecuente en suelos de cultivo, considerándose que 50% de estos tienen bajos niveles de zinc asimilable [3]. Este déficit inhibe en las plantas la síntesis de proteínas haciéndolas más susceptibles al ataque de enfermedades fungosas.
Lo anterior justifica el incremento del interés que ha adquirido el estudio de la bioacumulación de Zn en diferentes cultivos, principalmente, aquellos de mayor consumo popular. Por ejemplo, la corrección de la deficiencia de Zn en arroz (alimento muy popular en muchos países) ha sido de las más estudiadas. Buenos resultados se han logrado mediante el tratamiento de su semilla con sulfato de zinc [4], el empleo de fertilizantes dopados con Zn [5], así como el desarrollo de genotipos con mayor extracción de minerales esenciales hacia la parte comestible mediante técnicas de ingeniería genética [6].
Las técnicas analíticas más frecuentemente empleadas para determinar el contenido de zinc en muestras orgánicas son la espectrometría de masa inducida por plasma (ICP-MS) [7,8], la espectrometría de emisión atómica inducida por plasma (ICP-AES) [8-10] y el análisis por activación neutrónica (AAN) [7, 11-13], técnicas de gran sensibilidad que requieren de instalaciones muy costosas; así como la espectroscopia de absorción atómica (EAA) [12, 14-16], la cual es muy precisa y de gran reproducibilidad, pero requiere de la destrucción de la muestra. Por otra parte, las ventajas de la fluorescencia de rayos X (infraestructura relativamente menos costosa, técnica instrumental no destructiva, mínimos requerimientos para la preparación de las muestras, etc.), le han hecho ganar simpatías en estudios de esta naturaleza [17-20].
En el presente estudio se determinan las concentraciones de Zn en muestras nacionales e importadas de arroz (principal guarnición de la dieta cubana) y varios vegetales y raíces comestibles, con vistas a determinar su aporte a la ingesta diaria de Zn por la población de nuestro país. Por otra parte, se estudia la bioacumulación de Zn en estos productos agrícolas a través de la relación suelo-planta.
Materiales y Métodos
Muestreo: se tomaron muestras de arroz importado y de producción nacional. Se tomó un kilogramo de arroz importado (con origen en Canadá, Bolivia, Brasil, España y Vietnam) de manera aleatoria de un lote de 100 sacos. Las muestras de arroz nacional proceden de Matanzas y Cienfuegos y se tomó 1 kg de un saco aleatorio de los producidos en el cultivo. Las muestras de lechuga, remolacha, zanahoria y quimbombó se tomaron de un cantero aleatorio de organopónicos de Ciudad de La Habana, en tanto las muestras de tomate y pepino se tomaron de un zeopónico de Matanzas (zeolita de Tasajera). Las muestras de suelos provienen de la misma área de cultivo de los vegetales y raíces estudiadas, en tanto para el arroz se tomó suelo solo en el caso matancero. Cada muestra de arroz, suelo o vegetal está compuesta por 3 submuestras.
Preparación de muestras, patrones y estándares: Las muestras de alimentos se lavaron con agua fresca y se prepararon de la misma manera que para su consumo (cortadas, peladas, etc., según el caso), y posteriormente se secaron a 60 °C durante 24 horas hasta peso constante. Luego se trituraron en mortero ágata y se tamizaron a 125 µm. A las muestras de suelos de cultivo se le retiraron manualmente las piedras, restos de raíces, etc. y luego se secaron a 60 °C durante 24 horas hasta peso constante, triturados y tamizados a 125 µm.
El conjunto de muestras-patrones se desarrolló con celulosa dopada con zinc a diferentes concentraciones.
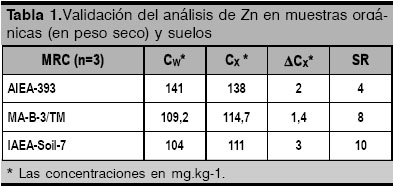
Para ello se preparó una solución estándar de nitrato de zinc de 0,5 mol/L diluida en agua destilada, la que se añadió en diferentes volúmenes a 16 g de celulosa en cada caso. Homogenizando y secando a 60 °C hasta peso constante se logran obtener los patrones con la concentración deseada de Zn (5, 7, 10, 16 y 27 ![]() ). La calidad del conjunto de muestras patrones se verificó mediante el análisis de los materiales de referencia certificada (MRC) AIEA 393 «Algae» y MA-B-3/TM «Fish Tissue Lyophilised», utilizando el criterio de McFarrell [21], donde se define un parámetro SR de la forma:
). La calidad del conjunto de muestras patrones se verificó mediante el análisis de los materiales de referencia certificada (MRC) AIEA 393 «Algae» y MA-B-3/TM «Fish Tissue Lyophilised», utilizando el criterio de McFarrell [21], donde se define un parámetro SR de la forma:
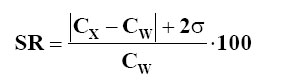
donde ![]() es el valor experimental de la concentración,
es el valor experimental de la concentración, ![]() - el valor certificado y s es la desviación estándar de
- el valor certificado y s es la desviación estándar de ![]() . Según este criterio la similitud entre el valor hallado y el reportado se clasifica en tres categorías:
. Según este criterio la similitud entre el valor hallado y el reportado se clasifica en tres categorías:
SR ![]() 25 – excelente, 25 < SR
25 – excelente, 25 < SR ![]() 50 – aceptable y SR > 50 - no aceptable. Los resultados de la verificación de la calidad del análisis se muestran en la tabla 1.
50 – aceptable y SR > 50 - no aceptable. Los resultados de la verificación de la calidad del análisis se muestran en la tabla 1.
Para determinar el Zn en los suelos se utilizaron los MRC: IAEA-356, IAEA-SL-1, IAEA Soil-5, IAEA Soil-7, BCR-2 «Basalt Columbia River» del Servicio Geologico de los EEUU y BCSS-1 «Marine sediment»del Consejo Nacional de Investigaciones de Canadá.
Todas las muestras (tres replicas por cada muestra) y MRC se mezclaron con celulosa (calidad analítica) en proporción 4:1 y prensadas a 15 toneladas en forma de pastillas de 20 mm de diámetro y un espesor de 10-15 mm, de modo que cumplan con la condición de muestra infinitamente gruesa.
Análisis: las pastillas se excitaron con una fuente de ![]() (1,11 GBq) con geometría de anillo y medidas en un detector de Si(Li) Canberra (150 eV de resolución energética para 5,9 keV y espesor de ventana de Be = 12,0 µm) acoplado a un analizador de 2048 canales. El tiempo de medicion fue de 6 horas en tiempo vivo. Todos los espectros se procesaron con el código WinAxil [22]. Para estimar las concentraciones de Zn se utilizo el metodo de Estandar Externo, empleando el conjunto de patrones en las muestras de alimentos y los MRC IAEA-356, IAEA-SL-1, IAEA-Soil-5, BCR-2 y BCSS-1 para la calibración correspondiente en el estudio de los suelos de cultivo. En todos los casos se garantizó que el área de la línea analítica K a del Zn excediera en 6 veces a su desviación estándar. Los resultados de la calidad del ançalisis en los suelos mediante el MRC IAEA Soil-7 se presentan en la tabla 1.
(1,11 GBq) con geometría de anillo y medidas en un detector de Si(Li) Canberra (150 eV de resolución energética para 5,9 keV y espesor de ventana de Be = 12,0 µm) acoplado a un analizador de 2048 canales. El tiempo de medicion fue de 6 horas en tiempo vivo. Todos los espectros se procesaron con el código WinAxil [22]. Para estimar las concentraciones de Zn se utilizo el metodo de Estandar Externo, empleando el conjunto de patrones en las muestras de alimentos y los MRC IAEA-356, IAEA-SL-1, IAEA-Soil-5, BCR-2 y BCSS-1 para la calibración correspondiente en el estudio de los suelos de cultivo. En todos los casos se garantizó que el área de la línea analítica K a del Zn excediera en 6 veces a su desviación estándar. Los resultados de la calidad del ançalisis en los suelos mediante el MRC IAEA Soil-7 se presentan en la tabla 1.
Para estudiar la absorcion de zinc por cada tipode vegetal, en correspondencia con su suelo de cultivo, se calculó el factor de bioacumulación (FB) como:
![]()
donde ![]() es la concentración de Zn en el vegetal y
es la concentración de Zn en el vegetal y ![]() la concentración de Zn en el medio de cultivo correspondiente.
la concentración de Zn en el medio de cultivo correspondiente.
Resultados y Discusión
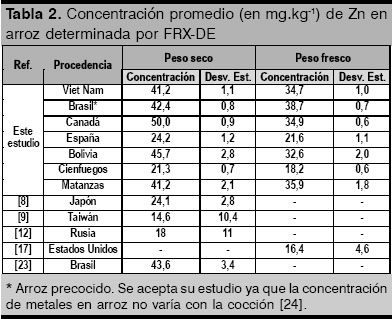
En la tabla 2 se presentan las concentraciones promedios de Zn (peso seco y fresco) en los arroces nacionales e importados estudiados y su comparación con las reportadas por otros autores.
Para la mayoría de los arroces estudiados (con las excepciones del arroz español y del cienfueguero) las concentraciones de Zn oscilan entre los 40 y 50 ![]() (peso seco), rango relativamente alto en comparación con los reportados con anterioridad al año 2002. Esto debe tener su origen en el programa que en los últimos años viene desarrollando la FAO con vistas a aumentar la concentración de zinc en este cereal. El bajo nivel de Zn encontrado en el arroz procedente de Cienfuegos se puede deber a la calidad de la semilla empleada, baja concentración de Zn biodisponible en el suelo, o al poco uso de fertilizantes que contengan este elemento.
(peso seco), rango relativamente alto en comparación con los reportados con anterioridad al año 2002. Esto debe tener su origen en el programa que en los últimos años viene desarrollando la FAO con vistas a aumentar la concentración de zinc en este cereal. El bajo nivel de Zn encontrado en el arroz procedente de Cienfuegos se puede deber a la calidad de la semilla empleada, baja concentración de Zn biodisponible en el suelo, o al poco uso de fertilizantes que contengan este elemento.
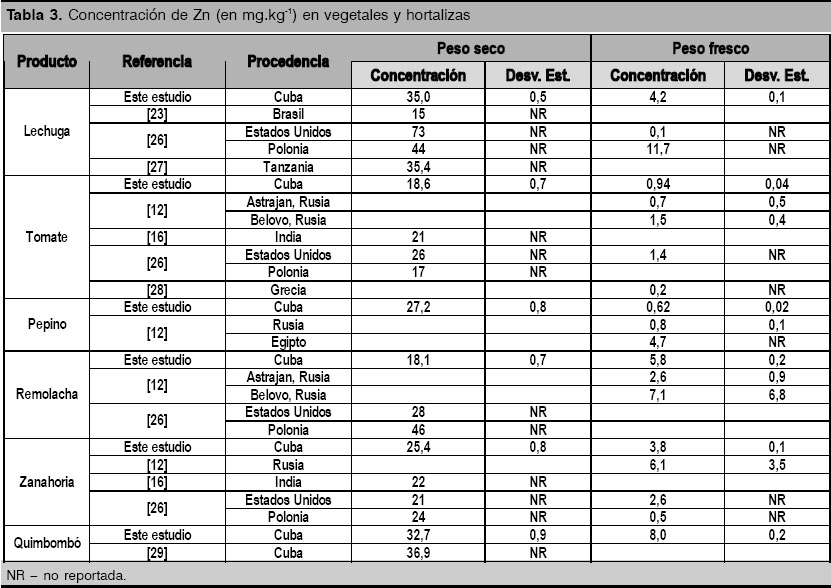
Por otra parte, el estudio de varios vegetales y raíces comestibles de uso común (tomate, lechuga y pepino), regular (zanahoria y remolacha) y esporádico (quimbombó) en nuestra dieta, muestra que estos tienen una concentración de Zn (en peso fresco) muy inferior a la obtenida en el arroz (tabla 3), pero se encuentran en el intervalo de concentración reportado en la literatura.
Teniendo como referencia el promedio de la concentración de Zn en los arroces estudiados y considerando un consumo diario de 200 gramos, la ingesta semanal permisible (ISP) de un individuo de 60 kg de peso corporal sería de 0,72 ![]() , cantidad que representa 72% de la ISP normada en nuestro país [25], lo que convierte a este alimento en la principal fuente de zinc en la dieta de la población cubana.
, cantidad que representa 72% de la ISP normada en nuestro país [25], lo que convierte a este alimento en la principal fuente de zinc en la dieta de la población cubana.
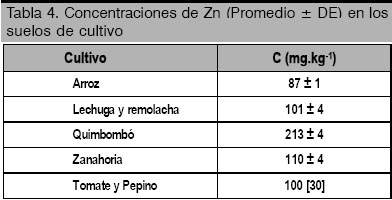
En la tabla 4 se muestran los resultados del estudio de la mayoría de los suelos de cultivo por FRX. En el caso del zeopónico (tomate y pepino) se toman los resultados reportados para la zeolita de Tasajera, obtenidos por activación neutrónica [30]. El cálculo del factor de bioacumulación (tabla 5) muestra al arroz como el mayor acumulador de zinc de los productos estudiados, siendo incluso superior a los FB reportados con anterioridad al año 2002, lo que debe estar en correspondencia con el mencionado programa de la FAO para este cereal. De manera general, el FB de los vegetales y hortalizas estudiados es muy inferior al FB del arroz, y sus valores están en correspondencia con lo reportado por otros autores. En el caso particular del tomate y el pepino, hortalizas muy comunes en nuestra dieta, presentan el menor FB. Ambos productos provienen de un zeopónico, pero sus FB coinciden plenamente con el reportado en estudios realizados en suelos agrícolas, por lo que su poder de acumulación de zinc no parece depender del medio de cultivo.
Conclusiones
El empleo de la FRX en el estudio del contenido de zinc en varios productos alimenticios, permitió determinar que el arroz es el alimento de mayor bioacumulación de zinc de los estudiados, aportando más del 70% de la ingesta semanal permisible normada en Cuba para este elemento esencial. Por otra parte, la bioacumulación de Zn en vegetales muy comunes en la dieta alimenticia de nuestra población (por ejemplo, tomate y pepino) es muy pequeña, lo que incide en que su aporte a la ISP sea mínimo. Sería recomendable complementar este estudio con la evaluación del contenido de Zn en otros alimentos esenciales (cárnicos, lácteos, granos, etc.).
Referencias Bibliográficas
[1] TORRES R, BAHR P. El Zinc: la chispa de la vida [artículo en línea]. Revista Cubana de Pediatría. 2004; 76(4). [consulta: 4 de octubre de 2008]. Disponible en: <http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S0034-75312004000400008&lng=es&nrm=iso&tlng=es> .
[2] VALDÉS S, GÓMEZ A. Temas de Pediatría. La Habana: Editorial Ciencias Médicas, 2006.
[3] MUÑIZ UGARTE O. Los elementos en la agricultura. La Habana: Agrinfor, 2008.
[4] SLATON NA, et. al. Evaluation of Zn seed treatment for rice. Agron. J. 2001; 93: 152-157.
[5] SLATON NA, NORMAN R, WILSON CE. Effect of Zinc Source and Application Time on Zinc Uptake and Grain Yield of Flood-Irrigated Rice. Agron. J. 2005; 97: 272-278.
[6] CAKMAK I. Plant nutrition research: Priorities to meet human needs for food in sustainable ways. Plant and Soil. 2002; 247: 3-24.
[7] HOU X, LI C, DING W, QIAN Q, CHAI C. Determination of 24 elements in four algae reference materials by neutron activation analysis and inductively coupled plasma mass spectrometry. Fresenius J Anal Chem. 1998; 360(3-4): 423-426.
[8] YASUI A, SHINDHO K. Determination of the geographic origin of brown-rice with trace element composition. Bunseki Kagaku. 2000; 49(6): 405-410.
[9] LIN H, WONG S, LI G. Heavy metal content of rice and Shellfish in Taiwan. Journal of Food and Drug Analysis. 2004; 12(2): 167-174.
[10] MEETU G, MRUNALINI S, DILIP SR, SATISH RW. Heavy Metal Content of Potato Chips and Biscuits from Nagpur City, India. Bull Environ Contam Toxicol. 2007; 79(4): 384-387.
[11] DÍAZ O, GRIFFITH J. Soil-plant relation in Cuban sugar cane by instrumental neutron activation analysis. J. Radioanal. Nucl. Chem. Letters. 1996; 213(5): 377-384.
[12] GORBUNOV A; FROTASYEVA M; KISTANOV A; et. al. Heavy and toxic metals in staple foodstuffs and agriproduct from contaminated soils. JINR Communication E18-2002-111. Dubna: JINR, 2002.
[13] KARIN RA, HOSSAIN SM, MIAH M, et. al. Arsenic and heavy metal concentrations in surface soils and vegetables of Feni district in Bangladesh. Environ Monit Assess 2008; 145(1-3): 417-425.
[14] ERDOÐRUL Ö, ERBILIR F. Heavy Metal and Trace Elements in Various Fish Samples from Sýr Dam Lake, Kahramanmaraþ, Turkey. Environ Monit Assess. 2007; 130(1-3): 373-379.
[15] GUPTA N, KHAN D, SANTRA S. An Assessment of Heavy Metal Contamination in Vegetables Grown in Wastewater-Irrigated Areas of Titagarh, West Bengal, India. Bull Environ Contam Toxicol. 2008; 80(2): 115-118.
[16] PANDEY J, PANDEY U. Accumulation of heavy metals in dietary vegetables and cultivated soil horizon in organic farming system in relation to atmospheric deposition in a seasonally dry tropical region of India. Environ Monit Assess. 2009; 148(1-4): 61-74.
[17] VILLAREAL C, MARANVILLE J, JULIANO B. Nutrient Content and Retention During Milling of Brown Rices from the International Rice Research Institute. Cereal Chem. 1991; 68(4): 437-439.
[18] NOZAKI A , MAKITA T. Energy Dispersive X-Ray Fluorescence Spectrometry of Major Tissues of Silky Fowls. J. Vet. Med. Sci. 1998; 60(4): 485-488.
[19] CARVALHO M, SANTIAGO S, NUÑES M. Assessment of the essential element and heavy metal content of edible fish muscle. Anal Bioanal Chem. 2005; 382(2): 426-432.
[20] YANADA Y, HOKURA A, MATSUDA K, et. al. Highsensitive determination of inorganic elements in spinach leaves by X-ray florescence and its application to identification of their production area. Bunseki Kagaku. 2007; 56(12): 1053-1061.
[21] QUEVAUVILLER Ph, MARRIER E. Quality Assurance and Quality Control for Environmental Monitoring. In: Quality Assurance in Environmental Monitoring. Weinheim: VCH, 1995.
[22]WinAxil Code. Version 4.5.2. Canberra-MiTAC, 2005.
[23]VIVES A, MOREIRA S, BRIENZA S, et. al. Synchrotron radiation total reflection X-ray fluorescence (SR-TXRF) for evaluation of food contamination. J. Radioanal. Nucl. Chem. 2006; 270(1): 147-153.
[24] YASUI A , SHINDHO K . Change in cadmium concentration in rice during cooking. Food Sci. Technol.Res. 2003; 9(2): 193-196.
[25] ININ/ Oficina Nacional de Normalización. Norma Cubana NC-493. Contaminantes metálicos en alimentos. Regulaciones sanitarias. ICS: 67.020. La Habana: Oficina Nacional de Normalización, 2006.
[26] KABATA-PENDIAS A, PENDIAS H. Trace element in soils and plants. Boca Raton: CRC Pres, 1992.
[27] BAHEMUKA T, MUBOFU E. Heavy metals in edible green vegetables grown along the sites of the Sinza and Msimbazi rivers in Dares Salaam, Tanzania. Food Chem. 1999; 66(1): 63-66.
[28] GOLIA E, DIMIRKOU A, MITSIOS I. Influence of Some Soil Parameters on Heavy Metals Accumulation by Vegetables Grown in Agricultural Soils of Different Soil Orders. Bull Environ Contam Toxicol. 2008; 81(1): 80-84.
[29] OLIVARES S. Informe parcial del Proyecto "Niveles de Cadmio, Plomo, Cobre y Zinc en vegetales cultivados en la cercanía del aterradero de calle 100, Ciudad de La Habana". La Habana: InSTEC, 2008.
[30] DÍAZ O, HERRERA E. Multi-elemental characterization of Cuban natural zeolites. J. Radioanal. Nucl. Chem. 1997; 221(1-2): 255-258.
[31] LI G, LIN H, LAI C. Uptake of Heavy Metals by Plants in Taiwan. Environmental Geochemistry and Health. 1994; (Special issue): 153-160.
Recibido: 13 de octubre de 2009
Aceptado: 12 de noviembre de 2009