Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Nucleus
versión impresa ISSN 0864-084X
Nucleus no.49 Ciudad de La Habana ene.-jun. 2011
CIENCIAS NUCLEARES
Modificación del hR3 con DOTA-NHS. Marcaje con 90Y y biodistribución
hR3 modification with DOTA-NHS. 90Y labeling and biodistribution
Dianelys Ondarse Álvarez1, Rene Leyva Montaña2, Minely Zamora Barrabí2, Luis Ducat Pages2, Ignacio Hernández2, Luis Michel Alonso2
1Universidad de Matanzas, Autopista a Varadero, km 3½, Matanzas 44740, Cuba
2Centro de Isótopos, (CENTIS) AP 3415 San José de las Lajas (Cuba)
dianelys.ondarse@umcc.cu
RESUMEN
En el trabajo se reporta la conjugación y biodistribución del radioinmunoconjugado ![]() -DOTAhR3. Se empleó el ácido 1, 4, 7, 10 tetraazaciclododecano N, N’, N’’, N’’’ tetraacético (DOTA) como agente quelatante bifuncional (AQB) y se estudiaron las relaciones molares 320:1, 160:1 y 88:1 DOTA/anticuerpo monoclonal (hR3), evaluándose su influencia en la integridad del conjugado y la eficiencia de marcaje. La estabilidad in vivo de los radioinmunoconjugados
-DOTAhR3. Se empleó el ácido 1, 4, 7, 10 tetraazaciclododecano N, N’, N’’, N’’’ tetraacético (DOTA) como agente quelatante bifuncional (AQB) y se estudiaron las relaciones molares 320:1, 160:1 y 88:1 DOTA/anticuerpo monoclonal (hR3), evaluándose su influencia en la integridad del conjugado y la eficiencia de marcaje. La estabilidad in vivo de los radioinmunoconjugados ![]() -DOTAhR3 se determinó en ratas Wistar sanas a las 4, 24 y 48 horas. Los estudios de estabilidad realizados mediante reto versus ácido dietilentriaminopentaacético (DTPA) demostraron que el compuesto es estable en un amplio intervalo de tiempo (hasta 216 h). Los estudios de estabilidad in vivo basados en la captación en hueso del radioinmunoconjugado demostraron que no es apreciable la pérdida del radiometal en el radioinmunoconjugado hasta las 48 horas.
-DOTAhR3 se determinó en ratas Wistar sanas a las 4, 24 y 48 horas. Los estudios de estabilidad realizados mediante reto versus ácido dietilentriaminopentaacético (DTPA) demostraron que el compuesto es estable en un amplio intervalo de tiempo (hasta 216 h). Los estudios de estabilidad in vivo basados en la captación en hueso del radioinmunoconjugado demostraron que no es apreciable la pérdida del radiometal en el radioinmunoconjugado hasta las 48 horas.
Palabras claves: itrio 90, reglas de embalaje, anticuerpos monoclonales, in vivo.
ABSTRACT
The conjugation, characterization and biodistribution of ![]() -DOTA-hR3 radioimmunoconjugate are reported in this work. DOTA was used as bifunctional chelating agent. Molar ratios 320:1, 160:1 and 88:1 DOTA/monoclonal antibody hR3 were studied in order to evaluate their influence on the integrity of conjugate and labeling effi ciency. In vivo stability of
-DOTA-hR3 radioimmunoconjugate are reported in this work. DOTA was used as bifunctional chelating agent. Molar ratios 320:1, 160:1 and 88:1 DOTA/monoclonal antibody hR3 were studied in order to evaluate their influence on the integrity of conjugate and labeling effi ciency. In vivo stability of ![]() -DOTA-hR3 radioimmunoconjugates was determined in healthy Wistar rats at 4, 24 and 48 h after the injection. Stability studies performed by means of DTPA challenge showed that the compound is stable in a wide period of time (up to 216 h). In vivo stability studies, based on the bone uptake, showed that the radiometal release from the radioimmunoconjugate is not signifi cant in the first 48 hours.
-DOTA-hR3 radioimmunoconjugates was determined in healthy Wistar rats at 4, 24 and 48 h after the injection. Stability studies performed by means of DTPA challenge showed that the compound is stable in a wide period of time (up to 216 h). In vivo stability studies, based on the bone uptake, showed that the radiometal release from the radioimmunoconjugate is not signifi cant in the first 48 hours.
Key words: yttrium 90, labelling, monoclonal antibodies, in vivo.
Introducción
En la actualidad el empleo de anticuerpos monoclonales continúa ganando popularidad como plataforma para la radioinmunoterapia (RIT) de cáncer. Los radiofármacos para terapia involucran moléculas con afinidad por blancos específicos acopladas a radionúclidos [1-6]. Los ligandos aminocarboxilatos como el DTPA, el DOTA y sus análogos son los agentes quelatantes más empleados para acomplejar radiometales con número de oxidación 3+ como el ![]() [7-10].
[7-10].
En el trabajo se reporta la preparación y caracterización del radioinmunoconjugado ![]() -DOTA-hR3, así como su estudio de estabilidad in vitro y biodistribución en ratas Wistar sanas. De los resultados se sugiere que el
-DOTA-hR3, así como su estudio de estabilidad in vitro y biodistribución en ratas Wistar sanas. De los resultados se sugiere que el ![]() -DOTA-hR3 puede ser un candidato potencial para su empleo en procedimientos radioinmunoterapéuticos.
-DOTA-hR3 puede ser un candidato potencial para su empleo en procedimientos radioinmunoterapéuticos.
Materiales y Métodos
Reactivos y equipos
El hR3 (5 mg/mL), fue suministrado por el Centro de Inmunología Molecular (CIM). El ![]() se obtuvo en forma de
se obtuvo en forma de ![]() a partir de un generador de
a partir de un generador de ![]() /
/![]() fabricado en el Centro de Isótopos (CENTIS). El DOTA se adquirió de Macrocyclics Dallas TX. El patrón de punto isoeléctrico y el de peso molecular fueron suministrados por Bio-Rad. Se utilizó un sistema modular de HPLC Shimadzu equipado con bombas LC-10, detector SPD-6AV, detector radiométrico Berthold (Alemania) y columna Protein Pack SW300 Waters (7,5 X 300 mm, 10 μm, Waters). La electroforesis SDS-PAGE se realizó en un equipo con fuente de alto voltaje (Mini-PROTEAN® 3 Cell) y la determinación del punto isoeléctrico se desarrolló en un equipo PhastSystem. La medición de la actividad se realizó en un contador de centelleo líquido LKB-WALLAC-RacBeta 1209, Finlandia) y en un calibrador de dosis CMR 35C (Capintec, EE.UU.). En procesamiento estadístico se utilizaron los paquetes estadísticos de MS Excel. Se aplicaron métodos no paramétricos; se utilizó el test de Kolmogorov-Smirnov con un nivel de significación
fabricado en el Centro de Isótopos (CENTIS). El DOTA se adquirió de Macrocyclics Dallas TX. El patrón de punto isoeléctrico y el de peso molecular fueron suministrados por Bio-Rad. Se utilizó un sistema modular de HPLC Shimadzu equipado con bombas LC-10, detector SPD-6AV, detector radiométrico Berthold (Alemania) y columna Protein Pack SW300 Waters (7,5 X 300 mm, 10 μm, Waters). La electroforesis SDS-PAGE se realizó en un equipo con fuente de alto voltaje (Mini-PROTEAN® 3 Cell) y la determinación del punto isoeléctrico se desarrolló en un equipo PhastSystem. La medición de la actividad se realizó en un contador de centelleo líquido LKB-WALLAC-RacBeta 1209, Finlandia) y en un calibrador de dosis CMR 35C (Capintec, EE.UU.). En procesamiento estadístico se utilizaron los paquetes estadísticos de MS Excel. Se aplicaron métodos no paramétricos; se utilizó el test de Kolmogorov-Smirnov con un nivel de significación ![]() = 0,05.
= 0,05.
Conjugación del hR3 con DOTA-NHS
Se trabajó con las relaciones molares (88:1, 160:1 y 320:1) DOTA/hR3, donde para 10 mg de hR3 en solución se pesaron 5,6 mg, 8,1mg y 20 mg de DOTA. Al DOTA sólido se le añadieron 400 μL de buffer fosfato 0,1M pH-8,5 y posteriormente se le añadió el hR3. Luego se añadió NaOH 2M para ajustar el pH hasta 8,5. La mezcla reaccionante se incubó a 16 ºC durante toda la noche con agitación en un Vortex. Los inmunoconjugados se purificaron por columna PD-10 calibrada con aproximadamente 20 mL de buffer acetato de amonio (![]() (ac)) 0,1 M (1,0% HSA) pH-7,0 purificado. La elusión se llevó a cabo igualmente con buffer
(ac)) 0,1 M (1,0% HSA) pH-7,0 purificado. La elusión se llevó a cabo igualmente con buffer ![]() (ac). Para determinar la concentración de los inmunoconjugados se utilizó el método de Bradford [11]. Paralelamente se midió la absorbancia del inmunoconjugado obtenido a 280 nm, empleando el coeficiente de extinción molar del hR3 (1,4), usando buffer fosfato (0,01M) como blanco. Para determinar los agregados de alto peso molecular, la pureza y la integridad de los conjugados se utilizó HPLC de exclusión molecular (HPLC-EM).
(ac). Para determinar la concentración de los inmunoconjugados se utilizó el método de Bradford [11]. Paralelamente se midió la absorbancia del inmunoconjugado obtenido a 280 nm, empleando el coeficiente de extinción molar del hR3 (1,4), usando buffer fosfato (0,01M) como blanco. Para determinar los agregados de alto peso molecular, la pureza y la integridad de los conjugados se utilizó HPLC de exclusión molecular (HPLC-EM).
Para realizar la electroforesis SDS-PAGE se prepararon los geles de poliacrilamida al 12,5% (p/v), según el procedimiento descrito por Laemmli (1970). La corrida electroforética se realizó en una cámara BioRad (BioRad Cat. 1610318, Suecia).
Para realizar el isoelectroenfoque se prepararon los geles embebiendo un Phastgel DYR en una solución de 7,5% Pharmalyte 8-10,5 y 10% glicerol durante 30 min con agitación. Además, se utilizó el servicio on line del Instituto Europeo de Bioinformática (EMBL WWW Gateway to Isoelectric Point Service), para la estimación teórica de los puntos isoeléctricos. Para determinar el número promedio de moléculas de DOTA enlazados a una molécula de hR3 se mezclaron 50 μL de una solución estandarizada de Y(III) (1,4 x 10-4 μM, 7 nmol) que contenía ~5,5 x 107 cpm/μL de ![]() ; 50 μl de buffer acetato de amonio 0,5 M pH-7,0 y 50 μL del conjugado DOTA-hR3 con relación molar DOTA/ hR3 160:1. La mezcla se hizo reaccionar por 3 horas a 42 oC y posteriormente se le añadió 16 μL de DTPA 10 mM pH-6 y se incubó 15 min zax a temperatura ambiente. La mezcla de reacción se analizó, utilizando cromatografía ITLC-SG (1 X 10 cm) y las mediciones se realizaron en un contador de centelleo líquido (LKB-WALLAC-RacBeta 1209, Finlandia). La relación ligando/proteína (L/P) se determinó con la expresión:
; 50 μl de buffer acetato de amonio 0,5 M pH-7,0 y 50 μL del conjugado DOTA-hR3 con relación molar DOTA/ hR3 160:1. La mezcla se hizo reaccionar por 3 horas a 42 oC y posteriormente se le añadió 16 μL de DTPA 10 mM pH-6 y se incubó 15 min zax a temperatura ambiente. La mezcla de reacción se analizó, utilizando cromatografía ITLC-SG (1 X 10 cm) y las mediciones se realizaron en un contador de centelleo líquido (LKB-WALLAC-RacBeta 1209, Finlandia). La relación ligando/proteína (L/P) se determinó con la expresión:
Marcaje de los inmunoconjugados DOTA-hR3 con ![]()
En tubos Eppendorf se mezclaron alícuotas de![]() (2-8 mCi, 2,5-5 μL) en una solución de HCl 0,05 N, 100 μL de buffer
(2-8 mCi, 2,5-5 μL) en una solución de HCl 0,05 N, 100 μL de buffer ![]() 0,5 M pH-7,0 y 100 μL del conjugado DOTA-hR3 según el caso. La mezcla de reacción se incubó a 42 °C por 1 h, transcurrido este tiempo se le adicionó 1/9 del volumen de reacción de una solución de DTPA 10 mM pH-6,0 para acomplejar el
0,5 M pH-7,0 y 100 μL del conjugado DOTA-hR3 según el caso. La mezcla de reacción se incubó a 42 °C por 1 h, transcurrido este tiempo se le adicionó 1/9 del volumen de reacción de una solución de DTPA 10 mM pH-6,0 para acomplejar el ![]() que no reaccionó y se incubó por 15 min a temperatura ambiente. La eficiencia de marcaje se determinó mediante cromatografía ITLC-SG. Como fase móvil se usó una mezcla de acetato de amonio (10% m/v) y metanol (1:1). La medición del
que no reaccionó y se incubó por 15 min a temperatura ambiente. La eficiencia de marcaje se determinó mediante cromatografía ITLC-SG. Como fase móvil se usó una mezcla de acetato de amonio (10% m/v) y metanol (1:1). La medición del ![]() se basó en el efecto Cherenkov. La purificación de los radioinmunoconjugados se realizó de forma similar a la purificación de los inmunoconjugados, pero la columna de purificación y el resto de las operaciones se realizaron dentro de una cabina de plexiglass con blindaje interno como protección contra las radiaciones del
se basó en el efecto Cherenkov. La purificación de los radioinmunoconjugados se realizó de forma similar a la purificación de los inmunoconjugados, pero la columna de purificación y el resto de las operaciones se realizaron dentro de una cabina de plexiglass con blindaje interno como protección contra las radiaciones del ![]() .
.
Estudio de estabilidad del ![]() -DOTA-hR3 en reto contra de DTPA
-DOTA-hR3 en reto contra de DTPA
La estabilidad del radioinmunoconjugado ![]() DOTA- hR3 se evaluó en presencia de exceso de DTPA. Una alícuota del conjugado radiomarcado (25-90 μL) con aproximadamente 2x
DOTA- hR3 se evaluó en presencia de exceso de DTPA. Una alícuota del conjugado radiomarcado (25-90 μL) con aproximadamente 2x![]() cpm de
cpm de ![]() se adiciona a 1 mL de DTPA 1 mM en solución salina que contiene 1% HSA, pH 6,0; en estas condiciones la relación molar DTPA/
se adiciona a 1 mL de DTPA 1 mM en solución salina que contiene 1% HSA, pH 6,0; en estas condiciones la relación molar DTPA/ ![]() -DOTA-hR3 fue 20800:1. Esta solución se incubó a 37 °C durante el tiempo de estudio, y se analizó por HPLC de exclusión molecular, utilizando como fase móvil 0,01 M de buffer fosfato y 0,05%
-DOTA-hR3 fue 20800:1. Esta solución se incubó a 37 °C durante el tiempo de estudio, y se analizó por HPLC de exclusión molecular, utilizando como fase móvil 0,01 M de buffer fosfato y 0,05% ![]() a pH 7,0 en régimen isocrático. Las muestras se analizaron en intervalos de 0 a 216 h.
a pH 7,0 en régimen isocrático. Las muestras se analizaron en intervalos de 0 a 216 h.
Estudio de biodistribución del ![]() -DOTA-hR3
-DOTA-hR3
El producto del marcaje del anticuerpo con ![]() purificado se adicionó a una solución del anticuerpo sin marcar hasta obtener una disolución de 533 μg/mL de anticuerpo y una concentración radiactiva de 66,7 MBq/mL.
purificado se adicionó a una solución del anticuerpo sin marcar hasta obtener una disolución de 533 μg/mL de anticuerpo y una concentración radiactiva de 66,7 MBq/mL.
Se utilizaron ratas Wistar machos, suministradas por el Centro Nacional para la Producción de Animales de Laboratorio (CENPALAB), en un rango de masa corporal de 241,3 a 318 g. Se formaron tres grupos experimentales de tres ratas cada uno para ser sacrificados a tres tiempos diferentes después de la administración, 4, 24 y 48 horas. Se administraron en la vena marginal de la cola 0,3 mL (20 MBq) de la disolución preparada para una dosis de 160 μg de anticuerpo por animal.
Resultados
Conjugación del hR3 con DOTA
La concentración de los conjugados fue 2,0 mg/mL (1,36 ± 0,01) x 10-5 M y 2,1 mg/mL (1,48± 0,04) x 10-5 M determinada por el método directo y de Bradford respectivamente.
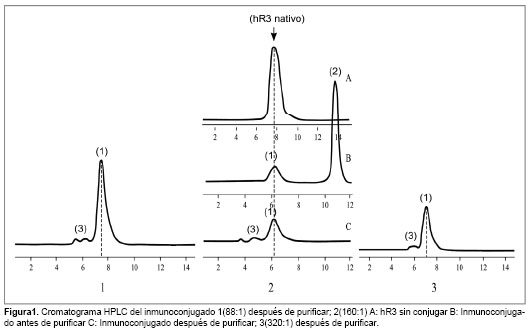
En la Fig.1 se aprecia el perfil cromatográfico del inmunocojugado con relación molar 160:1 antes y después de la purificación. Las relaciones molares 320:1 y 88:1 se comportan de manera similar, por lo que para estas solo se muestran los cromatogramas de los inmunoconjugados después de ser purificados.
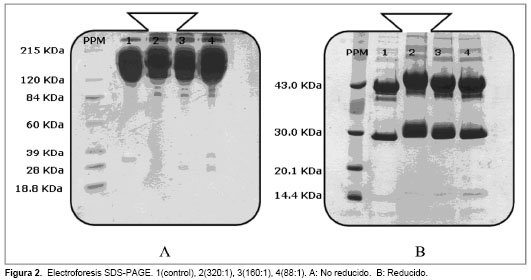
En la Fig. 2 se muestran las placas electroforéticas SDS-PAGE en condiciones no reductoras (A) y reductoras (B).
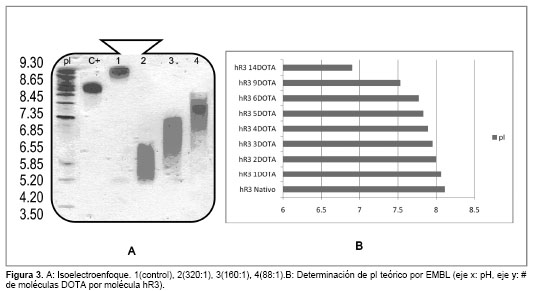
El perfil electroforético de punto isoeléctrico (pI) (Fig. 3 A) mostró valores para el hR3 nativo, dentro del intervalo de valores reportados en sus especificaciones de calidad; valores de pI entre 8,1-8,7; resultados que se comprobaron mediante la estimación teórica de los pI a partir de su secuencia primaria por el servicio on line del Instituto Europeo de Bioinformática (EMBL WWW Gateway to Isoelectric Point Service) (Fig. 3B).
Marcaje del conjugado DOTA-hR3 con 90Y
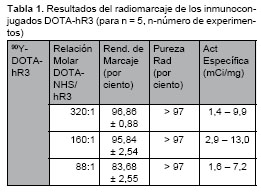
Los resultados de la Tabla 1 no mostraron diferencias significativas (![]() = 0,05) entre las formulaciones 320:1 y 160:1, sin embargo las diferencias sí fueron significativas al comparar estas formulaciones con la formulación de 88:1 que mostró efi ciencias de marcaje inferiores al 90%. Los resultados de la pureza radioquímica mayor que 97% se corresponden con otros estudios [12], en los cuales se han alcanzado resultados superiores al 99%.
= 0,05) entre las formulaciones 320:1 y 160:1, sin embargo las diferencias sí fueron significativas al comparar estas formulaciones con la formulación de 88:1 que mostró efi ciencias de marcaje inferiores al 90%. Los resultados de la pureza radioquímica mayor que 97% se corresponden con otros estudios [12], en los cuales se han alcanzado resultados superiores al 99%.
Determinación de la cantidad de grupos DOTA enlazados a una molécula de hR3 Se obtuvieron alrededor de 14,1 ± 0,9 moléculas de DOTA por cada molécula de anticuerpo monoclonal.
Estudio de estabilidad in vitro
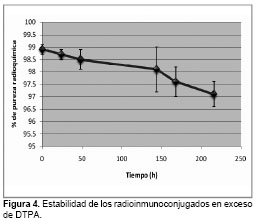
Los resultados del estudio de estabilidad del radioinmunoconjugado en relación molar DTPA/![]() DOTA- hR3 (20800:1) se muestran en la Fig.4.
DOTA- hR3 (20800:1) se muestran en la Fig.4.
Estudio de biodistribución
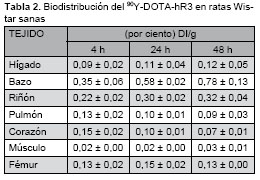
El objetivo fundamental del estudio de biodistribución fue determinar preliminarmente la estabilidad in vivo del radioinmunoconjugado. Los posibles sitios de acumulación del radiometal son el tejido óseo y el tejido hematopoyético. Tabla 2.
Se conjugó el DOTA-NHS con el hR3, aprovechando la relativa facilidad que tiene el DOTA de reaccionar con los grupos amino de los residuos de lisina de las cadenas laterales del anticuerpo en medio acuoso suavemente básico (pH 8-9). Con anterioridad se había estudiado las relaciones molares DOTA-NHS/hR3 en el intervalo 200:1 a 600:1, obteniendo buenos resultados [13]. Tratando de disminuir estas, se compararon tres proporciones diferentes, una dentro del intervalo ya estudiado y otras dos por debajo de este.
La purificación de los inmunoconjugados permite separar adecuadamente las especies de alto peso molecular de los contaminantes más ligeros (DOTA en exceso y posibles fragmentos del anticuerpo), evitando prolongados tiempos de purificación por diálisis empleados por Lewis y cols [10]. La muestra purificada se caracterizó por HPLC. En el espectro no se observa la presencia del AQBF libre ni de agregados moleculares, lo cual es una medida de la alta pureza del inmunoconjugado y la conservación íntegra del anticuerpo después del proceso de conjugación.
En la caracterización por electroforesis SDSPAGE, se observó cómo mediante el tratamiento de la muestra con 2 – mercaptoetanol fue posible detectar la presencia de grupos DOTA acoplados al anticuerpo monoclonal. Esto se debe a que los puentes disulfuro intra e intercatenario de las cadenas pesadas tipo gamma y liviana tipo kappa y lambda son disociados por la acción de este agente reductor, permitiendo que se pierda la estructura cuaternaria con mayor facilidad y se favorezca la interacción del anticuerpo monoclonal distendido en cadena peptídicas individuales con el SDS.
En la caracterización por isoelectroenfoque se aprecia cómo a medida que aumenta la relación molar DOTA/hR3 el punto isoeléctrico se hace menor en magnitud. Ello muestra una posible relación entre el número de grupos DOTA y la cantidad de residuos lisina ocupados por este ligando que no aportan carga a la determinación de pI. Los resultados se comprobaron mediante la estimación teórica de los pI a partir de su secuencia primaria por el servicio online del Instituto Europeo de Bioinformática (EMBL WWW Gateway to Isoelectric Point Service). La Fig. 3 B muestra un comportamiento similar al obtenido en la determinación experimental.
A pesar de que estos resultados no son aún definitorios, se concluye que existe cierta relación entre el número de grupos DOTA-NHS enlazados a los residuos lisina del hR3 y el valor del pI, el cual disminuye sin afectar la identidad del anticuerpo monoclonal.
Estudios anteriores del conjugado DOTA-hR3 mostraron que con relaciones molares DOTA/hR3 en el intervalo 600:1-200:1, se obtienen eficiencias de marcaje superiores al 90% [13]. Utilizando las relaciones molares 320:1, 160:1 y 88:1, los resultados de la Tabla 1 no mostraron diferencias significativas entre las formulaciones 320:1 y 160:1; sin embargo, las diferencias sí fueron signifi cativas cuando se compararon con la formulación de 88:1 que mostró eficiencias de marcaje inferiores al 90%. Teniendo en cuenta este resultado se continuaron los estudios con la formulación de 160:1, debido a que es necesario emplear menor cantidad de DOTA, mostrando resultados satisfactorios. En la purificación de los radioinmunoconjugados se eliminan impurezas como el ![]() -DTPA, coloides marcados y
-DTPA, coloides marcados y ![]() -Acetato.
-Acetato.
La relación L/P estuvo en correspondencia con lo obtenido en la determinación teórica del punto isoeléctrico (Fig. 3 B); sin embargo, algunas publicaciones señalan que un elevado número de AQB unido al anticuerpo puede afectar su inmunoreactividad, por lo que la evaluación de esta es prácticamente inevitable para caracterizar correctamente al radioinmunoconjugado.
Los resultados en la incubación del radioinmunoconjugado en exceso de DTPA evidencian su estabilidad [14,17] para radioinmunoconjugados de este tipo. El ![]() que se encuentra libre puede ser consecuencia de que parte de este no se haya enlazado al DOTA y se haya acoplado a otros sitios en el anticuerpo, en este caso el radisótopo se pudiera desacoplar de estos sitios, cuyos enlaces son más débiles que los enlaces con DOTA y transquelar al DTPA que es un AQB con capacidad de acomplejar rápidamente al radiometal.
que se encuentra libre puede ser consecuencia de que parte de este no se haya enlazado al DOTA y se haya acoplado a otros sitios en el anticuerpo, en este caso el radisótopo se pudiera desacoplar de estos sitios, cuyos enlaces son más débiles que los enlaces con DOTA y transquelar al DTPA que es un AQB con capacidad de acomplejar rápidamente al radiometal.
En los estudios de biodistribución se aprecia (Tabla 2), que no existe una acumulación significativa de radiactividad en ninguno de los órganos o tejidos muestreados. Se discute acerca de la acumulación del ![]() en tejido óseo cuando se presenta como impureza o cuando se libera del radioinmunoconjugado por inestabilidad del mismo [14,15]. Solamente podemos apreciar un ligero aumento de la captación esplénica y hepática que no supera el 1% de la dosis por gramo de tejido, siendo el tejido donde, además, se encuentra la mayor acumulación. Esto pudiera explicarse porque la excreción de los anticuerpos ocurre por vía biliar, por lo que al ser parte del radioinmunoconjugado un anticuerpo monoclonal, es posible que haya mayor captación hepática. De estos resultados podemos aseverar que no existe una pérdida del radionucleido que implique una captación indeseada en tejido no blanco.
en tejido óseo cuando se presenta como impureza o cuando se libera del radioinmunoconjugado por inestabilidad del mismo [14,15]. Solamente podemos apreciar un ligero aumento de la captación esplénica y hepática que no supera el 1% de la dosis por gramo de tejido, siendo el tejido donde, además, se encuentra la mayor acumulación. Esto pudiera explicarse porque la excreción de los anticuerpos ocurre por vía biliar, por lo que al ser parte del radioinmunoconjugado un anticuerpo monoclonal, es posible que haya mayor captación hepática. De estos resultados podemos aseverar que no existe una pérdida del radionucleido que implique una captación indeseada en tejido no blanco.
Conclusiones
Se obtuvieron conjugados DOTA-hR3 en las relaciones molares 88:1, 160:1 y 320:1, a los cuales se le realizaron estudios de HPLC, electroforesis SDS e isoelectroenfoque, demostrándose que se preserva la integridad y pureza del inmunoconjugado. Los rendimientos de marcaje fueron superiores al 95% para la relación molar 160:1 y 320:1; la primera fue seleccionada como resultado de la aplicación del test Kolmogorov-Smirnov para continuar los estudios, debido a que emplea menor cantidad de DOTA. Los estudios de estabilidad realizados a la formulación seleccionada (160:1) hasta 216 h se basaron en estudios de reto contra DTPA, siendo la pureza radioquímica superior al 97%, y estudios de biodistribución, los cuales evidenciaron que el radioinmunoconjugado no presenta especial afinidad por ningún órgano sano, siendo los riñones, el bazo y el hígado los órganos donde se acumula el mayor porcentaje de actividad.
Referencias Bibliográficas
1. LIU S, EDWARDS DS. Bifunctional chelator for therapeutic lanthanide radiopharmaceutical. Bioconjugate Chem. 2001; 12(1): 7-34.
2. ILLIDGE TM, BROCK S. Radioinmunotherapy of cancer: using monoclonal antibodies to target radiotherapy. Curr. Pharm. Res. 2000; 6(14): 1399-1418.
3. VRIESENDORP HM, QUADRI SM, BORCHARD PE. Tumor therapy with radiolabeled antibodies: optimization of therapy. BioDrugs. 1998; 10(4): 275-293.
4. POTAMIANOS S, VARVARIGOU AD, ARCHIMANDRITIS SC. Radioimmunoscintigraphy and radioimmunotherapy in cancer: principles and applications. Anticancer Res. 2000; 20(2A): 925–948.
5. WUN T, KWON DS, TUSCANO JM. Radioimmunotherapy: potential as a therapeutic strategy in non-Hodgekin’s lymphoma. BioDrugs. 2001; 15(3): 151-162.
6. WITZIG TE. The use of ibritumomab tiuxetan radioimmunotherapy for patients with relapsed B-cell non-Hodgekin’s lymphoma. Semin. Oncol. 2000; 27 (6 suppl 12)1: 74-78.
7. HIDER RC, HALL AD. Iron chelating agents medicine. The application of bidentate hydroxypyridin-4-ones. In: Perspectives Bioinorganic Chemistry. JAI Press, 1991. vol. 1. p. 209-253.
8. DADACHOVA E, CHAPPELL LL, BRECHBIEL MW. Spectrophotometric method for determination of bifuncional macrocyclic ligands in macrocyclic ligand-protein conjugates. Nucl Med and Biology. 1999; 26(8): 977-982.
9. PIPPIN CG, PARKER TA, MCMURRY TJ, BRECHBIEL MW. Spectrophotometric method for the determination of a bifuncional DTPA ligand in DTPA-monoclonal antibody conjugates. Bioconjug Chem. 1992; 3(4): 342-345.
10. LEWIS MR, KAO JY, ANDERSON ALJ, et. al. An improved method for conjugating monoclonal antibodies with NHydroxysulfosuccinimidyl DOTA. Bioconjug Chem. 2001; 12(2): 320-324.
11. BRADFORD MM. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Anal Biochem. 1976; 72: 248.
12. LIU S, et. al. Comparison of Yttrium and indium complexes of DOTA-BA and DOTA-MBA: Models for 90Y- and 111Inlabelled DOTA- biomolecule conjugates. Bioconjug Chem. 2002. 13(4): 902-913.
13. BECKFORD VERA DR, XIQUES CASTILLO A, LEYVA MONTAÑA R, et. al. Nuevo radioinmunoconjugado 90Y-DOTA- hR3. Síntesis y radiomarcaje. Nucleus. 2007; (41): 3-8.
14. GRIFFITHS GL, GOVINDAN SV, SHARKEY RM, et. al. 90Y-DOTA-hLL2: An agent for radioimmunotherapy of non- Hodgkin’s lymphoma. J. Nucl. Med. 2003; 44(1): 77-84.
15. HANCOCK RD, MARTELL AE, MOTEKAITIS RJ. Factors affecting stabilities of chelate, macrocyclic and macrobicyclic complexes in solution. Coord. Chem. Rev. 1994; 133: 39-65.
16. MORALES AA, NUÑEZ G, PEREZ N, et. al. Freeze-dried formulation for direct 99mTc-labeling ior-egf/r3 MAb: Additives, biodistribution and stability. Nucl. Med. & Biol. 1999; 26(6): 717-723.
17. IZNAGA N, MORALES A, DUCONGÉ J, et. al. Pharmacokinetics, biodistribution and dosimetry of 99mTc-labeled anti-human epidermal growth factor receptor humanized monoclonal antibody R3 in rats. Nucl. Med. & Biol. 1998; 25(1): 17- 23.
Recibido: 14 de marzo de 2011
Aceptado: 28 de abril de 2011