Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Nucleus
versión impresa ISSN 0864-084X
Nucleus no.52 Ciudad de La Habana jul.-dic. 2012
CIENCIAS NUCLEARES
Investigaciones no clínicas en el Centro de Isótopos en función de la industria biotecnológica y farmacéutica
Non clinical research at CENTIS supporting biotechnological and pharmaceutical industry
Ignacio Hernández González
Centro de Isótopos. Ave. Monumental y Carretera La Rada, km 3 ½, San José de las Lajas, Mayabeque, Cuba
RESUMEN
La producción de medicamentos es hoy muy demandada debido al alto rigor que imponen las regulaciones y normativas actuales. Ese rigor no es solo aplicable a las facilidades de fabricación, sino que también es exigido en la fase de investigación y desarrollo. Nuestro país se destaca actualmente por una industria biotecnológica creciente que ha puesto ya en el mercado nacional e internacional importantes medicamentos de probada eficacia en el tratamiento de patologías como el cáncer. El Centro de Isótopos es una institución, cuyas instalaciones están a disposición de esa industria, brindando una plataforma de trabajo para llevar a cabo investigaciones que permitan dar respuesta a estudios de biodistribución y farmacocinética en modelos experimentales relevantes. Durante los años de experiencia en estas actividades se ha contribuido a la investigación y desarrollo de productos de diversa naturaleza como los biotecnológicos, experimentando una evolución hacia la puesta a punto de nuevas tecnologías y a la incorporación de metodologías más adecuadas a los estándares actuales. La aplicación del marcaje de moléculas con isótopos radiactivos ha demostrado su vigencia, especialmente en su conveniencia para obtener imágenes de distribución de los fármacos y su cinética. Se dispone de técnicas para dar respuesta a las más importantes investigaciones que se demanden.
Palabras claves: péptidos, anticuerpos monoclonales, tratamiento de imágenes, medicamentos, estándar, manufactura.
ABSTRACT
Drugs production is a highly demanding industry because of the high rigor of current regulations and standards which apply to manufacturing facilities. They are also required in the research and development stage. Our national biotechnological industry is developing and producing important drugs for national and international market to treat diseases like cancer. The Isotope Centre is an institution supporting such a development by means of a work platform to carry out researches in the field of pharmacokinetic and biodistribution in experimental models. Accumulated experience allows us to contribute to research and development of different kind of products (i.e. biotechnological), what represents a move towards the development of new technologies and the incorporation of appropriate methodologies to current standards. Radiolabeling is still a convenient choice to obtain images of drug distribution and kinetics. With the techniques currently available and those to be used in a near future, we can undertake to the most important researches required.
Key words: peptides, monoclonal antibodies, image processing, drugs, standards, manufacturing.
INTRODUCCIÓN
George Hevesy, descubridor del método de los indicadores radiactivos, inició sus trabajos con animales de laboratorio en 1924, identificando aspectos metodológicos claves como la selección del radisótopo y el establecimiento de modelos experimentales. Sus resultados, publicados en 1937, se relacionan con investigaciones del tejido óseo, marcaje de glóbulos rojos de la sangre, ácidos grasos, estudios de permeabilidad, metabolismo del hierro, efectos biológicos de las radiaciones, aplicaciones en botánica, entre otros [1], por lo que se considera el pionero de los estudios biomédicos con sustancias radiactivas y en alguna medida, padre de la medicina nuclear. La preparación de di-iodofluoresceína marcada con ![]() por Moore en 1948 da origen al concepto de marcaje al incorporarse un radionúclido a una molécula específica [2]. Como el hidrógeno y el carbono son los elementos químicos más abundantes en las moléculas de naturaleza biológica, sus radisótopos
por Moore en 1948 da origen al concepto de marcaje al incorporarse un radionúclido a una molécula específica [2]. Como el hidrógeno y el carbono son los elementos químicos más abundantes en las moléculas de naturaleza biológica, sus radisótopos ![]() y el
y el ![]() han sido muy utilizados desde entonces, siguiéndole
han sido muy utilizados desde entonces, siguiéndole ![]() ,
, ![]() ,
, ![]() ,
, ![]() y
y![]() , entre otros [3]. Hoy día han ganado particular importancia aquellos que permiten obtener imágenes in vivo como
, entre otros [3]. Hoy día han ganado particular importancia aquellos que permiten obtener imágenes in vivo como ![]() ,
, ![]() ,
, ![]() ,
, ![]() ,
, ![]() , asociado también a las investigaciones clínicas con el uso de moléculas marcadas como componentes esenciales de radiofármacos. Los primeros radiofármacos derivaron de fármacos convencionales como el ácido iodohipúrico, medio de contraste en radiografía que al ser marcado con
, asociado también a las investigaciones clínicas con el uso de moléculas marcadas como componentes esenciales de radiofármacos. Los primeros radiofármacos derivaron de fármacos convencionales como el ácido iodohipúrico, medio de contraste en radiografía que al ser marcado con ![]() en 1960 por Tubis [4] se convirtió desde entonces en estándar de oro para la evaluación de la función excretora de los riñones mediante la medición del flujo plasmático renal (FPR). El FPR es una medida del aclaramiento renal, una aplicación concreta de la farmacocinética en la medicina nuclear.
en 1960 por Tubis [4] se convirtió desde entonces en estándar de oro para la evaluación de la función excretora de los riñones mediante la medición del flujo plasmático renal (FPR). El FPR es una medida del aclaramiento renal, una aplicación concreta de la farmacocinética en la medicina nuclear.
Los estudios farmacocinéticos con sustancias radiactivas son la base de las aplicaciones en medicina nuclear y de la evaluación dosimétrica de radiofármacos. Pero además, son una herramienta esencial en el desarrollo de medicamentos. La farmacología por su parte, ha contribuido también con modelos experimentales, tanto in vitro como in vivo para la evaluación de radiofármacos. Al mismo tiempo la medicina nuclear, a través de su instrumentación y metodología, ha hecho un importante aporte en estudios farmacocinéticos y farmacodinámicos en animales vinculándose estrechamente ambas especialidades y brindando un puente entre la evaluación preclínica y clínica [5].
En oncología dos de los más relevantes protocolos clínicos, la fluorodeoxigludosa (FDG) para cuantificar el metabolismo tisular e inflamación y la fuorotimidina (FLT) para cuantificar la proliferación celular son de los procedimientos más utilizados en investigaciones preclínicas [6-9]. El ![]() para evaluar la variable perfusión y un péptido marcado con
para evaluar la variable perfusión y un péptido marcado con ![]() , que reconoce receptores de integrinas como trazador de angiogénesis, se han utilizado para evaluar la influencia de una metaloproteinasa constitutiva en la recuperación de infartos de miocardio en modelos con ratones transgénicos. La instrumentación utilizada es el micro SPECT [10]. Interés particular revisten los estudios imagenológicos en el largo y engorroso proceso de aprobación de nuevos medicamentos, ya sean fármacos o radiofármacos. El cuerpo humano, como el de todo ser viviente, es un sistema muy complejo y la adquisición de datos estáticos y dinámicos resulta en una gran cantidad de información. Uno de los mayores retos para investigadores y clínicos es cómo adquirir, procesar y mostrar esa vasta información de forma que se pueda interpretar y transformar en métodos de diagnóstico y terapéuticos más útiles. En muchos casos el enfoque más conveniente para enfrentar ese reto es la presentación de esa información en imágenes [11], las cuales contribuyen a agilizar la evaluación de nuevas moléculas de diagnóstico y facilitan el estudio de los efectos farmacológicos de drogas para el cáncer, Alzheimer, terapia génica, etc. [12]. La explicación es sencilla: estas técnicas pueden reducir en un tercio el tiempo de ensayo en las fases I y II de aprobación de un fármaco, con la disminución del costo en el proceso de investigación.
, que reconoce receptores de integrinas como trazador de angiogénesis, se han utilizado para evaluar la influencia de una metaloproteinasa constitutiva en la recuperación de infartos de miocardio en modelos con ratones transgénicos. La instrumentación utilizada es el micro SPECT [10]. Interés particular revisten los estudios imagenológicos en el largo y engorroso proceso de aprobación de nuevos medicamentos, ya sean fármacos o radiofármacos. El cuerpo humano, como el de todo ser viviente, es un sistema muy complejo y la adquisición de datos estáticos y dinámicos resulta en una gran cantidad de información. Uno de los mayores retos para investigadores y clínicos es cómo adquirir, procesar y mostrar esa vasta información de forma que se pueda interpretar y transformar en métodos de diagnóstico y terapéuticos más útiles. En muchos casos el enfoque más conveniente para enfrentar ese reto es la presentación de esa información en imágenes [11], las cuales contribuyen a agilizar la evaluación de nuevas moléculas de diagnóstico y facilitan el estudio de los efectos farmacológicos de drogas para el cáncer, Alzheimer, terapia génica, etc. [12]. La explicación es sencilla: estas técnicas pueden reducir en un tercio el tiempo de ensayo en las fases I y II de aprobación de un fármaco, con la disminución del costo en el proceso de investigación.
Existen revisiones de modalidades de imágenes, basadas en diferentes principios físicos, que han ido ganando espacio paulatinamente a medida que se le han dado soluciones a los aspectos técnicos que implica su utilización en modelos experimentales [13-15].
Las tecnologías imagenológicas basadas en diferencias físicas pueden distinguir al tejido normal del patológico sin considerar los eventos moleculares específicos responsables de la enfermedad. Ha sido necesario un cambio de enfoque para explotar la posibilidad de sondear eventos fisiológicos, bioquímicos o moleculares. Este cambio de enfoque, desde lo no específico a lo específico, representa un cambio cualitativo importante por cuanto nos provee del potencial para entender y caracterizar tempranamente las enfermedades y evaluar la eficacia de su tratamiento, siguiendo un trayecto que ha conducido a lo que conocemos hoy como imagen molecular [16].
La tomografía por emisión positrónica (PET) y la tomografía por emisión monofotónica (SPECT), se han reseñado bien [14], constituyendo herramientas ideales para la investigación y desarrollo de medicamentos, ya que permiten medir las variaciones de concentración de la droga en los tejidos antes no accesibles, la farmacocinética, a la vez que se observa el proceso de efecto de la droga, la farmacodinamia.
Investigaciones no clínicas en el Centro de Isótopos
Lo primero fue el desarrollo de métodos de marcaje, iniciado antes de inaugurarse el CENTIS: prostanoides [17,18], Policosanol (PPG), G1 (un producto para infecciones de la piel), antibióticos, entre otros, con algunos ensayos en animales. La investigación y producción de fármacos novedosos por parte de la industria biotecnológica nacional estimularon los estudios de farmacocinética y biodistribución en animales de laboratorio, siendo una de las funciones actuales del Centro de Isótopos, dada sus instalaciones únicas y la experiencia adquirida por sus especialistas. Al tratarse como regla, de productos en desarrollo, cada estudio ha devenido de hecho en una investigación. En 15 años han sido numerosos, nos referiremos a los más importantes como la Melagenina, fármaco cubano único en su tipo para el tratamiento eficaz del vitiligo desarrollado en el Centro de Histoterapia Placentaria. Marcada la molécula con ![]() , se realizó un detallado estudio de absorción percutánea in vivo en ratas e in vitroen celdas de difusión, este último sin antecedentes en el país. El objetivo, probar que el producto de uso tópico, no se incorporaba al lecho vascular, factor que contribuyó a su registro médico. Siguiendo la línea de la absorción percutánea se evaluaron cinco formulaciones diferentes de Propionato de Clobetasol, trabajo realizado a solicitud del Centro de Investigación y Desarrollo de Medicamentos. El Clobetasol es un antiinflamatorio esteroidal de elevada potencia también de uso tópico en el tratamiento de diversas patologías de la piel. Su aplicación crónica presenta serias reacciones adversas y de ahí la necesidad de obtener una formulación encapsulada en liposomas capaz de concentrar la mayor cantidad del medicamento en el sitio de aplicación reduciendo su absorción sistémica. El trabajo realizado permitió comprobar la hipótesis inicial en relación con la nueva formulación, dando lugar a una patente de invención [19]. Más recientemente la colaboración se ha centrado en estudios sobre productos líderes, asociados al receptor del factor de crecimiento epidérmico (EGF-r) blanco celular, de interés desde hace varios años, en el desarrollo de fármacos para el tratamiento de patologías relacionadas con este receptor. El EGF-r se expresa o sobre-expresa en una gran variedad de tumores sólidos humanos. Las aplicaciones oncológicas de radiofármacos cubanos basados en anticuerpos monoclonales dirigidos al EGF-r se tratan por su importancia en otro trabajo de esta revista. Uno de los primeros esfuerzos, la obtención del perfil farmacocinético del anticuerpo monoclonal hR3, llevado a cabo en CENTIS en monos verdes resultó un significativo hito que puso en tensión durante 3 meses a esta institución, a investigadores del Centro de Inmunología Molecular, al Centro Nacional para la Producción de Animales de Laboratorio y al Centro Nacional de Seguridad Nuclear, resultando una experiencia única de integración y esfuerzo en función de un objetivo. Se realizaron también estudios en ratas con radiofármaco para diagnóstico marcado con
, se realizó un detallado estudio de absorción percutánea in vivo en ratas e in vitroen celdas de difusión, este último sin antecedentes en el país. El objetivo, probar que el producto de uso tópico, no se incorporaba al lecho vascular, factor que contribuyó a su registro médico. Siguiendo la línea de la absorción percutánea se evaluaron cinco formulaciones diferentes de Propionato de Clobetasol, trabajo realizado a solicitud del Centro de Investigación y Desarrollo de Medicamentos. El Clobetasol es un antiinflamatorio esteroidal de elevada potencia también de uso tópico en el tratamiento de diversas patologías de la piel. Su aplicación crónica presenta serias reacciones adversas y de ahí la necesidad de obtener una formulación encapsulada en liposomas capaz de concentrar la mayor cantidad del medicamento en el sitio de aplicación reduciendo su absorción sistémica. El trabajo realizado permitió comprobar la hipótesis inicial en relación con la nueva formulación, dando lugar a una patente de invención [19]. Más recientemente la colaboración se ha centrado en estudios sobre productos líderes, asociados al receptor del factor de crecimiento epidérmico (EGF-r) blanco celular, de interés desde hace varios años, en el desarrollo de fármacos para el tratamiento de patologías relacionadas con este receptor. El EGF-r se expresa o sobre-expresa en una gran variedad de tumores sólidos humanos. Las aplicaciones oncológicas de radiofármacos cubanos basados en anticuerpos monoclonales dirigidos al EGF-r se tratan por su importancia en otro trabajo de esta revista. Uno de los primeros esfuerzos, la obtención del perfil farmacocinético del anticuerpo monoclonal hR3, llevado a cabo en CENTIS en monos verdes resultó un significativo hito que puso en tensión durante 3 meses a esta institución, a investigadores del Centro de Inmunología Molecular, al Centro Nacional para la Producción de Animales de Laboratorio y al Centro Nacional de Seguridad Nuclear, resultando una experiencia única de integración y esfuerzo en función de un objetivo. Se realizaron también estudios en ratas con radiofármaco para diagnóstico marcado con ![]() y para terapia marcado con
y para terapia marcado con ![]() e
e ![]() . El Heberprot es una formulación del Centro de Ingeniería Genética y Biotecnología (CIGB), resultado de los estudios del EGF-r. Su aplicación local en ulceraciones de extremidades en pacientes diabéticos, ha permitido implementar un tratamiento efectivo ante esta complicación, muy frecuente en esta patología y que conduce frecuentemente a la amputación del miembro. Bien probada la utilidad clínica del Heberprot, quedaban factores por caracterizar, desde el punto de vista experimental. El marcaje del producto con
. El Heberprot es una formulación del Centro de Ingeniería Genética y Biotecnología (CIGB), resultado de los estudios del EGF-r. Su aplicación local en ulceraciones de extremidades en pacientes diabéticos, ha permitido implementar un tratamiento efectivo ante esta complicación, muy frecuente en esta patología y que conduce frecuentemente a la amputación del miembro. Bien probada la utilidad clínica del Heberprot, quedaban factores por caracterizar, desde el punto de vista experimental. El marcaje del producto con ![]() se realizó mediante el método del iodógeno [20], la purificación por exclusión molecular, los estudios de farmacocinética y biodistribución en ratones y ratas después de una administración y a dosis repetidas. Muy recientemente se concluyó la evaluación de su absorción en un modelo de lesión granulada inducida en conejos. En este último trabajo se empleó la gammagrafía y el marcaje con
se realizó mediante el método del iodógeno [20], la purificación por exclusión molecular, los estudios de farmacocinética y biodistribución en ratones y ratas después de una administración y a dosis repetidas. Muy recientemente se concluyó la evaluación de su absorción en un modelo de lesión granulada inducida en conejos. En este último trabajo se empleó la gammagrafía y el marcaje con ![]() para evaluar la velocidad de decrecimiento del EGF radiomarcado después de aplicado en la lesión, con un diseño experimental que comprendió variables como la dosis y el volumen administrado. Los resultados de estos trabajos serán publicados en breve. En todos los casos, tanto el rendimiento de marcaje como la pureza radioquímica después de la purificación resultaron satisfactorios para la posterior administración en el modelo experimental. Acudiendo a otras técnicas analíticas como el ELISA se comprobó la veracidad de los datos aportados mediante el marcaje y análisis radiométrico.
para evaluar la velocidad de decrecimiento del EGF radiomarcado después de aplicado en la lesión, con un diseño experimental que comprendió variables como la dosis y el volumen administrado. Los resultados de estos trabajos serán publicados en breve. En todos los casos, tanto el rendimiento de marcaje como la pureza radioquímica después de la purificación resultaron satisfactorios para la posterior administración en el modelo experimental. Acudiendo a otras técnicas analíticas como el ELISA se comprobó la veracidad de los datos aportados mediante el marcaje y análisis radiométrico.
La metodología más utilizada por CENTIS es el análisis compartimental, siguiendo el enfoque tradicional o poblacional en dependencia del diseño experimental. Otras herramientas fueron las simulaciones del comportamiento de la molécula a diferentes regímenes de dosis, muy útil en la optimización de estudios posteriores. La utilidad de la aplicación de medios imagenológicos se aprecia en la biodistribución [![]() ]-EGF en ratones (figura 1). Solo el sitio de administración al inicio, la orina a las cuatro horas y la tiroides después de las ocho horas son significativamente visibles, este último sitio debido a la degradación in vivo de la molécula.
]-EGF en ratones (figura 1). Solo el sitio de administración al inicio, la orina a las cuatro horas y la tiroides después de las ocho horas son significativamente visibles, este último sitio debido a la degradación in vivo de la molécula.
Al aplicarse la gammagrafía, la desaparición de la molécula del sitio de administración se puede medir fácilmente en el transcurso del tiempo con un número reducido de animales, de lo contrario el estudio farmacocinético se limita a la determinación de concentraciones en sangre. Este principio, vinculado a un diseño experimental basado en el enfoque poblacional, fue aplicado en el indicado modelo de lesión inducida en conejos. Otro objeto de estudio han sido los péptidos como el CIGB-300 con demostrada actividad antitumoral en modelos experimentales y que se encuentra en evaluación clínica. Por la naturaleza de su actividad farmacológica, es conveniente la adquisición de imágenes, por lo que fue marcado por método directo con ![]() , aprovechando la propia estructura del péptido. Enfoques similares han sido propuestos por otros autores para el desarrollo de radiofármacos basados en radisótopos de Re [21]. La evaluación farmacocinética y de biodistribución se realizó en animales sanos y en modelos tumorales. Los diseños experimentales siguieron igualmente el enfoque poblacional, y el cálculo de los parámetros farmacocinéticos se basó, en la mayoría de los casos, en el análisis compartimental. Los estudios abarcaron: farmacocinética y biodistribución en ratas sanas por vía intravenosa, subcutánea e intramuscular, farmacocinética y biodistribución en ratones con xenoinjerto de tumor, administrando por vía intravenosa, subcutánea e intraperitoneal.
, aprovechando la propia estructura del péptido. Enfoques similares han sido propuestos por otros autores para el desarrollo de radiofármacos basados en radisótopos de Re [21]. La evaluación farmacocinética y de biodistribución se realizó en animales sanos y en modelos tumorales. Los diseños experimentales siguieron igualmente el enfoque poblacional, y el cálculo de los parámetros farmacocinéticos se basó, en la mayoría de los casos, en el análisis compartimental. Los estudios abarcaron: farmacocinética y biodistribución en ratas sanas por vía intravenosa, subcutánea e intramuscular, farmacocinética y biodistribución en ratones con xenoinjerto de tumor, administrando por vía intravenosa, subcutánea e intraperitoneal.
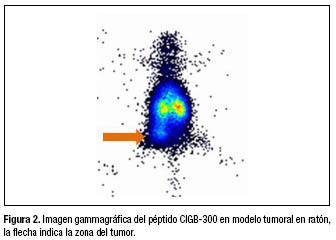
La imagen gammagráfica jugó un papel importante en los modelos de tumores y en la administración subcutánea, por cuanto no solo se visualiza y cuantifica la captación en el tejido blanco, sino también se cuantifica su aclaramiento desde el sitio de administración. De esta forma, aplicando la modelación compartimental con un balance de masas apropiado se pueden establecer las tasas de intercambio entre el sitio de administración y los probables blancos. También se pueden introducir variables categóricas como la dosis o el sitio de absorción o covariables como el tamaño del tumor.
En la figura 2 se observa una imagen gammagráfica de la distribución del péptido CIGB-300 en ratones con xenoinjerto de tumor. El tumor implantado se encontraba en la cara interna del muslo derecho.
El radiomarcaje diseñado se ha utilizado tanto en modelos experimentales como en ensayos clínicos, algunos resultados ya se han publicado [22-24].
Otro trabajo importante es el de los estudios de biodistribución y farmacocinética a productos naturales como la mangiferina, componente fundamental del Vimang con propiedades antioxidantes. CENTIS a su vez ha prestado atención al desarrollo de su nomenclatura de radiofármacos, con la realización de estudios similares. Sirva de ejemplo el Fosfato de Cromo (III)-![]() para el tratamiento de la sinovitis crónica, ya en aplicación clínica [25,26].
para el tratamiento de la sinovitis crónica, ya en aplicación clínica [25,26].
Metodología de trabajo
El equipo multidisciplinario de CENTIS realiza el marcaje de la molécula, la preparación del modelo en animales y la parte experimental. Los diseños de experimentos implican en muchos casos la realización de imágenes gammagráficas. Los estudios de biodistribución se realizan, tanto por disección y conteo directo de las muestras de órganos y tejidos como por procesamiento de imágenes gammagráficas. Para ello se cuenta con herramientas de cálculo elaboradas específicamente para estos fines como hojas de cálculo que forman parte de un sistema informatizado único junto a los sistemas de procesamiento de imágenes basados en plataformas libres.
En los estudios farmacocinéticos se ha utilizado fundamentalmente el análisis compartimental aprovechando las posibilidades que brinda los datos de biodistribución, especialmente cuando provienen de imágenes gammagráficas seriadas. Esta es una de las ventajas que aporta la imagenología, por cuanto se pueden realizar diseños experimentales más completos con un número menor de animales y se obtiene una cantidad de información mayor. Con estas posibilidades se pueden hacer análisis farmacocinéticos, aplicando diseños de datos escasos ("sparse data") o de perfiles incompletos por individuos. El análisis se conoce como farmacocinética poblacional y se basa en la modelación no lineal de efectos mixtos descrita por Sheiner y col. [27]. Este enfoque, aplicado en la evaluación farmacocinética y farmacodinámica está cobrando cada día más aplicación en la práctica clínica y experimental, porque aporta una poderosa herramienta de análisis adaptable a un sin número de situaciones.
El análisis permite que los estudios de farmacocinética y farmacodinamia se desarrollen bajo condiciones de recogida de datos menos estricta o restringida por cuanto la unidad de análisis no es el individuo sino la población. Las muestras pueden ser escasas, no balanceadas o fragmentarias en comparación con el enfoque tradicional que exige esquemas de muestreos rígidos y extensos [28]. De esta forma, combinado con un adecuado análisis matemático y estadístico se convierte en una alternativa a los diseños exhaustivos y cuenta desde hace tiempo con normativas para su aplicación [29].
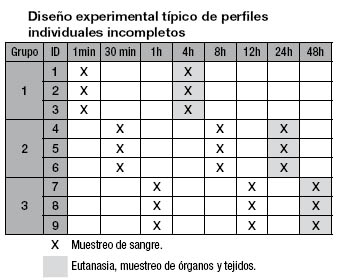
Desde el punto de vista experimental también ha cobrado relevancia y se ha sugerido su uso en animales como enfoque especial en algunas normativas [30]. Hoy día es cada vez más frecuente su aplicación en farmacocinética experimental [31,32] y toxicología [33]. El sistema de cálculo farmacocinético adoptado recientemente en CENTIS es el MONOLIX [34], cuyo algoritmo SAEN (stochastic approximation expectation maximization), ha demostrado ser robusto y con buenas posibilidades de modelación y simulación en estudios farmacocinéticos y farmacodinámicos [35]; se puede emplear en el análisis de datos continuos y discretos, proporcionando estimados precisos de los parámetros y de su error estándar con un tiempo de procesamiento más rápido que otros algoritmos. Un estudio farmacocinético típico se puede realizar con un diseño experimental como se resume en la tabla. Este se podría aplicar, por ejemplo, a anticuerpos monoclonales por ser usualmente de lento aclaramiento. Las ventajas son: con solo dos a tres muestras de no más de 70 microlitros por idividuo no se altera hemodinámicamente el animal, basándonos en su volumen de sangre total, se pueden agrupar los individuos introduciendo puntos intermedios de eutanasia para disección y biodistribución y se utilizan menos animales en el diseño. Otras técnicas analíticas pueden necesitar un volumen mayor de muestra, en cuyo caso adquiere mayor valor el diseño.
Aplicando la modelación descrita a este diseño se obtienen los parámetros farmacocinéticos poblacionales e individuales con sus respectivos errores. La influencia de determinados factores sobre ellos se realiza mediante análisis categórico o de covariables. Este enfoque se ha aplicado con éxito en nuestras investigaciones obteniéndose estimados poblacionales e individuales de los parámetros farmacocinéticos con errores relativos inferiores al 20%. La experiencia técnica en la ejecutoria también juega un papel importante, por lo que los datos escasos no pueden ser una consecuencia del desempeño, son una necesidad de diseño basada en aspectos éticos y prácticos en experimentación animal.
Como perspectiva de trabajo inmediata tenemos la puesta a punto próximamente de sistemas tomográficos SPECT y un microPET/CT con lo que aumentaría cualitativamente y cuantitativamente las posibilidades de experimentación junto con el establecimiento del Sistema de Buenas Prácticas en investigaciones no clínicas. Otros ensayos serán incorporados a nuestro arsenal como los ensayos in vitro en cultivos celulares, una vez que estén creadas las condiciones para ello.
CONCLUSIONES
El CENTIS ha probado que puede abordar tareas de marcaje de moléculas de diversa naturaleza y realizar estudios de farmacocinética en modelos experimentales en animales de laboratorio con posibilidades de abarcar desde roedores hasta primates no humanos.
Los resultados obtenidos han contribuido a la conformación de los expedientes exigidos por los órganos reguladores nacionales e internacionales para iniciar ensayos clínicos de productos líderes de la industria biotecnológica nacional.
Si bien no siempre se ha contado con los medios más apropiados, el rigor de los datos suministrados ha sido adecuado, probándose que no se trata solamente de disponer de herramientas, sino de saberlas utilizar apropiadamente.
REFERENCIAS BIBLIOGRÁFICAS
1. HEVESY G von. Adventures in radioisotope research: the collected papers. New York: Pergamon Press, 1962. vols. 1 and 2.
2. MOORE GE. Use of radioactive diiodofluorescein in the diagnosis and localization of brain tumors. Science. 1948; 107(2787): 569-571.
3. DALVIE D. Recent advances in the applications of radioisotopes in drug metabolism toxicology and pharmacokinetics. Curr. Pharm. Design. 2000; 6(10): 1009-28.
4. TUBIS M, POSNICK E, NORDYKE RA. Preparation and use of I 131 labeled sodium iodohippurate in kidney function tests. Proc Soc Exp Biol Med. 1960; 103: 497-498.
5. KAIMAL V, MCCONVILLE P. Importance of preclinical imaging in drug discovery. Technical Sheet. Charles River Laboratory International, Inc. 2009.
6. PAUWELS EK, et. al. FDG accumulation and tumor biology. Nucl. Med. Biol. 1998. 25(4): 317-322.
7. RUDD JH, et. al. Atherosclerosis inflammation imaging with 18F-FDG PET: carotid, iliac, and femoral uptake reproducibility, quantification methods and recommendations. J Nucl Med. 2008; 498(6): 871-878.
8. SHIELDS AF, et. al. Imaging proliferation in vivo with [F-18] FLT and positron emission tomography. Nature Med. 1998; 4: 1334-1336.
9. FRANC BL, ACTON PD, MARI M, HASEGAWAY BH. Small-animal SPECT and SPECT/CT: important tools for preclinical investigation. J Nucl Med. 2008; 49(10):1651-1663.
10. HENDEE WR, RUSSELL RITENOUR E. Medical imaging physics. John Wiley & Sons, Inc, 2002. Cuarta edición.
11. NARVÁEZ M, MERELLO E, TORIBIO C, BENLLOCH JM. Ciencias de la salud: diagnóstico por Imagen. estudio de prospectiva. Fundación OPTI y FENIN. Federación Española de Empresas de Tecnologías Sanitaria, 2009.
12. HENGERER A, MERTELMEIER T. Molecular biology for medical imaging. Electromedia. 2001; 69(1): 44-49.
13. CHATZIIOANNOU AF. Instrumentation for molecular imaging in preclinical research micro-pet and micro-spect. Proc Am Thorac Soc. 2005; 2(6): 533-536.
14. CASSIDY PJ, RADDA GK. Molecular imaging perspectives. J. R. Soc. Interface. 2005; 2(3): 133-144.
15. MASSOUD TF, GAMBHIR SS. Molecular imaging in living subjects: seeing fundamental biological processes in a new light. Genes Dev. 2003; 17(5): 545-580.
16. DUCAT L. Obtención de prostaglandina A2 (PGA2) marcada con tritio. Rev Cub Farm. 1982; 16(3): 264-270.
17. DUCAT L. Obtención de ácido eicosatriénico marcado con tritio por hidrogenación catalítica. Radioquímica.1985; 3: 301.
18. PÉREZ X, DE LA PAZ N, GARCÍA L. Formulación liposómica de propionato de clobetasol. (Patente WO-02/07702.). 2002.
19. FRAKER PJ, SPECK JC Jr. Protein and cell membrane iodinations with a sparingly soluble Iodogen. Biochem. Biophys. Res. Commun. 1978; 80(4): 849-857.
20. HEINRICH TK, KRAUS W, PIETZSCH HJ, et. al. Novel rhenium chelate system derived from dimercaptosuccinic acid for the selective labeling of biomolecules. Inorg. Chem. 2005; 44(26): 9930-9937.
21. PERERA Y, FARINA HG, HERNÁNDEZ I, et. al. Systemic administration of a peptide that impairs the Protein Kinase (CK2) phosphorylation reduces solid tumor growth in mice. Int. J. Cancer. 2008; 122(1): 57-62.
22. PEREA SE, REYES O, BALADRON I, et. al. CIGB-300, a novel proapoptotic peptide that impairs the CK2 phosphorylation and exhibits anticancer properties both in vitro and in vivo. Mol Cell Biochem. 2008; 316(1-2):163-167.
23. PEREA SE, BALADRON I, GARCIA Y, et. al. CIGB-300, a synthetic peptide-based drug that targets the CK2 phosphoaceptordomain. Translational and clinical research. Mol Cell Biochem. 2011; 356(1-2): 45-50.
24. RODRÍGUEZ J, DI PIERRO D, GIOIA M, et. al. Effect of a natural extract from Mangiferaindica L. and its active compound, mangiferin, on energy stage and lipid peroxidation of red blood cells. Biochim Biophys Acta. 2006; 1760: 1333-1342.
25. CRUZ ARENCIBIA J, et. al. Fosfato de cromo (III) marcado con diferentes radionúclidos para uso en radiosinoviortesis. Rev Cubana Farm. 2012; 46(2): 162-172.
26. SHEINER LB, ROSENBERG B, MARATHE VV. Estimation of population characteristics of population pharmacokinetic parameters from routine clinical data. J Pharmacokinet Biopharm. 1977; 5(5): 445-479.
27. ROY A, ETTE EI. A pragmatic approach to the design of population pharmacokinetic studies. AAPS J. 2005; 7(2): E408-E420.
28. United States Food and Drug Administration. Guidance for industry: population pharmacokinetics. Washington, DC: United States Food and Drug Administration, 1999.
29. Directive 81/852/EEC as amended. Conduct of pharmacokinetic studies in animals. 1992.
30. BENDER G, FLORIAN JA, BRAMWELL S, et. al. Pharmacokinetic-pharmacodynamic analysis of the static allodynia response to pregabalin and sildenafil in a rat model of neuropathic pain. J Pharmacol Exp Ther. 2010; 334(2): 599-608.
31. LEE SH, GHIM JL, SONG MH, et. al. Pharmacokinetics and pharmacodynamics of a new reformulated microemulsion and the long-chain triglyceride emulsion of propofol in beagle dog. Brit J Pharm. 2009; 158(8): 1982-1995.
32. AARONS L, GRAHAM G. Methodological approaches to the population analysis of toxicity data. Toxicology Letters. 2001; 120(1-3): 405-410.
33. LIXOFT SA. MONOLIX versión 4.1.0 [software en línea]. <http://www.lixoft.com> [diciembre 2011].
34. SAVIC R M, MENTRÉ F, LAVIELLE M. Implementation and evaluation of the saem algorithm for longitudinal ordered categorical data with an illustration in pharmacokinetics-pharmacodynamics. AAPS J. 2011; 13(1): 45-53.
35. BROWN RP, DELP MD, LINDSTEDT SL. Physiological parameters values for physiologically based pharmacokinetic models. Toxicol Ind Health. 1997; 13(4): 407-484.
Recibido: 3 de septiembre de 2012
Aceptado: 4 de octubre de 2012