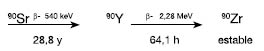Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Nucleus
versión impresa ISSN 0864-084X
Nucleus no.52 Ciudad de La Habana jul.-dic. 2012
CIENCIAS NUCLEARES
Itrio 90 como radionúclido para terapia
Ytrium 90 as a radionuclide for therapy
Alejandro Alberti Ramírez, Amed Cruz Morales, José Morín Zorrilla
Centro de Isótopos. Ave. Monumental y Carretera La Rada, km 3 ½, San José de las Lajas, Mayabeque, Cuba
RESUMEN
El ![]() es un emisor beta puro con período de semidesintegración de 64.1 horas y 2.28 MeV de energía, características apropiadas para su uso como radionúclido terapéutico. Radiofármacos de
es un emisor beta puro con período de semidesintegración de 64.1 horas y 2.28 MeV de energía, características apropiadas para su uso como radionúclido terapéutico. Radiofármacos de ![]() han sido efectivos en el tratamiento de diferentes enfermedades como sinovitis crónica, cáncer de hígado, dolor por metástasis óseas y tumores de origen neuroendocrino. Mención aparte merecen los resultados en el tratamiento de los linfomas no-Hodgkin, que combinan la especificidad de un anticuerpo monoclonal por el antígeno CD20 y la energía beta pura del
han sido efectivos en el tratamiento de diferentes enfermedades como sinovitis crónica, cáncer de hígado, dolor por metástasis óseas y tumores de origen neuroendocrino. Mención aparte merecen los resultados en el tratamiento de los linfomas no-Hodgkin, que combinan la especificidad de un anticuerpo monoclonal por el antígeno CD20 y la energía beta pura del ![]() . Aunque el período de semidesintegración del
. Aunque el período de semidesintegración del ![]() permite su transportación, se comercializa a precios elevados para una utilización sistemática o a gran escala. El hecho de que se pueda obtener a través de un generador radisotópico, basado en el equilibrio secular que se establece con el
permite su transportación, se comercializa a precios elevados para una utilización sistemática o a gran escala. El hecho de que se pueda obtener a través de un generador radisotópico, basado en el equilibrio secular que se establece con el ![]() , hace que su producción local sea atractiva, pues reduciría significativamente los costos y facilitaría su disponibilidad. En este trabajo se exponen las vías para obtener
, hace que su producción local sea atractiva, pues reduciría significativamente los costos y facilitaría su disponibilidad. En este trabajo se exponen las vías para obtener ![]() , aspectos relacionados con la calidad del producto final, sus principales aplicaciones y los resultados obtenidos en el Centro de Isótopos.
, aspectos relacionados con la calidad del producto final, sus principales aplicaciones y los resultados obtenidos en el Centro de Isótopos.
Palabras claves: Itrio 90, radisótopos, terapia, radiofármacos, estimación de costo, Estroncio 90, generadores de radisótopos.
ABSTRACT
![]() is a pure beta emitter with a half-life of 64.1h and 2.28 MeV of energy, suitable properties for its use as a therapeutic radionuclide. Radiopharmaceuticals based on
is a pure beta emitter with a half-life of 64.1h and 2.28 MeV of energy, suitable properties for its use as a therapeutic radionuclide. Radiopharmaceuticals based on ![]() have been effectively used in the treatment of different diseases such as chronic synovitis, liver cancer, pain caused by bone metastases and neuroendocrine tumors. The results in the treatment of no-Hodgkin lymphoma, that combine the specificity of a monoclonal antibody for CD20 antigen and the pure beta energy of
have been effectively used in the treatment of different diseases such as chronic synovitis, liver cancer, pain caused by bone metastases and neuroendocrine tumors. The results in the treatment of no-Hodgkin lymphoma, that combine the specificity of a monoclonal antibody for CD20 antigen and the pure beta energy of ![]() , deserve a particular distinction. Although the half-life of
, deserve a particular distinction. Although the half-life of ![]() makes possible its transportation, it is sold at high prices for a systematic or large-scale use. The fact that
makes possible its transportation, it is sold at high prices for a systematic or large-scale use. The fact that ![]() can be produced through a radionuclide generator system, based on the secular equilibrium of
can be produced through a radionuclide generator system, based on the secular equilibrium of ![]() decaying to
decaying to ![]() , is very attractive for developing a local production because the cost could be significantly reduced and
, is very attractive for developing a local production because the cost could be significantly reduced and ![]() availability could be guaranteed. The present work shows the ways to obtain
availability could be guaranteed. The present work shows the ways to obtain ![]() , the aspects related to the quality of final product, the main applications and the results achieved by the Isotope Centre in this area.
, the aspects related to the quality of final product, the main applications and the results achieved by the Isotope Centre in this area.
Key words: Yttrium 90, radioisotopes, therapy, radiopharmaceuticals, cost estimation, Strontium 90, radioisotope generators.
INTRODUCCIÓN
El ![]() es un emisor puro de partículas beta de energía promedio de 0.935 y máxima de 2.284 MeV y período de semidesintegración de 64.1 horas, características apropiadas para uso terapéutico. El itrio, elemento asociado al
es un emisor puro de partículas beta de energía promedio de 0.935 y máxima de 2.284 MeV y período de semidesintegración de 64.1 horas, características apropiadas para uso terapéutico. El itrio, elemento asociado al ![]() , está bien estudiado, con grado de oxidación 3+ y versátil química de coordinación, características favorables para la obtención de radiofármacos. Preparados de
, está bien estudiado, con grado de oxidación 3+ y versátil química de coordinación, características favorables para la obtención de radiofármacos. Preparados de ![]() han sido efectivos en sinovitis crónica, tratamiento paliativo de cáncer de hígado y se encuentran en extensión en el tratamiento del dolor por metástasis óseas y en el de tumores de origen neuroendocrino [1-5]. Mención aparte merecen los resultados en el tratamiento de los linfomas no-Hodgkin, que combinan la especificidad de un anticuerpo monoclonal por el antígeno CD20 y la energía beta pura del
han sido efectivos en sinovitis crónica, tratamiento paliativo de cáncer de hígado y se encuentran en extensión en el tratamiento del dolor por metástasis óseas y en el de tumores de origen neuroendocrino [1-5]. Mención aparte merecen los resultados en el tratamiento de los linfomas no-Hodgkin, que combinan la especificidad de un anticuerpo monoclonal por el antígeno CD20 y la energía beta pura del ![]() [6]. El éxito alcanzado en el tratamiento de esta patología, junto a las indicadas aplicaciones actuales y en desarrollo, han aumentado la demanda actual y potencial del
[6]. El éxito alcanzado en el tratamiento de esta patología, junto a las indicadas aplicaciones actuales y en desarrollo, han aumentado la demanda actual y potencial del ![]() . Aunque el período de semidesintegración del 90Y permite su transportación, se comercializa a precios elevados [7] para su utilización sistemática o a gran escala. El hecho de que se pueda obtener vía un generador de radionúclidos a partir del
. Aunque el período de semidesintegración del 90Y permite su transportación, se comercializa a precios elevados [7] para su utilización sistemática o a gran escala. El hecho de que se pueda obtener vía un generador de radionúclidos a partir del ![]() , producto de fisión con un período de semidesintegración de 28.8 años, hace que su producción local sea atractiva pues reduciría significativamente los costos y facilitaría su disponibilidad.
, producto de fisión con un período de semidesintegración de 28.8 años, hace que su producción local sea atractiva pues reduciría significativamente los costos y facilitaría su disponibilidad.
En el presente trabajo se exponen los métodos de obtención de ![]() , aspectos relacionados con la calidad del producto final, sus principales aplicaciones y los resultados preliminares obtenidos en el Centro de Isótopos durante la puesta en marcha y evaluación de un primer prototipo de generador electroquímico obtenido a través de un proyecto de cooperación técnica del Organismo Internacional de Energía Atómica.
, aspectos relacionados con la calidad del producto final, sus principales aplicaciones y los resultados preliminares obtenidos en el Centro de Isótopos durante la puesta en marcha y evaluación de un primer prototipo de generador electroquímico obtenido a través de un proyecto de cooperación técnica del Organismo Internacional de Energía Atómica.
Obtención de ![]() . Sistemas generadores
. Sistemas generadores
Existen dos vías principales de obtención de ![]() :
:
1. En reactores nucleares por la reacción ![]() (n,
(n,![]() )
) ![]() , en la que se obtienen bajas actividades específicas, ya que la sección eficaz de captura th es de pocos mb, aunque la abundancia natural, nat es del 100%. Eso hace que el producto obtenido sea inadecuado para las aplicaciones terapéuticas con radiofármacos basados en péptidos y anticuerpos monoclonales [1,6].
, en la que se obtienen bajas actividades específicas, ya que la sección eficaz de captura th es de pocos mb, aunque la abundancia natural, nat es del 100%. Eso hace que el producto obtenido sea inadecuado para las aplicaciones terapéuticas con radiofármacos basados en péptidos y anticuerpos monoclonales [1,6].
2. A partir de ![]() obtenido de productos de fisión de acuerdo con el esquema:
obtenido de productos de fisión de acuerdo con el esquema:
Como fuente de ![]() , el
, el ![]() posee las siguientes ventajas: vida media larga (28.8 años), que combinada con la vida media corta del producto de su desintegración (
posee las siguientes ventajas: vida media larga (28.8 años), que combinada con la vida media corta del producto de su desintegración (![]() ; 2.67 d) permite explotar un generador a partir del equilibrio radiactivo que se establece entre ambos radionúclidos, procedimientos conocidos de separación química e importantes reservas a partir del combustible nuclear [7,8].
; 2.67 d) permite explotar un generador a partir del equilibrio radiactivo que se establece entre ambos radionúclidos, procedimientos conocidos de separación química e importantes reservas a partir del combustible nuclear [7,8].
No existe hasta la fecha un generador comercial de ![]() /
/![]() , como ocurre con otros generadores de radionúclidos (
, como ocurre con otros generadores de radionúclidos (![]() /
/![]() ,
, ![]() /
/![]() ) [3]. Actualmente la producción de
) [3]. Actualmente la producción de ![]() es centralizada y los métodos de obtención se basan en las diferencias existentes entre la química del
es centralizada y los métodos de obtención se basan en las diferencias existentes entre la química del ![]() y el
y el ![]() . Los más empleados son el intercambio iónico y la extracción líquido-líquido. La extracción permite la producción de grandes cantidades de
. Los más empleados son el intercambio iónico y la extracción líquido-líquido. La extracción permite la producción de grandes cantidades de ![]() , pues los efectos de la radiólisis provocados por la radiación de alta energía de ambos radionúclidos es menor en este caso, pero se generan importantes volúmenes de desechos radiactivos orgánicos y acuosos que requieren ser tratados y dispuestos de forma segura. Por otra parte, la solución de
, pues los efectos de la radiólisis provocados por la radiación de alta energía de ambos radionúclidos es menor en este caso, pero se generan importantes volúmenes de desechos radiactivos orgánicos y acuosos que requieren ser tratados y dispuestos de forma segura. Por otra parte, la solución de ![]() debe ser reemplazada después de cierto período de uso (generalmente un año) y tratada también como desecho radiactivo. Esta tecnología es asequible económicamente solo a centros de producción que procesan de forma rutinaria grandes volúmenes de desechos radiactivos, en particular los que se dedican al reprocesamiento de combustible nuclear. El intercambio iónico, aunque más conveniente para preparar generadores, tiene la desventaja de que el
debe ser reemplazada después de cierto período de uso (generalmente un año) y tratada también como desecho radiactivo. Esta tecnología es asequible económicamente solo a centros de producción que procesan de forma rutinaria grandes volúmenes de desechos radiactivos, en particular los que se dedican al reprocesamiento de combustible nuclear. El intercambio iónico, aunque más conveniente para preparar generadores, tiene la desventaja de que el ![]() se obtiene en forma de un complejo no adecuado, como regla, para el marcaje directo de moléculas como los anticuerpos monoclonales, necesitándose por tanto un posterior procesamiento del eluido. Sin embargo, su punto más débil es que las resinas orgánicas usadas como soporte son susceptibles a los daños radiacionales, lo que limita el tiempo de uso de estos generadores y hace necesario prestar atención especial al contenido de
se obtiene en forma de un complejo no adecuado, como regla, para el marcaje directo de moléculas como los anticuerpos monoclonales, necesitándose por tanto un posterior procesamiento del eluido. Sin embargo, su punto más débil es que las resinas orgánicas usadas como soporte son susceptibles a los daños radiacionales, lo que limita el tiempo de uso de estos generadores y hace necesario prestar atención especial al contenido de ![]() en el producto final. Estas circunstancias han impedido su puesta en el mercado, lo que facilitaría la utilización sistemática de
en el producto final. Estas circunstancias han impedido su puesta en el mercado, lo que facilitaría la utilización sistemática de ![]() directamente en hospitales, además de la indicada reducción de los costos [7-13].
directamente en hospitales, además de la indicada reducción de los costos [7-13].
Desarrollo en CENTIS
Con el propósito de preparar un generador cromatográfico de utilidad en la práctica, se realizó una caracterización química y radioquímica de los procesos que tienen lugar durante la separación, el escalado paulatino en actividad y el establecimiento de un método de purificación para obtener ![]() adecuado para el marcaje de biomoléculas. En la preparación de estos generadores se utilizó Resina Dowex 50 x 8
adecuado para el marcaje de biomoléculas. En la preparación de estos generadores se utilizó Resina Dowex 50 x 8 ![]() 50-100 mesh y como eluyente, solución de EDTA 6 mmol/L pH 4.5. Se observó que un generador de 11.8 GBq (320 mCi) puede ser convenientemente explotado, haciendo atractivo el método de intercambio iónico para obtener apreciables cantidades de
50-100 mesh y como eluyente, solución de EDTA 6 mmol/L pH 4.5. Se observó que un generador de 11.8 GBq (320 mCi) puede ser convenientemente explotado, haciendo atractivo el método de intercambio iónico para obtener apreciables cantidades de ![]() [14,15], aunque tecnologías de este tipo no se consideran todavía maduras en la práctica para la obtención de
[14,15], aunque tecnologías de este tipo no se consideran todavía maduras en la práctica para la obtención de ![]() a escala productiva en condiciones de cumplimiento de las Buenas Prácticas de Producción [7]. Sobre la base de esta experiencia y con el objetivo de favorecer la automatización del proceso y asegurar producciones aún mayores, se han dado pasos para obtener un generador electroquímico a partir de estudios anteriores, en los que se demostró la posibilidad de obtener por electrólisis
a escala productiva en condiciones de cumplimiento de las Buenas Prácticas de Producción [7]. Sobre la base de esta experiencia y con el objetivo de favorecer la automatización del proceso y asegurar producciones aún mayores, se han dado pasos para obtener un generador electroquímico a partir de estudios anteriores, en los que se demostró la posibilidad de obtener por electrólisis ![]() de elevada pureza a partir de
de elevada pureza a partir de ![]() [7]. Un esquema del dispositivo empleado a escala de laboratorio (operación manual) se aprecia en la figura 1. Se reportaron los siguientes resultados [7]: recobrado de
[7]. Un esquema del dispositivo empleado a escala de laboratorio (operación manual) se aprecia en la figura 1. Se reportaron los siguientes resultados [7]: recobrado de ![]() > 90%, contaminación de 90Sr ~0,83 ppm, por debajo de los límites permisibles (20 ppm a la fecha de vencimiento), probado hasta 50 mCi y experimento simulado hasta 1 Ci, usando portador.
> 90%, contaminación de 90Sr ~0,83 ppm, por debajo de los límites permisibles (20 ppm a la fecha de vencimiento), probado hasta 50 mCi y experimento simulado hasta 1 Ci, usando portador.
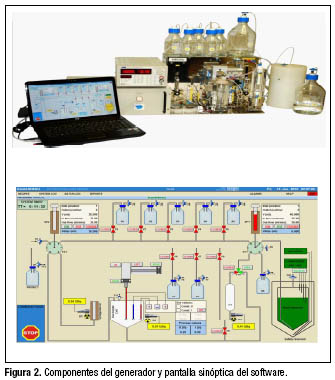
Un primer prototipo de generador de operación automática se desarrolló por Elex Commerce para la firma Isotope Technologies de Dresde (ITD) y fue entregado a CENTIS para su puesta a punto en los marcos del Proyecto de Asistencia Técnica del OIEA CUB/2/015 "Producción de radiofármacos terapéuticos para aplicaciones clínicas en el tratamiento del cáncer y la artritis reumatoide" ejecutado durante los años 2009-2011.
El generador (figura 2) está compuesto por:
1. Módulo con celda electroquímica y dos electrodos de platino (uno de ellos móvil);
2. Reservorio de ![]() ;
;
3. Unidad de control estándar;
4. Fuente de voltaje programable;
5. Computadora con software específico;
Este se opera en dos modos: manual y automático. El modo manual permite el control total de todos los componentes del módulo y el modo automático provee una operación confortable y reproducible que minimiza los posibles errores del técnico que realiza la producción.
Durante la puesta en marcha de este prototipo varios parámetros se ajustaron para obtener ![]() con los niveles de
con los niveles de ![]() requeridos.
requeridos.
La composición final de la solución de partida de ![]() establecida fue HNO3 0.01 M, conteniendo
establecida fue HNO3 0.01 M, conteniendo
0.07 mg/mL de ![]() y 0.625 mg/mL de
y 0.625 mg/mL de ![]() ; pH 2.5-3.0.
; pH 2.5-3.0.
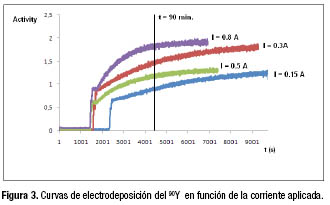
Se estudió el efecto de la corriente aplicada en la deposición del 90Y, determinando el porcentaje de deposición en función de la corriente cuando la separación electroquímica se ejecutó a pH 2.5-3.0. La tabla 1 y la figura 3 muestran los resultados obtenidos.
Se observó que el porcentaje de ![]() depositado se incrementa con el aumento de la corriente aplicada, alcanzando un valor máximo en nuestras condiciones, para un valor de corriente de 0.8 A. Mayores valores de corriente provocan una alta resistencia del electrolito y consecuentemente un alto valor de voltaje que puede incrementar la posibilidad de codeposición del
depositado se incrementa con el aumento de la corriente aplicada, alcanzando un valor máximo en nuestras condiciones, para un valor de corriente de 0.8 A. Mayores valores de corriente provocan una alta resistencia del electrolito y consecuentemente un alto valor de voltaje que puede incrementar la posibilidad de codeposición del ![]() .
.
El proceso de separación electroquímica del ![]() a partir del 90Sr en dos ciclos de electrólisis (un ciclo de separación y uno de purificación), reportado previamente [7], no fue suficiente para alcanzar la pureza radionuclídica deseada. De forma general tres ciclos de purificación fueron necesarios y todo el proceso de separación ocurre en aproximadamente 6 horas. La figura 4 muestra un gráfico típico del proceso.
a partir del 90Sr en dos ciclos de electrólisis (un ciclo de separación y uno de purificación), reportado previamente [7], no fue suficiente para alcanzar la pureza radionuclídica deseada. De forma general tres ciclos de purificación fueron necesarios y todo el proceso de separación ocurre en aproximadamente 6 horas. La figura 4 muestra un gráfico típico del proceso.
Después de establecidas las condiciones de la separación, en todos los casos el ![]() se obtuvo en forma de
se obtuvo en forma de ![]() en HCl 0.05 M con un contenido de
en HCl 0.05 M con un contenido de ![]() inferior a 3 ppm, y alrededor del 90% de la actividad inicial es recuperada al finalizar el proceso. La tabla 2 muestra algunos resultados del rendimiento obtenido para diferentes procesos de separación.
inferior a 3 ppm, y alrededor del 90% de la actividad inicial es recuperada al finalizar el proceso. La tabla 2 muestra algunos resultados del rendimiento obtenido para diferentes procesos de separación.
Como se aprecia la actividad máxima empleada en estos procesos fue de 50 mCi, por lo que el próximo paso en la evaluación del generador electroquímico instalado en CENTIS es el escalado de actividad hasta 1 Ci de ![]() y la estimación de las pérdidas de
y la estimación de las pérdidas de ![]() en cada proceso.
en cada proceso.
Requerimientos de calidad del ![]()
Los requerimientos del ![]() , en cuanto a pureza química y actividad específica en el caso de la radioinmunoterapia, son muy elevados. Los receptores blanco en los tumores, como regla limitados en número, obligan a que los radiofármacos y por tanto los radionúclidos escogidos, tengan alta actividad específica [16]. Ello solo se puede alcanzar con radionúclidos sin portador añadido, en el caso del
, en cuanto a pureza química y actividad específica en el caso de la radioinmunoterapia, son muy elevados. Los receptores blanco en los tumores, como regla limitados en número, obligan a que los radiofármacos y por tanto los radionúclidos escogidos, tengan alta actividad específica [16]. Ello solo se puede alcanzar con radionúclidos sin portador añadido, en el caso del ![]() , obtenido a partir de
, obtenido a partir de ![]() . La adición de portador favorece la presencia de metales trazas como el Fe, Cd, Pb, Cu y el Zn, que compiten con el radionúclido en el proceso de marcaje de las biomoléculas [16]. La presencia de metales trazas se determina por espectrometría de emisión por plasma acoplado inductivamente (ICP-ES) y se reportan diferentes valores por Ci de
. La adición de portador favorece la presencia de metales trazas como el Fe, Cd, Pb, Cu y el Zn, que compiten con el radionúclido en el proceso de marcaje de las biomoléculas [16]. La presencia de metales trazas se determina por espectrometría de emisión por plasma acoplado inductivamente (ICP-ES) y se reportan diferentes valores por Ci de ![]() [10,13], esta también se puede evaluar de forma indirecta mediante el marcaje de anticuerpos monoclonales, péptidos o del ácido dietilentriaminopentaacético (DTPA) [17].
[10,13], esta también se puede evaluar de forma indirecta mediante el marcaje de anticuerpos monoclonales, péptidos o del ácido dietilentriaminopentaacético (DTPA) [17].
La mayor exigencia en todo momento se relaciona con los niveles de ![]() permisibles en la solución de
permisibles en la solución de ![]() final. Estos deben ser muy bajos y según la USP 30 la concentración máxima permisible de
final. Estos deben ser muy bajos y según la USP 30 la concentración máxima permisible de ![]() es de 20 ppm a la fecha de vencimiento del producto dada la elevada radiotoxicidad de este radionúclido [12,13], para el que se ha definido que el límite de acumulación en un individuo durante toda su vida es de 74 kBq (2µCi) [18].
es de 20 ppm a la fecha de vencimiento del producto dada la elevada radiotoxicidad de este radionúclido [12,13], para el que se ha definido que el límite de acumulación en un individuo durante toda su vida es de 74 kBq (2µCi) [18].
La determinación precisa de ![]() en presencia de
en presencia de ![]() ha sido un reto, cuya magnitud se puede valorar por el número de publicaciones que se han reportado en el tema. Al ser ambos radionúclidos emisores beta puros y existir solapamiento de sus espectros beta se dificulta el establecimiento de métodos de cuantificación del 90Sr, ya que inevitablemente se requiere entonces la separación de ambos elementos. En este sentido se ha desarrollado un procedimiento que permite determinar la pureza radionuclídica del
ha sido un reto, cuya magnitud se puede valorar por el número de publicaciones que se han reportado en el tema. Al ser ambos radionúclidos emisores beta puros y existir solapamiento de sus espectros beta se dificulta el establecimiento de métodos de cuantificación del 90Sr, ya que inevitablemente se requiere entonces la separación de ambos elementos. En este sentido se ha desarrollado un procedimiento que permite determinar la pureza radionuclídica del ![]() . Esta nueva técnica combina la extracción basada en quelatos con la cromatografía de papel, usando papel cromatográfico impregnado con ácido 2 etilhexil-2 etilhexil fosfónico (KSM 17), el cual es un quelato específico para el
. Esta nueva técnica combina la extracción basada en quelatos con la cromatografía de papel, usando papel cromatográfico impregnado con ácido 2 etilhexil-2 etilhexil fosfónico (KSM 17), el cual es un quelato específico para el ![]() [19].
[19].
Radiofármacos de ![]()
Nos hemos referido a algunos de los que están en uso, a ellos se añade un número de ensayos clínicos con anticuerpos monoclonales y péptidos para el tratamiento de linfoma, cáncer de colon, páncreas, hígado, pulmón, próstata, mamas [20-22]. De mayor interés son las perspectivas que se abren a la introducción a corto plazo en nuestro medio de algunos radiofármacos como el ![]() -EDTMP, para paliación del dolor por metástasis óseas, producto registrado en Hungría, obtenido localmente y para el que puede ser formulado un kit liofilizado. Está en estado avanzado una formulación de
-EDTMP, para paliación del dolor por metástasis óseas, producto registrado en Hungría, obtenido localmente y para el que puede ser formulado un kit liofilizado. Está en estado avanzado una formulación de ![]() -Fosfato crómico para uso en radiosinoviortesis, que favorecerá la extensión de esa modalidad terapéutica y disminuirá los costos al evitarse la importación del
-Fosfato crómico para uso en radiosinoviortesis, que favorecerá la extensión de esa modalidad terapéutica y disminuirá los costos al evitarse la importación del ![]() . Se ensayan parches marcados con
. Se ensayan parches marcados con ![]() para el tratamiento de cáncer de la piel. Se ha marcado asimismo con
para el tratamiento de cáncer de la piel. Se ha marcado asimismo con ![]() el AcMo anti CD-20 Rituximab, lo que abre las puertas al tratamiento del linfoma no Hodgkin, producto con el que se comenzará un ensayo clínico próximamente en una institución del país. La producción rutinaria de AcMo y la síntesis de péptidos en Cuba, amplía las perspectivas al uso del
el AcMo anti CD-20 Rituximab, lo que abre las puertas al tratamiento del linfoma no Hodgkin, producto con el que se comenzará un ensayo clínico próximamente en una institución del país. La producción rutinaria de AcMo y la síntesis de péptidos en Cuba, amplía las perspectivas al uso del ![]() como radionúclido terapéutico.
como radionúclido terapéutico.
CONCLUSIONES
El desarrollo de métodos de obtención de ![]() de calidad farmacéutica bajo condiciones de Buenas Prácticas, en particular por separación electrolítica, crea las condiciones para obtener radiofármacos terapéuticos y su uso extendido en el país sobre una base rutinaria, sostenible y a más bajo costo que otras alternativas existentes.
de calidad farmacéutica bajo condiciones de Buenas Prácticas, en particular por separación electrolítica, crea las condiciones para obtener radiofármacos terapéuticos y su uso extendido en el país sobre una base rutinaria, sostenible y a más bajo costo que otras alternativas existentes.
Los trabajos en curso indican que al menos 4 de ellos se podrán introducir a muy corto plazo en la práctica clínica.
REFERENCIAS BIBLIOGRÁFICAS
1. FERRARI M, CREMONESI M, BARTOLOMEI M, et al. Dosimetric model for locoregional treatment of brain tumours with 90Y conjugates: clinical applications with 90Y-DOTATOC. J Nucl Med. 2006; 47(1): 105-12.
2. GOING JE, ROBERTS CA, DANCEY JE, et. al. Treatment of unresectable metastatic coloretal carcinoma to the liver with intrahepatic microspheres: Dose-ranging study. World J Nucl. Med. 2003; 2(3): 216-225.
3. KAMPEN WU, VOTH M, PINKERT J, KRAUSE A. Therapeutic status of radiosynoviorthesis of the knee with yttrium [90Y] colloid in rheumatoid arthritis and related indications. Rheumatology. 2007; 46(1): 16-24.
4. KUTZNER J, DAHNERT W, SCHREYER T, et. al. Treatment of pains from bone metastases with 90Y. Nuklearmedizin. 1981; 20(5): 229-35.
5. MULTIBONE (EDTMP) (Y-IK-26) Summary of Product Characteristics. (Prospecto médico).
6. DAVIES AJ. Radioimmunotherapy for B-cell lymphoma: Y-90 ibritumomab
tiuxetan and I-131 tositumomab. Oncogene, 2007; 26(25): 3614-28.
7. CHAKRAVARTY R, PANDEY U, MANOLKAR RB, et. al. Development of an electrochemical 90Sr-90Y generator for separation of 90Y suitable for targeted therapy. Nucl. Med. Biol. 2008; 35(2): 245-253.
8. WESTER DW, STEELE RT, RINEHART DE, et. al. Large scale purification of 90Sr from nuclear waste materials for production of 90Y, a therapeutical medical radioisotope. Appl. Radiat. Isot.. 2003; 59(1): 35-41.
9. CHINOL M, HNATOWICH DJ. Generator produced yttrium-90 for radioimmunotherapy. J. Nucl. Med. 1987; 28(9): 1465-1470.
10. KODINA GE. Preparation of high-purity radionuclide 90Y in specially designed centrifugal semicounterflow extractors. Radiochemestry. 2002; 44(1): 62-66.
11. RAMANUJAM A, ACHUTHAN PV, DHAMI PS, et. al. Separation of carrier-free 90Y from high level waste by supported liquid membrane using KSM-17. J Radioanal Nucl Chem. 2001; 247(1): 185-191.
12. SYLVESTER P. Novel ion exchange materials for the separation of 90Y from 90Sr. Patent US 20030231994. 2003.
13. WIKE JS, GUYER CE, RAMEY DW, PHILLIPS BP. Chemistry for Commercial Scale Production of Yttrium-90 for Medical Research. Appl. Radiat. Isot. 1990; 41(9): 861-865.
14. XIQUES A, PÉREZ M, ISAAC K, et. al. Production of large quantities of 90Y by ion-exchange chromatography using an organic resin and a chelating agent. Nucl. Med. Biol. 2010; 37(8): 935-942.
15. XIQUES A, ISAAC K, CASANOVA E, et. al. An adapted purification procedure to improve the quality of 90Y for clinical use. Radiochim. Acta . 2009; 97(12): 739-746.
16. LIU S, EDWARDS DS. Bifunctional chelators for therapeutic lanthanide radiofarmaceuicals. Bioconjug Chem. 2001; 12(1): 7-34.
17. MALJA S, SCHOMACKER K, MALJA E. Preparation of 90Y by the 90Sr-90Y Generator for Medical Purpose. J Radioanal. Nucl. Chem. 2000; 245(2): 403-406.
18. United States National Bureau of Standards. Maximum permissible body burden and maximum permissible concentrations of radionuclides in air and water for occupational exposure: recommendations. Handbook. Volumen 69. 1959. p. 38.
19. PANDEY U, DHAMI PS, JAGESIA P, VENKATESH M, PILLAI MR. Extraction Paper Chromatography Technique for the Radionuclidic Purity Evaluation of 90Y for Clinical Use. Anal. Chem. 2008; 80(3): 801-807.
20. BREEMAN WA, KWEKKEBOOM DJ, DE BLOIS E, et. al. Radiolabelled regulatory peptides for imaging and therapy. Anticancer Agents. Med Chem 2007; 7(3): 345-7.
21. GULEC SA, MESOLORAS G, DEZARN WA, et. al. Safety and efficacy of Y-90 microsphere treatment in patients with primary and metastatic liver cancer: the tumor selectivity of the treatment as a function of tumor to liver flow ratio. J. Trans. l Med. 2007; 5: 15.
22. KWEKKEBOOM DJ, MUELLER-BRAND J, PAGANELLI G, et. al. Overview of results of peptide receptor radionuclide therapy with three radiolabelled somatostatin analogs. J Nucl Med. 2005; 46 (Suppl 1):62S-6S.
Recibido: 3 de septiembre de 2012
Aceptado: 4 de octubre de 2012