Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Nucleus
versión On-line ISSN 2075-5635
Nucleus no.59 Ciudad de La Habana ene.-jun. 2016
CIENCIAS NUCLEARES
Uso de solventes no acuosos en la síntesis del radioconjugado DOTA-1-![]() -octreotida marcado con galio-68
-octreotida marcado con galio-68
Use of non-aqueous solvents in the synthesis of radioconjugate DOTA-1-![]() -octreotide labeled with gallium-68
-octreotide labeled with gallium-68
Marylaine Pérez-Malo Cruz, René Leyva Montaña, José Morín Zorrilla
Centro de Isótopos. Ave. Monumental y Carretera La Rada, Mayabeque. Cuba
marylaine@centis.edu.cu
RESUMEN
Los tumores neuroendocrinos sobreexpresan receptores de somatostatina. Su diagnóstico se ha extendido debido al radiomarcaje de DOTA-péptidos como el análogo de somatostatina DOTA-1-![]() -octreotida (DOTA-NOC) conjugado con radionúclidos emisores β+ como el
-octreotida (DOTA-NOC) conjugado con radionúclidos emisores β+ como el ![]() , de propiedades físico-nucleares muy favorables. El presente trabajo describe los procedimientos para el radiomarcaje del DOTA-NOC con
, de propiedades físico-nucleares muy favorables. El presente trabajo describe los procedimientos para el radiomarcaje del DOTA-NOC con ![]() , en medio acuoso puro y en presencia de solventes no acuosos, así como los métodos usados para el control de calidad, donde se obtuvo una formulación con un rendimiento radioquímico superior al 95 %. La adición de etanol (30%- vol/vol) a la mezcla de reacción permitió incrementar la actividad específica del radioconjugado
, en medio acuoso puro y en presencia de solventes no acuosos, así como los métodos usados para el control de calidad, donde se obtuvo una formulación con un rendimiento radioquímico superior al 95 %. La adición de etanol (30%- vol/vol) a la mezcla de reacción permitió incrementar la actividad específica del radioconjugado ![]() -DOTA-NOC, y se alcanzó un valor de 182 MBq/nmol, superior al reportado en la literatura (50 MBq/nmol) para el marcaje en medio acuoso puro. También se presentan los estudios de estabilidad (en presencia de solución salina y tampón fosfato salino), estudios de transmetalación en soluciones de
-DOTA-NOC, y se alcanzó un valor de 182 MBq/nmol, superior al reportado en la literatura (50 MBq/nmol) para el marcaje en medio acuoso puro. También se presentan los estudios de estabilidad (en presencia de solución salina y tampón fosfato salino), estudios de transmetalación en soluciones de ![]() ,
, ![]() ,
, ![]() y
y ![]() , competencia por retos contra los quelatos EDTA y DTPA y estabilidad in vitro en transferrina humana, realizados al radioconjugado
, competencia por retos contra los quelatos EDTA y DTPA y estabilidad in vitro en transferrina humana, realizados al radioconjugado ![]() -DOTA-NOC, del cual se mostró su elevada estabilidad (> 95 %). En comparación con el medio acuoso puro, el uso de solventes no acuosos en la síntesis del radioconjugado DOTA-1-
-DOTA-NOC, del cual se mostró su elevada estabilidad (> 95 %). En comparación con el medio acuoso puro, el uso de solventes no acuosos en la síntesis del radioconjugado DOTA-1-![]() -octreotida marcado con galio-68, permite disminuir la masa de conjugado y los tiempos de reacción, incrementar significativamente los rendimientos y la actividad específica del compuesto marcado. Ello pudiera favorecer la obtención del producto con mejores características en sistemas modulares que se encuentran en fase de desarrollo.
-octreotida marcado con galio-68, permite disminuir la masa de conjugado y los tiempos de reacción, incrementar significativamente los rendimientos y la actividad específica del compuesto marcado. Ello pudiera favorecer la obtención del producto con mejores características en sistemas modulares que se encuentran en fase de desarrollo.
Palabras claves: marcado; neoplasmas; somatostatina; galio 68; disolventes no acuosos.
ABSTRACT
Neuroendocrine tumors specifically over-express somatostatin receptors. Their diagnosis has expanded due to radiolabelling of DOTA-peptides such as somatostatin analogue DOTA-1-![]() -Octreotide (DOTA-NOC) conjugated to β+ emitting radionuclides such as
-Octreotide (DOTA-NOC) conjugated to β+ emitting radionuclides such as ![]() , with very favorable decay-properties. This paper describes the radiolabeling procedures of DOTA-NOC with
, with very favorable decay-properties. This paper describes the radiolabeling procedures of DOTA-NOC with ![]() , in a pure aqueous medium and in presence of non-aqueous solvents as well as the methods used for quality control where a formulation is obtained with a radiochemical yield exceeding 95%. Adding ethanol (30 % - v / v) to the reaction mixture allowed increasing the specific activity of
, in a pure aqueous medium and in presence of non-aqueous solvents as well as the methods used for quality control where a formulation is obtained with a radiochemical yield exceeding 95%. Adding ethanol (30 % - v / v) to the reaction mixture allowed increasing the specific activity of ![]() -DOTA-NOC radioconjugated, reaching a value of 182 MBq / nmol, higher than reported in literature (50 MBq / nmol) for labeling in a pure aqueous medium. Stability studies are also presented (in presence of saline solution and saline phosphate buffer, transmetallation studies in
-DOTA-NOC radioconjugated, reaching a value of 182 MBq / nmol, higher than reported in literature (50 MBq / nmol) for labeling in a pure aqueous medium. Stability studies are also presented (in presence of saline solution and saline phosphate buffer, transmetallation studies in ![]() ,
, ![]() ,
, ![]() and
and ![]() solutions, challenges competition against EDTA and DTPA chelators and in vitro stability in human transferrin) performed to
solutions, challenges competition against EDTA and DTPA chelators and in vitro stability in human transferrin) performed to ![]() -DOTA-NOC radioconjugated, showing its high stability (> 95 %). Compared with the aqueous medium, the use of non aqueous solvents in the synthesis of radioconjugate DOTA-1-
-DOTA-NOC radioconjugated, showing its high stability (> 95 %). Compared with the aqueous medium, the use of non aqueous solvents in the synthesis of radioconjugate DOTA-1-![]() -octreotide labeled with gallium-68, helps reduce the mass of conjugate and the reaction time, significantly increase yields and specific activity of the labeled compound. This could facilitate obtaining the product with better characteristics in modular systems that are under development.
-octreotide labeled with gallium-68, helps reduce the mass of conjugate and the reaction time, significantly increase yields and specific activity of the labeled compound. This could facilitate obtaining the product with better characteristics in modular systems that are under development.
Key words: labelling; neoplasms; somatostatin; gallium 68; nonaqueous solvents.
INTRODUCCIÓN
Los tumores neuroendocrinos (TNEs) constituyen un raro y heterogéneo grupo de tumores, que se manifiestan en forma de distintos síndromes clínicos y expresan receptores a somatostatina, en particular los del tipo sstr2, por lo que estos han sido blancos moleculares en el diagnóstico y tratamiento de estos tumores. Como la somatostatina tiene una vida media biológica muy pequeña, se han desarrollado análogos de mayor tiempo de residencia [1]. Miles de pacientes han sido estudiados con ![]() -DOTATOC,
-DOTATOC, ![]() -DOTATATE, y
-DOTATATE, y ![]() -DOTANOC y tratados con los mismos conjugados marcados con
-DOTANOC y tratados con los mismos conjugados marcados con ![]() e
e ![]() [2]. El DOTA-NOC muestra una gran afinidad no solo por los sstr2, sino también por sstr3 y sstr5, de ahí su eficiencia en el diagnóstico de tumores neuroendocrinos [3].
[2]. El DOTA-NOC muestra una gran afinidad no solo por los sstr2, sino también por sstr3 y sstr5, de ahí su eficiencia en el diagnóstico de tumores neuroendocrinos [3].
La preparación de ![]() -DOTANOC bajo condiciones de BPF, se ha reportado en medio acuoso, incluido el desarrollo de módulos de síntesis, bajo el concepto de acceso expandido de exoneración de drogas nuevas en investigación que puede ser un mecanismo de utilización en pacientes de fármacos aun no aprobados por la FDA [4-6]. El uso de solventes orgánicos ha probado mejorar los indicadores de preparación de este radiofármaco [7]. El presente trabajo se dirige a optimizar los parámetros de síntesis del radiofármaco en esos medios y a evaluar su calidad a los efectos de su posible utilización en módulos de síntesis.
-DOTANOC bajo condiciones de BPF, se ha reportado en medio acuoso, incluido el desarrollo de módulos de síntesis, bajo el concepto de acceso expandido de exoneración de drogas nuevas en investigación que puede ser un mecanismo de utilización en pacientes de fármacos aun no aprobados por la FDA [4-6]. El uso de solventes orgánicos ha probado mejorar los indicadores de preparación de este radiofármaco [7]. El presente trabajo se dirige a optimizar los parámetros de síntesis del radiofármaco en esos medios y a evaluar su calidad a los efectos de su posible utilización en módulos de síntesis.
MATERIALES Y METÓDOS
El ácido clorhídrico fue de calidad ultrapuro, los restantes reactivos, puros para análisis. El péptido DOTA-1-![]() -octreótido (DOTA-NOC) se obtuvo de ABX (Radeberg, Alemania) y se prepararon soluciones estándar de 1mg/mL En todos los experimentos se utilizó agua ultrapura (equipo EURO-60 Integra Plus). El rendimiento de marcaje se determinó mediante cromatografía en láminas de silica-gel 60 (Merck, Alemania), con dos sistemas de solventes: (a) buffer citrato 0,1
-octreótido (DOTA-NOC) se obtuvo de ABX (Radeberg, Alemania) y se prepararon soluciones estándar de 1mg/mL En todos los experimentos se utilizó agua ultrapura (equipo EURO-60 Integra Plus). El rendimiento de marcaje se determinó mediante cromatografía en láminas de silica-gel 60 (Merck, Alemania), con dos sistemas de solventes: (a) buffer citrato 0,1 ![]() , pH = 4,0 y (b) mezcla de NaCl 5% con metanol (3:1). La distribución de la actividad en las placas cromatográficas se midió en un sistema de autorradiografía electrónico con software asociado (Instant Imager, Packard Canberra).
, pH = 4,0 y (b) mezcla de NaCl 5% con metanol (3:1). La distribución de la actividad en las placas cromatográficas se midió en un sistema de autorradiografía electrónico con software asociado (Instant Imager, Packard Canberra).
Para determinar la pureza radioquímica del péptido marcado se utilizó un equipo de Cromatografía Líquida de Alta Resolución (CLAR), con un sistema de bombas (Hitachi L-7100) acoplado a un detector UV (Hitachi 7400) y uno radiométrico (Raytest). Se empleó una columna de fase reversa (Lichrosphere 100-RP18EC; 5μm, 250 x 4 mm) y un gradiente de elución que utilizó la fase móvil compuesta por los solventes A: 5 % de acetonitrilo y B: 95 % de acetonitrilo, y un flujo de 1,2 mL/min. Ambos solventes de la fase móvil contienen 0,01 % de ácido trifluoroacético. La pureza radioquímica del péptido marcado se tomó como el área bajo el pico en el cromatograma.
Para la síntesis del radioconjugado ![]() -DOTA-NOC, el
-DOTA-NOC, el ![]() se obtuvo de un generador comercial de 370 MBq (10 mCi) (Eckert & Ziegler, Berlín, Alemania), en forma de
se obtuvo de un generador comercial de 370 MBq (10 mCi) (Eckert & Ziegler, Berlín, Alemania), en forma de ![]() , que se purificó y concentró según se describe en [8]. En cada reacción se empleó aproximadamente una actividad de 30 MBq. Las mediciones de la actividad de
, que se purificó y concentró según se describe en [8]. En cada reacción se empleó aproximadamente una actividad de 30 MBq. Las mediciones de la actividad de ![]() se realizaron en un calibrador de dosis M2316 (Messelektronik, Dresden GmbH, Alemania).
se realizaron en un calibrador de dosis M2316 (Messelektronik, Dresden GmbH, Alemania).
Marcaje de DOTA-NOC con ![]() en medio acuoso
en medio acuoso
A fracciones de 2,6 mL de agua ultrapura se adicionaron alícuotas de la solución de DOTA-NOC, de forma tal que la masa de péptido empleada estuviera en el rango de 0,1-50,0 μg y 0,4 mL de la solución de ![]() , con un volumen total aproximadamente 3 mL y el pH final de 2,60 ± 0,04. Las reacciones se realizaron por triplicado, a 95°C durante 15 minutos, en un bloque de calentamiento con agitación (HLC Biotech Heating ThermoMixer MHR 13). Para estudiar la cinética de la reacción se emplearon 30 μg (20 nmol) de DOTA-NOC diluidos en 2,6 mL de agua y 0,4 mL de eluido. Cada reacción se realizó por triplicado a 25, 40, 70 y 95°C y tiempos de 1, 3, 5, 10 y 15 minutos.
, con un volumen total aproximadamente 3 mL y el pH final de 2,60 ± 0,04. Las reacciones se realizaron por triplicado, a 95°C durante 15 minutos, en un bloque de calentamiento con agitación (HLC Biotech Heating ThermoMixer MHR 13). Para estudiar la cinética de la reacción se emplearon 30 μg (20 nmol) de DOTA-NOC diluidos en 2,6 mL de agua y 0,4 mL de eluido. Cada reacción se realizó por triplicado a 25, 40, 70 y 95°C y tiempos de 1, 3, 5, 10 y 15 minutos.
Síntesis en presencia de solventes no acuosos
Para evaluar la influencia de solventes orgánicos en el rendimiento de marcaje de DOTA-NOC con ![]() , se adicionaron 0,9 mL de solvente (etanol, isopropanol y acetonitrilo según el caso) a 1,67 mL de agua, 0,03 mL de péptido (1mg/mL) y 0,4 mL de la solución de
, se adicionaron 0,9 mL de solvente (etanol, isopropanol y acetonitrilo según el caso) a 1,67 mL de agua, 0,03 mL de péptido (1mg/mL) y 0,4 mL de la solución de ![]() , con un volumen total de 3 mL. Las reacciones se llevaron a cabo a 70°C y tiempos de 1, 3, 5, 10 y 15 minutos.
, con un volumen total de 3 mL. Las reacciones se llevaron a cabo a 70°C y tiempos de 1, 3, 5, 10 y 15 minutos.
Influencia de la adición de etanol en la actividad específica de 68Ga-DOTA-NOC
El estudio se llevó a cabo en medio acuoso puro y en solución de etanol al 30 %, variando la concentración de péptido en el rango de 1,1-6,8 μ![]() . En cada reacción se emplearon actividades entre 3000 y 3885 MBq, provenientes de dos generadores de 50 mCi (1850 MBq) y uno de 10 mCi (370 MBq), de la firma (Eckert & Ziegler, Berlín, Alemania). La mezcla de reacción (3 mL) se expuso a 95°C durante 5 minutos.
. En cada reacción se emplearon actividades entre 3000 y 3885 MBq, provenientes de dos generadores de 50 mCi (1850 MBq) y uno de 10 mCi (370 MBq), de la firma (Eckert & Ziegler, Berlín, Alemania). La mezcla de reacción (3 mL) se expuso a 95°C durante 5 minutos.
Purificación del radioconjugado  -DOTA-NOC
-DOTA-NOC
La solución del péptido marcado se pasó a través de una columna de fase reversa (Strata-X, Phenomenex) acondicionada con 1 mL de etanol, seguido de 1 mL de agua, en la que queda atrapado. Las impurezas asociadas a la reacción de marcaje se eluyeron con 1 mL de agua y el péptido de interés con 0,4 mL de etanol absoluto.
Evaluación de la estabilidad del péptido radiomarcado ![]() -DOTA-NOC
-DOTA-NOC
Una formulación con pureza radioquímica de 99,1 (± 0,5) % se incubó en : Solución de NaCl (0,9 %) y tampón fosfato salino (adición de 0,05 mL de ![]() -DOTA-NOC a 0,5 mL de cada una de las soluciones); soluciones de los iones metálicos
-DOTA-NOC a 0,5 mL de cada una de las soluciones); soluciones de los iones metálicos ![]() ,
, ![]() ,
, ![]() y
y ![]() (adición de 0,05 mL de
(adición de 0,05 mL de ![]() -DOTA-NOC a 0,5 mL de soluciones 0,01
-DOTA-NOC a 0,5 mL de soluciones 0,01 ![]() de aquellos); soluciones de 0,01
de aquellos); soluciones de 0,01 ![]() en NaCl (0,9%) de EDTA y DTPA de tal manera que la relación molar ligando: péptido marcado fuera 100:1 y el volumen final, 0,5 mL; solución de transferrina humana (0,1 mL de
en NaCl (0,9%) de EDTA y DTPA de tal manera que la relación molar ligando: péptido marcado fuera 100:1 y el volumen final, 0,5 mL; solución de transferrina humana (0,1 mL de ![]() -DOTA-NOC se añadió a igual volumen de una solución de transferrina de concentración 50 μ
-DOTA-NOC se añadió a igual volumen de una solución de transferrina de concentración 50 μ![]() ). Todas las soluciones se incubaron en un bloque de calentamiento con agitación (HLC Biotech Heating ThermoMixer MHR 13) a 37 °C para simular las condiciones in vivo. Se tomaron alícuotas al transcurrir 1, 15, 30, 60, 80 y 120 minutos. Cada reacción se realizó por triplicado y la pureza radioquímica se determinó por cromatografía de capa delgada.
). Todas las soluciones se incubaron en un bloque de calentamiento con agitación (HLC Biotech Heating ThermoMixer MHR 13) a 37 °C para simular las condiciones in vivo. Se tomaron alícuotas al transcurrir 1, 15, 30, 60, 80 y 120 minutos. Cada reacción se realizó por triplicado y la pureza radioquímica se determinó por cromatografía de capa delgada.
RESULTADOS Y DISCUSIÓN
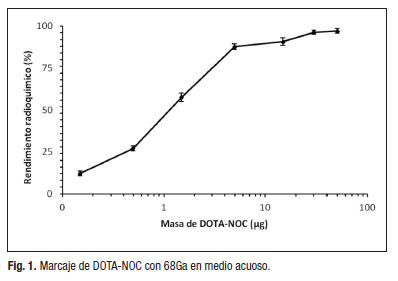
La figura 1 muestra rendimientos de marcaje por encima del 95 % para una masa del péptido ≥ 30 μg, lo que concuerda con los reportados para el marcaje de péptidos derivados del DOTA con metales trivalentes [7-9].
Los resultados del rendimiento de marcaje en diferentes tiempos y temperaturas, utilizando 30 μg de DOTA-NOC se muestran en la figura 2. Puede apreciarse que estos se favorecen con el incremento de la temperatura, asociados al efecto de deprotonación del quelato (DOTA), lo que facilita la formación del complejo. Además, con el pH = 2,6 de la mezcla de reacción, el galio se encuentra en forma de ión hidratado, ![]() , y un incremento de la temperatura favorece la velocidad de intercambio de las moléculas de agua de la esfera de hidratación, y en consecuencia, el acomplejamiento del
, y un incremento de la temperatura favorece la velocidad de intercambio de las moléculas de agua de la esfera de hidratación, y en consecuencia, el acomplejamiento del ![]() [10, 11]. Estos resultados confirman que para mejorar la eficiencia en la formación del complejo de ese ligando con iones trivalentes, en medio acuoso, influyen la temperatura y la relación ligando: metal [12].
[10, 11]. Estos resultados confirman que para mejorar la eficiencia en la formación del complejo de ese ligando con iones trivalentes, en medio acuoso, influyen la temperatura y la relación ligando: metal [12].
Rendimientos por encima del 95 % tan solo en 10 minutos de reacción, hacen que no sea necesaria la purificación del radioconjugado antes de su administración, además de reducir el tiempo total de la síntesis, aspecto esencial en el uso de radionúclidos de vida media corta como el ![]() . En relación con esto en la figura 3 puede apreciarse, que los rendimientos de marcaje son significativamente superiores cuando la reacción se realiza en presencia de acetonitrilo, etanol o isopropanol al 30 %, lo que se evidencia al transcurrir solamente tres minutos de reacción. Los rendimientos más relevantes se obtuvieron con la adición de etanol e isopropanol, y se alcanzaron los valores (75,6 ± 1,9) % y (83,0 ± 2,4) %, respectivamente, al transcurrir 15 minutos de reacción. De las figuras 1, 2 y 3 se desprende que a temperatura superior (95 °C), la presencia de solventes orgánicos debe disminuir los tiempos de reacción para la obtención de iguales rendimientos radioquímicos, lo que puede ser de utilidad en la práctica. En medio acuoso se ha reportado 46 ± 5 minutos como tiempo total de síntesis en procedimiento manual desde la elución del generador hasta la liberación, después de los controles de calidad del producto final estéril. La pureza radioquímica es de 98.1 ± 0.7 %. El tiempo de reacción del conjugado comercial cGMP DOTA-NOC (60 µg) con el radionúclido es de 10 minutos a 80 °C. No se reportan los rendimientos [5]. En condiciones similares se muestran tiempos de síntesis de 47 ± 5 minutos con calentamiento por 10 minutos (sin indicar temperatura), pureza radioquímica de 99.0 ± 0.5 y el uso de generadores de Eckert & Ziegler y ITG Isotope Technologies Garching GmbH. Como el eluato del generador ITG tiene bajo tenor de trazas metálicas, permite realizar la síntesis con masa menor del conjugado (30-µg vs. 60-µg) [4]. En otro trabajo, usando el generador ITG , se precalienta 5 minutos el recipiente de reacción con 40 μg del conjugado, se añade el radionúclido y se calienta a 90-95 °C durante 10 minutos en un módulo de marcaje con blindaje interno, todo con el objetivo de disponer de un sistema que cumpla regulaciones, útil para radiofarmacias pequeñas [6].
. En relación con esto en la figura 3 puede apreciarse, que los rendimientos de marcaje son significativamente superiores cuando la reacción se realiza en presencia de acetonitrilo, etanol o isopropanol al 30 %, lo que se evidencia al transcurrir solamente tres minutos de reacción. Los rendimientos más relevantes se obtuvieron con la adición de etanol e isopropanol, y se alcanzaron los valores (75,6 ± 1,9) % y (83,0 ± 2,4) %, respectivamente, al transcurrir 15 minutos de reacción. De las figuras 1, 2 y 3 se desprende que a temperatura superior (95 °C), la presencia de solventes orgánicos debe disminuir los tiempos de reacción para la obtención de iguales rendimientos radioquímicos, lo que puede ser de utilidad en la práctica. En medio acuoso se ha reportado 46 ± 5 minutos como tiempo total de síntesis en procedimiento manual desde la elución del generador hasta la liberación, después de los controles de calidad del producto final estéril. La pureza radioquímica es de 98.1 ± 0.7 %. El tiempo de reacción del conjugado comercial cGMP DOTA-NOC (60 µg) con el radionúclido es de 10 minutos a 80 °C. No se reportan los rendimientos [5]. En condiciones similares se muestran tiempos de síntesis de 47 ± 5 minutos con calentamiento por 10 minutos (sin indicar temperatura), pureza radioquímica de 99.0 ± 0.5 y el uso de generadores de Eckert & Ziegler y ITG Isotope Technologies Garching GmbH. Como el eluato del generador ITG tiene bajo tenor de trazas metálicas, permite realizar la síntesis con masa menor del conjugado (30-µg vs. 60-µg) [4]. En otro trabajo, usando el generador ITG , se precalienta 5 minutos el recipiente de reacción con 40 μg del conjugado, se añade el radionúclido y se calienta a 90-95 °C durante 10 minutos en un módulo de marcaje con blindaje interno, todo con el objetivo de disponer de un sistema que cumpla regulaciones, útil para radiofarmacias pequeñas [6].
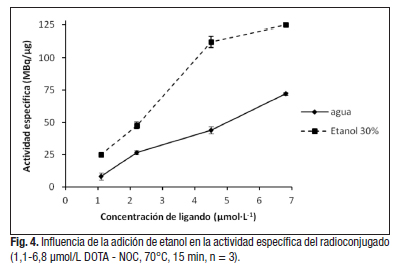
En relación a lo anterior, la adición de etanol a la mezcla de reacción tuvo un efecto significativo en la actividad específica del radioconjugado ![]() -DOTA-NOC (figura 4), lo que favorecería también el uso de menor masa de conjugado. Para cada valor de concentración seleccionado, este parámetro aumentó en un factor de dos o tres, con magnitudes superiores a las reportadas para el marcaje en medio acuoso puro [13]. Debe señalarse, que el valor máximo de actividad específica, reportado para DOTA-péptidos marcados con
-DOTA-NOC (figura 4), lo que favorecería también el uso de menor masa de conjugado. Para cada valor de concentración seleccionado, este parámetro aumentó en un factor de dos o tres, con magnitudes superiores a las reportadas para el marcaje en medio acuoso puro [13]. Debe señalarse, que el valor máximo de actividad específica, reportado para DOTA-péptidos marcados con ![]() en medio acuoso puro, es 50 MBq/nmol y en nuestro caso, 182 MBq/nmol (124 MBq/μg representado en el gráfico).
en medio acuoso puro, es 50 MBq/nmol y en nuestro caso, 182 MBq/nmol (124 MBq/μg representado en el gráfico).
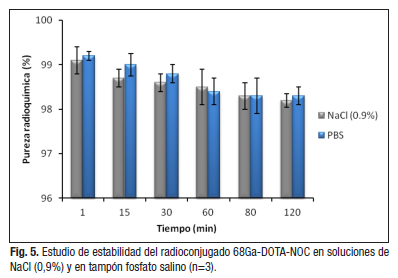
Los estudios de estabilidad se llevaron a cabo con un producto de pureza radioquímica igual a 99,1 (± 0,5). El ![]() -DOTA-NOC es estable durante al menos dos horas en NaCl (0,9 %) o en tampón fosfato salino ya que su pureza radioquímica se mantiene en un valor superior al 98% (figura 5).
-DOTA-NOC es estable durante al menos dos horas en NaCl (0,9 %) o en tampón fosfato salino ya que su pureza radioquímica se mantiene en un valor superior al 98% (figura 5).
Estos medios son de interés, ya que en ellos se reconstituyen los radiofármacos antes de ser administrados.
Con relación a la presencia de las impurezas metálicas indicadas en materiales y métodos, la pureza radioquímica se mantuvo superior al 97,5%, en dos horas. La estabilidad del enlace del radionúclido a la biomolécula se evaluó a partir de la competencia que puede existir por parte de agentes quelantes, de constantes de estabilidad altas con ![]() como EDTA (log β=21,7) y DTPA (log β=23,3) [14]. Aun a las dos horas, la pureza radioquímica es de 97,0 ± 0,5 (n=3) para EDTA y 97,1 ± 0,8 (n=3) para DTPA, a 37 °C y razón molar ligando competente: péptido 100:1.
como EDTA (log β=21,7) y DTPA (log β=23,3) [14]. Aun a las dos horas, la pureza radioquímica es de 97,0 ± 0,5 (n=3) para EDTA y 97,1 ± 0,8 (n=3) para DTPA, a 37 °C y razón molar ligando competente: péptido 100:1.
El estudio de transquelación del péptido radiomarcado en presencia de transferrina, muestra que la pureza radioquímica es superior al 95 % después de dos horas de incubación. La concentración de transferrina empleada en este experimento (25 μ![]() ) es comparable con la reportada para la circulación sanguínea (30 μ
) es comparable con la reportada para la circulación sanguínea (30 μ![]() ) [15]. Dicha proteína presenta dos sitios de enlace al hierro con alta afinidad por el galio, cuyas constantes de estabilidad son log β1 (GaT) = 19,75, y log β2 (GaT) = 18,80 [11,16]. Del resultado obtenido puede inferirse que el radioconjugado no transquelará apreciablemente y por tanto será estable en este medio, de lo contrario, el galio enlazado a la transferrina podría acumularse en columna vertebral, hígado, bazo, riñones, tumores de tejido blando y lesiones inflamatorias [17].
) [15]. Dicha proteína presenta dos sitios de enlace al hierro con alta afinidad por el galio, cuyas constantes de estabilidad son log β1 (GaT) = 19,75, y log β2 (GaT) = 18,80 [11,16]. Del resultado obtenido puede inferirse que el radioconjugado no transquelará apreciablemente y por tanto será estable en este medio, de lo contrario, el galio enlazado a la transferrina podría acumularse en columna vertebral, hígado, bazo, riñones, tumores de tejido blando y lesiones inflamatorias [17].
CONCLUSIONES
En comparación con el medio acuoso puro, el uso de solventes no acuosos en la síntesis del radioconjugado DOTA-1-![]() -octreotida marcado con galio-68, permite disminuir la masa de conjugado y los tiempos de reacción, incrementar significativamente los rendimientos y la actividad específica del compuesto marcado, lo que pudiera favorecer la obtención del producto con mejores características en sistemas modulares que se encuentran en fase de desarrollo.
-octreotida marcado con galio-68, permite disminuir la masa de conjugado y los tiempos de reacción, incrementar significativamente los rendimientos y la actividad específica del compuesto marcado, lo que pudiera favorecer la obtención del producto con mejores características en sistemas modulares que se encuentran en fase de desarrollo.
Agradecimientos
Los autores quieren agradecer al Dr. Frank Rösch, profesor del Instituto de Química Nuclear de la Universidad Johannes Gutenberg, Mainz, Alemania, por su valiosa contribución al desarrollo del presente trabajo.
REFERENCIAS BIBLIOGRÁFICAS
[1] LI WP, MEYER LA, ANDERSON CJ, et. al. Radiopharmaceuticals for positron emission tomography imaging of somatostatin receptor positive tumors. Top Curr Chem. 2005; 252: 179-192.
[2] FANI M, DEL POZZO L, ABIRAJ K, et. al. PET of somatostatin receptor–positive tumors using 64Cu- and 68Ga-somatostatin antagonists: the chelate makes the difference. J Nucl Med. 2011; 52(7): 1110-1118.
[3] BALDELLI R. Somatostatin analogues therapy in gastroenteropancreatic neuroendocrine tumours: current aspects and new perspectives. Front Endocrinol. 2014; 5: 7.
[4] MATHIAS CJ, GREEN M A & FLETCHER JW. Clinical PET/CT evaluation of patients with neuroendocrine cancer: experience with expanded access IND production and use of 68Ga-DOTA-NOC [document on line]. Indiana University Melvin and Bren Simon Cancer Center Cancer Research. Poster Presentation. May 21, 2015. http://imaging.medicine.iu.edu/research/office-for-research-imaging/office-for- research-imaging/forms-and-resources/expanded-access-acetate-and-ga- dota- noc/ overview-of-68ga-dota-noc-at-iu/.
[5] GREEN M, MATHIAS C & FLETCHER J. Preparation of 68Ga-DOTA-NOC for PET/CT evaluation of neuroendocrine tumors under an expanded access IND. J Nucl Med. 2014; 55 (supplement 1): 1144.
[6] VIS R, LAVALAYE J, VAN DE GARDE EM. GMP- compliant 68Ga radiolabelling in a conventional small-scale radiopharmacy: a feasible approach for routine clinical use. EJNMMI Research. 2015; 5: 27.
[7] RÖSCH F, PÉREZ-MALO M. Improved efficacy of synthesis of 68Ga radiopharmaceuticals in mixtures of aqueous solution and non-aqueous solvents. J Nucl Med. 2013; 54 (Supplement 2): 163.
[8] ZHERNOSEKOV KP, FILOSOFOV DV, BAUM RP, et. al. Processing of generator-produced 68Ga for medical application. J. Nucl. Med. 2007; 48(10): 1741-1748.
[9] PRUSZYŃSKI M, MAJKOWSKA-PILIP A, LOKTIONOVA NS, et. al. Radio-labeling of DOTATOC with the long-lived positron emitter 44Sc. Appl. Rad. Isot. 2012; 70(6): 974-979.
[10] KUBICEK V, HAVLICKOVA J, KOTEK J, et. al. Gallium(III) complexes of DOTA and DOTA- monoamide: kinetic and termodinamic studies. Inorg. Chem., 2010; 49(23): 10960-10969.
[11] GREEN MA, WELCH MJ. Gallium radiopharmaceutical chemistry. Int J Rad Appl Instrum B. 1989; 16(5): 435-448.
[12] DE LEÓN-RODRÍGUEZ LM, KOVACS Z. The synthesis and chelation chemistry of DOTA − peptide conjugates. Bioconjugate Chem. 2008; 19(2): 391-402.
[13] ANTUNES P, GINJ M, ZHANG H, et. al. Are radiogallium-labelled DOTA-conjugated somatostatin analogues superior to those labelled with other radiometals?. Eur.J. Nucl. Med. Mol. Imaging. 2007; 34(7): 982-993.
[14] CLARKE ET, MARTELL AE. Stabilities of trivalent metal ion complexes of the tetraacetate derivatives of 12-, 13-, and 14-membered tetraazamacrocycles. Inorg. Chim. Acta, 1992; 190(1): 37-46.
[15] BROCK JH, HALLIDAY J W, PIPPARD MJ & POWELL LW. Iron metabolism in health and disease. London: W B Saunders Co, 1994.
[16] MOERLEIN SM, WELCH MJ. The chemistry of gallium and indium as related to radiopharmaceutical production. Int. J. Nucl. Med. Biol. 1981; 8(4): 277-287.
[17] ZHANG Z. Bioinorganic chemistry of Aluminum, Gallium, and Indium complexes of 1-aryl-3-oxy-4-pyridinones [tesis on line] [doctoral thesis in philosophy]. University of British Columbia, december 1991. https://open.library.ubc.ca/cIRcle/collections/ubctheses/831/items/1.0061723.
Recibido: 17 de marzo de 2016
Aprobado: 25 de mayo de 2016