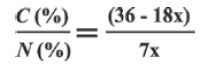Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Nucleus
versión On-line ISSN 2075-5635
Nucleus no.60 Ciudad de La Habana jul.-dic. 2016
CIENCIAS NUCLEARES
Síntesis y toxicidad de hidrogeles de poli(metacrilato de 2-hidroxietilo-co-acrilamida) obtenidos mediante irradiación con cuantos gamma
Sinthesys and toxicity of poly (2-hydroxyethyl methacrylate-co-acrylamide) hydrogels obtained by gamma photon irradiation
Manuel Rapado1, Marioly Vernhes1, Carlos Peniche2
1 Centro de Aplicaciones Tecnológicas y Desarrollo Nuclear, (Ceaden), Cuba
2 Centro de Biomateriales de la Universidad de La Habana, (Biomat), Cuba
RESUMEN
En el presente trabajo se reporta la obtención de hidrogeles de copolímeros de polimetacrilato de 2-hidroxietilo-co-acrilamida mediante la copolimerización y reticulación simultánea a partir de sus correspondientes monómeros y mediante irradiación con cuantos gamma. La composición del copolímero se determinó mediante análisis elemental y espectroscopia infrarroja. Adicionalmente se muestran los resultados de toxicidad de sus matrices, para ello se evaluó la acrilamida libre y se realizó el ensayo SOS en bacterias. Se comprobó que los extractos de lavados de las matrices de estos copolímeros contenían muy bajos niveles de acrilamida libre y no mostraron efecto tóxico en las células de E. coli para ninguno de los tiempos evaluados.
Palabras claves: toxicidad, escherichia, hidrogeles, radiacion gamma, acrilamida.
ABSTRACT
In this paper is reported the obtaining of hydrogels from poly hydroxyethyl methacrylate-co-acryla-mide, by simultaneous crosslinking copolymerization from corresponding monomers by gamma photon irradiation. The composition of network chains in the copolymer was estimated from elemental analysis and infrared spectroscopy. Additionally, the toxicity of these materials was tested finding the free acrylamide and biological assay SOS in bacteria. The extracts of washed matrices of copolymers showed low level of free acrylamide. Moreover, they were non toxic on the E. coli cells tested at any time.
Key words: toxicity, escherichia coli, hydrogels, gamma radiation, acrylamide.
INTRODUCCIÓN
Los polímeros son, actualmente, el grupo de estudio más amplio en la gama de los biomateriales. Dentro de ellos juegan un papel importante las matrices poliméricas hidrofílicas denominadas hidrogeles. Estas tienen una extraordinaria capacidad para absorber grandes cantidades de agua, hidratándose hasta alcanzar el equilibrio [1].
Uno de los métodos empleados para obtener nuevos polímeros a partir de sus correspondientes monómeros es la polimerización radioinducida. Entre sus bondades se destacan la posibilidad de polimerizar algunos monómeros que no lo logran por los métodos convencionales, como los compuestos fluoogenados, además, facilita la polimerización en fase sólida [2]. Particularmente, la radiación gamma permite la iniciación homogénea en todo el volumen del monómero. Por esta vía se obtienen polímeros de un alto grado de pureza, sin residuos de iniciadores, catalizadores ni otros compuestos [3-4].
Los hidrogeles pueden ser usados con fines médicos siempre que sean biocompatibles y no tóxicos. Por tanto, ante nuevos materiales sintéticos de este tipo, se hace imprescindible la evaluación de la toxicidad de estos candidatos antes de su posible aplicación en el sector de la salud. Se ha reportado que generalmente los efectos tóxicos de los hidrogeles se deben a restos de monómeros, oligómeros e iniciadores de la reacción [5]. Los copolímeros de polimetacrilato de 2-hidroxietilo-co-acrilamida (poli(HEMA-co-AAm)) han sido preparados y estudiados por diferentes autores [6, 7], sin embargo, un estudio de toxicidad de los mismos no ha sido reportado. En tal sentido, la estimación de acrilamida libre brinda información relacionada según lo establecido en la farmacopea [8]. Por otra parte, el ensayo SOS en bacterias también ha sido empleado para la detección de efectos tóxicos de diversos agentes, tanto químicos como físicos [9-11]. Con este ensayo es posible cuantificar el daño en el ADN o genotoxicidad que puede ejercer algún compuesto mediante la fusión transcripcional de un gen involucrado en la respuesta SOS, en bacterias con un gen reportero que puede codificarpara una proteína o una enzima que en presencia del sustrato apropiado desarrolla color o fluoescencia. También se puede evaluar la citotoxicidad mediante de la disminución de los niveles proteícos de enzimas como la fosfatasa alcalina [12-14].
Considerando lo anterior, el presente trabajo aborda la síntesis y evaluación de la toxicidad de matrices de copolímeros (poliHEMA-co-AAm) con la determinación de la acrilamida residual y mediante el ensayo biológico SOS en células de Escherichia coli, cepa PQ37.
MATERIALES Y MÉTODOS
Reactivos
El metacrilato de 2-hidroxietilo (HEMA) 99 % de pureza (Fluka, Suiza) se purificó mediante filtración por columnas rellenas con resinas HQ/MEHQ de la firma Polysciences (Eppelheim, Alemania) para eliminar el inhibidor e inmediatamente antes del uso, se destiló al vacío (10 Pa) a 50 °C. Solo se empleó la fracción intermedia. La acrilamida (AAm, Fluka, Suiza) se utilizó sin previa purificación. En todas las experiencias se utilizó agua bidestilada.
Síntesis de los hidrogeles
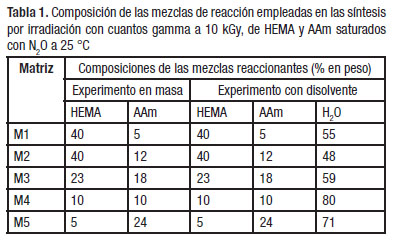
Los hidrogeles de poli(HEMA-co-AAm) se prepararon por copolimerización y reticulación simultáneas, inducidas por irradiación con cuantos gamma sin el uso de agentes de entrecruzamiento químico.Se realizó un estudio preliminar donde se evaluó la consistencia mecánica de los hidrogeles en su estado completamente hinchado. Las consideraciones para la selección de las composiciones de alimentación utilizadas en el presente trabajo fueron la solubilidad de la AAm en HEMA y la consistencia mecánica de los hidrogeles obtenidos en su estado hinchado en el equilibrio. Primero se realizó un experimento preliminar de copolimerización en masa donde se variaron las composiciones de los comonómeros HEMA y AAm, manteniendo la concentración total entre 2 y 5 mol/L. Se ensayaron cinco composiciones de HEMA/AAm, las cuales se denotan por las matrices M1- M5 y representan los xerogeles (geles sin agua) de los experimentos en masa y con disolvente de los copolímeros obtenidos de las mezclas de reacción de HEMA y AAm indicadas en la Tabla 1. Los experimentos se realizaron por triplicado y se reportan los resultados de la media y su desviación estándar.Las síntesis se llevaron a cabo en una instalación de irradiación autoblindada con fuentes radioisotópicas de Co-60, modelo ISO GAMMA LL-CO de fabricación húngara, a una dosis absorbida de 10 kGy con una homogeneidad del campo de 1,3. El proceso de irradiación se controló mediante dosimetría Fricke con una incertidumbre del 1,0 % y fílmica con el empleo de dosímetros Perpex [15].
Determinación de la composición del hidrogel
La determinación de la composición química de los hidrogeles fue calculada a partir de un análisis elemental de C, H, y N, mediante la determinación de la relación C(%)/N(%) efectuada en un analizador elemental CHNS-OCHA 1108 (Carlo Erba Intruments, Reino Unido).
Caracterización espectral mediante FTIR
Los espectros infrarrojos se obtuvieron usando un espectrofotómetro (AVATAR, Nicolet Instrument Corp., Madison, Reino Unido), las mediciones se realizaron en el intervalo de 4 000 hasta 500 ![]() con una resolución de 2
con una resolución de 2 ![]() y se promediaron sobre los 100 barridos. Se utilizaron 5 mg de cada muestra en pastillas de KBr, preparadas mediante compresión al vacío a 20 MPa.
y se promediaron sobre los 100 barridos. Se utilizaron 5 mg de cada muestra en pastillas de KBr, preparadas mediante compresión al vacío a 20 MPa.
Evaluación de la toxicidad de las disoluciones de lavados de hidrogeles
Determinación de acrilamida libreSe determinó la absorbancia de las disoluciones del primer lavado de matrices de hidrogeles poli(HEMA-co-AAm) obtenidos por irradiación a 10 kGy en presencia de disolvente y en masa de las matrices (M1-M5). La absorbancia fue determinada a una longitud de onda de 199 nm en un espectrofotómetro UV/VIS T60 U (PG Instruments, EEUU).
Para determinar la concentración de la AAm libre se construyó una curva de calibración a partir de disoluciones de acrilamida en un intervalo de concentración de 1.![]() a 1.
a 1. ![]()
![]() .
.
Evaluación de la toxicidad en células bacterianas
Se evaluó la citotoxicidad y genotoxicidad solo de los extractos de lavado de hidrogeles obtenidos según la composición descrita para M5, por ser la matriz de más alto contenido de pAAm y obtenidos a diferentes dosis absorbidas: 3, 5, 10, 15, 25 y 40 kGy respectivamente.
Se empleó el ensayo SOS en células de Escherichia coli, versión fluoescente [16]. Se utilizó la cepa PQ-37 de genotipo: (F7 thr, leu, his-4, pyrD, thi, galE, galK (o galT), lacAU169, srl-3OO::TnlO, rpoB, rpsL, rfa, uvrA, sulA::Mud(Ap, lac) cts, trp::Muc + y PhoC. Esta cepa que expresa constitutivamente la enzima fosfatasa alcalina es resistente a la ampicillina y presenta una fusión transcripcional entre el promotor de un gen SOS, el gen sfi y la región codificadorade la enzima ß-galactosidasa [9].
El medio de cultivo utilizado fue Luria-Bertani, suplementado con 50 µg/mL de ampicillina. Los cultivos fueron crecidos durante toda la noche a 100 rpm y 37 °C; posteriormente se diluyeron en medio fresco (1/25) y se incubaron a igual temperatura y agitación hasta una densidad óptica a 600 nm de 0,4. Posteriormente se realizó una dilución 1/10 en medio LBA (2X) y distribuidos en viales estériles que contenían disoluciones de lavados de las matrices de lavados (M5) (v:v). Los viales se incubaron durante 30, 60 y 120 minutos a 8 °C. Posteriormente, las células se incubaron durante 2 horas a 37 °C para su recuperación. Seguidamente se realizaron los ensayos enzimáticos [16].
Como criterio de citotoxicidad se utilizó la inhibición de la síntesis de proteínas en las células tratadas. Para ello se cuantificó la actividad enzimática de la fosfatasa alcalina [13, 16].
Para la evaluación de la genotoxicidad se tomó como criterio la inducción de la respuesta SOS, medida a través del Factor de Inducción SOS (FISOS) y calculada según lo indicado por Quillardet y Hofnung [13, 16]. En cada experimento se incluyó un control negativo no tratado y un control positivo, células E. coli, irradiadas con rayos gamma a 150 Gy.
Análisis estadístico
Se calcularon los valores medios de actividad fosfatasa alcalina obtenidos mediante el ensayo SOS. Se comprobó la normalidad y homogeneidad de varianza de los datos por medio de una prueba de Kolmogorov-Smirnov y de F máxima, respectivamente. Los valores medios fueron comparados respecto al control negativo utilizando una prueba de Dunnett con una significación del 95 %. Para este análisis se empleó el software Statistic 6.0.
RESULTADOS Y DISCUSIÓN
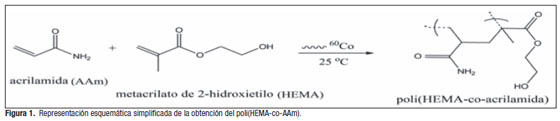
Obtención de hidrogeles por irradiación con cuantos gammaLa reacción de copolimerización del HEMA y la AAm se puede representar en forma simplificada, según el esquema que se muestra en la Figura 1.
Los hidrogeles obtenidos mostraron buena consis-tencia mecánica, eran estables, fáciles de manipular y todos resultaron ser transparentes. Las matrices M4 y M5 fueron más blandas y de mayor elasticidad. En la Figura 2 se evidencia la transparencia de los hidrogeles hinchados y su apariencia vítrea en su forma de xerogel (primero a la izquierda).
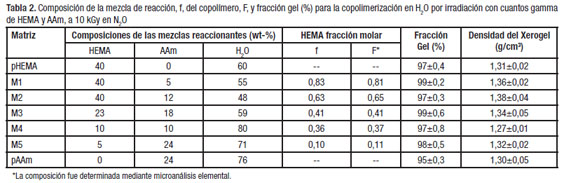
Determinación de la composición del copolímero
La composición de las cadenas de la red polimérica en los hidrogeles se estimó a partir del análisis elemental y se tomó la composición del copolímero como: ![]() ,
,
Donde x + y = 1 Así, se tiene que la composición de carbono del copolímero será:
![]() +
+ ![]() , que en términos de peso será 12 (3x+6y) = 12(3x +6(1-x)) = 72 - 36x
, que en términos de peso será 12 (3x+6y) = 12(3x +6(1-x)) = 72 - 36x
La composición en nitrógeno será xN = 14N = 14xPor tanto, la relación C/N será: 36 -18x/7x
De donde la fracción molar x de AAm en el copolímero se calculó utilizando la relación:
Donde, C(%) y N(%) son los correspondientes con-tenidos de nitrógeno y carbono en el copolímero. Los resultados se muestran en la Tabla 2.
Las reactividades relativas de los monómeros reportadas para la copolimerización del HEMA (1) con la AAm (2) son r1= 1,84 y r2= 0,41 [6], pero debido a que los grados de conversión logrados en este trabajo estuvieron cercanos al 100 %, las composiciones de los copolímeros prácticamente fueron las mismas que las de las mezclas de alimentación. No existen diferencias significativas en las densidades de los xerogeles con respecto a su composición (Tabla 2).
Caracterización espectral mediante FTIR
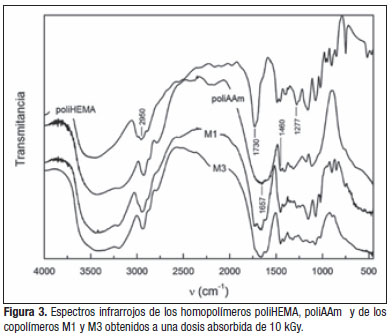
En la Figura 3 se muestran los espectros infrarrojos de los hidrogeles pertenecientes a los homopolímeros de HEMA, AAm y sus correspondientes copolímeros M1 y M3, obtenidos a partir de las disoluciones de sus res-pectivos monómeros (Tabla 2), a una dosis suministrada constante de 10 kGy. Los espectros IR de los copolímeros M1 y M3 exhiben todas las bandas características de los homopolímeros correspondientes. Las bandas de absorción observadas a 1 277 y 1 460 ![]() , características de los grupos metílicos y amida del poliHEMA y la poliAAm, respectivamente, también están presentes en los espectros de M1 y M3 [17].
, características de los grupos metílicos y amida del poliHEMA y la poliAAm, respectivamente, también están presentes en los espectros de M1 y M3 [17].
La poliAAm presenta una banda de absorción característica a los 1 657 ![]() correspondiente al (estiramiento C=O, amida I). La banda de estiramiento N-H, (amida II) absorbe en el intervalo de 3 500 a 3 100
correspondiente al (estiramiento C=O, amida I). La banda de estiramiento N-H, (amida II) absorbe en el intervalo de 3 500 a 3 100 ![]() y la banda de absorción a 1 460
y la banda de absorción a 1 460 ![]() se asoció con la vi-bración de estiramiento de grupos aminoacilos [18]. Por otro lado, el poliHEMA exhibe una banda de absorción fuerte a 1 730
se asoció con la vi-bración de estiramiento de grupos aminoacilos [18]. Por otro lado, el poliHEMA exhibe una banda de absorción fuerte a 1 730![]() , que es característica de la vibración de estiramiento del grupo C=O. La banda de absorción a 2 950
, que es característica de la vibración de estiramiento del grupo C=O. La banda de absorción a 2 950 ![]() con un “hombro” débil se atribuye a la vibración de estiramiento C-H de los grupos metileno. Los copolímeros de poli(HEMA-co-AAm) con otras composiciones exhibieron espectros cualitativamente similares y no se muestran.
con un “hombro” débil se atribuye a la vibración de estiramiento C-H de los grupos metileno. Los copolímeros de poli(HEMA-co-AAm) con otras composiciones exhibieron espectros cualitativamente similares y no se muestran.
Toxicidad de los extractos de lavados de matrices de copolímeros
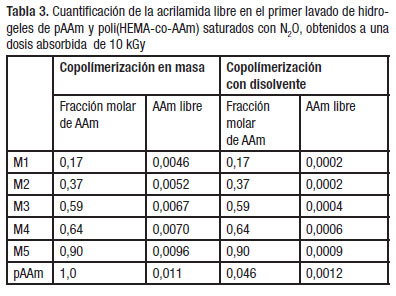
Determinación de acrilamida libreLa farmacopea de los EEUU ha legislado que el límite de exposición de la acrilamida para uso en humanos es de 0,003 mg/kg de peso [8]. Los resultados obtenidos muestran que cuando los experimentos fueron realizados con disolvente, los valores de acrilamida libre son menores que el señalado con anterioridad. Sin embargo, los experimentos realizados en masa muestran valores de concentraciones por encima de lo permitido en la norma, por tanto, los compuestos obtenidos de este modo no se consideraron en la continuidad del trabajo (Tabla 3). Es interesante señalar que en las disoluciones de los lavados de los hidrogeles obtenidos, los niveles de acrilamida son muy inferiores al compararlos con los reportados para numerosos productos de consumo habitual, según estudios realizados por la Food and Drug Administration (FDA) [19].
Toxicidad de las disoluciones de los extractos de lavados de las matrices M5 en células de E. coli
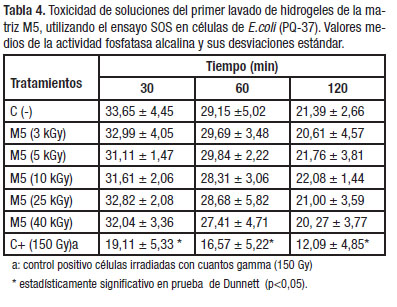
En la Tabla 4 se presentan los valores medios de la actividad de la fosfatasa alcalina de células de E. coli, expuestas a extractos del primer lavado de las matrices de copolímeros M5, irradiadas a distintas dosis absor-bidas durante diferentes tiempos.
Los resultados obtenidos con relación a la citotoxicidad mostraron que los niveles de fosfatasa alcalina en las células de E. coli no disminuyeron en presencia de los extractos evaluados para los tiempos de exposición estudiados. Los lavados de hidrogeles no fueron tóxicos en estas células bacterianas.
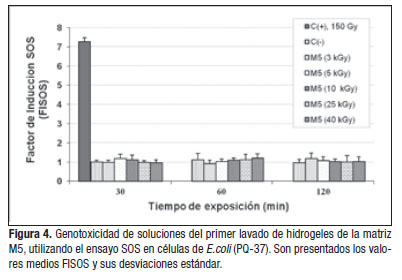
El estudio de genotoxicidad de los extractos mostró que estos no indujeron daño primario en el ADN en las células de E.coli. Para ninguno de los tratamientos evaluados se duplicó el factor de inducción (FISOS) en relación al control no tratado (Figura 4). Los valores de FISOS fueron menores de 1,5 lo que permitió calificara los extractos evaluados como compuestos no geno-tóxicos según lo sugerido por Kevekordes y colaboradores [20].
CONCLUSIONES
La irradiación con cuantos gamma de las disoluciones acuosas de acrilamida y metacrilato de 2-hidroxietilo, bajo las condiciones experimentales aplicadas, permite obtener copolímeros de poli(HEMA-co-AAm) con rendimientos de síntesis mayores del 97 % en un amplio intervalo de composiciones.
Los hidrogeles de copolímeros de poli(HEMA-co-AAm) evaluados no mostraron efecto tóxico. Los niveles de acrilamida residual están en el intervalo permisible para su uso en humanos, según lo reportado por la norma USP XXX [8]. Adicionalmente, bajo las condiciones experimentales ninguno de los extractos estudiados mostraron un efecto citotóxico ni genotóxico en las células de Escherichia coli.
Agradecimientos
Los autores agradecemos al profesor Januz M. Rosiak del Instituto de Química de las Radiaciones Aplicadas de la Universidad Técnica de Lotdz, Polonia; por su valiosa ayuda durante las discusiones y revisión de parte de éste trabajo.
REFERENCIAS BIBLIOGRÁFICAS
[1] OTTENBRITTE RM, PARK K, OKANO P. Biomedical applications of hydrogels handbook. Springer, 2010. ISBN: 978-1-4419-5919-5.
[2] YASSINE O, et. al. Highly efficient thermoresponsive nanocomposite for controlled release applications. Sci. Rep. 2016; 6(2): 28539.
[3] RAPADO M, PENICHE C. Synthesis and characterization of pH and temperature responsible poly(2-hydroxyethyl methacrylate-co-acrylamide) hydrogels. Polímeros: Ciencia e Tecnología. 2015; 25(6): 547-555.
[4] CANTON I, WARREN NJ, CHAHAL A, et. al. Mucin-Inspired Thermoresponsive synthetic hydrogels induce stasis in human pluripotent stem cells and human embryos. ACS Central Science. 2016; 2(2): 65-74.
[5] YOSHII E. Cytotoxic effects of acrylates and methacrylates: relationships of monomer structures and cytotoxicity. J Biomed Mater Res. 1997; 37(4): 517-524.
[6] DUŠEK K & JANÁČEK J. Hydrophilic gels based on copolymers of 2- hydroxyethyl methacrylate with methacrylamide and acrylamide. J Appl Polim Sci. 1975; 19(11): 3061-3075.
[7] SINGH B, CHAUHAN N, KUMAR S, BALA R. Psyllium and copoly-mers of 2-hydroxyethyl methacrylate and acrylamide- based novel devices for the use in colon specificantibiotic drug delivery. Int J Pharm. 2008; 352(1-2): 74-80.
[8] Unites States Pharmacopeial Convention. USP XXX. United States Pharmacopea Convention. 30 ed. Rockville: Mack Printing, 2007. p. 2883-2885.
[9] QUILLARDET P, DE BELLECOMBE C, HOFNUNG M. The SOS Chromotest, a colorimetric bacterial assay for genotoxins: valida-tion study with 83 compounds. Mutat Res. 1985; 147(3): 79-95.
[10] KOSUBEK S, OGIEVETSKAYA MM, KRASAVIN EA, et. al. Inves-tigation of the SOS response of Escherichica coli after irradiation by means of the SOS Chromotest. Mutat. Res. 1990; 230(1): 1-7.
[11] MONTANO M. Actividad fotoprotectora de la fracción aceites esenciales de Cymbopogon citratus (DC) Staff, sobre el DNA de Escherichia coli frente a la radiación UVC [tesis de diploma]. Uni-versidad de La Habana: Facultad de Bioliología, 2011.
[12] QUILLARDET P, HUISMAN O, D’AIR R, HOFNUNG M. The SOS chromotest: direct assay of the expression of gen SfiA as a me-sure of genotoxicity of chemicals. Biochimie. 1982; 64(8-9): 797-801.
[13] QUILLARDET P, HOFNUNG M. The SOS Chromotest, a colori-metric bacterial assay for genotoxins: procedures. Mutation Re-search. 1985; 147(3): 65-78.
[14] JANION C. Inducible SOS Response System of DNA Repair and Mutagenesis in Escherichia coli. Int J Biol Sci. 2008; 4(6): 338-344.
[15] International Organization for Standardization (ISO). Practice for using the Fricke Reference Standard Dosimetry System. ISO/ASTM 51205. ISO, 2002.
[16] CUÉTARA E, ÁLVAREZ A, VERNHE M, SÁNCHEZ-LAMAR A. A microanalytical variant of the SOS Chromotest for genotoxicolo-gical evaluation of natural and synthetic products. Biotecnología Aplicada. 2012; 29(2): 108-112.
[17] SOTO D, OLIVA H. Métodos para preparar hidrogeles químicos y físicos basados en almidón: Una revisión. Rev. LatinAm. Met. Mat. 2012; 32(2): 154-175.
[18] MURUGAN R, MOHAN S, BIGOTTO A. FTIR and Polarised Raman Spectra of Acrylamide and Polyacrylamide. Journal of the Korean Physical Society. 1998; 32(4): 505-512.
[19] U.S. Department of Health and Human Services. Guidance for Industry: analytical procedures and methods validation. FDA & Center for Drugs Evaluation and Research (CDER), 2000.
[20] KEVEKORDES S, MERSCH-SUNDERMANN V, BURGHAUS CH, et. al. SOS induction of selected naturally occurring substances in Escherichia coli SOS chromotest. Mutation Research. 1999; 445(1): 81-91.
Recibido: 30 de junio de 2016
Aprobado: 27 de agosto de 2016