Introducción
El hipertiroidismo constituye una enfermedad frecuente, caracterizada por el conjunto de signos y síntomas secundarios a la exposición de niveles aumentados de hormonas tiroideas, producto del incremento de su síntesis y/o liberación por parte de la glándula tiroides. El 131I- Yoduro de Sodio se usa como medio terapéutico desde 1941, y es en la actualidad una herramienta utilizada como primera o segunda línea en el tratamiento de esta enfermedad por su eficacia terapéutica, su bajo costo, facilidad de administración y seguridad [1]. Sin embargo, a pesar de la experiencia acumulada, no existe un acuerdo o evidencia científica clara sobre la actividad y/o dosis a aplicar para estos tratamientos. Los cálculos de dosis/actividad en su mejor aproximación clínica toman en cuenta el tamaño de la glándula, la captación del yodo, la vida media efectiva del isótopo y la severidad del hipertiroidismo, aunque no tienen en cuenta las no homogeneidades en la distribución de la dosis en el tiroides o la radiosensibilidad del tejido. A esta situación se le atribuye, por algunos autores, la falla de los métodos y modelos empleados hasta la actualidad [2-4].
El desarrollo tecnológico y computacional, unido a la introducción de nuevos tratamientos con radiofármacos, ha facilitado el desarrollo de métodos más eficaces para calcular la dosis de radiación que recibirá el tejido producto de una terapia con radiofármacos, de manera que se impone la revisión y actualización de los métodos empleados para la prescripción de dosis de 131I en Hipertiroidismo. A esto se unen los dilemas éticos sobre la conveniencia moral de sustituir una enfermedad por otra (Hipotiroidismo), el reto de la medicina moderna de brindar el tratamiento óptimo y de cumplir los principios de protección radiológica.
La mayoría de los métodos de cálculo de dosis reportados hasta ahora para el Hipertiroidismo se tipifican como unidimensionales o bidimensionales (1D y 2D respectivamente, esta última empleando la gammagrafía planar), por lo que este trabajo se planteó estudiar la distribución tridimensional de dosis (3D) en el tiroides para aportar nueva información sobre el tratamiento y sus resultados.
Materiales y métodos:
En 2013, la AEMN recomendó una metodología de cálculo de actividad a administrar (A a ) para entregar una dosis prescrita (DP) en la Tiroides de masa (M), que se basa en la medición paciente específica de la biodistribución y farmacocinética del 131I en el órgano blanco, con una aproximación unidimensional o bidimensional estimada a partir de la fórmula 1 [5].
donde:
M(g) |
es la masa calculada por US (1D) o gammagrafía (2D) |
U(t) |
es la fracción de actividad administrada captada por el tiroides en el tiempo t, obtenida generalmente por el captor de yodo. |
E |
es la energía media depositada en el tiroides por desintegración del 131I, y es igual a: |
(válida para tiroides con M=20g) introducirá errores ≤5% para masas M ≤90g
La dosis entregada al tejido depende significativamente de la distribución de actividad que este capta, que puede ser visualizada a partir de una imagen SPECT. Este trabajo toma como aproximación que todo el tejido tiroideo captante se comporta temporalmente de la misma manera, por lo que podremos describir la biodistribución y farmacocinética del 131I, a través del estudio de captación y el SPECT realizado a las 24horas. Si aplicamos el formalismo de la MIRD (Medical Internal Radiation Dose, por sus siglas en inglés) [6], la dosis en tiroides se puede expresar como:
donde:
|
es la actividad máxima en el voxel i de la imagen SPECT |
N voxeles |
es el número de vóxeles en el volumen captante del tiroides. |
M voxel |
(g) masa del voxel calculada a partir del volumen cúbico del pixel en cm3 y la densidad teórica del tiroides g/cm3. |
τ |
(d) tiempo de residencia en días, obtenido a partir de la curva generada por el estudio de captación. |
k=E |
demostrado por correspondencia entre 1 y 2 |
Desde el punto de vista de cálculo matemático la dosis a entregar en cada voxel será calculada como:
donde:
Cvoxel, i ; Ctotal |
son las cuentas reconstruidas de la imagen SPECT en el voxel i y el total de cuentas en el volumen captante respectivamente. |
Aa |
es la actividad terapéutica a administrar para lograr la dosis prescrita por el especialista (Gy). |
La actividad a administrar para garantizar la dosis prescrita se calculó por la ecuación 1, empleando el ajuste matemático de la captación tiroidea. La distribución tridimensional de dosis que produjo esa actividad en todo el tejido tiroideo se calculó a partir de la fórmula 3, empleando las imágenes SPECT.
Las herramientas disponibles para la planificación de tratamientos con radionúclidos son escasas y de amplia complejidad para el escenario clínico disponible, por lo que para este análisis se desarrolló una herramienta en MATLAB versión 2008b, que está disponible a partir de una cooperación con la Universidad de San Martin (UNSAM), Buenos Aires, Argentina. En él, se desarrollaron todos los algoritmos de procesamiento de imágenes, ajuste de funciones, cálculo numérico, visualización y objetos gráficos. Esta aplicación desarrolla el ajuste de la farmacocinética tiroidea, los cálculos de actividad acumulada, la estimación de la masa funcional tiroidea, el cálculo de la actividad a administrar para garantizar la dosis prescrita por el médico, y estimar el mapa tridimensional (3D) de dosis y los parámetros estadísticos relacionados que la caracterizan. La aplicación desarrollada se verificó empleando una imagen-maniquí y 6 farmacocinéticas conocidas [7]. Los ajustes matemáticos se compararon con el Microcal (TM) Origin (version 6.0). El cálculo automático de masa captante usando SPECT empleó un umbral de 35% para nódulo único hiperfuncionante y 50% para enfermedad difusa, los resultados fueron comparados con Ultrasonido. La dosis prescrita y la dosis promedio calculada fueron comparadas para asegurar el correcto funcionamiento de la herramienta. Se estimaron además las diferencias entre la dosis por voxel y la dosis prescrita.
Resultados y discusión
Se desarrolló y verificó una herramienta computacional integral, capaz de desarrollar la planificación dosimétrica empleando el formalismo recomendado por AEMN para tiroides y se estimó la distribución de dosis 3D a partir de la actividad calculada para la masa tiroidea estimada por SPECT.
Los resultados de la comparación del ajuste matemático desarrollado por la aplicación vs Microcal se muestran en la tabla 1. Las diferencias entre los parámetros de ajuste mostraron diferencias no significativas (p<0.01), el punto de mayor desviación fue menor del 2%, mientras que los índices de correlación R2 fueron superiores a 0.98 en todos los casos. Los tiempos de residencia calculados por ambos métodos presentaron diferencias menores del 1%, mostrando una buena concordancia.
Tabla 1 Comparación de resultados del ajuste farmacocinético por la aplicación en Matlab y por Microcal.
| Programa/Dif(%) | Caso | Parámetros de Ajuste* | Caso | Parámetros de Ajuste* | ||||
|---|---|---|---|---|---|---|---|---|
| A | B | C | A | B | C | |||
| matlab | P1 | 0.729 | 0.0075 | 0.386 | P4 | 0.585 | 0.0041 | 0.336 |
| origin | 0.728 | 0.0075 | 0.384 | 0.585 | 0.0041 | 0.336 | ||
| Dif(%) | 0.230 | -0.053 | 0.604 | 0.024 | -0.098 | 0.059 | ||
| matlab | P2 | 0.6903 | 0.00555 | 0.419 | P5 | 0.6934 | 0.0045 | 0.507 |
| origin | 0.6916 | 0.00554 | 0.421 | 0.6934 | 0.0045 | 0.507 | ||
| Dif(%) | -0.195 | 0.253 | -0.688 | -0.013 | 0.000 | -0.033 | ||
| matlab | P3 | 0.678 | 0.0049 | 0.261 | P6 | 0.5273 | 0.00386 | 0.3784 |
| origin | 0.681 | 0.0049 | 0.266 | 0.5279 | 0.00386 | 0.3799 | ||
*función doble exponencial
Para el cálculo de masa, se empleó el método de los umbrales, ampliamente usado en la literatura para técnicas planares, y ha comenzado a usarse también en cuantificación SPECT [8]. El valor a utilizar fue obtenido por calibración del sistema bajo condiciones similares a las clínicas, en este caso se estableció 35 y 50% [9].
La estimación de masa por SPECT y su comparación con Ultrasonido (US) se muestra en la tabla 2. La desviación relativa de la masa varió entre -4,85,% y 18,69,%. Este valor es esperado pues para masas pequeñas como el tiroides el efecto discreto del tamaño del voxel introduce mayores errores a menor masa. El US es una técnica con mejor resolución espacial que el SPECT, pero dista de ser óptima para cálculo el volumétrico del tiroides pues subestima la masa del tejido tiroideo entre -47,5% a -5,9% (-16,7 a -1.5 ml) [10]. A esto se suma que la masa funcional y la morfológica pueden discrepar de forma significativa, de manera que los volúmenes a usar deben a lo sumo consensuarse entre ambas técnicas, pues la distribución de dosis depende de la masa funcional captante [5,11].
Discrepancias entre la planificación 1D y 3D: Los cálculos dosimétricos de planificación empleando la formulación de la AEMN con la masa calculada por US y la calculada por SPECT, en 6 pacientes con dosis prescritas entre 150-400 Gy (promedio 241,67 Gy), se encuentran en la tabla 2. Para analizar el impacto de la estimación de la masa por SPECT en la actividad a administrar, se calculó la relación entre las discrepancias absolutas vs. dosis prescrita en cada paciente, esta relación muestra diferencias mayores que el 20% sólo en la paciente PA2, que posee una masa tiroidea grande y muestra zonas de necrosis y calcificaciones en el reporte del Ultrasonido de Tiroides. En este caso la SPECT aporta información valiosa para la dosimetría, pues el US es incapaz de definir dentro del cálculo de masa este fenómeno de distribución de actividad no-homogénea o nula, apuntando a la primacía del método gammagráfico [1-3,11].
Tabla 2 Diferencias absolutas y relativas para el cálculo de masa tiroidea entre US y SPECT. Diferencias entre el método 3D y el 1D en el cálculo de actividad a administrar.
| Pacientes | Diferencias en cálculo de masa por US y SPECT | Diferencias en el cálculo de actividad a administrar para la dosis prescrita (DP) | ||||||
|---|---|---|---|---|---|---|---|---|
| Masa US (g) | Masa SPECT (g) | Dif. Absoluta (g) | Dif. Relativa (%) | 1D (MBq) | 3D (MBq) | DP (Gy) | D/DP (%) | |
| P1 | 10.95 | 12.58 | -1.63 | -14.91 | 144.21 | 165.72 | 150 | 14.3 |
| P2 | 76.97 | 71.67 | 5.30 | 6.89 | 794.04 | 739.04 | 150 | 36.6 |
| P3 | 26.3 | 24.96 | 1.34 | 5.08 | 487.37 | 462.62 | 300 | 8.33 |
| P4 | 14.66 | 11.92 | 2.74 | 18.69 | 263.19 | 213.99 | 300 | 16.6 |
| P5 | 18.89 | 20.19 | -1.29 | -6.87 | 157.33 | 168.04 | 150 | 7.33 |
| P6 | 26.85 | 28.15 | -1.30 | -4.85 | 679.49 | 712.46 | 400 | 8.25 |
Resultados del cálculo dosimétrico tridimensional: se generó la distribución 3D de dosis empleando el método teórico recomendado por AEMN. La herramienta provee un mapa tridimensional de dosis en los tres ejes y la posibilidad de visualizar las isodosis solicitadas por el usuario secuencialmente en los cortes axiales (ver figura 1). Se analizaron las diferencias máximas por voxel en cada caso y su impacto en los parámetros característicos de la planificación (ver tabla 3).
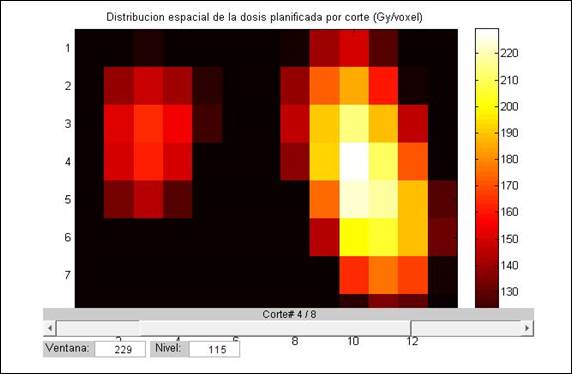
Figura 1 Corte axial de la distribución de dosis por voxel, dosis prescrita 150Gy. Observar mapa de colores relacionado con las dosis
Tabla 3 Parámetros característicos de las distribuciones de dosis obtenidas.
| Parámetros | P1 | P2 | P3 | P4 | P5 | P6 |
|---|---|---|---|---|---|---|
| Dprom (Gy): | 150.00* | 150.00* | 300.00* | 300.00* | 150.00* | 400.00* |
| % Tiroides ≥DP | 40.71 | 40.88 | 43.77 | 45.00 | 43.61 | 42.89 |
| D.Estándard(Gy) | 27.01 | 37.58 | 54.63 | 59.26 | 20.41 | 108.30 |
| Dmax/Voxel: | 229.28 | 297.57 | 448.00 | 438.60 | 203.06 | 759.85 |
| Dmin/voxel: | 114.64 | 104.26 | 224.00 | 219.30 | 101.53 | 266.91 |
| DFP (%) | 76.42628 | 128.87 | 74.67 | 73.10 | 67.69 | 123.24 |
DFP- Diferencia porcentual entre dosis máxima y mínima por voxel entre la dosis prescrita
Las distribuciones de actividad acumulada y de dosis absorbida fueron marcadamente heterogéneas, observar la desviación estándar, así como la diferencia entre dosis máxima y mínima por voxel. La figura 2 muestra el histograma dosis/ volumen de una paciente como ejemplo de esta heterogeneidad. La distribución de dosis 3D mostró desviaciones estándar entre 18,01-27,08 % de la dosis prescrita. Las diferencias entre la dosis máxima y mínima por voxel/MBq de actividad administrada fue de 74-129 %. De acuerdo a los resultados, sólo entre el 50,2 % y 71,4 % de volumen tiroideo se tratará con la dosis prescrita ±20 %. Esto significa que estos pacientes podrían recibir una sub-dosificación significativa menor del 80% entre el 11,5 y 27,9% del tejido, así mismo se podría esperar una sobre-exposición del 120% o más entre el 16,2 y 21,9% del volumen blanco.
La aplicación de estos métodos híbridos de cuantificación de imágenes 3D, simplifica y viabiliza la planificación dosimétrica, y si bien no tienen antecedentes bibliográficos en tiroides, ha mostrado resultados aceptables en las terapias con radionúclidos a altas dosis [2-3,11-15], por lo que puede ser empleado en el tratamiento con Hipertiroidismo para aportar mayor información sobre la relación dosis-efecto.
Conclusiones y recomendaciones
La dosis administrada al tejido tiroideo es no-homogénea y discrepa significativamente de la prescrita en algunas regiones, situación que requiere estudios posteriores más profundos con el objetivo de optimizar el tratamiento y sus resultados. La uniformidad de la energía transferida en todo el voxel como aproximación teórica es factible pero dista de la realidad física porque la componente beta/gamma de los voxeles vecinos no es homogénea, por lo que recomendamos comparar estos resultados con simulación por Monte Carlo para evaluar este efecto y su alcance dosimétrico de forma concreta.















