Introducción
La determinación de hormonas y otros analitos por métodos de radioinmunoanálisis (RIA) o inmunoradiométricos (IRMA), no obstante utilizarse desde la década de los años 60 [1], continúa siendo una opción viable en el diagnóstico eficaz de diversas patologías, entre las que figuran las relacionadas con el funcionamiento de las glándulas tiroideas e hipofisaria. Ello se debe a su sensibilidad y especificidad, lo que las hace confiables, robustas y de buena exactitud, además de tener relativo bajo costo [2]. A inicios del nuevo siglo, teniendo en cuenta la experiencia productiva, equipos disponibles y presencia de personal especializado se organizó en CENTIS, a solicitud del MINSAP, un servicio de determinación de analitos de interés, mediante las indicadas metodologías con el fin de favorecer los servicios de salud, fundamentalmente de la capital.
La actividad comenzó a organizarse en febrero del 2003 con el nombre de “Servicio centralizado de determinación de analitos” (SDA), de acuerdo a la siguiente secuencia de eventos interrelacionados y con el empleo de herramientas de automatización a partir de una base de datos:
Recogida de muestras cada lunes en los hospitales y entrega de resultados de la semana precedente. La recogida va acompañada de un modelo con los datos necesarios y los resultados se entregan mediante documento impreso.
-Recepción de las muestras el mismo dia en CENTIS. Los datos son registrados mediante formulario diseñado al respecto y cada muestra está identificada mediante un código unívoco. Al activar un comando el operario, se genera el número correcto que corresponde al consecutivo para cada hospital.
Elaboración de los protocolos de ensayo. A partir de la base de datos se obtienen los protocolos de ensayos, los cuales están diseñados en forma de “mapas” de las gradillas que indican los lugares donde se colocarán las muestras a ensayar, los calibradores, las muestras controles y de referencia, y el control interno. Este sistema facilita la realización del ensayo, puesto que en todo momento el analista conoce la ubicación exacta de las muestras y los controles a ensayar, lo que garantiza la trazabilidad y minimiza posibles errores durante el ensayo.
Ejecución de los ensayos: Se ejecuta según el protocolo y lo establecido para cada analito. En la figura 1 se muestra una foto del momento de la ejecución de un ensayo.
Control de calidad de los ensayos. La adquisición de los datos para el control de calidad del ensayo se realiza de forma automatizada desde el propio equipo de medición, eliminando así los errores en la trascripción de los mismos. El control de calidad se realiza mediante procedimientos establecidos, basados en la representación gráfica de los resultados analíticos de controles a lo largo del tiempo [3]. El programa permite, además, evaluar el trabajo de los analistas mediante gráficos de control y análisis de tendencias.
Elaboración de los informes de resultados. Los resultados se obtienen de forma automatizada después de realizada la medición de las muestras y se entregan impresos.
El empleo de bases de datos y otras herramientas informáticas además de permitir el almacenamiento y procesamiento de la información referente a las muestras y sus resultados, jugó un importante papel en el aseguramiento de la calidad de los resultados, el tiempo de respuesta y la satisfacción de los clientes.
Certificación de Buenas Prácticas de Laboratorio Clínico
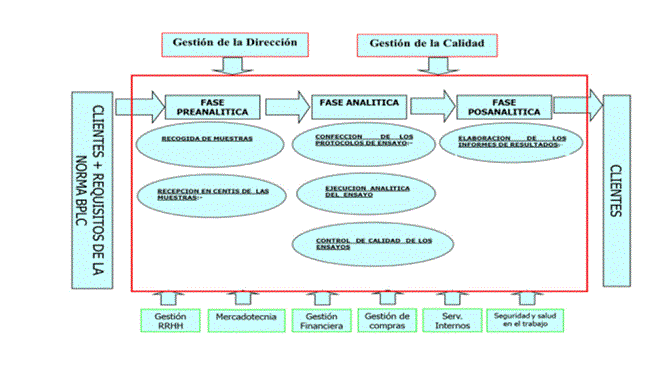
Luego de cinco años de operación, el sistema de gestión del laboratorio fue rediseñado para ajustarse a la nueva emisión de la Regulación de Buenas Prácticas para Laboratorio Clínico (BPLC), que incluyó la necesidad de certificar este tipo de servicio [4]. A fin de lograr una mejor organización del sistema documental y garantizar la trazabilidad de las muestras de forma más efectiva se estableció el trabajo por procesos (figura 2). Ello, bajo la premisa de que se insertaría con los diferentes subsistemas de gestión de calidad del centro, tales como compras, quejas y reclamaciones, auditorías internas de calidad, no conformidades y acciones correctivas y preventivas [5]. Un aspecto importante para el cumplimiento de los requisitos de la Regulación de BPLC fue la división del proceso del SDA en sus tres etapas o fases: preanalítica, analítica y posanalítica y la elaboración de los procedimientos correspondientes a cada una de ellas [3].
Fase Preanalitica
Para el laboratorio esta etapa comienza con la recogida de muestras en los hospitales hasta su recepción, conservación y empleo en la fase analítica. Los clientes son informados de los requisitos para la recepción de las muestras, donde se les especifica cómo deben identificarlas y rotularlas, el volumen necesario, como ordenarlas y almacenarlas y como completar el formulario de solicitud. El traslado de las muestras de suero se realiza de acuerdo a la Resolución Nº 8 (2000) del Ministerio de Ciencia, Tecnología y Medio Ambiente [6] y a la “Guía sobre la reglamentación relativa al Transporte de sustancias infecciosas 2009-2010” [7].
Un avance importante en esta etapa fue la digitalización de los registros de solicitud manuscritos, la que se lleva a cabo mediante escáner con empleo de un software que convierte la imagen directamente en texto de formato RTF, semejante a un lector de barra. Esto permite ganar tiempo en la recepción de las muestras, asegurar la trazabilidad y eliminar los posibles errores durante la transcripción (cero confusión de analitos, cero peticiones de clientes ignoradas, cero error de transcripción de los analitos).
Fase Analítica
La fase analítica se inicia con la orden de servicio y concluye con la aprobación de los resultados. Los cambios fundamentales relacionados con esta fase se origina en la BD de Control de Calidad. En ella queda almacenada toda la información de los controles de calidad de los ensayos y su actualización basada en los requisitos de la regulación, permitió obtener una mayor información sobre el comportamiento del servicio. A través de las diferentes ventanas en máquina, se obtiene información variada sobre el comportamiento del servicio, lo que permite realizar valoraciones sobre el comportamiento de los parámetros de cada ensayo y la idoneidad de los juegos de reactivos. Se diseñó un registro (figura 3) que permite al Responsable de Calidad tomar la decisión sobre la aprobación o rechazo de los ensayos con solo la observación y evaluación visual del comportamiento de los parámetros de la determinación [8]. Este registro contiene información sobre el ensayo, la cantidad de muestras analizadas, el lote del diagnosticador empleado, las fechas del ensayo y de la medición, los resultados el ensayo para las muestras de referencia y los criterios de aceptación que le sirven al responsable de calidad del laboratorio para la toma de la decisión final. En este caso los resultados se pueden visualizar en forma de gráficos de control, que muestran tanto los resultados del ensayo en cuestión, como todos los anteriores realizados, lo que permite juzgar la tendencia en el desempeño del ensayo. Se evalúan también una serie de parámetros llamados de “observación”, que no definen la aceptación o rechazo de un ensayo individual, pero cuyo comportamiento permite evaluar el desempeño en un periodo determinado y con ello identificar posibles problemas y tomar medidas preventivas para evitar fallas de calidad en el servicio.
Fase posanalítica
Esta fase comprende el proceso desde que se obtiene el resultado de una prueba hasta que el informe es recibido por el médico o el cliente. El informe se atiene a requisitos regulatorios, a partir de los cuales se incluyó la emisión de informe individual por cada paciente [4].
Sobre la base del mapa de procesos y para lograr una mejor organización del sistema documental y garantizar la trazabilidad de las muestras de forma más efectiva, se combinaron las bases de datos (BD) diseñadas para el servicio analítico (figura 4). La base de datos “Servicios” asegura la trazabilidad de la cadena informativa: paciente-muestra-analito solicitado-analito ensayado-resultado-informe. La base de datos “Control de calidad” contiene las herramientas para la ejecución del control interno de la calidad y la aceptación de ensayos. Contiene también el banco de información con la data histórica pertinente a la calidad de los ensayos analíticos y de la participación en ejercicios de aptitud, útil a los efectos del seguimiento estadístico, facilita asimismo los estudios de precisión y trazabilidad. La base de datos “Control de los recursos” es la herramienta que favorece la gestión del almacén de reactivos, materiales e insumos.
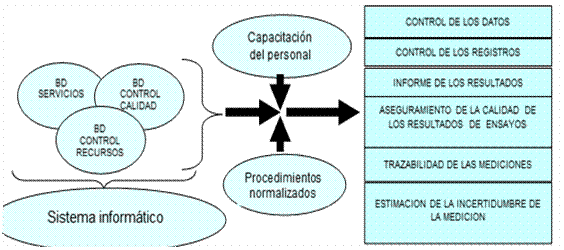
Figura 4 Concepción del sistema informático para el cumplimiento de los requisitos vinculados a actividades técnicas específicas del servicio analítico del SDA.
Una vez diseñadas las bases de datos se procedió a su validación de acuerdo a la norma IEEE 1012:2004 [9]. La esencia del procedimiento consistió en comprobar la pertinencia del software en las condiciones de operación del usuario (es decir en las reales del servicio analítico del SDA), sometiéndose a prueba los diferentes códigos de programación implicados en la transformación y manipulación de la información a través del flujo completo de procesos del servicio analítico. El tipo de prueba utilizado es de la modalidad “Prueba funcional - caja negra”. Los resultados de las validaciones de la base de datos en cuanto a la recepción de las muestras, protocolos, control de calidad, adquisición de resultados e informe de resultados funcionaron consistentemente, de forma confiable y siempre se obtuvieron los resultados esperados.
La combinación y mejoras en las bases de datos permitieron asegurar la trazabilidad de las muestras y de sus resultados a través de todas las etapas de ejecución del servicio, además de permitir el seguimiento a las muestras que por motivos técnicos su resultado había sido corregido.
La implementación de este sistema de gestión de calidad y las mejoras introducidas permitieron al Laboratorio SDA en obtener en el año 2012 la certificación de Buenas Prácticas de Laboratorio Clínico que otorga el CECMED, convirtiéndose en el primer laboratorio en el país en lograr este certificado.
La norma NC-ISO 15189-2016.
En el año 2016 el país adoptó la norma NC-ISO 15189: 2016: “Laboratorios Clínicos - Requisitos para la calidad y la competencia” [10], en la que se han actualizado varios aspectos del sistema de gestión: tratamiento de las muestras, competencia técnica, análisis de riesgos y desempeño del Laboratorio. La mejora continua y la implicación de los profesionales son los elementos claves para la continuación de la garantía de la calidad en un laboratorio clínico. Se hizo necesario, por lo tanto, el rediseño del sistema de gestión de calidad para adecuarlo a las nuevas exigencias de la norma, lo que implicó trabajar en los siguientes requisitos: organización, documentación, así como en las fases preanalítica y analítica [11].
Fase preanalítica
Se plantea que es en esta fase donde se comete el mayor número de errores, entre el 45 y el 84 % a escala mundial. De ahí su importancia en la trazabilidad de la muestra y el resultado final que se le entrega al paciente [12]. Uno de los nuevos requisitos incorporados está relacionado con el tiempo total que transcurre desde la extracción y preparación de la muestra de sangre hasta la realización del ensayo de modo que el resultado mantenga su validez clínica, que constituye el objetivo fundamental del proceso. En este sentido es de particular importancia asegurar la estabilidad de la muestra de suero en uso. El laboratorio diseñó y realizó un estudio teniendo en cuenta las diversas condiciones que se pueden presentar en las instituciones hospitalarias y su posible influencia en la integridad físico-química y biológica del suero. Se encontró que las muestras pueden ser conservadas entre 8 y -25 °C y congelarse y descongelarse hasta 5 veces sin que se afecten los resultados de los ensayos [12].
Fase analítica
En esta fase se realizaron modificaciones importantes a la base de datos de Control de Calidad con vistas a obtener una mayor información sobre el comportamiento de cada servicio, así por ejemplo se incluyeron nuevos gráficos de control, entre ellos la carta control para el seguimiento del desempeño de un analista en particular, como se muestra en la figura 5, donde en el gráfico b se aprecia el comportamiento del control medio del juego de reactivos para la determinación de TSH para todos los ensayos realizados (con lo cual se evalúa el desempeño del producto en el tiempo) y en el gráfico c para un solo analista, lo que permite una evaluación más fidedigna del trabajo de los técnicos.

Figura 5 Base de Datos “Control de Calidad”. a) Gráfico histórico de control de Calidad del control medio de TSH. b) Gráfico de control de Calidad del control medio de TSH realizado por un solo analista
Otro aspecto de nueva inclusión dentro del control interno de la calidad fue la política de reensayo para muestras individuales aun cuando el ensayo en su conjunto haya sido aceptado. Para dar respuesta a este aspecto se estableció que el Jefe del Laboratorio o el Responsable de Calidad del SDA podrán rechazar resultados de muestras individuales con vistas a su reensayo. En la base de datos se programó un ícono de seguimiento de las muestras que son rechazadas por motivos técnicos, lo que permite obtener en cualquier momento la información sobre las muestras individuales rechazadas y las causas que motivaron esta decisión [8].
Adicionalmente se definió un grupo de indicadores de desempeño del Laboratorio, los que se controlan con una frecuencia semanal a fin de evaluar en qué medida se cumplen y en consecuencia cómo funciona el servicio. A continuación algunos datos de interés al respecto.
Indicadores de desempeño SDA
> 85% de los resultados entregados a la semana de solicitado el ensayo.
Total de determinaciones planificadas/Total de determinaciones realizadas ≥ 1.
Ensayos rechazados (≤ 0.5 %).
Estos indicadores se programan en la base de datos, lo que permite su visualización gráfica y su evaluación de forma sencilla y rápida con vistas a asegurar las acciones necesarias para garantizar su cumplimiento. La figura 6 muestra, a manera de ejemplo, la evaluación del indicador para un cliente específico. Se puede apreciar información no solo del total de ensayos solicitados/ejecutados, sino también para cada uno de los analitos. De la misma forma se realiza para el conjunto del servicio, lo que asegura una evaluación sistemática y profunda del desempeño del laboratorio.
Actualmente se trabaja en otros requisitos de la norma NC-ISO 15189: 2016, como la evaluación de riesgos del proceso y de la incertidumbre de los resultados, lo que debe permitir la certificación por dicha norma. En esta línea se trabaja de forma integrada con las instituciones de salud que reciben el servicio para lograr disminuir los errores en la fase preanalítica, lo que debe contribuir a un mayor aseguramiento de los resultados de los ensayos, lo que redunda en mayor beneficio para los pacientes.
Los trabajos de rediseño del Sistema de Gestión de Calidad basados en los requerimientos actuales para laboratorios clínicos han permitido un desempeño cada vez más creciente del laboratorio, cuya certificación de cumplimiento de Buenas Prácticas está vigente hasta junio/2020. Importante ha sido también el impacto que ha tenido desde el punto de vista social, lo que se evidencia en el número de determinaciones realizadas en los últimos 8 años (figura 7).
Conclusiones
El funcionamiento estable durante más de 15 años del Laboratorio SDA muestra la conveniencia de la vinculación de un centro productivo con las necesidades de la práctica, lo que favorece la optimización de recursos y mejoras en su desempeño y en el del sector destino. Lo anterior se manifiesta en que el SDA ha devenido el principal laboratorio que emplea métodos radiactivos en el país para la cuantificación de hormonas, con certificación de Buenas Prácticas de Laboratorio Clínico. Su quehacer ha favorecido la atención a más de 70 000 pacientes como promedio en el año, resultado de más de 90 000 determinaciones en ese mismo período, principalmente en la capital del país. Un pequeño y sostenido aporte al 500 aniversario de La Habana, propósito que continua a partir de un nuevo proyecto.