Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Medicina General Integral
versión On-line ISSN 1561-3038
Rev Cubana Med Gen Integr v.13 n.2 Ciudad de La Habana mar.-abr. 1997
Cuantificación de IGG contra los componentes inmunogénicos de VA-ENGOC-BC en plasma de lactantes vacunados
José Rodríguez Canosa,(1) José Antonio Malberty Agüero,(2) Yaíma Merchán Milia(3), Gustavo Sierra González(4) y Concepción Campa Huergo(5)
RESUMEN: Debido a las características particulares de la respuesta inmune en lactantes, así como a la eficacia mostrada por la vacuna cubana antimeningocóccica VA-MENGOC-BC, nos propusimos cuantificar la respuesta de la inmunoglobulina G contra los componentes inmunogénicos de los meningococos B y C presentes en la vacuna, en lactantes vacunados. Se tomó muestra por punción capilar a 109 lactantes entre 3 y 6 meses de edad antes de la vacunación a los 31,4 ± 2 días después de la primera y 32,3 ± días después de la segunda dosis vacunal. Se determinaron las concentraciones de inmunoglobulina G contra cada inmunógeno de la vacuna. Los niveles de inmunoglobulina G específica prevacunación, fueron elevadas contra el meningococo C. Se produjo un incremento estadísticamente significativo de anticuerpos para ambos inmunógenos después de la primera y segunda dosis, más marcado contra el meningococo C en la primera y para el meningococo B en la segunda, lo que apoya la presencia de memoria inmunológica.
Descriptores DeCS: IgG/análisis; ANTICUERPOS ANTIIDIOTIPOS/análisis; FORMACION DE ANTICUERPOS; NEISERIA MENINGITIDIS/inmunología; VACUNAS BACTERIANAS/inmunología; POLISACARIDOS BACTERIANOS/inmunología; PROTEINAS DE LA MEMBRANA BACTERINANA EXTERNA/inmunología; ELISA.
Introducción
La enfermedad meningocóccica tiene una elevada letalidad que alcanza entre un 4 a un 15 % de los enfermos.1 Afecta fundamentalmente a niños entre 6 meses y 1 año de edad, donde los niveles de anticuerpos son bajos;
durante las epidemias se incrementan los casos,2,3 en los niños entre 5 y 10 años. Las manifestaciones clínicas de la enfermedad meningocóccica son diversas, se pueden encontrar: estado de portador asintomático, meningitis y meningococcemia.4
El agente causal de la meningitis meningocóccica es la Neisseria meningi tis (N. meningiditis), diplococo arriñona do, gramnegativo, oxidasa positivo, aerobio, que fermenta la glucosa y la maltosa. Su habitat natural son las mucosas humanas, fundamentalmente la nasofaringe, la que es usualmente colonizada asintomáticamente. Las cepas virulentas son aisladas general mente en la sangre o en el líquido cefalorraquídeo, siendo casi siempre encapsuladas. La cápsula está compues ta de polisacáridos, que es la base para su división en serogrupos; existen 12 serogrupos reconocidos actualmente: A, B, C, 29E, H, I, K, L, W135, X, Y y Z. Todos estos polisacáridos tienen estructura química definida.5,6 Existen 5 polisacáridos con ácido siálico en su estructura lo que hace al serogrupo ser patògeno (A, B, C, W135 y Y). Este ácido siálico es regulador de la vía alternativa del complemento, esto ha sido demostrado en el meningococo B.7
ANTECEDENTES EN CUBA
A partir de 1976, se produce en Cuba un brote de meningitis meningo cóccica, así la tasa de incidencia que era de 0,1 x 100 000 habitantes en 1962 (10 casos) pasó a 0,8 x 100 000 habitan tes (72 casos) en este año. En el análisis de los enfermos en el primer cuatrimestre de 1979 la proporción de cepas de meningococos C figuró en el 63,3 % y los del B en un 36,7 %, En 1982, se diagnosticaron en los hospitales pediátricos de Ciudad de La
Habana, 159 casos de enfermedad meningocóccica, de los cuales fallecie ron 20 (Hevia X. Factores de Pronósti co en la enfermedad meningocóccica en el niño. Trabajo para optar por el título de especialista en Pediatría, 1984). En 1983, la enfermedad menin gocóccica continuaba su tendencia ascendente, y se registraron 1 420 casos para una tasa de incidencia de 14 x 100 000 habitantes. La mayor inciden cia continuó en niños y adultos jóvenes menores de 30 años con el 84,7 % y dentro de ellos el mayor riesgo siguió en los niños menores de 1 año. En Cuba, entre 1982 y 1987, se desarrolló y evaluó en todas sus fases preclínicas y clínicas, una vacuna con proteínas de membrana externa del grupo B, que formando un complejo no covalente con el polisacárido C, resultó ser inmunogénica y eficaz.8
La enfermedad meningocóccica por serogrupo C ataca con mayor frecuen cia a los niños menores de 18 meses y provoca una alta mortalidad en este grupo etáreo que son los menores respondedores a este polisacárido como inmunógeno.9 En Brasil, donde existe la enfermedad causada por el serogru po C, la aplicación de la vacuna cubana en niños ha sido una experiencia con resultados muy positivos.10
El estudio serológico para evaluar la respuesta a vacunas, que se adminis tran a niños sanos, se dificulta en lactantes fundamentalmente en la toma de muestras y si tenemos en cuenta, la necesidad de evaluar la dinámica de esta respuesta, sólo la obtención de muestras en diferentes momentos, incluyendo prevacunación, nos permiti rá evaluar ésta, donde cada caso sea su propio control.
Método
POBLACIÓN EN ESTUDIO
Se vacunaron 190 niños nacidos entre diciembre de 1991 y septiembre de 1992 pertenecientes al área de salud del Policlínico Docente "Luis A. Turcios Lima", del municipio 10 de Octubre, Ciudad de La Habana. Con previo consentimiento de los padres para la extracción de sangre, se estudia ron 150 niños. Se excluyeron del estudio los niños que en el momento de la toma de muestra de sangre presentaron alguna enfermedad infecciosa aguda o alérgica.
ESQUEMA DE VACUNACIÓN CON VA-MENGOC-B
Consistió en 2 dosis de 0,5 mL cada una por vía intramuscular en la región deltoidea. La primera dosis se programó administrarla entre los 105 y los 150 días de nacido y la segunda dosis entre los 56 y los 70 días después de la primera. Todos los niños fueron vacunados con el mismo lote de vacuna.
RECOLECCIÓN DE MUESTRAS DE SANGRE
Se realizó punción capilar en el talón con lancetas, se utilizaron capilares para obtener las muestras y transportarlas al laboratorio. Se obtuvo el plasma por centrifugación de los capilares. Los tiempos de extracción fueron los siguientes:
To: inmediatamente antes de la primera dosis.
T1: a los 28 días después de la primera dosis.
T2: a los 28 días después de la segunda dosis.
DESCRIPCIÓN DE LOS ENSAYOS REALIZADOS
A las muestras de plasma se les realizó la cuantificación de anticuerpos inmunoglobulina G (IgG) contra ambos componentes inmunogénicos de la vacuna (proteínas de membrana de meningococo serogrupo B y polisacári do capsular del C), mediante el análisis inmunoenzimático conocido por ELISA.11
Se empleó además, para el cálculo del ELISA el programa del Centro de Control de Enfermedades, Atlanta, U.S.A.
ANÁLISIS DE LOS DATOS
Se utilizó la prueba de Kolmogorov- Smirnov. Se calculó la tendencia central mediana, media geométrica y media aritmética, así como los percentiles 25 y 75 en los datos orignales y transformados. Se utilizó la prueba de la t de Student para muestras pareadas en los momentos To, T1 y T2 para ambos componentes de la vacuna. Por último, se calcularon los coeficientes de correlación entre los 3 momentos estudia dos.
Resultados
Fue vacunado un total de 190 niños. De éstos, cumplieron el tiempo necesario para obtener las 3 muestras 150, pero las pérdidas, debido a cambios de domicilios o salidas voluntarias del estudio (41 casos), redujo las muestras estudiadas a 109.
Las reacciones colaterales relacionadas con la vacunación fueron (19 casos) induración en el sitio de la vacuna y fiebre de 38 0C. Sólo en 1 caso apareció absceso en el sitio de inoculación que desapareció con antibioticoterapia.
Se obtuvieron como promedio 6 capilares de sangre en cada toma de muestra de la que se extrajo aproximadamente 200 mL de suero, suficiente para las pruebas a realizar y la conservación de una muestra testigo. Las muestras T1 y T2 se colectaron a los 31,4 ± 2,37 días de la primera dosis y a los 32,1 ± 3,28 días de la segunda dosis respectivamente. La variación en el cumplimiento del esquema de vacunación establecido, ocurrió en 11 niños en los que se administró la primera dosis de la vacuna entre los 150 y los 240 días de nacidos. Estas fueron analizadas inicialmente por separado, y se incluyeron posteriormente en el estudio, por presentar valores semejantes a los hallados en el resto del grupo, aunque no se compararon estadísticamente debido al pequeño número de este grupo. Se muestran los resultados iniciales y finales de ambos grupos en la tabla 1. La administración de la primera dosis se realizó a los 117,6 ± 23,5 días y la segunda a los 61,45 ± 6,59 días después de la primera.
TABLA 1. Valores pre y posvacunación de ELISA1 contra polisacárido y proteínas de VA-MENGOC-BC en los 2 grupos de lactantes en diferentes momentos
|
|
| Anti-men B2 | Anti-men C3 | ||
|
| Edad (1ra) | T0 | T2 | T0 | T2 |
| 117±23 | 98 | 136 | 8229 | 693 | 1186 |
| 189±37 | 11 | 200 | 9509 | 645 | 1510 |
- Media geométrica en u/mL.
- Anti-menB - IgG contra proteína del meningococo B.
- Anti-menC - IgG contra polisacárido del meningococo C.
- Media geométrica en u/mL.
- Anti-menB - IgG contra proteína del meningo coco B.
- Anti-menC - IgG contra polisacárido del meningococo C.
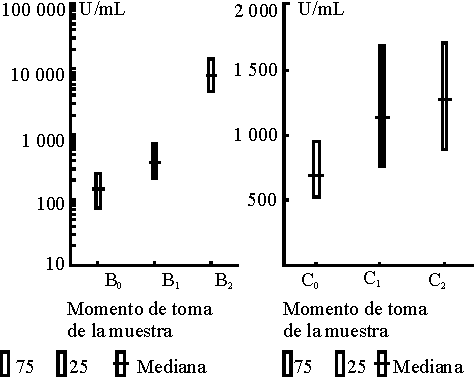
La mediana de los valores obtenidos en la cuantificación de los anticuerpos específicos contra el polisacárido capsular del meningococo C fue mayor que la observada contra las proteínas de membrana externa del meningococo B como se muestra en la tabla 2. En el caso de la respuesta al polisacárido, el mayor incremento de los valores se produjo después de la primera dosis y para la proteína después de la segunda dosis. El efecto de la vacunación se evaluó mediante la prueba t para muestras pareadas con las variables transformadas logarítmica mente, pues los datos originales no tienen una distribución normal. Se muestra el comportamiento de la respuesta para cada inmunógeno presente en la vacuna en la figura y puede observarse la diferencia entre los 3 momentos estudiados. Esta diferencia se demostró con un nivel de significación a £ 0,01 en la tabla 2 para la combinación T0-T1; T0-T2 y T1- T2 tanto en la respuesta al polisacárido como al componente proteínico de la vacuna.
TABLA 2. Medianas y percentiles 25 y 75 de los valores de ELISA (u/mL) de IgG antipolisacárido C y proteínas de Men B en los 3 momentos estudiados en lactantes vacunados con VA--MENGOC-BC
|
| Anti-men B | Anti-men C | ||||
| Muestra | Med | 25 | 75 | Med | 25 | 75 |
| T0 | 147 | 78 | 252 | 692 | 528 | 950 |
| T1 | 381 | 224 | 748 | 1 140 | 763 | 1 692 |
| T2 | 8 267 | 4 743 | 14 853 | 1 279 | 902 | 1 710 |
No se encontraron diferencias significativas en la prueba de comparación de medias entre los resultados de hijos de madres previamente vacuna das, y no vacunadas. Ninguna madre fue vacunada durante el embarazo (tabla 3).
TABLA 3. Estudio comparativo de los resultados de ELISA de IgG contra polisacáridos C y proteínas de Men B en lactantes vacunados, en relación con la vacunación previa de la madre
| Vacunación de las madres (No.) | Anti-men B | Anti-men C | ||||
| T0 | T1 | T2 | T0 | T 1 | T2 | |
| Sí (15) | 133 | 392 | 8 777 | 679 | 1 084 | 1 224 |
| No (94) | 188 | 307 | 7 158 | 739 | 1 201 | 1 202 |
En el estudio de correlación entre los ln de los valores en los diferentes momentos (tabla 4) se halló una correlación significativa (p < 0,01) para la respuesta a cada inmunógeno entre todos los momentos. No se encontró correlación en la respuesta a ambos componentes entre sí.
TABLA 4. Análisis de correlación entre los diferentes momentos estudiados para anticuerpos contra los antígenos de VA-MENGOC-BC
|
| Anti-men B | Anti-men C |
| T0-T1 | 10,527 | 0,467 |
| T0-T2 | 0,393 | 0,400 |
| T1-T2 | 0,370 | 0,788 |
FIGURA. Medianas y percentiles 25 y 75 de los valores de : a) IgG antipolisacárido C medidas por ELISA en lactantes vacunados. b) IgG antiproteínas de meningococo B medidas por ELISA en lactantes vacunados.
Una limitante para la inclusión de vacunas contra la N. meningitidis en las vacunaciones de rutina, ha sido la no existencia de un preparado eficaz contra el serogrupo B.12 Este serogrupo se ha incrementado en los últimos años en muchos países de América, Europa y Asia.
La eficacia mostrada por VA-MENGO-BC, permitió incluir dicha vacuna en nuestro programa nacional de vacunación y actualmente se administra a toda la población en las edades comprendidas entre 3,5 meses y 24 años.
En el grupo estudiado en el presente trabajo, los niveles prevacunales de anticuerpos contra el polisacárido del meningococo C, más elevados que contra las proteínas del meningococo B, pueden estar relacionados con diversos sucesos que son reflejo de la complejidad de la respuesta a los diversos componentes de la N. meningitidis y a los polisacáridos de las bacterias encapsuladas en general. En el caso del meningococo B, se evaluó la respuesta contra las proteínas, y se encontraron bajos niveles prevacunales, lo que refleja la buena especificidad del sistema empleado, pues existen para este serogrupo igualmente, mecanismos de producción de reactividad cruzada.13
Si bien no fue un objetivo de nuestro trabajo la comparación de la respuesta en relación con el estado inmune previo de la madre, sí analizamos ambos grupos, pues la presencia de anticuerpos previa vacunación transferidos de una madre vacunada, podría introducir variaciones en la interpretación de los resultados y en el análisis de correlación de la respuesta en relación con el estado prevacunal de los niños. No se realizó otro tipo de análisis en este sentido, pues las madres que habían sido vacunadas, lo fueron cada una en etapas diferentes pero ninguna durante el embarazo.
Algunas publicaciones refieren haber encontrado respuestas en proporción inversa al título inicial14 aunque otros no encontraron relación alguna entre éstos.15 Por otra parte, los títulos finales alcanzados contra el polisacárido C, si bien más bajos que los obtenidos en adultos (con títulos prevacunales mayores) con esta misma vacuna en estudios previos realizados en el Instituto Finlay,16 lo cual es explicable por la menor capacidad de los niños pequeños para responder a los polisacáridos, son suficientemente elevados para desencadenar una buena actividad bactericida correlacionada con los niveles de IgG evaluados por ELISA.
Conclusiones
- El grupo de lactantes estudiados presentó niveles prevacunales de anticuerpos IgG contra el polisacárido del menigococo C, variables, pero más elevados que contra las proteínas presentes en dicha vacuna. Estos pueden ser de origen materno o propios y como resultado del estímulo de sustancias que porten antígenos comunes.
- Existe una buena respuesta humoral contra ambos componentes de la vacuna, y se corroboró la eficacia de la segunda dosis para la respuesta a las proteínas del meningococo B.
- Se observó un efecto estimulante de la segunda dosis en la producción de anticuerpos IgG contra el polisacárido del meningococo C, que puede reflejar la presencia de memoria inmunológica.
SUMMARY: Due to the particular characteristics of the immune response in infants and to the efficacy shown by the Cuban antimeningococcal vaccine denominated VA-MENGOC-BC, we propose ourselves to quantify the response of immunoglobulin G against the immunogenic components of the meningococci B and C present in the vaccine among the vaccinated infants. The sample was taken by capillary puncture from 109 infants between 3 and 6 months before vaccination, at 31.4±2 days after the first dose and at 32.3± days after the second one. The concentrations of immunoglobulin G against each immunogen of the vaccine were determined. The levels of prevaccination specific immunoglobulin G were elevated against meningococcus C. There was a statistically significant increase of atibodies
for both immunogens after the first and second dose. It was more marked against meningococcus C in the first, and for meningococcus B in the secons one, which supports the presence of immunological memory.
Subject headings: IgG/analysis; ANTIBODIES, ANTI-IDIOTYPIC/ana-lysis; ANTIBODY FORMATION; NEISSERIA MENINGITIDIS/immunology; BACTERIAL VACCINES/immunology; POLYSACHARIDES, BACTERIAL OUTER MEMBRANE PRO TEINS/immunology; ENZYME-LINKED IMMUNOSORBENT ASSAY.
Referencias bibliográficas
- Benson CA, Harris AA, Levin S. Acute bacterial meningitis: general aspects. En: Vinken PJ, Bruyn GW, Klawans H. Hand book of Clinical Neurology Microbiol Dis 1988;8(52):1-15.
- Goldschneider I, Gotschlich EC, Artenstein MS. Human immunity to the meningococcus: II. Development of natural immunity. J Exp Med 1969;129:1327-48.
- Band JD, Chamberland ME, Platt T, Weaver RE, Thornsberry C, Fraser DW. Trends in meningogoccal disease in the United States 1975-1980. J Infect Dis 1983;41:754-8.
- Grossman M, Jawetz E. Enfermedades infecciosas causadas por bacterias. En: Krupp MA, Chatton MJ. Diagnóstico clínico y tratamiento. La Habana 1983;942. (Edición Revolucio naria).
- Jaennings HJ. Capsular polysaccharides as human vaccines. Adv Carbohydr Chem Biochem 1983;41:155-208.
- Michon F, Brisson JR, Roy R, Jennings HJ, Ashton FE. Structural determination of the capsular polysaccharide of Neisseria meningi tidis group I: A 2D - NMR analysis. Bioche mistry 1985;24:5592-8.
- Jarvis GA, Vedros NA. Sialic acid of group B Neisseria meningitidis regulates alternative complement pathway activation. Infect Inmunol 1987;55: 174-80.
- Valcárcel M, Rodríguez R, Terry H. La enfermedad meningocóccica en Cuba. Cronología de una epidemia. 2 ed. La Habana: Editorial Ciencias Médicas, 1991:1-84.
- Goldschneider I, Draper TF, Gotschlich EC. Kinetics of antibody production to group A and group C meningoccal prospects polysacharide vaccines administered during the firts six years of life: for routine inmunization of infants and children. J Infect Dis 1979; 140:690-7.
- Anónimo. Doença meningocócica. Vacinas para a prevençâo da doença meningocócica. Imunizaçoes-Actualizaçâo. 1991;4(1):12-25.
- Engvall EP. Pearlman: Enzyme linked immu nosorbent assay (ELISA) III. Cuantitation of specific antibodies by enzyme labded antiim munologlobulin in antigen coated tubes. Inmunol 1972;109(1): 129-35.
- Frasch CE. Vaccines for prevention of meningococcal disease. Clin Microbiol Rev 1989; (Supl):S134-8.
- Rubinstein JL, Stein EK. Murine Immune response to the N. meningitidis group C capsular polysaccharide. II Specificity. J Immunol 1988;141:4357-62
- Gotschlich EC, Goldschdneider I, Artenstein MS. Human immunity to the meningococcus. IV immunogenicity of group A and group meningococcal. J Exp Med 1969;129:1367-84.
- Malberty JA, Sotolongo F, Galguera M, Nerey M, Camaraza MA, Bacallao J, et al. Respues ta Inmune humoral al polisacárido capsular de la Neisseria meningitidis serogrupo C en vacunados con VA-MENGOC-BC en el Departamento de Antioquia. Biomédica. 1993 (en prensa).
- Malberty JA, Sotolongo F, Bacallao J, Blanco R, Martínez OM, Galguera M. Estudio comparativo de la prueba de anticuerpos bactericidas y dos sistemas inmunoenzimáticos en la evaluación de la respuesta inmune a VA-MANGOC-BC. Biomédica. 1993 (en prensa).
Recibido: 22 de julio de 1996. Aprobado: 3 de octubre de 1996.
Dr. José Rodríguez Canosa. Ave 35, Edificio 3 MD-4, La Coronela, La Lisa, Ciudad de La Habana, Cuba.
(1) Especialista de I Grado en Medicina General Integral. Policlínico "Luis A. Turcios Lima". Municipio 10 de octubre, Ciudad de La Habana.
(2) Especialista de II Grado en Inmunología. Instituto Finlay. Ciudad de La Habana.
(3) Licenciada en Bioquímica. Instituto Finlay. Ciudad de La Habana.
(4) Doctor en Ciencias Médicas. Instituto Finlay. Ciudad de La Habana.
(5) Doctora en Ciencias Farmaceúticas. Instituto Finlay. Ciudad de La Habana.