Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Medicina General Integral
versión impresa ISSN 0864-2125
Rev Cubana Med Gen Integr vol.28 no.3 Ciudad de La Habana jul.-set. 2012
TRABAJO DE REVISIÓN
Mecanismos moleculares implicados en las enfermedades cardiovasculares aterotrombóticas
Molecular mechanisms involved in atherothrombotic cardiovascular disease
Lic. Judith Borrero Sánchez,I Dra. Ela María Céspedes Miranda,I Lic. Marisol Peña Sánchez,II Dra. Niurelkis Suárez Castillo,I Lic. Reison Adalberto Olivero BetancourtI
I Facultad de Ciencias Médicas "General Calixto García". La Habana, Cuba.
II Instituto de Neurología y Neurocirugía. La Habana, Cuba.
RESUMEN
El síndrome coronario agudo es un problema de salud y constituye la primera causa de muerte en el mundo desarrollado y en Cuba. Esta enfermedad, que incluye infarto de miocardio, angina de pecho y muerte súbita, causa más muertes cada año que el resto de las enfermedades combinadas. El factor causal de mayor relevancia del infarto del miocardio, radica en la formación y evolución crónica de un ateroma, o eventos que son favorecidos por el estrés oxidativo, las citocinas proinflamatorias, la trombina y el no control de los factores de riesgo. La presente revisión se realizó con el propósito de explicar los mecanismos moleculares y la influencia de los factores de riesgo implicados en la fisiopatología de estas enfermedades. Se concluyó que las especies reactivas del oxígeno y el estrés oxidativo, desempeñan un papel importante en la fisiopatología de estas afecciones cardiovasculares, de relevancia para el diagnóstico y la terapéutica.
Palabras clave: especies reactivas de oxígeno, estrés oxidativo, enfermedad cardiovascular aterotrombótica.
ABSTRACT
Acute coronary syndrome is a health problem and is the leading cause of death in Europe, North America, and Cuba. This disease, which includes heart attack, angina and sudden death, causes more deaths each year than all other diseases combined. The most important causal factor of myocardial infarction lies in the formation and chronic evolution of atheroma, or events that are favored by oxidative stress, proinflammatory cytokines, thrombin and no control of risk factors. This review was conducted in order to explain the molecular mechanisms and the influence of the risk factors involved in the pathophysiology of these diseases. It was concluded that reactive oxygen species and oxidative stress play an important role in the pathophysiology of such cardiovascular disorders, of relevance for its diagnosis and therapy.
Keywords: reactive oxygen species, oxidative stress, atherothrombotic cardiovascular disease.
INTRODUCCIÓN
El síndrome coronario agudo es un problema de salud y constituye la primera causa de muerte en el mundo desarrollado y en Cuba. Esta enfermedad, que incluye infarto de miocardio (IM), angina de pecho y muerte súbita, causa más muertes cada año que el resto de las enfermedades combinadas. En Cuba, la tasa de mortalidad fue de 135,6 × 100 000 habitantes en 2011,1 a pesar de los programas de control de los factores de riesgo, que se realizan en la atención primaria de salud, en el que los médicos, enfermeros y la comunidad están involucrados.
Hacia fines de la década de loa años sesenta (siglo XX) se comprobó la teoría de que la aterotrombosis coronaria es la base de estas enfermedades. Los factores locales y sistémicos, así como estilos de vida poco saludables, influyen en el tránsito del ateroma hacia la inestabilidad y el evento clínico. Este tránsito está dado por la probabilidad de la placa vulnerable de sufrir eventos tales como: calcificación, fisura o rotura, hemorragia, ulceración y trombosis.2,3 Sin embargo, los mecanismos involucrados en la progresión de una placa estable o asintomática a una placa inestable o con alto riesgo de ruptura, no son conocidos en su totalidad, aunque se invocan diversos mecanismos moleculares entre los que el daño oxidativo mediado por especies reactivas del oxígeno (ERO) y el estrés oxidativo, son importantes.
En la presente revisión se ofrecen evidencias de los mecanismos patogénicos de la aterogénesis.
FACTORES DE RIESGO Y ATEROSCLEROSIS
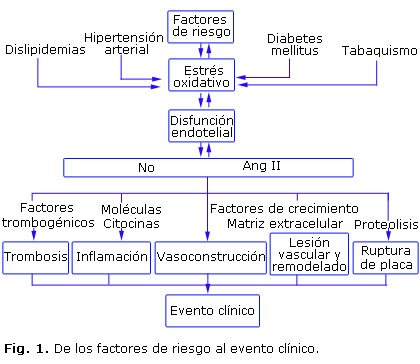
Numerosos estudios epidemiológicos, apoyados en enfermedades genéticas y en modelos animales, permitieron identificar diferentes factores de riesgo cardiovascular. Se distinguen entre estos los factores no modificables, como la edad y el sexo; y los modificables, como las dislipidemias, el tabaquismo, la obesidad, la diabetes mellitus y la hipertensión arterial, que se asocian con aterosclerosis acelerada.4 Estos factores actúan sobre la pared del vaso sanguíneo, favorecen la producción de especies reactivas del oxígeno, inducen estrés oxidativo y disfunción endotelial (Fig. 1), lo que favorece la liberación de mediadores celulares, la aterosclerosis y el evento clínico.5
El endotelio vascular funciona como una barrera permeable entre la sangre y los tejidos, y genera especies químicas que regulan el tono vascular, la inflamación y la trombosis. Entre estas especies se incluyen los radicales libres o las ERO, lo que convierte también al endotelio en diana del daño oxidativo. Las ERO producen efectos adversos por su poder oxidante sobre las diferentes biomoléculas; aunque también se reconoce su papel como moléculas señal en cascadas que regulan la función celular, de importancia en condiciones fisiológicas y patológicas.6,7
ACCIÓN DE LAS ESPECIES REACTIVAS DEL OXÍGENO
Un radical libre es toda especie química que presenta al menos un electrón desapareado en su orbital más externo, lo que le permite ser una especie muy reactiva e interactuar muy rápido con otros átomos o moléculas. Se identifican entre estos el anión superóxido y el radical hidroxilo, quienes junto al oxígeno singulete y el peróxido de hidrógeno, se consideran especies reactivas del oxígeno.7
Aunque la formación de ERO es consecuencia del funcionamiento normal de diversas vías metabólicas, resultan oxidantes potentes para las biomoléculas. Es por esto que se dispone de mecanismos antioxidantes que controlan los posibles efectos adversos derivados de su reactividad. Cuando existe un exceso de especies reactivas oxidantes, una disminución en los mecanismos antioxidantes, o ambos, con repercusión en las vías específicas de control de la señalización de oxido-reducción, se produce un desbalance que determina un estado de estrés oxidativo.
Las ERO se originan en diversos procesos biológicos intra y extracelulares. Entre estas fuentes se citan: la respiración mitocondrial, y la actividad de las enzimas nicotinamín adenin dinucleótido fosfato oxidasa (NADPH oxidasa), óxido nítrico sintasa desacoplada, xantina oxidasa y mieloperoxidasa, entre otras.8
Una vez generadas, las ERO reaccionan rápidamente con cualquier biomolécula o sustrato oxidable, accesible a nivel de su sitio de formación, en posiciones susceptibles a la oxidación.
Las especies reactivas producen:
– Lesiones directas sobre el ácido desoxirribonucleico (ADN) nuclear y mitocondrial, que determinan mutaciones y rupturas de doble y simple cadena.9
– Peroxidación lipídica con destrucción de las membranas y organelos celulares.8
– Oxidación de proteínas, con los cambios conformacionales que comprometen su función.10
– Auto-oxidación de la glucosa y fragmentación de polisacáridos.11
– Consecuencias que derivan del efecto de las propias especies o de los productos de su oxidación, como lesión del endotelio vascular e inducción de la respuesta inflamatoria.
Para disminuir o inhibir la oxidación se identifican los antioxidantes, quienes actúan en bajas concentraciones comparadas con el sustrato oxidable.12 Estas sustancias previenen la formación de ERO, interrumpen las reacciones en cadena por ataque de las ERO, secuestran metabolitos reactivos, facilitan mecanismos de reparación y favorecen la acción de otros antioxidantes, con mecanismos de regulación que dependen de oxidantes y de los propios antioxidantes, algunos de los cuales actúan incluso como mediadores de la señalización celular.13 Estrategias de intervención con antioxidantes se han empleado para tratar de disminuir los riesgos para la enfermedad cardiovascular, aunque los resultados en relación con riesgo y beneficio no son concluyentes.
Se incluyen entre los mecanismos de defensa antioxidante:13
– Enzimas como las superóxido dismutasas, catalasa, glutatión peroxidasa, tiorredoxinas, peroxirredoxinas.
– Adecuados niveles tisulares y plasmáticos de compuestos antioxidantes hidrofílicos, como el ácido úrico, la bilirrubina, el glutatión reducido y la vitamina C.
– Compuestos de naturaleza lipofílica como las vitaminas A y E, y la coenzima Q10.
–Transportadores de metales de transición como la transferrina y la ceruloplasmina.
La oxidación de las biomoléculas por ERO o la menor biodisponibilidad de antioxidantes favorece la aterogénesis.
MECANISMOS MOLECULARES IMPLICADOS EN LA ATEROGÉNESIS
La aterosclerosis es un proceso inflamatorio crónico consistente en un endurecimiento progresivo de las arterias de mediano y gran calibre. Durante este proceso ocurre un estrechamiento de las arterias que puede resultar en la oclusión del vaso e impedir el flujo de sangre. Sin embargo, uno de los hallazgos significativos en las últimas décadas resulta el reconocimiento de que la composición de la placa y no la severidad de la estenosis, se asocia a la trombosis y el evento clínico isquémico.4
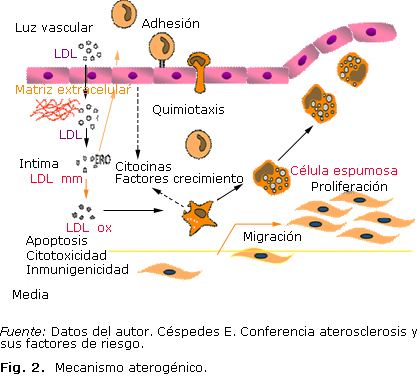
Los estudios con cultivos de células vasculares y con animales, sugirieron las vías de inicio y progresión de la lesión. Desde el punto de vista histológico, la lesión ateromatosa puede transitar por varios estadios (Fig. 2):14
Lesión tipo I: Aquella en la que ocurren cambios mínimos, se observa engrosamiento de la pared y macrófagos cargados de lípidos (célula espumosa).
Lesión II o estría grasa: Aquella en la que se observa un número elevado de células espumosas en relación con el estadio anterior, y se disponen estratificadas en capas adyacentes. También pueden observarse células musculares lisas cargadas de lípidos y linfocitos T, en el espacio extracelular. En particular se ha identificado ésteres de colesterol, colesterol y fosfolípidos.
Lesión intermedia o preateroma: Aquella en la que se observan acúmulos de lípidos entre capas de células musculares lisas.
Lesión IV: Aquella en la que se identifica un núcleo de lípidos intracelulares y lípidos extracelulares.
Lesión V o fibroateroma: Aquella en la que se verifica un núcleo de lípidos y la capa fibrosa.
Lesión VI o lesión complicada: Aquella en la que se observan defectos de superficie con zona de hemorragia, trombosis o calcificación.
Aunque las hipótesis aterogénicas han pretendido abordar el proceso desde puntos de vista aparentemente diferentes, todas tienen elementos comunes que hacen pensar en un mecanismo patogénico multifactorial:
– De la pared arterial.
– Físicos, relacionados con la hemodinamia del vaso (shear stress, HTA).
– Metabólicos, relacionados con el metabolismo de los lípidos, las lipoproteínas, oxidativos y otros.
–Reactivos, en particular los mecanismos de inflamación e inmunidad.
– De la coagulación.
Los cambios hemodinámicos de la pared arterial, favorecen la disfunción endotelial, con la consecuente alteración de la permeabilidad vascular y el incremento en la entrada y retención de las lipoproteínas de baja densidad (LDL) al espacio subendotelial. Estas LDL experimentan modificaciones oxidativas debido a la exposición continua a especies reactivas oxidantes producidas por macrófagos, células endoteliales y células musculares lisas.15 La presencia de lípidos y proteínas oxidadas se ha demostrado en todos los estadios de la lesión tanto por estudios inmunohistoquímicos como por inmunoensayos.16,17
Las lipoproteínas de baja densidad oxidadas (LDLox), o sus productos de oxidación, favorecen la adhesión de monocitos al endotelio, la internalización de estas células y su diferenciación a macrófagos, así como la inhibición de la movilidad de los macrófagos residentes. Las LDLox son reconocidas por los receptores depuradores, principalmente receptores atrapadores del tipo A (SR-A) y el cluster de diferenciación 36 (CD36), presentes en estas células y que son regulados por factores de transcripción sensibles al estado redox de las células. Este reconocimiento molecular favorece la formación de las células espumosas que se identifican en la lesión ateromatosa tipo I.4 En animales que no expresan los receptores depuradores, se encontró disminución de la lesión.4
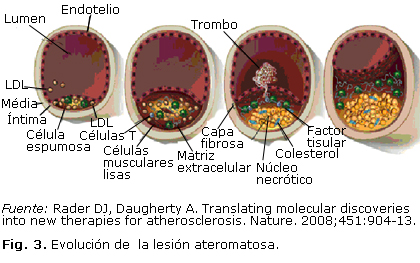
Las LDLox son citotóxicas, inmunogénicas e inflamatorias, estimulan la liberación de citocinas, moléculas de adhesión y factores de crecimiento, que favorecen el aumento de la adhesión de leucocitos y las plaquetas a la pared vascular, con lo que la lesión ateromatosa transita hacia las complicaciones (Fig. 3).18
La acumulación de células espumosas conduce a la formación de la estría grasa. Además se reclutan leucocitos en la lesión y se favorece la inflamación.15 Los lípidos en exceso se liberan en el espacio subendotelial y se define un núcleo de células espumosas y detritus celulares que se rodea de proteínas de la matriz extracelular, lo que forma la placa fibrosa estable. Esta placa puede experimentar ulceración, hemorragia, el endotelio se erosiona y se liberan moléculas trombogénicas, como el factor tisular, que favorecen la formación de un trombo, causantes del síndrome coronario.19,20
En los últimos años se presta atención al tejido adiposo perivascular. Las citocinas proinflamatorias y adipocitocinas pudieran liberarse también del tejido adiposo epicárdico, producir disfunción endotelial, incremento de las moléculas de adhesión, aumento de la quimiotaxis para monocitos e hipercoagulabilidad, condiciones que se producen en presencia de un estrés oxidativo.21
Los factores de riesgo, la exposición continua a los radicales libres y la acción de las metaloproteinasas de la matriz, se consideran elementos que conducen a la inestabilidad de la placa. En la mayoría de los estudios se demuestra un incremento en las metaloproteinasas secretadas por los macrófagos, en la región prona a la ruptura.19,22 Las propias ERO pueden aumentar la producción de metaloproteinasas que están presentes en la pared vascular.18
En el estudio publicado por Barbosa y otros, se encontró asociación entre LDLox y marcadores de estrés oxidativo, en 160 personas jóvenes saludables, por lo que se identifica desde edades tempranas una compleja relación entre variables lipídicas y el estado redox, con posibles implicaciones en el estado de salud.17
En los casos de muerte súbita, no se produce disrupción de la placa vulnerable, sino una erosión superficial de una placa fibrótica y estenótica.18 La formación del trombo depende del estado hipertrombogénico en condiciones tales como LDL elevada, tabaquismo, hiperglicemia, hipertensión arterial, entre otros. La trombosis se observa en sitios con gran estenosis preexistente, en particular en mujeres, y en hombres con algún factor de riesgo protrombótico asociado.23
La participación del estrés oxidativo debe continuar dando respuestas en relación con los mecanismos moleculares, implicados en la aterotrombosis.
Consideraciones finales
Los mecanismos patogénicos de la aterotrombosis involucran a las especies reactivas del oxígeno, el estrés oxidativo y la disfunción del endotelio. La expresión clínica de estos procesos, que corresponde a las enfermedades cardiovasculares, específicamente en el infarto agudo del miocardio, depende de la magnitud de la respuesta molecular ante los mecanismos que se activan en la progresión de la placa ateromatosa y en el control de los factores de riesgo.
En Cuba, que dispone de un desarrollo científico y técnico que involucra a muchos profesionales, es necesario insistir en la promoción de salud mediante la educación a la población, actividad que requiere del concurso de todas las personas en su entorno social, en particular, los enfermeros. El control de los factores de riesgo cardiovascular es fundamental para disminuir la mortalidad.
REFERENCIAS BIBLIOGRÁFICAS
1. Ministerio de Salud Pública. República de Cuba. Anuario Estadístico de Salud 2011. Edición Especial. Dirección Nacional de Registros Médicos y Estadísticas de Salud. La Habana; 2012. p. 75.
2. Virmani R, Burke AP. Pathology of unstable plaque. Progress Cardiovasc Dis. 2002;44(5):349-56.
3. Leopold JA, Loscalzo J. Oxidative risk for atherothrombotic cardiovascular disease. Free Rad Biol Med. 2009;47(12):1673-706.
4. Lusis AJ. Atherosclerosis. Nature. 2000;407(6801):233-41.
5. Vassalle C, Pratali L, Boni C, Mercuri A, Ndreu R. An oxidative stress score as a combined measure of the pro-oxidant and anti-oxidant counterparts in patients with coronary artery disease. Clin Biochem. 2008;41(14-15):1162-7.
6. Münzel T, Gori T, Bruno RM, Taddei S. Is oxidative stress a therapeutic target in cardiovascular disease? Eur Heart J. 2010;31(22):2741-8.
7. Sugamura K, Keaney JF. Reactive oxygen species in cardiovascular disease. Free Radic Biol Med. 2011;51(5):978-92.
8. Santos CXC, Anilkumar N, Zhang M, Brewer AC, Shah AM. Redox signaling in cardiac myocytes. Free Rad Biol Med. 2011;50(7):777-93.
9. Zhang Y, Du Y, Le W, Wang K, Kieffer N, Zhan J. Redox Control of the Survival of Healthy and Diseased Cells. Antioxid Redox Signal. 2011;15(11):2867-908.
10. Armstrong AE, Zerbes R, Fournier PA, Arthur PG. A fluorescent dual labeling technique for the quantitative measurement of reduced and oxidized protein thiols in tissue samples. Free Radic Biol Med. 2011;50(4):510-7.
11. Choi S, Benzie IF, Ma SW, Strain JJ, Hannigan BM. Acute hyperglycemia and oxidative stress: Direct cause and effect? Free Radic Biol Med. 2008;44(7):1217-31.
12. Halliwell B. Free radicals and antioxidants quo vadis?. Trends Pharmacol Sci. 2011;32(3):125-30.
13. Niki E. Assessment of antioxidant capacity in vitro and in vivo. Free Rad Biol Med. 2010;49(4):503-15.
14. Stary HC, Chandler AB, Dinsmore RE. A definition of advanced types of atherosclerotic lesions and a histological classification of atherosclerosis. A report from the Committee on Vascular Lesions of the Council on Arteriosclerosis, American Heart Association. Arterioscler Thromb Vasc Biol. 1995;15(9):1512-31.
15. Duryee MJ, Klassen LW, Schaffert CS, Tuma DJ, Hunter CD, Garvin RP, et al. Malondialdehyde-acetaldehyde adduct is the dominant epitope after MDA modification of proteins in atherosclerosis. Free Radic Biol Med. 2010;49(10):1480-6.
16. Tsimikas S, Brilakis ES, Miller ER, McConnell JP, Lennon RJ, Kornman KS, et al. Oxidized phospholipids, Lp(a) lipoprotein, and coronary artery disease. N Engl J Med. 2005;353(1):46-57.
17. Burgos MI, Avilés F, Martínez R, Sánchez M, Larqué E, Pérez F, et al. Oxidized LDL and its correlation with lipid profile and oxidative stress biomarkers in young healthy Spanish subjects. J Physiol Biochem. 2010;66(3):221-7.
18. Schulz E, Gori T, Mûnzel T. Oxidative stress and endothelial dysfunction in hypertension. Hypertension Res. 2011;34(6):665-73.
19. Èuliæ V. Acute risk factors for myocardial infarction. Intern J Cardiol. 2007;117(2):260-9.
20. Niki E. Do free radicals play causal role in atherosclerosis? Low density lipoprotein oxidation and vitamin E revisited. J Clin Biochem Nutr. 2011;48(1):3-7.
21. Verhagen SN, Visseren FLJ. Perivascular adipose tissue as a cause of atherosclerosis. Atherosclerosis. 2011;214(1):3-10.
22. Jerjes SC. Venous and arterial thrombosis. A continuum spectrum of the same disease? Eur Heart J. 2005;26(1):3-4.
23. Subirana MT, Juan-Babot JO, Puig T, Lucena J, Rico A, Salguero M, et al. Specific characteristics of sudden death in a mediterranean Spanish population. Am J Cardiol. 2011;107(4):622-7.
Recibido: 15 de abril de 2011.
Aprobado: 18 de abril de 2012.
Judith Borrero Sánchez. Facultad de Ciencias Médicas "General Calixto García". Ave. Universidad y J. La Habana, Cuba. Correo electrónico: yborrero@infomed.sld.cu