Introducción
Las infecciones del tracto urinario (ITU) son uno de los principales motivos de demanda de consulta en el primer nivel de atención médica. Es la segunda enfermedad infecciosa más común detrás de las vías respiratorias, y es la infección bacteriana más frecuente en mujeres.1 Si consideramos que las ITU no son enfermedades notificables y que, en la mayoría de los casos, el diagnóstico se realiza con base al cuadro clínico, sin el apoyo de un cultivo, la incidencia real es difícil de establecer. No obstante, se han reportado frecuencias de 12,9 %, 19,6 % y 24 % en Estados Unidos de América, Europa y en países en desarrollo, respectivamente.2 En México, el Sistema Nacional de Vigilancia Epidemiológica reportó que, en 2017, las ITU ocuparon el tercer sitio dentro de las principales causas de morbilidad, con 4 474 599 casos registrados en ese año.3 Se han documentado una serie de factores de riesgo como causales de las ITU y, de estos, el sexo biológico parece ser el mayormente implicado. Se reporta que las mujeres presentan frecuencias más altas, con diferencias importantes.4 Otros factores involucrados son la edad (principalmente la reproductiva en mujeres), la presencia de diabetes mellitus, ITU previas y los hábitos de higiene. Las ITU pueden ser causadas por una variedad de bacterias Gram positivas y Gram negativas. Sin embargo, la especie de mayor importancia por su frecuencia y severidad es Escherichia coli.1 Diversos autores incluyen también bacilos Gram positivos como: Gardnerella vaginalis y otros dentro del cuadro etiológico de las ITU, principalmente en pacientes con inmunosupresión.5 En los últimos años se ha descrito un aumento importante en la resistencia a los antimicrobianos de las bacterias causales de ITU. Un probable factor implicado es el inicio del tratamiento empírico antes de tener disponible los resultados del cultivo.6) Considerando lo anterior, es importante que en cada región o comunidad se tenga actualizado el cuadro etiológico y los factores que pudieran estar condicionando su aparición, así como los patrones de susceptibilidad antimicrobiana de las bacterias implicadas, para que se favorezca un adecuado diagnóstico clínico, microbiológico y de prevención de ITU, y así evitar complicaciones y aumento en los costos familiares e institucionales. El objetivo del presente trabajo fue caracterizar tanto clínica como microbiológicamente las ITU bajas, en una población ambulatoria que asiste a consulta a un Centro de Salud de Primer Nivel de Atención del sur de la Ciudad de México.
Métodos
Se realizó un estudio transversal descriptivo en pacientes de ambos sexos y de cualquier edad, con diagnóstico de ITU bajas no complicadas, realizado con base en el cuadro clínico por el médico de primer nivel de atención, del Centro de Salud Comunitario “Dr. José Castro Villagrana”, de la Secretaría de Salud, del sur de la Ciudad de México, en el período comprendido entre mayo de 2018 a octubre de 2019. El cálculo del tamaño de muestra se realizó con la fórmula para estudios descriptivos, variables cualitativas y distribución binominal (proporciones), así como criterio de diferencia absoluta. El muestreo fue no probabilístico por conveniencia.
Los pacientes que aceptaron participar mediante su firma o la de su tutor de un consentimiento informado fueron enviados al Laboratorio de Bacteriología para confirmar diagnóstico por medio de un cultivo de orina. A los pacientes se les instruyó para que tomaran una muestra de la mitad de la micción siguiendo las especificaciones establecidas. Las muestras se sembraron en los medios: Agar sangre, Agar Mc Conkey, Agar Sal y Manitol y Agar V para Gardnerella. Se consideró positivo un cultivo puro con 105 UFC/ml. La identificación de las bacterias se realizó según métodos estándares establecidos.7 La prueba de susceptibilidad a los antimicrobianos se realizó por la técnica de Kirby-Bauer. Se utilizaron discos comerciales siguiendo las indicaciones de los fabricantes. Con base a la Guía de Práctica Clínica Institucional,8 y la clasificación de Magiorakos AP,9 basada en el mecanismo de acción, se eligieron antimicrobianos de 6 categorías diferentes: categoría 1: flouroquinolonas; levofloxacino, categoría 2: cefalosporinas de segunda generación; cefalotina, categoría 3; cefalosporinas de 3ª y 4ª generación; cefotaxima y cefepime, categoría 4; aminoglucósidos; gentamicina, categoría 5; penicilinas: ampicilina y categoría 6; inhibidores de la vía de los folatos: trimetoprim-sulfametoxazol. Se distinguieron patrones de susceptibilidad de acuerdo con los parámetros establecidos por CLSI (Clinical and Laboratory Standards Institute).10 Para asociar las variables de estudio, tanto sociodemográficas como de antecedentes urinarios y de hábitos de higiene con los resultados del cultivo, se utilizó la prueba de ji al cuadrado de independencia, o la prueba exacta de Fisher en caso de ser necesario. Se asignó nivel de significancia de 0,05. Se utilizó el programa estadístico SPSS en su versión 26. Se determinó también razón de momios, utilizando el programa estadístico EPI Info 7. Para el análisis de la edad se dividió en cuatro grupos: 1. de 1 a 20 años de edad; 2. de 21 a 40 años; 3. de 41 a 60 años; y 4. de 61 y más años. Para hábitos de higiene (cada cuando se baña), se realizó una clasificación dicotómica; grupo 1: baño diario, grupo 2: sin baño diario, independiente del número de días. Adicionalmente se realizó un análisis discriminante, método de inclusión por pasos, (técnica multivariada), que incluyó todos los casos para construir un modelo lineal predictivo que pudiera incluir las variables ya referidas que, en su conjunto y sinergia, pudieran explicar la negatividad o positividad de la infección de vías urinarias. Los autores declaran que se respetaron los principios éticos para las investigaciones en seres humanos de la Declaración de Helsinki,11 y del Reglamento de la Ley General de Salud en Materia de Investigación para la Salud de México,12 en la realización de este trabajo, así como haber sometido el proyecto al Comité de Investigación y Ética institucional. Número de Registro 636-2018. Fecha del 22 de octubre de 2018.
Resultados
Se incluyeron en el estudio 270 pacientes, con promedio de edad de 46,7 +/- 20,2 (IC 95 % 44,3-49,2) años. El 85,9 % pertenecía al sexo femenino. Se identificaron 34,4 % pacientes con diagnóstico instalado de diabetes mellitus, 79,2 % refirieron una ITU previa, y de estas, 55,6 % en un período no mayor a 6 meses. Además, 66,7 %, mencionaron haber tenido más de una ITU en el transcurso de su vida.
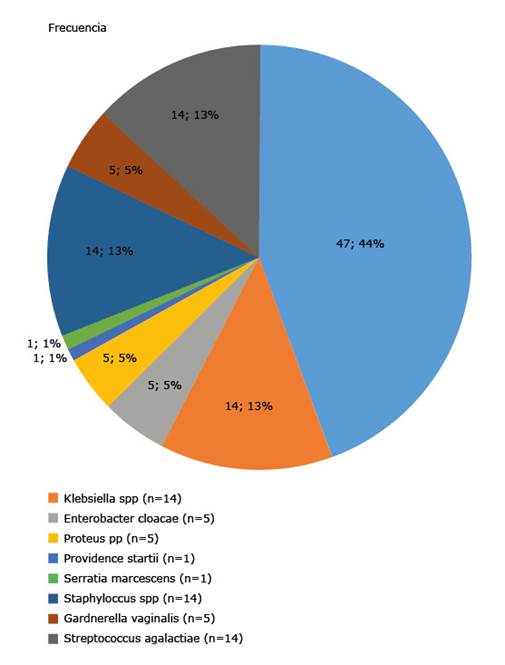
Se obtuvo una frecuencia de 39,3 % de cultivos positivos (106/270), (uno por paciente), 69,7 % pertenecientes a bacterias Gram negativas, con Escherichia coli, como la especie predominante, presente en 44,3 % de los casos, seguida de Klebsiella spp, con 14,13 % de los casos. El 31,3 % de los cultivos positivos correspondieron a bacterias Gram positivas, incluyendo 14,13 % de Streptococcus agalactiae e igual porcentaje de Staphylococcus spp; además de 4,7 % de Gardnerella vaginalis. Estos resultados se presentan en la figura 1.
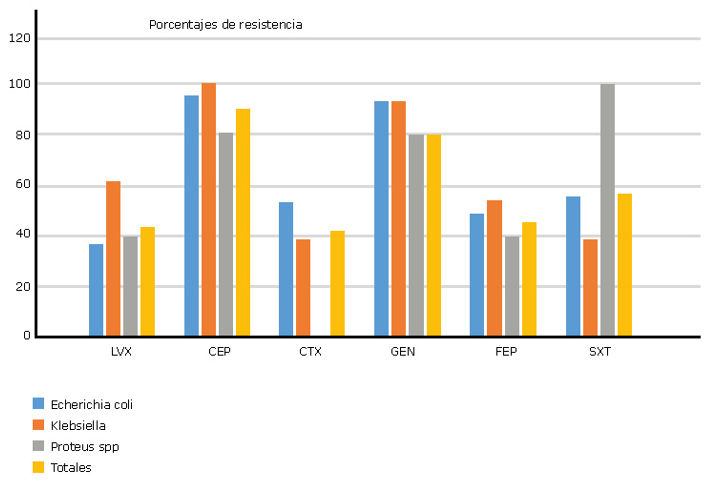
En el análisis de la relación entre las variables sociodemográficas y la presencia de ITU, se obtuvo significancia estadística con el sexo biológico; 42,7 % para el femenino por 18,4 % del masculino, (p = 0,004), razón de momios de 3,2 (IC 95 % 1,3-7,7). Para la edad por grupos (categorizada según lo referido en la metodología), no se obtuvieron diferencias estadísticas significativas en el análisis de toda la población, sin embargo, al separar la variable por sexo, se presentaron diferencias significativas en los hombres (p = 0,01), con una mayor frecuencia en el grupo de 21 a 40 años, remarcando que entre 41 a 60 años, en 16 casos no se presentó ninguno positivo. Para las variables de salud; no se obtuvo significancia estadística con DM2, o hipertensión arterial. En las variables de antecedentes urinarios, para las ITU previas, no se presentó significancia en el análisis de toda la población, sin embargo, al separarla por sexo, en las mujeres, se obtuvo significancia estadística (p = 0,036), y razón de momios de 2,01 (IC95 % 1,2-4,8). No se presentaron diferencias con el tiempo transcurrido de la ITU anterior, ni con el número de infecciones previas. Para hábitos higiénicos, la variable cada cuanto se baña, no presentó diferencias estadísticas en toda la población, pero al separarla por sexo, se presentaron dichas diferencias en el grupo de los hombres (p = 0,021), con razón de momios de 6,9 (IC95 % 1,7 - 40,9), con una mayor frecuencia en los que refirieron bañarse cada tercer o más días. En el análisis discriminante, solo la variable sexo mantuvo significancia estadística (p = 0,004). Con relación a la evaluación de la susceptibilidad antimicrobiana realizada a 73 cepas de bacterias Gram negativas, los resultados se presentan en la figura 2. El 100 % de los aislamientos fueron resistentes a la ampicilina y 90,4 % a la cefalotina, mientras que, en contraste, el levofloxacino con 43,8 % y la cefotaxima con 42,4 % presentaron los porcentajes más bajos de resistencia. Al analizar por género y especie bacteriana, no se presentó ninguna cepa de Proteus spp. resistente a cefotaxima, otros porcentajes de resistencia bajos se presentaron en Escherichia coli con 31,9 % para levofloxacino, y en Klebsiella spp con 35,7 % para cefotaxima y para trimetoprim-sulfametoxazol.
.
Discusión
Las ITU son un causal importante de morbilidad en pacientes de la comunidad. En este estudio se obtuvieron 39,3 % de cultivos positivos, porcentaje superior a lo reportado por autores como Machado-Alba y otros,13) quienes obtuvieron 20,2 % y por Blanco y otros,14 quienes reportaron 29,6 % de positividad, ambos estudios en pacientes con ITU. adquiridas en la comunidad. En el análisis de las frecuencias por especie, Escherichia coli fue la bacteria más frecuentemente aislada. Foxman,15 menciona que esta especie causa la mayoría de las ITU en todos los entornos, para todos los síndromes y todos los grupos de edad. Con relación a las bacterias Gram positivas, la ITU causada por Streptococcus agalactiae (SGB) es común en los ancianos, en embarazadas, en diabéticos y en inmunocomprometidos. Estudios en poblaciones de ancianos refieren hasta un 39 % de prevalencia en residentes de hogares de adultos mayores.16 En este estudio fue aislado en 14,13 % del total de positivos, 85,7 % de ellos en mujeres; 35,7 % en edad reproductiva y el mismo porcentaje en adultos mayores, y de estos, 90 % eran diabéticos, lo que confirma lo anteriormente expuesto.
La etiología de las ITU parece estar condicionada al tipo de población estudiada, pero también a la búsqueda intencionada por el laboratorio de otros microorganismos, como los presentes a nivel vaginal, del tipo de Gardnerella vaginalis, Cándida spp. y los Mycoplasmas. En este estudio se identificaron 4,7 % cepas de Gardnerella vaginalis, y aunque no se identificaron especies de Cándida, su presencia en vías urinarias ya ha sido previamente documentada.17 Esto plantea la posibilidad de que organismos fastidiosos asociados con la vaginosis bacteriana, podrían desempeñar un papel más directo en la etiología de las interacciones uro patógeno-huésped dentro de las vías urinarias.18)
De los factores de riesgo estudiados, el sexo biológico presentó diferencias estadísticas significativas tanto en el análisis bivariado como en el multivariado. En las mujeres, las tasas de colonización urinaria son más elevadas; además de la consideración anatómica, hay que contemplar otros factores propios como los hormonales.15
Un historial de ITU previas también ha sido considerado un factor de riesgo importante. Algunas personas parecen ser más inherentemente susceptibles, lo que puede atribuirse a comportamientos del huésped. Sin embargo, hay una mayor evidencia de susceptibilidad genética.19) En este estudio, se obtuvo relación con significancia estadística entre la presencia de ITU previas y los casos positivos solamente en el grupo de mujeres. Foxman15) menciona que es un factor de riesgo importante y la asocia a una interacción de factores como los hábitos de conducta del huésped, la susceptibilidad genética ya referida y los mecanismos de virulencia de las bacterias.
En referencia a la susceptibilidad antimicrobiana, según la Guía de Práctica Clínica ya referida,8 se indica trimetoprim-sulfametoxazol como tratamiento de elección en las ITU no complicadas. En este estudio se obtuvo un porcentaje de resistencia del 56,2 % a dicho antimicrobiano, Aguinaga y otros20 obtuvieron 43,7 % de cepas resistentes de origen comunitario. A nivel de especie, estos mismos autores, reportan porcentajes de resistencia de 21,7 % para Escherichia coli, y de 25 % para Klebsiella pneumoniae. Porcentajes inferiores a los obtenidos en nuestro estudio (51,1 % y 35,7 %, respectivamente), tanto para el total como por especies, se tuvieron porcentajes por arriba del 30 % de resistencia, por lo anterior, no resulta recomendable administrar este antimicrobiano de forma empírica en la consulta de primer nivel.
Debido al alto porcentaje de resistencia al trimetoprim-sulfametoxazol, y como alternativa, la misma guía propone a las flouroquinolonas como antimicrobianos de segunda elección, por lo que su uso se ha difundido ampliamente. En este estudio, para el levofloxacino, se obtuvieron porcentajes de resistencia de 44,4 % en el total. Galván y otros21 obtuvieron 86,8 % en cepas de comunidad, y Guevara y otros22 refieren 33,2 % en cepas del mismo origen. A nivel de especie, Mayorga23 menciona 84,6 % de cepas de Escherichia coli resistentes al mismo levofloxacino. En este trabajo se obtuvo 37,2 % de cepas resistentes. El porcentaje de resistencia supera el 30 %, motivo por el cual su uso empírico en las ITU no complicadas también estaría contraindicado. No obstante, diversos autores defienden su utilización debido a la alta concentración que alcanza el fármaco en la orina.24
Para los beta-lactámicos, la totalidad de las cepas estudiadas fueron resistentes a la ampicilina, Castro y otros25 obtuvieron 81 % para Escherichia coli y 100 % para Klebsiella spp, en cepas de origen ambulatorio. Castrillon y otros26 reportan 72,6 % de resistencia en Escherichia coli y 96,9 % para Klebsiella spp. Estos altos porcentajes están asociados a la resistencia intrínseca de algunos de estos géneros bacterianos a la ampicilina. En el caso de las cefalosporinas de tercera y cuarta generación, se obtuvo resistencia cercana al 50 % tanto en el total de bacterias como por género bacteriano. Jadoon y otros27 refieren 51,3 % de cepas resistentes de Escherichia coli, y 50 % de Klebsiella spp, al cefepime.
Las diferencias en los porcentajes de resistencia al comparar los estudios pudieran estar dadas por el uso y desuso de los antimicrobianos en las regiones; esto es, al dejar de utilizarlos, las presiones de selección sobre las bacterias disminuirían o se eliminarían, los genes que confieren resistencia dejarían de expresarse, y se volvería al estado de sensibilidad anterior. Otro factor involucrado, pudiera ser un mayor uso en algunas comunidades de antimicrobianos de amplio espectro en lugar de agentes de espectro reducido, en parte debido a la disponibilidad de los mismos, lo que favorece la emergencia de la resistencia por una amplia eliminación de la microbiota competitiva susceptible.
En conclusión, Escherichia coli fue la especie más frecuentemente aislada, sin embargo, existe una serie de microorganismos implicados en enfermedades del tracto genital como Gardnerella vaginalis que parecen estar involucrados en la etiología de las ITU. Se identificaron factores de riesgo como el sexo biológico y las infecciones previas en mujeres. En general, se obtuvieron porcentajes de resistencia altos en los antimicrobianos probados.
Aporte científico
El tratamiento empírico de las ITU es una práctica habitual en el primer nivel de atención médica. Para prescribir un trata miento de esta naturaleza de manera racional, es importante identificar los géneros bacterianos que mayormente originan la enfermedad en cada zona, estar al tanto de los factores de riesgo que condicionan su aparición, así como identificar los patrones de susceptibilidad antimicrobiana y su avance en el tiempo. Proponemos la realización de trabajos como el presente, que faciliten la toma de decisiones del médico de primer nivel de atención con base en información actualizada de la etiología y la susceptibilidad antimicrobiana, para intentar incidir en la disminución de la resistencia bacteriana, así como en una mayor efectividad terapéutica.