Introducción
El término diabetes mellitus (DM) describe un desorden metabólico de múltiples etiologías, caracterizado por hiperglucemia crónica con disturbios en el metabolismo de los carbohidratos, grasas y proteínas, como consecuencia de defectos en la secreción y/o en la acción de la insulina.1) En la actualidad, existe una elevada prevalencia de personas con esta enfermedad, lo cual es resultado de su aumento vertiginoso a escala mundial; asimismo, la repercusión clínica, epidemiológica y económica de la DM hace de este padecimiento un serio problema de salud.1,2,3
Según la International Diabetes Federation (IDF, por su sigla en inglés) a nivel global, 1 de cada 11 adultos de entre 20-79 años padece de DM (≈ 463 millones de personas). Además, se conoce que 1 de cada 2 adultos con este padecimiento no se encuentra diagnosticado (232 millones de personas), lo que contribuiría a aumentar la prevalencia de esta enfermedad. Cuba presenta una tasa de prevalencia de DM que aumentó de 62,2 por 1000 habitantes en 2017 a 66,7 por 1000 habitantes en 2019, con un predominio en el sexo femenino y en los mayores de 60 años. Al mismo tiempo, la DM constituye la octava causa de muerte (20,6 por 100 000 habitantes) en el país.4
La región con el mayor número estimado de muertes de adultos relacionadas con la DM es la Región del Pacífico Occidental de la IDF, donde cada año 1,3 millones de muertes se deben a esta dolencia, seguida de la Región de Asia Sudoriental de la IDF, con 1,2 millones de muertes. Sin embargo, la región con menor número de muertes relacionadas con la DM es la Región de América Central y del Sur (SACA) de la IDF (a la cual pertenece Cuba) con 0,2 millones de defunciones por la enfermedad.2
La morbilidad y la mortalidad en las personas con DM y su aumento en las últimas décadas se debe al cuadro clínico propio de la enfermedad, sus complicaciones micro y macrovasculares, así como a la asociación de la DM a una o varias comorbilidades.5,6) Esto contribuye a una considerable afectación de la calidad de vida del paciente7,8) y hace necesario la realización de un mayor énfasis en el desarrollo y ejecución de medidas encaminadas a la prevención,9,10) su oportuno diagnóstico y adecuado tratamiento.1,11
Dentro de las complicaciones crónicas de la DM, la neuropatía diabética (ND) es la más frecuente y se observa en al menos 2 de cada 3 personas. La hiperglucemia crónica ocasionada por el mal control de la enfermedad puede dañar las fibras sensitivas, motoras y autonómicas del sistema nervioso periférico y como consecuencia aparecen sus síntomas y signos, sobre todo, en la porción distal de las extremidades inferiores.12,13,14,15,16
La ND, además, es la complicación crónica de aparición más temprana en la historia natural de la DM.17,18) Se define como la presencia de síntomas y signos de disfunción de los nervios periféricos como consecuencia del daño progresivo de las fibras nerviosas en personas con DM, después de la exclusión de otras causas18,19) y constituye el principal factor de riesgo para el desarrollo y aparición del “pie diabético” (PD) o Síndrome del pie diabético (SPD), así como de amputaciones de miembros inferiores en las personas afectadas.12,13,14,15,16
Desde el punto de vista conceptual, la Asociación Latinoamericana de Diabetes (ALAD) define al SPD como la condición en que la neuropatía, la isquemia y la infección provocan destrucción tisular en uno o ambos pies de los pacientes con DM, resultando en morbilidad, discapacidad y posible mortalidad prematura.16) Empero, otras organizaciones científicas han definido desde ese mismo punto de vista, el SPD. De hecho, en el Consenso sobre Úlceras Vasculares y Pie Diabético de la Asociación Española de Enfermería Vascular y Heridas se hace mención a esto, de manera tal que:20
La Sociedad de Angiología y Cirugía Vascular lo define como: “Una alteración clínica, de etiología neuropática, e inducida por la hiperglucemia mantenida, en la que con o sin coexistencia de isquemia y previo desencadenante traumático, produce lesión y/o ulceración del pie”.
La Organización Mundial de la Salud (OMS) lo define como: “La presencia de ulceración, infección y/o gangrena en el pie asociada a ND y a diferentes grados de enfermedad vascular periférica como consecuencia de la interacción compleja de diferentes factores inducidos por una hiperglucemia mantenida”.
El Grupo de Trabajo Internacional del Pie Diabético (The International Working Group on the Diabetic Foot [IWGDF, por su sigla en inglés]) da la siguiente definición: “Infección, ulceración o destrucción de los tejidos profundos del pie asociado a neuropatía o enfermedad arterial periférica en las extremidades inferiores de los pacientes con DM”.
Como se puede observar, los conceptos esbozados son similares, pues cambia la forma de expresarlo, pero la esencia es la misma. No obstante, el autor recomienda utilizar en la práctica diaria el correspondiente a la OMS.
La importancia de conocer acerca del SPD radica en que este padecimiento es la causa del 70-90 % de las amputaciones en personas con DM. En tal sentido, la DM es la causa más frecuente de amputación no traumática de miembros inferiores a nivel mundial, estimándose que el 40-60 % de todas las amputaciones están relacionadas con esta condición.16
El ataque de pie diabético es una potencial complicación del SPD y comprende situaciones clínicas como el ataque de pie diabético infectado, el ataque de pie diabético isquémico y la neuroartropatía de Charcot en fase aguda;17) estas tres formas clínicas tienen una presentación aguda y grave que representa una amenaza para la conservación del miembro afectado e incluso para la vida del paciente. Ataque de pie diabético es un término que surge por la necesidad de facilitar la identificación de aquellos pacientes que requieren intervención inaplazable, dándole un sentido de urgencia y gravedad a este problema de salud, reforzando el concepto de que “tiempo es tejido”.17
Por tanto, el SPD representa una importante complicación, pues el riesgo de muerte a los cinco años es 2,5 veces mayor para la persona con DM que, además, presenten una úlcera de pie diabético, al compararlos con aquellos pacientes que no la presenten, con el agravante que a los 10 años es tres veces mayor. Igualmente, la presencia concomitante de enfermedad arterial periférica (EAP) incrementa el riesgo de no cicatrización de la úlcera, de infección y de amputación. Asimismo, la mortalidad después de una amputación asciende al 70 % a los cinco años para todas las personas con DM.21,22
Consecuentemente, es de gran utilidad para los médicos del primer nivel de atención, conocer el comportamiento clínico de la ND y, sobre todo, como influye en el comienzo y progresión del SPD, lo que ayuda a distinguir el riesgo que este representa para el paciente con DM. Por este motivo, el objetivo del presente trabajo fue describir el papel de la ND en la aparición y desarrollo del SPD.
Métodos
Se realizó la búsqueda bibliográfica acerca del tema estudiado, en el trimestre de julio a septiembre de 2021. Se utilizaron como buscadores de información científica, los correspondientes a SciELO, PubMed y Google Académico; utilizando como palabras claves: diabetes mellitus; neuropatía diabética; pie diabético; síndrome de pie diabético; úlcera de pie diabético; ataque de pie diabético. Se consideraron como criterios de elección, aquellos que examinaran las características clínicas de la ND y del SPD, independientemente que se abordara la temática a través de cualquier metodología de investigación. Fueron excluidos los artículos que tuvieran más de 10 años de publicados, en idiomas diferentes al español, portugués e inglés y que no hicieran referencia al tema de estudio a través del título. Esto permitió la cita de 45 referencias bibliográficas.
Desarrollo
Aunque aún no ha sido aclarada totalmente la patogenia de la ND, se acepta la multicausalidad de esta, al estar implicados varios mecanismos combinados que concurren en el tiempo.23) Al no estar bien definido cuál es el elemento preponderante que desencadena y/o perpetúa las alteraciones, inicialmente funcionales y más tarde anatómicas de la lesión del nervio en el ambiente diabético, se acepta que la hiperglucemia crónica es un factor de relevancia primaria en la génesis de la afectación neuropática. A partir de ella se desencadenan las distintas vías metabólicas involucradas en este trastorno, consecuencia de una serie compleja de interacciones fisiopatológicas, donde intervienen diferentes elementos (fig. 1).24

Fig. 1 Vías metabólicas e interacciones fisiopatológicas involucradas en el desarrollo de la neuropatía diabética.
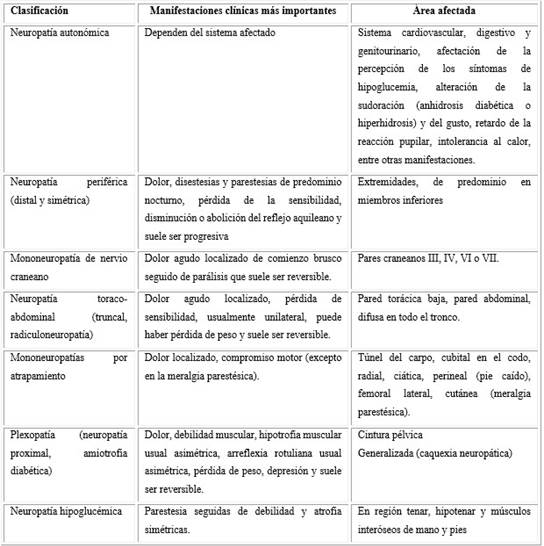
En estos casos es importante considerar el probable compromiso simultáneo del sistema nervioso central que, por sus características anatómicas de fibras finas y amielínicas, se puede alterar a varios niveles, desde etapas tempranas de la evolución de la DM.23) Sin embargo, es importante destacar que la ND es una complicación microvascular asociada a la DM18) y puede presentar varias formas clínicas (cuadro 1),11) aunque cerca del 50 % de los pacientes, al menos por un tiempo, son asintomáticos.
Este grupo heterogéneo de afecciones puede dañar diferentes partes del sistema nervioso y se presenta con diversas manifestaciones clínicas, generalmente acompañadas del deterioro del estado general del paciente.18,19,24,25) Muestra de ello es la neuropatía autonómica, la cual se produce cuando se dañan los nervios que controlan las funciones corporales involuntarias, es decir, daño en los nervios que controlan los órganos internos. El daño nervioso interfiere con los mensajes enviados entre el cerebro y otros órganos o áreas del sistema nervioso autónomo, como el corazón, los vasos sanguíneos y las glándulas sudoríparas, entre otros órganos; lo cual ocasiona diferentes tipos de neuropatía autonómica (cardiovascular, digestiva, genitourinaria, metabólica, sudoromotora y pupilar).26,27
No obstante, la forma de presentación más frecuente de la ND es la polineuropatía periférica simétrica distal (PNPSD) con afectación sensitiva, motora o mixta, bilateral, que tiene una prevalencia estimada en personas con DM tipo 1 (DM1) de 20 % después de 20 años de evolución de la enfermedad, siendo el pronóstico peor en las personas con DM tipo 2 (DM2), pues de 10-15 % de estos sujetos se pueden ver afectados en el momento del diagnóstico y, al menos, la mitad desarrollan dicha complicación después de 10 años de padecer DM.19,24
Un elemento de interés es que entre un 10 y un 30 % de las personas con prediabetes o síndrome metabólico, también desarrollan ND, especialmente el subtipo doloroso (neuropatías de fibras pequeñas).24) De las diferentes formas de presentación clínica de la ND descritas en la clasificación (cuadro 1), se hace énfasis a partir de aquí, en la PNPSD por su relación con el SPD.
En Cuba, Herrera y otros,28) realizaron un estudio encaminado a determinar los hallazgos neurofisiológicos y las características clínicas de la ND en 57 pacientes con 10 años de tiempo promedio de duración de la DM, con una edad que osciló entre 36 y 55 años, de ambos sexos (43 mujeres [75,4 %]). Ellos encontraron que el 94,7 % de pacientes presentó compromiso motor, con criterios de ND, y el 80,7 % refirió síntomas sensitivos, lo que constituye cifras cercanas a lo referido por López y otros29) y muy elevadas en comparación a los resultados obtenidos por Mantovani y otros.30
Desde el punto de vista clínico, la ND (PNPSD) puede causar síntomas sensitivos como dolor y disestesia debidos al daño de pequeñas fibras, que suelen ser los primeros síntomas. El dolor neuropático puede ser con ardor, lancinante, hormigueante o punzante, que se intensifica en horario nocturno, ocurre en una cuarta parte de las personas con esta complicación y puede llegar a ser incapacitante.24,28
La parestesia, hiperalgesia y alodinia se pueden asociar, y tienen un impacto negativo en el bienestar y la calidad de vida de la persona afectada; por el contrario, la pérdida de la función de las fibras grandes causa entumecimiento que resulta en la pérdida de la sensación protectora,24,28) con disminución o pérdida de la sensibilidad superficial y/o profunda, que se observa en manos y pies, sobre todo en estos últimos, lo que se traduce en la no percepción del trauma repetido, ya sea de tipo mecánico, térmico o químico y por esta causa actúa como un importante factor de riesgo para la ulceración del pie. Los reflejos osteotendinosos pueden estar disminuidos o incluso ausentes.16,28
La ND (PNPSD) contribuye al desarrollo de la atrofia de los músculos intrínsecos del pie. Esto puede provocar un desequilibrio de los músculos extensores y flexores del este, con la aparición de deformaciones, entre los que se describen los dedos en garra o en martillo y aparecen nuevos puntos de presión que favorecen la ulceración, a lo que se suma la posible afectación del movimiento de las extremidades, por ser causa de debilidad muscular.16,28
La ND también puede ser el origen de autosimpatectomía por neuropatía autonómica, y puede producir aumento del flujo sanguíneo local, incremento de la resorción ósea, colapso articular y pie deformado, ocasionando lo que se conoce como pie de Charcot (neuroartropatía de Charcot) y constituye una enfermedad degenerativa progresiva que afecta las articulaciones del pie, lo cual aumenta la creación de puntos de presión, favoreciendo el desarrollo de úlceras. A esto se puede sumar la piel seca (por anhidrosis) y agrietada, que induce la producción de fisuras cutáneas y predisposición a la infección; lo que puede ser agravado por la presencia de una angiopatía (EAP) asociada.16
En la práctica diaria, se considera importante que cuando el paciente con DM acuda a consulta, el médico de familia interrogue al paciente, acerca de síntomas típicos de PNPSD, como ardor, dolor punzante, calambres, adormecimiento, alodinia o hiperalgesia y lo examine detenidamente buscando signos como la disminución o abolición de los umbrales de sensibilidad distal táctil (de ser posible con monofilamento de 10 g.), alteración de la sensibilidad vibratoria, o de los reflejos tendinosos distales de manera simétrica; alteración de la sensibilidad térmica, vibratoria (diapasón) y dolorosa en forma simétrica, así como la disminución y/o ausencia de la fuerza muscular simétrica y distal (generalmente de presentación tardía) en los cuatro miembros, sobre todo en los inferiores.23
Sin dudas, el reconocimiento temprano y el manejo apropiado de la ND es muy importante, al ser un diagnóstico de exclusión;15,18) por este motivo, si no se reconoce tempranamente y no se implementa el cuidado preventivo de los miembros inferiores, acompañado del control de la glucemia, se corre el riesgo de sufrir lesiones en los pies insensibles y desarrollar el SPD, con o sin neuroartropatía de Charcot acompañante, lo cual ensombrece el pronóstico y evolución del paciente.15,18) Recordar que la ND se vincula con una mayor morbilidad y mortalidad, asociadas a amputaciones, caídas, fracturas y a cuadros de depresión, como consecuencia de este problema de salud. Igualmente, incrementa el coste económico de la enfermedad en relación con la duración y la gravedad de la DM, aunque existen otros factores adjuntos que pueden incidir en su evolución.17,18,19
Por lo antes referido, el médico de familia debe tener presente un importante concepto, el de pie de riesgo,31) donde la ND puede jugar un papel destacado. El termino pie de riesgo, se refiere a cualquier individuo con DM, en el que se demuestre en sus pies algún tipo de ciertas alteraciones, por mínima que sea, que facilitan la aparición del SPD y que se indican a continuación:31
Neuropatía periférica.
Artropatía (que incluye los trastornos en la alineación de los dedos, las deformidades estructurales de los pies y el pie de Charcot).
Dermopatía (que incluye hiperqueratosis plantar, fisuras calcáneas, callosidad interdigital, micosis interdigital, onicogrifosis, onicocriptosis y onicomicosis).
Enfermedad vascular periférica sin lesiones tróficas y antecedentes de úlcera o amputación anterior.
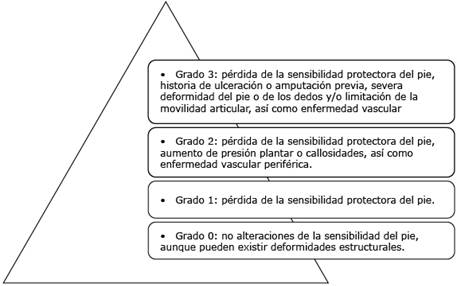
El concepto de pie de riesgo no incluye la ulceración e infección activa del pie. El médico del primer nivel de atención, que este sensibilizado con dicha expresión, tendrá la posibilidad de establecer prioridades en las acciones de prevención de úlceras y amputaciones a través del conocimiento y aplicación de la clasificación de la estratificación del pie de riesgo (fig. 2).32) Por tanto, su uso facilita una mejor orientación, ante la prioridad de atención que va a requerir el paciente.
Asimismo, es trascendental tener en cuenta que las neuropatías no diabéticas pueden estar presentes en pacientes con DM y pueden tratarse con medidas específicas.15,18) También, se debe reflexionar sobre la existencia de otros factores de riesgo, además de la ND, que pueden asociarse a la presencia del SPD, el cual es un síndrome clínicamente complejo.(15,33) Estos son:34,35
La edad avanzada (mayor de 60 años).
El sexo masculino.
Duración de la DM mayor de 10 años.
El inadecuado control glucémico.
EAP.
Retinopatía y nefropatía diabética.
Hipertensión arterial.
Historia de úlcera previa y/o amputaciones.
Deformidades del pie.
Calzado inapropiado.
Condiciones sociales particulares como:
De estos factores de riesgo, se debe hacer énfasis especial en algunos de los más importantes, entre los que se encuentra la hiperglucemia, en relación con un inadecuado control metabólico de la DM, que es uno de los más significativos, pues disminuye la fagocitosis, la adherencia, la quimiotaxis, la actividad oxidativa y bactericida de los neutrófilos; por lo que aumenta la susceptibilidad a la infección en el contexto de una angiopatía e inmunopatía diabética, en presencia de trauma local. Lo antes referido, condiciona el desarrollo de la ulceración del pie, con la posterior invasión bacteriana, infección y el desarrollo del SPD en toda su plenitud.36
Igualmente, se debe resaltar la importancia de las deformidades podálicas. Estas ocasionan un patrón de marcha y sitios de presión anormales en el pie, lo que puede provocar un deterioro y ulceración de los tejidos, sobre todo en individuos que también tienen PNPSD y, como consecuencia de esta, una disminución de la sensibilidad. Esto explica por qué las lesiones pueden pasar inadvertidas para el paciente, quien de continuar la deambulación se puede ocasionar una mayor deformidad del pie y aumentar las presiones plantares, con la formación de ampollas, callos y rotura de la piel (úlceras).37,38
En el caso de la EAP, esta se encuentra infradiagnosticada y en muchos casos el diagnóstico es tardío.39) Sobre todo, cuando forma parte del SPD, el cual se considera un grave problema de salud global por ser la principal causa de amputación no traumática, contar con elevadas tasas de morbilidad y mortalidad y por tener consecuencias socioeconómicas negativas para el paciente.40
Los principales factores de riesgo asociados a EAP son: la edad, el tabaquismo y la DM. Otros como la dislipidemia, la prediabetes, la obesidad y la hipertensión arterial, que conforman el síndrome metabólico y que se relacionan también. Asimismo, se plantea que existe una relación directa de esta enfermedad con el sexo femenino y el tiempo de evolución de la DM;39,41) por tanto, comparte algunos factores de riesgo con el SPD, de ahí que lo acompañe con tanta frecuencia.
La presencia de una enfermedad arterial oclusiva condiciona un insuficiente flujo sanguíneo a las extremidades. La isquemia por insuficiencia arterial periférica disminuye el aporte de oxígeno, antibióticos y nutrientes a los tejidos del pie, lo que predispone a retraso de la cicatrización de las heridas y al desarrollo de infección; al mismo tiempo, la embolia de colesterol y la llamada arterioesclerosis obliterans pueden ser causa de gangrena mayor.16
Detectar la presencia de EAP asintomática es de gran valor por el riesgo de presentar ateroesclerosis en otros sitios. El diagnóstico de las formas asintomáticas de la EAP se establece a través de la indicación de complementarios en aquellas personas con los factores de riesgo descritos, que sugieren la posible existencia de la enfermedad. Los valores disminuidos del Índice de presiones tobillo-brazo (ITB) ≤ 0,9 apoya el diagnóstico de enfermedad vascular periférica (tanto en los cuadros asintomáticos, como en los sintomáticos) e indican la presencia de aterosclerosis en los miembros inferiores y disminución de la luz arterial.42
La EAP, en las formas sintomáticas de la enfermedad, se puede diagnosticar a través de su cuadro clínico, en el cual se puede observar: claudicación intermitente (dolor al caminar), disminución de los pulsos periféricos y cambios en la piel de las extremidades afectadas (piel fría al tacto y decoloración azulada de los pies) y, en casos extremos, isquemia crítica con dolor en la extremidad que ocurre en reposo. A lo anterior, se le sumaría el empleo de medios complementarios como la medición de los índices de presiones tobillo-brazo (IPTB)42) y, en caso necesario, se puede realizar una prueba estándar no invasiva como es la ecografía doppler dúplex o incluso una angiografía con tomografía computadorizada, angiografía con resonancia magnética o una angiografía con catéter, para el diagnóstico de EAP.43
EL ITB es una prueba fácil de realizar, altamente reproducible, rápida, no invasiva y económica que se puede hacer en cualquier centro de la atención primaria de salud, si se dispone del equipo necesario y de un mínimo entrenamiento.43) Todo esto facilitaría la realización de un diagnóstico temprano de EAP en pacientes con DM y pie de riesgo o con alteraciones propias de un SPD, así como la posibilidad de realizar investigaciones en este importante tema.
Las infecciones en el SPD, son un factor agravante que, junto con la isquemia y la ND, aumenta el riesgo de graves complicaciones y constituyen la principal causa de hospitalización relacionada con DM y amputación de miembros inferiores, lo cual se debe a que los gérmenes predominantes son bacilos gram negativos, en su mayoría multirresistentes.38,44,45
La posibilidad de reducir la incidencia y prevalencia del SPD y sus posibles complicaciones, en primer lugar, pasa por la prevención, donde el médico de familia, con el apoyo de endocrinólogos o clínicos (preferentemente diplomados en la atención a personas con DM), personal de medios diagnósticos y administrativos que consoliden la actividad, tienen una importancia capital. Ellos, a través de su atención, deben garantizar un tratamiento adecuado que evite la hiperglucemia crónica, la cual está fuertemente involucrada en la aparición y desarrollo de la ND. A la par, evitando o al menos retardando esta frecuente complicación de la DM, y logrando la detección y control del resto de los factores de riesgo involucrados en la patogenia SPD, se garantizarían resultados positivos que repercutan de manera favorable en la salud de los pacientes con DM.1,34,35) La búsqueda activa y atención esmerada al pie de riesgo se debe priorizar.31
Por tanto, es urgente que en Latinoamérica los sistemas de salud, las diversas sociedades científicas que aglutinan médicos que asisten a personas con DM y las asociaciones de pacientes afectados por esta condición asuman programas y políticas que fomenten la educación en el paciente y la formación de especialistas en la prevención, diagnóstico y tratamiento del SPD en el primer nivel de atención,16) criterio con el que coincide el autor.
Conclusiones
La ND constituye el principal factor de riesgo en el aparición y desarrollo del SPD, sobre todo cuando se asocia a artropatía (defectos podálicos), enfermedad vascular periférica y/o sepsis, lo que incide en el aparición y desarrollo del síndrome del pie diabético. El control de la glucemia, la detección temprana del pie de riesgo, y el cuidado preventivo de los miembros inferiores, repercutirá en la salud y bienestar del paciente.
Aporte científico
Se describe de forma sencilla y actual lo que representa la ND en la aparición y desarrollo SPD, así como sobre la presencia de otros factores de riesgo de importancia en este sentido, que el médico del primer nivel de atención debe tener presente, cuando tiene delante a una persona con DM. De esta manera, se intenta (también( llamar la atención acerca del riesgo que la ND y el SPD representan para la salud y bienestar del paciente con DM.