Introducción
La osteoporosis (OP) es una enfermedad esquelética difusa caracterizada por una disminución generalizada de la resistencia ósea, que predispone a un mayor riesgo de fracturas por fragilidad.1
La OP está reconocida como un problema de salud grave, con alrededor de 200 millones de personas afectadas en todo el mundo. Más del 40 % de las mujeres y el 20 % de los hombres con OP tienen probabilidades de sufrir una fractura osteoporótica (fragilidad) durante su vida.2
En 2015, se estimaba que había 20 millones de personas con OP en la Unión Europea, de ellos, 15,8 millones eran mujeres.3
Según la Encuesta Nacional de Examen de Salud y Nutrición, la prevalencia de OP y baja masa ósea (BMO) en EE. UU. de los adultos de 50 años o más en 2013-2014 oscilaba entre el 6 % y el 11 % y entre el 28 % y el 45 %, respectivamente.(4
América Latina y, dentro de esta, Cuba, se encuentra inmersa en un fenómeno poblacional de transición demográfica y epidemiológica con descenso en las tasas de mortalidad, aumento en la esperanza de vida y el consecuente aumento de las enfermedades crónico-degenerativas, esta tendencia seguirá a lo largo del siglo xxi. Es de esperarse que la OP y las fracturas debido a ella aumenten exponencialmente con la edad, estas se perfilan como una de las causas de carga de morbilidad de mayor impacto en el sector salud, debido a la mortalidad asociada, sus altos costos y el deterioro en la calidad de vida.5
Con la OP se relacionan factores de riesgo modificables: inadecuada absorción nutricional, el sedentarismo, el riesgo de caídas, la pérdida de peso, el hábito de fumar, el consumo de alcohol, la contaminación del aire, el estrés; y los factores no modificables: historia de caídas frecuentes, la edad, el sexo, el color de piel blanca, las fracturas previas, los factores reproductivos, la historia familiar de OP, las causas de OP secundaria, como algunas enfermedades crónicas y el uso de ciertos medicamentos.6
Para el diagnóstico de OP se recomienda medir la densidad mineral ósea (DMO) por (absorciometría por rayos X de doble nivel de energía) DXA, en la cadera (cadera total y cuello femoral) y la columna lumbar. Los resultados de la DMO son reportados en g/cm2 y convertidos a índice T y Z (T-score y Z score). El índice T, representa el número de desviaciones estándar (DE) respecto a un adulto joven sano del mismo género y etnia. Este se debe usar en mujeres posmenopáusicas y hombres mayores de 50 años. El índice Z, representa el número de DE respecto a un adulto sano de la misma edad, género y etnia. Este se usa para mujeres premenopáusicas y hombres menores de 50 años.7
Cuba tiene una población envejecida, es conocido que la OP y las fracturas por la fragilidad afectan cada vez con mayor frecuencia este grupo poblacional; existen escasos trabajos relacionados con esta temática, pero un estudio realizado en el municipio “Plaza de la Revolución” puso en evidencia que más de la mitad de la población estudiada tenía afectación de la mala ósea.8
El presente estudio se realizó con el objetivo de determinar la masa ósea en mujeres de edad mediana y algunos factores relacionados con ella.
Métodos
Se realizó un estudio descriptivo transversal que incluyó mujeres de edad mediana (40-59 años) del Policlínico Universitario “19 de abril”, del municipio Plaza de la Revolución, en el período comprendido de octubre de 2014 a septiembre de 2015.
Universo: mujeres de edad mediana (40 a 59 años del policlínico estudiado).
Muestra: 82 mujeres entre 40-59 años.
Criterios de inclusión: Mujeres aparentemente sanas.
Criterios de exclusión: mujeres con OP secundaría o con intolerancia a lácteos, que hayan recibido tratamiento por más de un año y lo hayan suspendido o estén bajo tratamiento con medicamentos o suplementos que afecten o mejoren la masa ósea, mujeres que se encuentren inmovilizados de forma permanente.
A cada mujer se le citó a una consulta en el área de salud donde, previo consentimiento informado, se realizó una entrevista y el examen físico para completar la historia clínica confeccionada al efecto. Al interrogatorio se determinaron: características generales (edad en años, color de la piel) y datos relacionados con la esfera reproductiva (fecha de la última menstruación, número de embarazos, partos y tiempo de lactancia); estudios hormonales: hormona folículo estimulante (FSH), hormona luteinizante (LH), testosterona (T), Estradiol (E2), Prolactina (PRL). La toma de muestras de sangre se realizó en el departamento de extracciones y se procesaron en el laboratorio del Instituto de Endocrinología (INEN). Se determinó la masa ósea en la columna lumbar (L1-L4) y la cadera izquierda (CIz) mediante DXA, en el equipo LEXXUS, instalado en el hospital “Comandante Manuel Fajardo”.
Los términos se definieron como sigue:
Masa ósea: el resultado de la DXA se expresa como puntaje T-score que resulta de comparar el sujeto en estudio con el momento del pico de masa ósea (adulto joven) según sexo y etnia, se expresa como desviaciones estándar (DE), se consideró para mujeres posmenopáusicas:
En mujeres perimenopáusicas, se toma en consideración el Z-score (en relación con mujeres normales de la misma edad); se consideran normales valores mayores -2,0 DE, baja masa ósea (BMO) ≤ -2,0 DE.7
Perimenopausia: se extiende desde el inicio de los síntomas climatéricos hasta la menopausia. Es la fase de cambios en el patrón menstrual que antecede y acompaña a la última menstruación o menopausia.9
Posmenopausia es la etapa de la vida femenina posterior a la menopausia hasta los 64 años de edad. Se dividirá en: Etapa temprana: se refiere a los 5 primeros años de posmenopausia. Etapa tardía: desde 5 años después de la menopausia hasta los 64 años.9
Se determinaron distribuciones de frecuencia de variables cualitativas, así como promedio y DE de las cuantitativas. Se llevaron a cabo tabulaciones cruzadas de edad, color de piel y etapa del climaterio, con las distintas categorías de la masa ósea en dependencia de si se encontraban en perimenopausia o posmenopausia, utilizando la prueba ji al cuadrado para evaluar la significación estadística de la posible asociación.
Se evaluó la correlación entre tiempo de posmenopausia, tiempo de vida reproductiva, meses de lactancia, número de embarazos, LH, FSH, PRL, T y E2, con valores de DMO de L1-L4 y CIz; mediante el coeficiente de Pearson. En la totalidad de los análisis se consideró 0,05 como nivel de significación estadística.
En esta investigación se tuvo en cuenta el principio ético de confidencialidad mediante el uso anónimo de los datos para los fines científicos.
Resultados
La muestra estuvo constituida por 82 mujeres, las regiones óseas de interés que se estudiaron fueron L1-L4 y la CIz. 55 (67,07 %) tuvieron masa ósea normal en L1-L4, BMO u osteopenia 16 (19,51 %) y OP 11 (13,42 %). Sin embargo, en CIz la mayoría de las mujeres (n = 75, 91,46 %) presentó masa ósea normal, BMO u osteopenia (n = 7, 8,54 %) y ninguna presentó OP. De las 7 que tuvieron osteopenia en CIz, 6 tenían en L1-L4, lo que haría un total de 17 con osteopenia, teniendo en cuenta este resultado, la asociación de la masa ósea con los distintos factores se realizó solo con la región de L1-L4.
La media de la edad en el grupo de mujeres estudiadas fue de 49,7.
La tabla 1 refleja la distribución de la muestra según resultado de la DXA, teniendo en cuenta la etapa climatérica y su asociación con la edad. Podemos apreciar que en las mujeres perimenopáusicas, solo una entre 50 y 54 años presentó BMO, el resto presentó masa ósea normal. En las mujeres posmenopáusicas predominó (50 %) la OP en el grupo de 50-54 años; sin embargo, las de 55-59 fueron las que tenían hueso normal y osteopenia con 41,2 % cada una.
Tabla 1 Distribución de las mujeres peri (Z-score) y posmenopáusicas (T-score) según resultado de la DXA y la edad
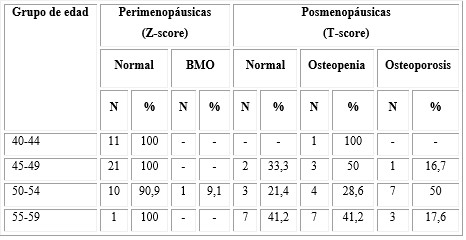
P = 0,015
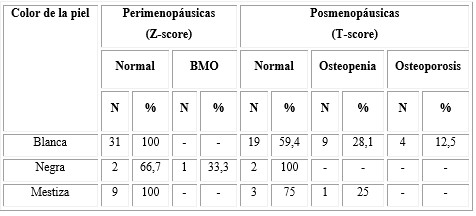
En la tabla 2 se puede apreciar la distribución de la masa ósea según el color de la piel. Se observó un predominio de la piel blanca en el total de la muestra. En las mujeres perimenopáusicas, la única que presentó BMO (n = 1-33 %) tenía el color de la piel negra. En las posmenopáusicas, las que tenían la piel blanca fueron las que presentaron mayor afectación de la masa ósea: 9 para un 28,1 % tuvieron osteopenia y 4 para un 12,5 % OP; las dos mujeres con piel negra (100 %) tenían hueso normal y una (25 %) de las 4 pacientes mestizas presentó osteopenia, el resto de las mujeres tuvieron hueso normal. Estos resultados no presentaron significación (p= 0,403) desde el punto de vista estadístico.
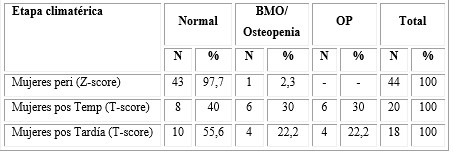
En la tabla 3 se observan los resultados de la asociación entre la masa ósea y la etapa climatérica. En los tres grupos predominaron las mujeres con hueso normal, sobre todo en las que se encontraban en etapa perimenopáusica, donde el 97,7 % presentó hueso normal; las mujeres que tuvieron mayor afectación de la masa ósea fueron las que se encontraban en la posmenopausia temprana, donde 6 (30 %) presentaron osteopenia y OP.
No se realizaron tablas para exponer los resultados de la masa ósea con embarazos a término y con el antecedente de lactancia materna, porque de un total de 82 mujeres, 79 (96,3 %) tuvieron embarazos a término y dieron lactancia materna. Las 3 mujeres que no tuvieron embarazos ni lactaron, tuvieron un hueso normal. Más del 50 % de las que lactaron lo hicieron durante 6 meses o más.
La tabla 4 muestra los resultados de la correlación entre las variables de la esfera reproductiva la DMO. En columna se observó correlación negativa significativa con el tiempo de postmenopausia (p= 0,031*); es decir, a mayor tiempo de posmenopausia menor masa ósea. Con la DMO de CIz no se observó correlación significativa, positiva ni negativa.
Tabla 4 Correlación entre la DMO en L1-L4 y CIz con las variables de la esfera reproductiva
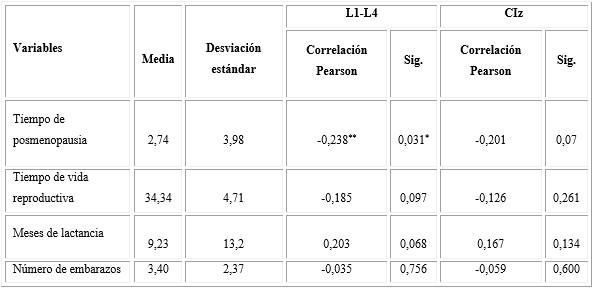
Test de correlación de Pearson.
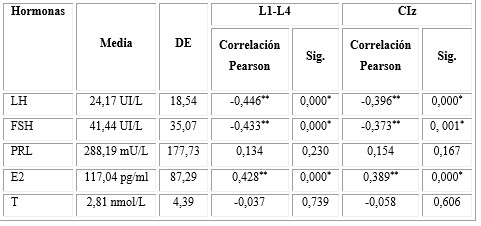
La tabla 5 muestra los resultados de la correlación entre la DMO de L1-L4 y CIz con los resultados hormonales, se encontró correlación negativa significativa con la LH (p= 0,000) y la FSH (p = 0,000) en L1-L4; en CIz para LH p= 0,000 y para FSH p= 0, 001, es decir, a niveles más elevados de LH y FSH, menor DMO en L1-L4 y en CIz; y se observó correlación positiva del E2 (p= 0,000) con la DMO, tanto en L1-L4 como en CIz, es decir, a niveles más elevados de E2, mayor DMO.
Discusión
La OP se considera un problema de salud pública, dado el número de personas afectadas y la repercusión socioeconómica que genera su tratamiento, rehabilitación y prevención.10
En los resultados de la presente investigación se observa una mayor prevalencia de osteopenia o BMO, esto coincidió con un estudio realizado en Guadalajara, donde se encontró que la osteopenia era casi el doble de frecuente que la OP.11
También coincide con otro trabajo realizado en México, donde un 20 % de las personas 40-49 años y el 35 % de 50-59 años presentaron osteopenia, pero solo el 6,28 % de 40-49 años y el 22,13 % de 50-59 años presentaron OP.10 En un metanálisis realizado en China, la prevalencia de osteopenia en mujeres fue mayor que la de OP, resultado similar al presente trabajo.12
Resultados similares se encontraron en otro trabajo realizado en el municipio “Plaza de la Revolución” en los policlínicos “Moncada” y “Puentes Grandes”, donde la osteopenia predominó sobre la OP, se diferenció de esta en que sus resultados arrojaron una mala masa ósea (osteopenia u OP) en más de la mitad de la población estudiada.8
Al realizar el análisis por los sitios evaluados en la DXA, se observó una mayor afectación en L1-l4 que en CIz, similares resultados se aprecian en un estudio realizado en España, donde la prevalencia de afectación de la masa ósea en L1-L4 fue de un 26 % en mujeres mayores de 50 años, ese mismo estudio encontró que en varones mayores de 50 años la prevalencia de OP densitométrica fue similar en la columna vertebral y en la cadera.13) Sin embargo, otro estudio realizado en México demostró que las mujeres mayores de 50 años tienen prevalencia de OP muy similar en la columna lumbar y el fémur de un 17 y 16 %, respectivamente.14
En los resultados de este estudio se observa que la masa ósea normal predominó en personas de menor edad; sin embargo, la osteopenia fue más frecuente en 55-59 años, y la OP de 50-54 años. El envejecimiento está asociado con disminuciones de la masa ósea y el deterioro de la microarquitectura, propiedades del hueso trabecular y cortical que pueden conducir a fragilidad esquelética. No obstante, actualmente se debate si la pérdida sustancial de hueso comienza en la edad adulta temprana o más tarde en la vida.15
En una investigación realizada en países de la Unión Europea, se encontró que la prevalencia de OP se incrementaba con la edad, con un 6,3 % para las mujeres de 50-54 años y un 9,6 % para las de 55-59. En ese mismo estudio se plantea que, aproximadamente, un 21 % de la mujeres entre 50-84 años de edad fueron diagnosticadas con OP, de más de 22 millones de mujeres en esos grupos de edad, en esos países.16)
Actualmente se conoce que, desde la cuarta década de la vida en adelante, se destruye más hueso del que se forma y ese desbalance aumenta con la edad.17 En resumen, se considera que a mayor edad, mayor es el riesgo de tener OP.18) Otro autor plantea que es una entidad clínica relacionada directamente con la edad, que su prevalencia aumenta con el envejecimiento y se duplica el riesgo de fractura por cada 10 años de edad. De esta forma, se estima que, para una mujer de 50 años, el riesgo de padecer una fractura es cercano a 40 %.19Lee20 encontró que los valores de DMO en los años 50, 60 y 70 disminuyeron significativamente con la edad, y el resultado fue similar a otro estudio en el que la DMO disminuía significativamente con el aumento de la edad en las mujeres posmenopáusicas.
En cuanto a su asociación con el color de la piel, se observó un predominio del color de piel blanca y, a su vez, una mayor proporción de esta sobre la mestiza y la negra a medida que empeora la masa ósea, esto pudiera ser expresión de la influencia negativa que tiene este color de piel sobre la masa ósea, como lo refleja el estudio de Greendale y otros, quienes21 plantean que las tasas de pérdida del puntaje de hueso trabécular durante la transición menopaúsica y la posmenopausia fueron similares en las mujeres blancas y japonesas, pero las mujeres negras experimentaron menos disminución de hueso trabecular. En otra investigación realizada recientemente se plantea que las asociaciones entre el cambio absoluto en la DMO total de la cadera (pero no la DMO del cuello femoral o de la columna lumbar) y el riesgo de fractura de cadera parecieron ser más pronunciadas en los participantes con piel blanca que en los participantes afroamericanos (p= 0,05).22
Al establecer la relación entre la masa ósea y etapa climatérica, se observa que las mujeres con hueso normal predominan en la perimenopausia, pero la osteopenia y la OP en la etapa de posmenopausia temprana. Resultados similares se observaron en un estudio realizado en Pakistán, donde la carga por OP fue más alta en mujeres posmenopáusicas (20-49,3 %), solo entre un 5,6 y un 17,8 % de las mujeres premenopáusicas presentaron BMO.23
Se ha demostrado que la menopausia constituye una causa importante de pérdida ósea. Los huesos sufren cambios constantemente a lo largo de la vida para cumplir con las necesidades metabólicas. Desde la edad adulta temprana y hasta la perimenopausia, la DMO de la zona lumbar, antebrazo distal y fémur proximal permanece estable o disminuye mínimamente, la mayor parte de los casos de OP ocurren en mujeres posmenopáusicas y la prevalencia de la enfermedad aumenta con la edad. La pérdida de hueso cortical es evidente después de la mediana edad, y todas las mujeres de 20 a 49 años tienen un CMO significativamente más alto que las mujeres de 49 a 59 años o más, aunque no está claro en qué medida estos resultados podrían atribuirse a la menopausia o resultar de otras causas.15
La literatura revisada coincide en que la menopausia es un factor de riesgo no modificable para la OP, debido a la falta de estrógenos, con una pérdida ósea franca.24
Al analizar la correlación entre las variables de la esfera reproductiva y la DMO de columna, se observó correlación negativa significativa con el tiempo de posmenopausia, es decir, a mayor tiempo de posmenopausia, menos DMO y peor masa ósea; esto no ocurrió en la cadera.
En este trabajo, el número de embarazos y la lactancia materna no mostraron significación estadística al relacionarlo con la masa ósea, pero se plantea que el esqueleto materno sirve como fuente importante de calcio para el crecimiento óseo fetal y durante el período de lactancia, se puede sufrir una reducción de la masa ósea al incrementarse los requerimientos de calcio durante estos períodos, y la ingesta real muchas veces está por debajo de estas demandas, como resultado se activan mecanismos alternativos para satisfacer esta mayor demanda de calcio, incluida una mayor absorción intestinal de calcio, alteraciones en su tasa de excreción renal y aumento de la reabsorción esquelética, que puede conducir a una disminución de un 1-4 % en la DMO durante el embarazo y hasta de un 1-1,5 % por mes durante la lactancia.25
Durante el embarazo, las mujeres también muestran cambios hormonales que pueden influir positivamente en la masa ósea: elevación del E2, una ligera reducción de los niveles de hormona paratiroidea (PTH) durante los dos primeros trimestres (después de lo cual vuelven a la normalidad) y elevación de los niveles séricos de calcitriol, que probablemente influya en el aumento de la absorción intestinal de calcio; aunque pueden influir negativamente los altos niveles de PRL y un incremento gradual de la proteína transportadora de la PTH (PTHrP). Durante la lactancia, la disminución del E2 también puede influir negativamente sobre el hueso, aunque se ha demostrado que los osteocitos son capaces de remodelar su matriz pericelular y alterar los espacios vacíos lacunares y canaliculares osteocíticos durante la lactancia.25
Si bien el embarazo y la lactancia inducen cambios significativos en la densidad y estructura ósea para proporcionar calcio durante el crecimiento fetal/infantil, la fisiología materna también comprende varios mecanismos compensatorios innatos que permiten el mantenimiento de la integridad mecánica esquelética. Los efectos esqueléticos durante el embarazo y la lactancia reflejan un equilibrio optimizado entre las funciones mecánicas y metabólicas del esqueleto. El reciente descubrimiento del remodelado perilacunar/canalicunar osteocítico inducido por la lactancia indica un nuevo medio de los osteocitos para modular la homeostasis mineral y las propiedades mecánicas a nivel de tejido del esqueleto materno.26
Tanto los estudios clínicos como en animales muestran que el embarazo y la lactancia no tienen efectos adversos sobre el riesgo de fracturas durante la vida futura, e incluso pueden ser beneficiosos para la salud ósea a largo plazo.26 Otro estudio reciente también plantea que al parecer la mejoría de la masa ósea observada durante el embarazo se debe los efectos positivos de los estrógenos en la regeneración ósea.27
Es conocido que los esteroides sexuales, especialmente los estrógenos, juegan un papel clave en la regulación del metabolismo óseo y con la pérdida ósea relacionada con la edad en mujeres y hombres. Otro hallazgo de este estudio consistió en que niveles más elevados de E2 en mujeres se asociaron a mejor masa ósea, concordando con lo reportado en la literatura, donde se plantea que los estrógenos promueven la adquisición de masa ósea durante la pubertad y ayudan a mantenerla a partir de entonces y que una disminución de estos durante la menopausia y la posmenopausia conduce a la pérdida de masa y fuerza óseas, y contribuye al desarrollo de OP, uno de los trastornos metabólicos más comunes de la vejez.28
Como se comentó anteriormente, la deficiencia estrogénica es un factor clave en la patogenia de la OP posmenopáusica y cursa con niveles elevados de LH y, sobre todo, de FSH. En este trabajo los valores elevados de estas hormonas tuvieron una correlación negativa significativa en la columna y la cadera; es decir, a mayores niveles de FSH y LH, menor DMO y peor masa ósea, resultados similares encontraron Shieh y otros.29) En un estudio realizado en 2019 que examinó si el E2 o la FSH, medidos en mujeres pre y perimenopáusicas, podían predecir una pérdida ósea significativa para el próximo año, se encontró que las mujeres con niveles más bajos de E2 y más elevados de FSH tenían más probabilidades de disminuir la DMO, cada reducción a la mitad de E2 y cada duplicación de FSH se asociaron con un 10 % y un 39 %, respectivamente, mayor de riesgo de pérdida ósea significativa.
El estudio de Seven30) y otros encontró que los niveles FSH, LH y E2 no mostraron estadísticamente diferencia significativa según los resultados de DMO de los pacientes (p= 0,153, p= 0,153, p= 0,814, respectivamente). Shin31 realizó estudios en coreanos gemelos y en familiares, y demostró que tanto la testosterona total como la testosterona libre se asociaron positivamente con la DMO y que los efectos genéticos fueron significativos sobre la asociación entre la testosterona y la DMO, en esta investigación no se encontraron asociaciones entre la masa ósea y los niveles de testosterona en mujeres.
Se concluye que la mayoría de las mujeres de edad mediana del policlínico “19 de abril” tenían hueso normal; la osteoporosis predominó en los grupos de mayor edad y el color de la piel blanca. Mayor tiempo de posmenopausia y niveles elevados de hormona luteinizante y foliculoestimulante se asociaron con mala masa ósea; niveles elevados de estradiol con mejor masa ósea.
Aporte científico
Esta investigación permitirá conocer la prevalencia de las afectaciones de la masa ósea en mujeres de edad mediana del área estudiada, así como los factores asociados con esta. Este conocimiento ayudará a los profesionales de la salud que se dedican a este campo de investigación a confeccionar protocolos de atención para evitar la progresión del daño óseo, evitar fracturas osteoporóticas y mejorar el estado de salud de este grupo poblacional.