Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Ortopedia y Traumatología
versión On-line ISSN 1561-3100
Rev Cubana Ortop Traumatol v.2003 n.1-2 Ciudad de la Habana ene.-dic. 2003
COMPLEJO CIENTÍFICO ORTOPÉDICO
INTERNACIONAL “FRANK PAÍS”.
CIUDAD DE LA HABANA, CUBA
Correlación eco-gammagráfica en la enfermedad de Legg-Calvé-Perthes
Dra. Matilde Rodríguez Vázquez,1 Dr. Luis Oscar Marrero Riverón,2 Dr. SC. Rodrigo Álvarez Cambras,3 Dr. Zenón de la Cruz San Anastacio,4 Dra. Hilda Elena Roché Egües,4 Dr. Francisco José Quintana Rodríguez4 y Dr. Orlando Hernández Espinosa4
Rodríguez Vázquez M, Marrero Riverón LO, Álvarez Cambras R, de la Cruz San Anastacio Z, Roché Egües HE, Quintana Rodríguez FJ, y Hernández Espinosa O. Correlación eco-gammagráfica en la enfermedad de Legg-Calvé-Perthes. Rev Cubana Ortop Traumatol 2003;17(1-2):27-36.
Resumen
Se muestran los resultados del estudio longitudinal prospectivo, efectuado de septiembre de 1996 a diciembre de 1997 en el Complejo Científico Ortopédico Internacional “Frank País” en 104 pacientes con el diagnóstico presuntivo de Enfermedad de Legg-Calvé-Perthes a quienes se realizó ultrasonido diagnóstico de las caderas; posteriormente a los 28 pacientes con diagnóstico positivo se les realizó una gammagrafía ósea con colimador pinhole. Se utilizó la clasificación gammagráfica de Conway y la ultrasonográfica según estadíos radiológicos de Waldenström. Al correlacionar los estudios ecográficos con los gammagráficos se encontró una gran coincidencia en los primeros estadios, lo que confirmó el diagnóstico presuntivo y precoz de la enfermedad. En la correlación de los estadios ecográficos de Waldenström con el tiempo de evolución se observó que, al aumentar el tiempo de evolución se hace mayor el estadio ecográfico de las caderas.
DeCs: ENFERMEDAD DE LEGG-CALVÉ-PERTHES/diagnóstico, ENFERMEDAD DE LEGG-CALVÉ-PERTHES/ultrasonografía.
La enfermedad de Legg-Calvé-Perthes, es uno de los más frecuentes problemas ortopédicos de la infancia1,2 y a pesar de saberse que la epífisis es afectada por un accidente vascular, su etiología, continúa siendo un enigma.3 Se define como una enfermedad autolimitada que no es inflamatoria, de evolución espontánea4-6 que afecta la epífisis femoral superior, caracterizada por necrosis avascular aséptica de ésta7-8 con fases de degeneración y regeneración (se reabsorbe y sustituye) condicionantes de un grado variable de deformidad de la cabeza femoral, con aplanamiento del núcleo de osificación,4,6,9 pero sin destrucción.6,9-10
La enfermedad de Legg-Calvé-Perthes se inicia, generalmente, de forma clínica silente, y aparecen los síntomas y signos semanas después del episodio avascularizante inicial. El período medio de duración de los síntomas antes del primer hallazgo radiológico es de 5 meses.9
La radiografía es, hasta el momento, la prueba más empleada en el diagnóstico y seguimiento de la enfermedad de Legg-Calvé-Perthes, pero tiene el inconveniente de no visualizar el tejido blando articular y por ello, no detecta el signo más precoz del proceso que es la hipertrofia del cartílago articular, evaluable por la ultrasonografía (ecografía, sonografía). Además, no permite conocer si se está en presencia de un episodio isquémico y si está ocurriendo la revascularización, hechos que sólo son demostrados con el uso de la gammagrafía ósea con el colimador pinhole, entre 6 y 8 semanas antes de la aparición de los signos radiográficos. 9,11-12,14
La ganmagrafía permite diferenciar la enferme-dad de Legg-Calvé-Perthes de otros procesos que radiológicamente la simulan,4,9,12 demuestra la integridad vascular ósea basada en los mecanismos de localización de los radionúclidos,es decir permite el reconocimiento temprano de la isquemia y su extensión.
La utilización de la ecografía como técnica diagnóstica y evolutiva en la enfermedad de Legg-Calvé-Perthes es un tema controvertido. Las características estructurales del tejido óseo hacen que las ondas sónicas no puedan atraversarlo; por ello, la cabeza femoral osificada no es explorable ultrasonográficamente. Pero en la fase cartilaginosa, en la que los ultrasonidos son capaces de penetrar en la matriz condral, sí tiene un valor diagnóstico en la enfermedad de Legg-Calvé-Perthes. Puede y debe utilizarse el estudio comparativo de la cadera contralateral en los pacientes con afección unilateral, además de los parámetros establecidos para la mensuración del grosor del cartílago y otras estructuras anatómicas.
La finalidad de este trabajo es comprobar cuánto y en qué período de la enfermedad pueden ser útiles la ecografía y la gammagrafía ósea, con el objetivo de valorar la sustitución radiológica excesiva a que son expuestos por necesidad de controles evolutivos estos pequeños pacientes, para contribuir a hacer un mejor y más amplio uso de éstas técnicas en aquellas instituciones en que estén disponibles. La ecografía y la gammagrafía son por sus características, técnicas económicas, "no invasivas" y de fácil ejecución.13
Métodos
Se realizó un estudio longitudinal prospectivo de los pacientes comprendidos entre 2 y 12 años de edad que acudieron a consulta de clasificación de cadera del CCOI “Frank País” con el diagnóstico presuntivo de enfermedad de Legg-Calvé-Perthes (104 pacientes) desde septiembre de 1996 hasta diciembre de 1997. A dichos pacientes se les realizó un estudio ecográfico en el Departamento de Ultrasonografía. Los pacientes que tuvieron resultados positivos en el ultrasonido se les indicó un estudio gammagráfico. Se confeccionaron modelos de recogida de datos y de consentimiento informado. La muestra quedó constituida por 28 pacientes (31 caderas).
Criterios de inclusión:
- Paciente pediátrico entre 2 y 12 años de edad con síntomas clínicos.
- Diagnóstico ultrasonográfico de Enfermedad de Legg-Calvé-Perthes.
Criterios de exclusión:
- Incumplimiento de los criterios de inclusión.
Criterios de interrupción:
- Incumplimiento de algún paso de la secuencia de estudios que impida la obtención de las imágenes.
- Voluntariedad del paciente o de sus familiares de abandonar el estudio.
Estudio gammagráfico
- Productos utilizados en gammagrafía:
- Kit liofilizado de Metiléndifosfonato (CENTIS, La Habana, Cuba)
- Generador Molibdeno-Tecnecio (Mo-Tc) (Amersham int plc, Reino Unido) - Equipos utilizados:
- Gammacámara Sophy® DS7 (SMV, Francia, 1989).
- Procedimiento:
- Recepción y preparación psicológica del paciente.
- Pesaje del paciente en kg.
- Inyección por vena antecubital de 99mTc-MDP (metiléndifosfonato, obtenido de un generador de Mo-Tc) según dosis para la edad; esperar de 2 a 3 horas durante las cuales el paciente se hidrata oralmente y evacua la vejiga de forma períodica.
- Adquisición de las imágenes en la gammacámara.
- Técnica:
Se creó un protocolo de adquisición de imágenes estáticas para la gammacámara Sophy DS7, con la siguiente instrumentación:
- Colimador pinhole.
- Fotopico: 140 ± 20 % KeV.
- Zoom:1
- Matríz: 128 x 128 pixels
- Parada por conteos: 100 kiloconteos (kc)
Se coloca al paciente en posición de decúbito supino y se sitúa el colimador pinhole en el centro de la epífisis femoral proximal (queda excluida la vejiga) y se comienza a adquirir las imágenes hasta un total de 100 kc, se realizan vistas anteriores y en posición de rana.
Estudio ultrasonográfico
- Productos utilizados:
· Gel de ultrasonido.
· Cama para ecografía.
· Cámara impresora y papel de impresión. - Equipos utilizados:
· Equipo de ultrasonido SONOLINE® S1-250
(Siemens, Alemania, 1995).
· Transductor 7,5 MHz y 5 MHz. - Técnica:
· Paciente en decúbito supino.
· Ligera abdución del miembro inferior.
· Barrido con el transductor a la altura de la articulación coxofemoral en dirección al eje longitudinal del cuello femoral (el barrido comprende el campo encuadrado entre los trocánteres y el espacio articular).
· Maniobra rotacional de la cadera. - Seguimiento eco-gammagráfico:
· Ultrasonido cada 6 semanas.
· Gammagrafía a los 6 meses del estudio inicial. - Evaluación de los resultados:
Las imágenes ecográficas y gammagráficas fueron evaluadas por 2 de los investigadores de forma independiente, y se llegó a un diagnóstico por consenso, en caso de discrepancias, se incorporó la valoración de un tercer investigador y se aceptó como diagnóstico el criterio de la mayoría. Se utilizó la clasificación gammagráfica de Conway JJ y la ecográfica según el estadio radiológico de Waldenström en la enfermedad de Perthes.
Clasificación ecográfica según estadio radiológico de Waldenström en la enfermedad de Perthes13
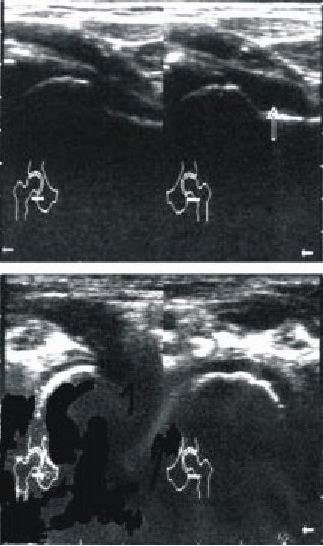
GRUPO A (FASE I o DE INICIO) (fig. 1 a)
- Espacio articular mayor en el lado enfermo con respecto al sano en 2,7± 2 mm (derrame articular).
- Hipertrofia del cartílago articular en el lado enfermo de 1,03 mm de media con respecto al lado sano.
- Tumefacción de partes blandas.
- Disminución de la ecointensidad en el extremo proximal del fémur.
- Ausencia de signos radiográficos específicos de la enfermedad de Legg-Calvé-Perthes.
Fig. 1 a. Estadios 1 a y 1 b ultrasonográficos.
GRUPO B (FASE II o de FRAGMENTACIÓN) (fig. 1 b)
- Aumento del espacio articular de 1,5 ± 1,4 mm (signo “no permanente”).
- Hipertrofia del cartílago de 1,6 mm, con DS 0,54 (signo “no permanente”).
- Se encuentran focos con ecogenicidad muy intensa dispersos en el área correspondiente a la lesión epifisaria, mezclados con otros focos de ecogenicidad disminuida que traducen el estado de necrosis/revascularización.
Fig. 1 b. Estadio 2 ultrasonográfico.
GRUPO C (FASE III o de REOSIFICACIÓN//REMODELACIÓN) (fig. 1 c)
- Espacio articular aumentado en 1,2 ± 0,9 mm al compararlo con el sano (signo “no permanente”).
- Hipertrofia del cartílago de 0,8 ± 0,4 mm (signo “no permanente”).
- Se observan imágenes de ecogenicidad homogénea menos intensa que cuando aparecen focos de necrosis.
Fig. 1 c. Estadio 3 ultrasonográfico.
GRUPO D (FASE IV o de CURACIÓN/SECUELAS) (fig. 1 d)
- Imagen ecográfica normal de curación.
- Secuelas: alteraciones morfológicas residuales vistas en la radiología convencional, como la pérdida del contorno esférico de la cabeza, disminución de la altura epifisaria.
- Secuelas:extrusión de la cadera afecta frente a la sana de 1,6 ± 1 mm.
Fig. 1 d. Estadio 4 ultrasonográfico.
Clasificación gammagráfica de JJ Conway.9,11,12,14
Camino A: RECANALIZACIÓN
1-A (cabeza total)
· Avascularidad total en las proyecciones anterior y de rana.
· Radiactividad medial por superposición acetabular.
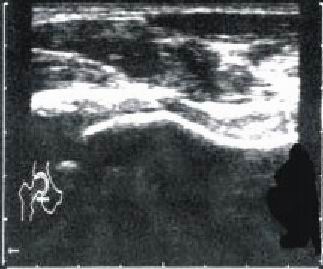
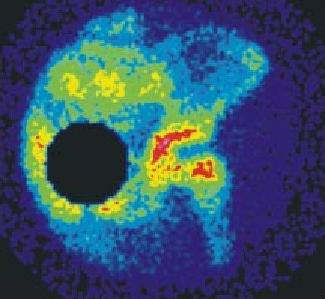
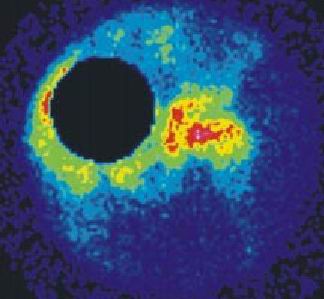
2-A (columna lateral) (fig. 2 a)
· Columna lateral de actividad en la proyección anterior, la cual desaparece en la proyección de rana.
3-A (extensión anteromedial)
· Relleno de la radiactividad entre la columna lateral previamente vista y la actividad acetabular media en proyección anterior. En la vista de rana, la actividad se extiende dentro de la porción anterior de la epífisis.
4-A (revascularización completa)
· La porción osificada de la epífisis está completamente revascularizada.
· El espacio articular aparece como zona angosta de actividad disminuida.
Fig. 2 a. Enfermedad de Perthes, estadio 2A.
Camino B: NEOVASCULARIZACIÓN
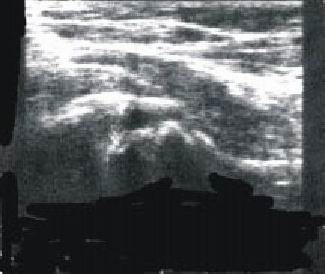
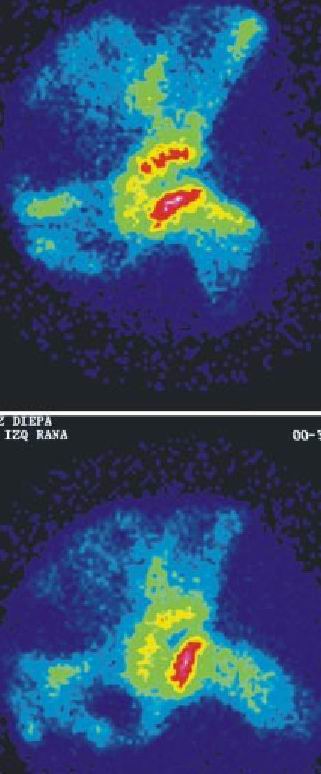
1-B (cabeza total) (fig. 2 b)
· Toda la cabeza desprovista de captación.
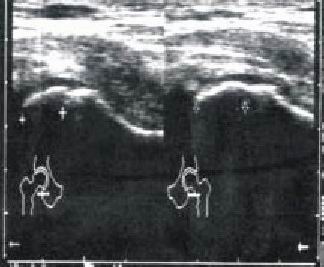
2-B (relleno de la base) (fig. 2 c)
· Engrosamiento “no uniforme” de la radiactividad de la placa de crecimiento.
· No se visualiza la columna lateral.
Fig. 2 b. Enfermedad de Perthes, estadio 1B, proyección anterior.
Fig. 2 c. Enfermedad de Perthes, estadio 2B, proyección anterior.
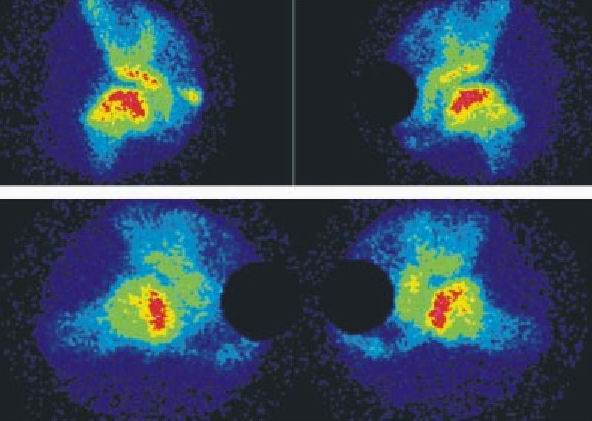
3-B (efecto de hongo) (fig. 2 d)
· Extensión de la radiactividad de la cúpula epifisaria.
Fig. 2 d. Enfermedad de Perthes bilateral, estadio 3B, proyecciones anterior y de rana.
4-B (revascularización completa)
· Revascularización de la porción osificada de la epífisis.
· Epífisis de contorno irregular.
· Varo del cuello femoral.
· Coxa magna.
Análisis estadístico
Se calcularon medidas de resumen a todas las variables estudiadas (porcentaje a las variables cualitativas, variación media y desviación estándar (DS) a las variables cuantitativas). Para determinar la diferencia entre los tiempos de evolución de los diferentes estadios se utilizó un análisis de varianza (Prueba F), se consideró una diferencia significativa entre los tiempos medios de evolución cuando el valor de probabilidad asociado a la prueba fue igual o menor que 0,05.
Resultados
Los datos obtenidos se presentan en las tablas y figuras que aparecen a continuación.
Discusión
En el estudio realizado, la mayor cantidad de pacientes con enfermedad de Legg-Calvé-Perthes tenían 6 años de edad (25 %), seguidos en frecuencia por los de 7 años (17,9 %). La enfermedad fue menos frecuente a la edad de 9 años (10,7 %) y no existieron pacientes de menos de 4 años de edad (tabla 1).
Tabla 1. Relación sexo/ edad
| Edad | Masculinos | Femeninos | Total | |||
| (años) | No. de casos | % | No. de casos | % | No. de casos | % |
| 4 | 3 | 10,7 | 1 | 3,6 | 4 | 14,3 |
| 5 | 3 | 10,7 | 1 | 3,6 | 4 | 14,3 |
| 6 | 7 | 25,0 | 0 | 0 | 7 | 25,0 |
| 7 | 4 | 14,3 | 1 | 3,6 | 5 | 17,9 |
| 8 | 3 | 10,7 | 2 | 7,1 | 5 | 17,9 |
| 9 | 1 | 3,6 | 2 | 7,1 | 3 | 10,7 |
| Total | 21 | 75,0 | 7 | 25,0 | 28 | 100,0 |
La edad media en los pacientes estudiados fue de 6,4 años (DS ±1,6 años). Estos resultados coinciden con los de otros autores, que plantean mayor incidencia de la enfermedad de Legg-Calvé-Perthes alrededor de los 6 años de edad4,6,15,16 y otros, a los 7 años de edad.13,17
Con relación al sexo, los resultados coincidieron con los de otros autores,4,6,13 predominio del sexo masculino con 21 caderas (75,0 %).En pacientes del sexo femenino se ubicaron 10 caderas (25,0 %).Se estableció una relación de 3:1 (tabla 1).
Los pacientes de piel blanca fueron los más afectados (82%), le continuaron en orden de frecuencia los de piel mestiza (18 %). Estos resultados coinciden con los de Benzahel H18 y con lo planteado en la teoría vascular de Trueta19 que refiere la “no afección” en pacientes de piel negra (fig. 3).
Fig. 3. Distribución de pacientes según el color de la piel.
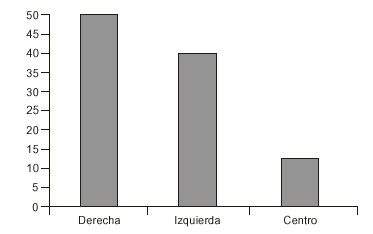
La cadera más afectada fue la derecha con 14 pacientes (45,2 %), se afectaron 11 caderas izquierdas (35,5 %) y hubo 3 pacientes con afección bilateral (19,4 %) (fig. 4). Se coincidió con Skaggs DL,16 Herring JA17 y Benzahel H18 acerca de que la cadera derecha es la de localización más frecuente.
Fig. 4. Localización de la afección.
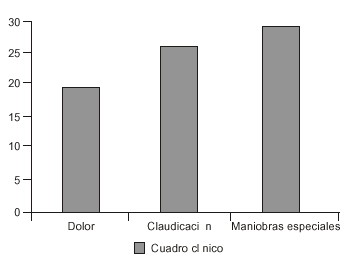
El síntoma más referido fue la claudicación intermitente al inicio y permanente después (89,28 %), lo que correspondió con el resultado de otros autores,4,6, 20 el dolor localizado y en el recorrido sensitivo del nervio obturador fue referido por 18 pacientes (64,28 %) (fig. 5).
Fig. 5. Manifestaciones clínicas.
Al igual que lo expuesto por otros autores, las maniobras especiales fueron positivas en el 100 % de los pacientes.21-23 La limitación de la rotación interna y de la abducción de cadera de los pacientes con la enfermedad del Legg-Calvé-Perthes se demostraron por la positividad de las maniobras de Fabere-Patrick y el Roll Test.
La distribución de caderas con la enfermedad de Legg-Calvé-Perthes en los diferentes estadios de la clasificación ecográfica según los estadíos radiológicos de Waldenström fue la siguiente:
ESTADIO I. Se agruparon 9 caderas, con un aumento del espacio articular por derrame e hipertrofia del cartílago articular en el lado afectado (fig. 1 a).
ESTADIO II. Se agruparon 14 caderas con un moderado aumento del espacio articular e hipertrofia del cartílago articular en el lado afectado (fig. 1 b).
ESTADIO III. Se hallaron 6 caderas con un ligero aumento del espacio articular e hipertrofia del cartílago articular del lado afectado (fig. 1 c).
ESTADIO IV. Se hallaron 2 caderas en las que pudo observarse disminución de la altura epifisaria de la cadera afectada y cambios de su contorno esférico (fig. 1 d).
A los 2 meses y medio del inicio de los síntomas se encontraban 9 caderas en el estadio I; a los 4 meses, se encontraban 14 caderas en el estadio II; a los 9 meses, 6 caderas en el estadio III y a los 13 meses y medio, 2 caderas en el estadio IV (tabla 2).
Tabla 2. Relación Clasificación Ecográfica de Waldenström / Tiempo de evolución de la enfermedad de Legg-Calvé-Perthes
| n=31 | ||
| Clasificación | No. de caderas | Media del tiempo de |
| de Waldenström | afectadas | evolución (meses) |
| I | 9 | 2,5 |
| II | 14 | 4,0 |
| III | 6 | 9,0 |
| IV | 2 | 13,5 |
Tabla 3. Correlación hallazgos ecográficos / hallazgos gammagráficos
| n=31 | ||||||||||||||
| Clasificación gammagráfica | ||||||||||||||
| Camino A | Camino B | Total | ||||||||||||
| Estadios ecográficos | I | II | III | IV | Total | % | I | II | III | IV | Total | % | No. | % |
| I | 2 | 6 | 1 | 0 | 9 | 100,0 | 0 | 0 | 0 | 0 | 0 | 0,00 | 9 | 29,0 |
| II | 0 | 0 | 1 | 0 | 1 | 14,2 | 7 | 6 | 0 | 0 | 13 | 85,8 | 14 | 45,2 |
| III | 0 | 1 | 2 | 0 | 3 | 50,0 | 1 | 0 | 1 | 1 | 3 | 50,0 | 6 | 19,3 |
| IV | 0 | 0 | 0 | 0 | 0 | 00,0 | 0 | 0 | 1 | 1 | 2 | 100,0 | 2 | 6,5 |
| Total | 2 | 7 | 4 | 0 | 13 | 42,0 | 8 | 6 | 2 | 2 | 18 | 58,0 | 31 | 100,0 |
Al correlacionar los estadios ecográficos con la media del tiempo de evolución, se observó cómo al aumentar el tiempo de evolución se hace mayor el estadio ecográfico de estas caderas. Se deduce que a mayor tiempo de evolución de la enfermedad de Legg-Calvé-Perthes, mayores serán los cambios epifisarios (p=0,00), similares resultados a los obtenidos por Díaz A,13 Terjesen T24 y Susuki S.25
Es necesario aclarar que el CCOI “Frank País” es una institución especializada terminal dentro del Sistema Nacional de Salud cubano y se reciben niños con enfermedad de Legg-Calvé-Perthes en estadios finales, lo que dificulta la valoración y seguimiento de los pacientes, y repercute en las secuelas de la enfermedad.
La eficiencia del ultrasonido como medio diagnóstico fue probaba en el examen de las caderas dolorosas de estos pacientes; la ecografía permite valorar la efusión sinovial, la forma de la epífisis, la configuración de la fisis, la forma de la metáfisis, el engrosamiento del cartílago articular y la extrusión lateral así como los estadios de la enfermedad y las secuelas.
Todos los pacientes ubicados en el estadio I ecográfico se encontraban en el camino A de Conway (100 %); la mayoría de los pacientes (58,8 %) del estadio II ecográfico estaban ubicados en el camino B de Conway (estadios I y II), los 6 pacientes del estadio III ecográfico se ubicaron igualmente en el camino A y B de Conway; mientras en el estadio IV ecográfico se encontraban 2 caderas ubicadas en el camino B de Conway en sus estadios finales (III y IV) para el 100 % (fig. 2 a - 2 d) (tabla 3).
El diagnóstico gammagráfico de la enfermedad de Legg-Calvé-Perthes, requiere de la magnificación de las imágenes, no son útiles las gammagrafías estáticas con colimador de orificios paralelos, baja energía y alta resolución (colimador LEHR) para visualizar adecuadamente la epífisis femoral, pues al incluirse la vejiga y la pelvis ósea, la epífisis femoral constituye sólo una pequeña porción del total de la radiactividad, y se presenta muy mal definida .9,11,14
El colimador pinhole permite apreciar una imagen bien definida de la epífisis, gracias a su capacidad de magnificar las imágenes, motivo por el cual fue introducido en 1976 en el estudio de la cadera pediátrica por la Medicina Nuclear.11,19,26-27
Con el uso del colimador quedan aclarados dos falsos conceptos:9,11-12,14
- Que el aumento de la captación del radiofármaco traduce sinovitis de la cadera.
- Que la disminución de la captación del radiofármaco traduce enfermedad de Legg-Calvé-Perthes.
Conway JJ14 demostró que el estudio gammagráfico permite plantear la forma de revascularización que ocurre después de los episodios isquémicos y llegó al siguiente análisis:
La revascularización de la cabeza femoral sigue un primer camino, la recanalización de los vasos colapsados. Ello se evidencia por la aparición de una columna lateral de captación de radiofármaco en la porción superior externa de la cabeza femoral.
En un segundo camino, la revascularización de la cabeza femoral ocurre de una forma más lenta que la anterior, desde la placa epifisaria con la invasión de vasos neoformados hacia la epífisis (revascularización por neovascularización).
Las observaciones anteriores permitieron a Conway14 clasificar la enfermedad de Legg-Calvé-Perthes desde el punto de vista gammagráfico en: Camino A (revascularización) y Camino B (neovascularización).
Aún no se conoce por qué se produce el episodio isquémico inicial (Camino A), ni cómo se produce la apertura de los vasos colapsados (recanalización). Tampoco se conoce si el camino B es el resultado de un episodio prolongado o, de múltiples infartos que impiden la recanalización y dejan como única opción la neovascularización.
Como conclusiones fundamentales del presente trabajo puede plantearse que el diagnóstico ecográfico precoz coincide con los estadios precoces de la gammagrafía ósea, la que anticipa el patrón de revascularización y permite pronosticar la evolución y planificar el tratamiento a aplicar, por lo cual se considera que el US y la gammagrafía ósea son investigaciones valiosas y confiables para el estudio de la enfermedad de Perthes.
Summary
The results of the prospective longitudinal study of 104 patients with presumptive diagnosis of Legg-Calvé-Perthes disease, which was carried out in “Frank País” International Scientific Orthopedic Institution from September 1996 to December 1997 are presented. Diagnostic ultrasound was performed on these patients; afterwards 28 patients with positive diagnosis were applied a bone scintigraph with pinhole collimator. Conway´s scintigraphic classification together with an ultrasonographic classification according to Waldestron´s radiological staging were used. When correlating the echographic studies to the scintigraphic ones, high coincidence was found in the first stages, which confirmed the early presumptive diagnosis of the disease. In the correlation of Waldestron´s echographic stages to the time of development, it was observed that the echographic staging of hips is higher as the time of development increases.
DeCS: LEGG-PERTHES DISEASE/diagnosis; LEGG-PERTHES DISEASE/ultrasonography.
Résumé
Les résultats de l’étude longitudinale prospective, effectuée du mois de septembre 1996 au mois de décembre 1997 dans le Complexe scientifique orthopédique international "Frank País", avec la participation de 104 patients présumés de maladie de Legg-Calvé-Perthes, qui ont été l’objet d’un écho–diagnostic des hanches, sont montrés; sur les 104 patients, 28, ayant un diagnostic positif, ont été l’objet d’une gammagraphie osseuse à collimateur pinhole. On a utilisé la classification gammagraphique de Conway et la classification ultrasonographique selon stades radiologiques de Waldenström. En comparant les études échographiques avec les gammagraphiques, on a trouvé une grande coïncidence aux premiers stades, ce qui a confirmé le diagnostic présumé et précoce de la maladie. Dans la comparaison des stades échographiques de Waldenström avec le temps d’évolution, on a constaté que le stade échographique des hanches augmente au fur et à mesure le temps d’évolution augmente.
Mots clés: MALADIE DE LEGG–PERTHES/diagnostic; MALADIE DE LEGG–PERTHES/ultrasonographie.
Referencias bibliográficas
- Thompson GH, Salter RB. Legg-Calvé-Perthes disease. Current concepts and controversies. Orthop Clin North Am 1987;18:617-35.
- Wenger DR, Ward WT, Hewing JA. Legg-Calvé-Perthes disease. J Bone Joint Surg 1991;73-A (5):778-88.
- Barker DG, Hall AJ. The epidemiology of Perthes disease. Clin Orthop 1986;209: 89-94.
- Tachdjian MO. Ortopedia pediátrica. 2 ed. Vol 2. México DF: Interamericana;1994 p. 1800-69.
- Harrinson MHM, Burwell RG. Perthes desease: A concept of pathogenesis. Clin Orthop 1981;156:115 – 27.
- Álvarez Cambras R. Enfermedad de Legg-Calvé-Perthes. Ortopedia .T 2. La Habana: Editorial Pueblo y Educación; 1986 p. 127–34.
- Salter RB, Thompson GH. Legg-Calvé-Perthes disease: The prognostic significance of the subcondral fracture and a two group clasification of the femoral head involvement. J Bone Joint Surg 1984,66-A(4):479–83.
- Mose K. Methods of measuring in Legg-Calvé-Perthes disease with special regard to the prognosis. Clin Orthop 1980;150:103–9.
- Tsao AK, Díaz LS, Conway JJ, Straka P. The prognostic value and significance of serial bone scintigraphy in Legg-Calvé-Perthes disease. J Pediatr Orthop 1997;17(2):230–9.
- Legg AT. The end results of Coxa Plana. J Bone Joint Surg 1927; 9: 26–36.
- Marrero Riverón LO, Álvarez Cambras R, Cárdenas Centeno OM de, Roché Egües HE, Martínez González M. Gamma-grafía ósea con pinhole en la enfermedad de Legg-Calvé-Perthes. Rev Cubana Ortop Traumatol 1999;13(1-2):31-42.
- Conway JJ , Weiss SC, Maldonado V. Scintigraphy pattern in Legg-Calvé-Perthes disease. Radiology 1983;(Suppl 149):102–15.
- Díaz A, Abril JC, Juanicotena MJ, Queiruga JA. Estudio ecográfico de la enfermedad de Legg-Calvé-Perthes. Rev Ortop Traumatol 1997;41(4):430–6.
- Conway JJ. A Scintigraphic classification of Legg-Calvé-Perthes disease. Semin Nucl Med 1993;23(4):274-95.
- Thompson GH, Salter RB. Legg-Calvé-Perthes disease. Clin Symposia CIBA 1986;38(1):3-12, 16-17, 20-21, 26-30.
- Skaggs DL, Tolo VT. Legg-Calvé-Perthes disease. J Am Acad Orthop Surg 1996;4(1):9-16.
- Herring JA. Legg-Calvé-Perthes disease. J Am Acad Orthop Surg (Monographs Series) 1996:6-14, 17-9, 36-7, 45-7.
- Bensahel H. Epidemiology of LCP disease. Mapfre Med 1995; 6 (Suppl 3):8-9.
- Trueta J The normal vascular anatomy of the human femoral head during growth. J Bone Joint Surg 1957;39-B:358-94.
- Moseley CF. Legg-Calvé-Perthes disease: Radiological findings stages. Mapfre Med 1995;6(Suppl 3):43-51.
- Waldenström H. The definite forms of Coxa Plana. Acta Radiol 1922;1:384–94.
- Epeldegui T. History of Legg-Calvé-Perthes disease. Mapfre Med 1995;6(Suppl 3): 3 - 7.
- Danigelis JA, Fischer RL, Ozonoff MB, Sziklas JJ. 99m Tc-polyphosphate bone imaging in Legg-Calvé-Perthes disease. Radiology 1975, 115:407-13.
- Terjesen T. Ultrasonography in the primary evaluation of patients with Perthes disease. J Pediatr Orthop 1993,13:437-43.
- Susuki S, Awaya G, Okada Y, Tada H. Examination by ultrasound of Legg-Calvé-Perthes disease. Clin Ortoph 1987;220:130-5.
- Gómez EA. Exploración osteoarticular en isótopos radiactivos. En manual de radiología clínica. Barcelona: Mosby - Doymaz 1995 p. 226-87.
- Calver R, Venugopal V, Dorgan J, Bentley G, Gimlette T. Radionuclide scanning in the early diagnosis of Perthes’ disease. J Bone Joint Surg 1981;63-B(3):379-82.
Recibido: 13 de enero de 2003. Aprobado: 4 de marzo de 2003.
Dra. Matilde Rodríguez Vázquez. CCOI “Frank País”. Ave. 51 No. 19603 entre 196 y 202. La Lisa. Ciudad de La Habana, Cuba.
1 Especialista de I Grado en Ortopedia y Traumatología. Jefe del Servicio de Ultrasonografía.
2 Especialista de II Grado en Ortopedia y Traumatología.Profesor Asistente. Jefe del Departamento de Medicina Nuclear.
3 Doctor en Ciencias. Profesor Consultante. Especialista de II Grado en Ortopedia y Traumatología. Director General del CCOI “Frank País”.
4 Especialista de I Grado en Ortopedia y Traumatología.