Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Ortopedia y Traumatología
versión On-line ISSN 1561-3100
Rev Cubana Ortop Traumatol v.20 n.2 Ciudad de la Habana jul.-dic. 2006
Hospital Militar "Dr. Carlos J. Finlay"
Ciudad de La Habana, Cuba
Resultados del relleno de defectos óseos tumorales con hidroxiapatita o injerto homólogo
Dr. Osvaldo Pereda Cardoso,1 Dr. Raúl Toca Caballero 2 y Dr. Ramón González Santos 3
Resumen
Durante 15 años se ha utilizando la hidroxiapatita obtenida a partir del coral Porites, en los defectos óseos subsiguientes a la cirugía de exéresis tumoral. Se realizó un estudio en 100 pacientes con diagnóstico de tumoraciones óseas benignas de las extremidades, en el período de tiempo comprendido desde el 1988 hasta el año 2000; con el objetivo de evaluar su eficacia como material de implante óseo. Se dividió la muestra aleatoriamente en dos grupos, un grupo estudio y un grupo control, con 50 pacientes cada uno. En el grupo estudio se realizó relleno de la cavidad tumoral con hidroxiapatita Coralina® HAP-200 y en el grupo control con injerto de hueso homólogo. Se constató que el 96 % de los pacientes implantados con hidroxiapatita presentaron curación, mientras que en los pacientes tratados mediante injertos de hueso homólogo solo se obtuvo la curación en el 88 %. Por lo que se recomienda el uso del biomaterial hidroxiapatita en el tratamiento restaurador de defectos óseos de las extremidades.
Palabras clave: hidroxiapatita, injerto óseo, defecto óseo, extremidad.
Todo defecto óseo de una extremidad, afecta la capacidad funcional del segmento corporal dañado. A esta situación se han enfrentado médicos desde años antaño hasta el presente y muchos investigadores se han afanado en encontrar una solución.
En una fase inicial, el defecto óseo se trató a expensas de la propia fuente natural del hueso, dando paso al injerto óseo, que ha perdurado hasta la actualidad y durante años se consideró el sustituto ideal por su comportamiento y estructura. Pero en la práctica presenta inconvenientes que limitan su uso, pues su obtención implica una intervención quirúrgica adicional para el paciente con mayor morbilidad postoperatoria, o presenta desventajas relacionadas con fracasos de incorporación, reabsorción, transmisión de enfermedades, rechazo inmunológico y sobre todo dificultades de obtención y conservación. 1-5
Los inconvenientes del injerto óseo incentivaron la búsqueda de materiales naturales o artificiales para implantes en hueso, en las últimas décadas han aparecido diversidad de biomateriales. En este sentido, los clasificados como bioactivos han adquirido mayor relevancia por el éxito en la aplicación práctica, dado por la interacción e intercambio químico que se establece entre el implante y el tejido vivo. Dentro de este grupo la hidroxiapatita ha acaparado particular interés por su similitud química y estructural con el principal componente mineral del hueso humano, que la ubica como uno de los materiales más biocompatibles reconocido en la implantología ósea. 6-11
En el Hospital Militar “Dr. Carlos J. Finlay”, desde el año 1988 se ha tratado defectos óseos subsiguientes a la cirugía de exéresis de tumoraciones benignas de las extremidades, mediante la utilización de hidroxiapatita obtenida a partir del coral Porites marino. Se realizó el presente estudio con el objetivo de evaluar su eficacia como material de implante óseo a través de un ensayo clínico controlado.
Métodos
Se realizó un estudio en 100 pacientes con diagnóstico de tumoración ósea benigna de las extremidades, atendidos en el Servicio de Ortopedia del Hospital "Dr. Carlos J. Finlay", en el período de tiempo comprendido desde el año 1988 hasta el año 2000.
Criterios de inclusión en el estudio
- Pacientes de ambos sexos
- Mayores de 16 años de edad
- Aceptación voluntaria en la participación en el ensayo
- Portadores de tumoraciones óseas benignas de las extremidades comprendidas en el siguiente grupo: encondroma, condroblastoma, osteoblastoma, defecto fibroso metafisario, quiste óseo solitario y quiste óseo yuxtaarticular. (Nombrados según la clasificación propuesta por el Centro Internacional de Referencia de la OMS y seleccionados según criterios basados en características comunes de estas tumoraciones). 12
Citerios de exclusión en el estudio
- Presencia de sepsis activa en el sitio de defecto óseo
- Pacientes que no cumplan con alguno de los criterios de inclusión
Criterios de salida en el estudio
- Deseo expreso del paciente de no continuar el tratamiento
- Imposibilidad de seguimiento clínico del paciente por un periodo de tiempo mínimo de un año
- Participación del paciente en otro tipo de investigación o tratamiento
A todos los pacientes se les realizó exámenes clínicos, radiográficos e histológicos; que permitieron diagnosticar con certeza la lesión ósea tumoral. Se dividieron en 2 grupos con 50 casos cada uno, seleccionados aleatoriamente en un grupo control y un grupo estudio. En el grupo control se realizó curetaje de la lesión ósea y se rellenó con injerto de hueso homólogo, mientras que en el grupo estudio se realizó los rellenos con el biomaterial.
Se empleó la hidroxiapatita Coralina® HAP-200 en forma de gránulos, obtenido a partir del coral Porites, producido en el Centro Nacional de Investigaciones Científicas de Cuba.
El seguimiento clínico se realizó mediante observación directa al paciente, control de los signos vitales y estudio local de la herida quirúrgica. Se empleó una clasificación en grados para la evaluación clínica del edema, dolor, inflamación, sepsis o exposición del material. 13
Las imágenes radiográficas permitieron evaluar el comportamiento del implante y la interfase hueso-implante, de la siguiente forma:
- Osteointegración positiva: desaparición del límite radiográfico entre el biomaterial o injerto y el tejido óseo adyacente
- Osteointegración negativa: reabsorción del implante o del tejido óseo adyacente, o encapsulación del biomaterial como respuesta a cuerpo extraño.
- Osteointegración sin evidencias: no se evidencia modificaciones entre el biomaterial o injerto y el tejido óseo adyacente.
La evaluación hematológica se hizo mediante estudio de hemograma completo, eritrosedimentación., calcio, fósforo y fosfatasa alcalina en el postoperatorio.
Los resultados se calificaron en base a las evaluaciones clínicas, hematológicas y radiográficas del modo siguiente (tabla 1):
Tabla 1. Clasificación de las variables
| Variables evaluadas | Resultado | ||
| Bueno | Regular | Malo | |
| Edema | Ausente o mínimo | Moderado | Intenso |
| Dolor | Ausente o mínimo | Moderado | Intenso |
| Inflamación | Ausente o mínima | Moderada | Intensa |
| Exposición | Ausente o mínima | Moderada | Intensa |
| Sepsis | No | No | Si |
| Osteointegración | Positiva | Sin evidencias | Negativa |
| Estado hematológico | Normal o d.min. v.n. | d. mod. v.n. | d. imp. v.n. |
d.min. = desviaciones mínimas / d.mod. = desviaciones moderadas / d.imp. = desviaciones importantes
v.n. = valores normales
Criterio de curación
- Solución del defecto óseo tumoral tratado con osteointegración del biomaterial o del injerto óseo.
Para el análisis estadístico se aplicaron las distribuciones de frecuencia para variables discretas, mientras que para las variables continuas se empleó la media y las desviaciones estándar. Para la comparación entre los grupos se practicó análisis de frecuencias basado en el estadígrafo Chi-cuadrado y Test de probabilidad exacta de Fisher.
Resultados
En el estudio se constató que el 75 % de todas las lesiones se encontraron alrededor de la rodilla (fémur distal y tibia proximal), seguido en orden de frecuencia por las del húmero.
La evaluación clínica del sitio de implante evidenció que el dolor y el edema exhibieron el comportamiento habitual en la cirugía ósea de las extremidades. En ambos grupos la aparición de signos flogísticos estuvo directamente relacionado con la presencia de infección en la herida quirúrgica y como respuesta del organismo, sin representar diferencia estadísticamente significativa (p>0,05).
En ningún paciente se observó inflamación relacionada con rechazo o intolerancia al injerto óseo o al biomaterial. En el grupo estudio, en 2 pacientes ocurrió expulsión de algunos gránulos aislados de hidroxiapatita, pero sin evidencias de reacción inflamatoria importante y en ambos se produjo curación de la lesión ósea y osteointegración del implante.
La evaluación de laboratorio de los parámetros sanguíneos no señaló diferencia estadísticamente significativa entre los grupos estudio y control (p>0,05). Se evidenció un aumento moderado en los valores del leucograma y de la eritrosedimentación en el primer mes de evolución, correspondiéndose en el caso de la inflamación, con la presencia de sepsis de la herida quirúrgica. La hemoglobina, sin embargo, no evidenció ningún cambio evolutivo en los pacientes estudiados. El calcio y el fósforo no rebasaron los límites de sus valores normales, no obstante se observó un discreto aumento de sus concentraciones plasmáticas después del primer mes de evolución. La fosfatasa alcalina a pesar de no rebasar sus límites normales, mostró una marcada tendencia a la elevación de sus valores sanguíneos entre los 30 y los 90 días de evolución.
La evaluación radiográfica de la osteointegración de la hidroxiapatita o del injerto óseo a los 6 meses de evolución (tabla 2), señaló diferencias estadísticas significativas entre los dos grupos (p<0,001). En el grupo estudio se produjo osteointegración del 96 % de los implantes y sólo en 2 pacientes los implantes se comportaron sin evidencias de osteointegración, pero también sin evidencias de encapsulación o rechazo. En el grupo control se produjo fracaso de la osteointegración en 5 pacientes dado por reabsorción del injerto óseo.
Tabla 2. Resultados postoperatorios de la evaluación radiográfica de la osteointegración
| Osteointegración | Grupo estudio | Grupo control | ||
| No. | % * | No. | % * | |
| Positiva | 48 | 96 | 45 | 90 |
| Sin Evidencias | 2 | 4 | -- | -- |
| Negativa | -- | -- | 5 | 10 |
*Porcentaje calculado sobre la base del total de pacientes de cada grupo (50).
X2 = 7,10; p < 0,001
A pesar de no existir una diferencia estadística significativa, el número de complicaciones fue mucho menor en el grupo estudio que en el grupo control. La recidiva de la lesión tumoral por reabsorción del injerto óseo y la fractura patológica postoperatoria ocurrieron en pacientes del grupo control.
Los resultados finales del tratamiento (tabla 3) en general fueron buenos, y aunque no hubo una diferencia estadística significativa, fueron discretamente más favorables en el grupo estudio que en el grupo control. La curación del defecto óseo ocurrió en el 96 % de los pacientes implantados con hidroxiapatita, mientras solo se obtuvo la curación en el 88 % de los pacientes tratados mediante injertos de hueso homólogo.
Tabla 3. Resultado final del tratamiento
| Resultado final | Grupo estudio | Grupo control | ||
| No. | % * | No. | % * | |
| Bueno | 43 | 86 | 40 | 80 |
| Regular | 5 | 10 | 4 | 8 |
| Malo | 2 | 4 | 6 | 12 |
| Total | 50 | 100 | 50 | 100 |
* Porcentaje calculado sobre la base del total de pacientes de cada grupo (50).
X2 = 2,22; p > 0,05
Discusión
En diversas bibliografías se menciona que la recidiva de la cavidad tumoral por reabsorción del injerto, es una de las complicaciones más frecuentes del tratamiento de los tumores, posiblemente relacionado con una exacerbación en la resorción ósea debido a una hiperactividad de los osteoclastos. La reparación en el caso del injerto óseo, ocurre por un mecanismo de resorción osteoclástica del mismo; seguida de la nueva deposición del hueso a expensas del fenómeno de osteoconducción que induce. Sin embargo, este proceso resulta limitado en tiempo y espacio, y con frecuencia la masa de hueso muerto no logra ser sustituida por el hueso nuevo y el resultado final es la pérdida del injerto. En cambio, en el caso de la hidroxiapatita Coralina® HAP-200 esto no sucede por tratarse de un material básicamente no reabsorbible. 14
Últimamente, algunos autores han utilizado la hidroxiapatita con la intención de establecer los materiales reabsorbibles como los ideales. Gil Albarova, planteó la conveniencia de contar con biomateriales con propiedades específicas según su aplicación clínica. Sin embargo, la hidroxiapatita Coralina® HAP-200 presenta baja velocidad de reabsorción, pues se considera que le confiere resistencia contra la actividad osteoclástica tumoral y la reparación se produce por proliferación penetrante del tejido de neoformación ósea en su interior; en lugar del proceso de reabsorción y sustitución que ocurre en el caso del injerto óseo, con mucha más alta probabilidad de fracaso cuando la velocidad de reabsorción excede la de sustitución, o cuando esta última es incapaz de completar el proceso. 15
Así como la elevada resistencia a la reabsorción, la hidroxiapatita exhibe resistencia contra la infección, aunque no ha sido experimentalmente demostrada, parece estar relacionada con la presencia de iones hidroxilo en su composición, que son responsables de un pH de superficie puntual de predominio básico que le confiere propiedades bactericidas. En la práctica clínica se ha podido constatar que este biomaterial, soporta la infección sin detrimento de su estructura y propiedades.
También es destacable que en el grupo estudio no se produjo fracturas patológicas postoperatorias, mientras en el grupo control ocurrió en 2 pacientes. Estas fracturas ocurren con bastante frecuencia cuando se trata de grandes tumoraciones que invaden más de la mitad del diámetro del hueso, o se ha producido adelgazamiento de las corticales por el crecimiento expansivo del tumor, lo que condiciona una disminución de la resistencia mecánica del hueso en la zona. 14
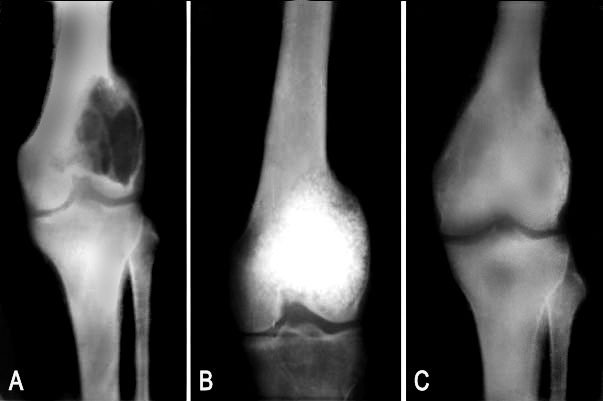
En el caso de la hidroxiapatita, la porosidad del biomaterial facilita la proliferación penetrante del tejido de neoformación ósea en su interior, lo que hace que la resistencia mecánica del implante aumente considerablemente (fig.1), con la subsiguiente disminución del riesgo de fracturas patológicas postoperatorias.
Fig.1. A- Condroblastoma de fémur B- Curetaje y relleno con hidroxiapatita Coralina® HAP-200 C- Radiografía evolutiva a los 6 meses, donde se observa un excelente soporte estructural
En cuanto a la exposición del biomaterial, algunos autores señalan la migración de partículas como una desventaja de la hidroxiapatita en forma de granulado y con intención de mejorar este inconveniente, han planteado el uso de polímeros en asociación a la misma. No obstante, en el estudio se fue meticuloso en la cobertura perióstica y contención del granulado, y esto fue suficiente para evitar esta complicación. 16-18
La evaluación del resultado final del tratamiento de defectos óseos tumorales señaló una mayor curación de los pacientes implantados con hidroxiapatita. Estos resultados aunque no revierten un valor estadístico significativo, permiten ratificar las cualidades del biomaterial de implante óseo, en cuanto a su biocompatibilidad y efecto osteogénico. Wilkins y Nelly, reportaron el 93 % de curación con la utilización de la matriz ósea desmineralizada y apuntan hacia la conveniencia de asociación a hidroxiapatita para tratar de mejorar estos resultados. 19
Hay autores que en la actualidad estudian el empleo de materiales osteoinductores, como es el caso de la proteína morfogenética ósea; pero reconocen la conveniencia de propiciar enlaces de estas proteínas con vehículos apropiados como la hidroxiapatita. 20
Aunque la hidroxiapatita es reconocida como un material osteoconductor por excelencia, de algún modo esta ejerce propiedades osteoinductoras; quizás por que actúa en los procesos celulares mediante un efecto de tipo piezoeléctrico a expensas de la presencia en su composición de iones hidroxilo, responsables de un pH alcalino que facilita la formación endocondral de hueso.
La ausencia de reacción inflamatoria aguda o crónica en el sitio de implante óseo, ratifica la biocompatibilidad del biomaterial, pues como plantean Kavanagh y cols,21 el éxito de un implante está dado por el atrapamiento de éste en el hueso mediante una interfase hueso-implante directa sin reacción inflamatoria. La identidad de la hidroxiapatita con el tejido óseo, favorece la formación de enlaces químicos interfaciales con el mismo, lo que contribuye a la osteoasimilación del implante. 16
La posibilidad de realizar una evaluación a los 5 años, después del implante de hidroxiapatita en los pacientes que curaron su defecto óseo; permitió por medio de estudios radiográficos longitudinales, observar que el biomaterial implantado disminuyó su densidad, igualándose con el tejido óseo circundante. En aquellos pacientes que el biomaterial no exhibió evidencias de osteointegración en el momento de la evaluación inicial, se produjo evolutivamente después. Mientras que en los pacientes que persistió la imagen radiográfica del implante, finalmente se evidenció una completa tolerancia clínica y humoral; donde se ratificó la asimilación e incorporación de la hidroxiapatita a la dinámica natural del metabolismo óseo. 22
Existen amplios estudios que exponen los resultados del injerto de banco, se considera según los resultados alcanzados, que la hidroxiapatita con características de biocompatibilidad y poder osteogénico es tan buena como el injerto óseo. Esto unido a otras propiedades del biomaterial, como la facilidad de obtención, conservación, esterilización, resistencia a la infección, incremento de la resistencia mecánica durante el proceso de reparación y adecuado costo-beneficio; permite recomendar la utilidad del uso de la hidroxiapatita como material de implante óseo en el tratamiento restaurador de grandes cavidades tumorales óseas benignas de las extremidades; pues reduce algunos inconvenientes como la necesidad de una intervención quirúrgica adicional con el subsiguiente incremento de la morbilidad, tiempo de hospitalización y de recuperación funcional del paciente, y por tanto una reincorporación laboral.
Summary
Results of the filling of bone tumoral defects with hydroxyapatite or homologous graft
For 15 years the hydroxyapatite obtained from Porites coral has been used in the bone defects following the tumoral exeresis. A study of 100 patients with diagnosis of bening bone tumors of the extremities from 1988 to 2000 was conducted in order to evaluate its efficacy as bone implant material. The sample was divided at random into 2 groups: a study group and a control group, with 50 patients each. The tumoral cavity was filled with Coralline hydroxyapatite HAP-200 in the study group, and with homologous bone graft in the control group. It was confirmed that 96 % of the patients implanted with Coralline hydroxyapatite HAP-200 were cured, whereas healing was only attained in 88 % of the patients treated with homologous bone graft. Therefore, the use of the biomaterial is recommended in the restorative treatment of bone defects of the extremeties.
Key words: hydroxyapatite, bone graft, bone defects, extremities.
RÉSUMÉ
Résultats de la correction des défauts osseux tumoraux en utilisant de l'hydroxy-apatite ou une homogreffe
L'hydroxy-apatite obtenue du corail Porites a été utilisée pendant 15 ans dans la correction des défauts osseux suivant une exérèse tumorale. Une étude de 100 patients diagnostiqués de tumeurs osseuses bénignes des extrémités a été réalisée dans la période comprise entre 1988 et 2000, afin d'évaluer son efficacité comme matériau d'implant osseux. L'échantillon a été aléatoirement divisé en deux groupes, un groupe étude et un groupe témoin, de 50 patients chacun. Dans le groupe étude, on a utilisé de l'hydroxy-apatite corallienne HAP-200®, et dans le groupe témoin une homogreffe osseuse. On a constaté que dans le premier groupe le traitement a réussi chez 96% des patients, tandis que dans le second le traitement a réussi chez 88% des patients. C'est pourquoi, l'utilisation de ce biomatériau est conseillée dans la correction des défauts osseux des extrémités.
Mots clés: Hydroxy-apatite, greffe osseuse, défaut osseux, extrémité.
Referencias bibliográficas
1. Senn N. On the healing of aseptic bone cavities by implantation of antiseptic decalcified bone. Amer J Med Sci. 1989; 98: 219-43.
2. Seiler JG, Johnson J. Iliac crest autogenous bone grafting: donor site complications. J South Orthop Assoc. 2000 Summer; 9(2): 91-7.
3. Patel R, Trampuz A. Infections transmitted through musculoskeletal-tissue allografts. N Engl J Med. 2004; 350(25): 2544-6.
4. Gil J, Garrido R, Gil R. Estado actual de los injertos óseos. Biología, función, conservación, riesgo de transmisión de enfermedades, inmunogenicidad e incorporación. Rev Esp Cir Osteoart. 2001; 36: 23-32.
5. Ortiz EJ, Campo J, Martínez J, Canosa R. Estructura y organización de un banco de huesos y tejidos. Rev Ortop Traumatol. 2000; 44: 127-38.
6. Bauert TW, Muschler GF. Bone graft materials. An overview of the science. Clin Orthop. 2000; 371:10-27.
7. Ong JL, Hoppe CA, Cardenas HL, Cavin R, Carnes DL, Sogal A, et al. Osteoblast precursor cell activity on HA surfaces of different treatments. J Biomed Mater Res. 1998; 39(2): 176-83.
8. Dickson KF, Friedman J, Buchholz JG, Flandry FD. The use of bone source hydroxyapatite cement for traumatic metaphyseal bone void filling. J Trauma. 2002; 53:1103-8.
9. Saiko M, Shimizu H, Beppu M, Takagi M. The role of tricalcium phosphate in vascularized periosteum. J Orthop Sci. 2000; 5: 275-82.
10. Wenisch S, Stahl JP, Horas U, Heiss C, Kilian O, Trinkaus K, et al. In vivo mechanisms of hydroxyapatite ceramic degradation by osteoclasts: fine structural microscopy. J Biomed Mater Res. 2003; 67A (3): 713-8.
11. Porter AE, Best SM, Bonfield W. Ultra structural comparison of hydroxyapatite and silicon-substituted hydroxyapatite for biomedical applications. J Biomed Mater Res. 2004; 68A (1): 133-41.
12. Valls O, Marinello Z. Tumores y lesiones seudotumorales del esqueleto. La Habana: Editorial Científico Técnica; 1979. p. 371-87.
13. Pereda Cardoso O. Implantes de hidroxiapatita Coralina® HAP-200 en el tratamiento de defectos óseos de las extremidades. [Tesis Doctoral]. Ciudad de La Habana; 2005.
14. Marrero Riverón LO y cols. Índice quístico. Valor pronóstico y terapéutico. Rev Cubana Ortop Traumatol. 1999; 13 (1-2): 19-26.
15. Gil J, Garrido R, Gil R, Melgosa M. Materiales para la reparación y sustitución ósea. Factores de crecimiento y terapia genética en Cirugía Ortopédica y Traumatología. Mapfre Medicina. 2003; 14: 51-65.
16. González R, Guerra-López J. Materiales bioactivos para implantes óseos. Características y aplicaciones. [Monografía]. La Habana: Editorial Ciencias Médicas; 1993.
17. Roeder RK, Sproul MM, Turner CH. Hydroxyapatite whiskers provide improved mechanical properties in reinforced polymer composites. J Biomed Mater Res. 2003; 67A (3): 801-12.
18. Ambrosio AM, Sahota JS, Runge C, Kurtz SM, Lakshmi S, Allcock HR, et al. Novel hydroxyapatite composites as biomaterials. Eng Med Biol Mag. 2003; 22(5): 18-26.
19. Wilkins RM, Kelly CM. The effect of allomatrix injectable putty on the outcome of long applications. Orthopedics. 2003; 26 (5 Suppl): s567-70.
20. Becerra A. Advances in skeletal reconstruction using Bone Morphogenetic Proteins (ed. T. S. Lindholm). World Scientific Publishing Co. 2002; 2: 147-53.
21. Kavanagh P, et al. A rodent model for the investigation of dental implants. JPD. 1985; 54: 252-7.
22. González R, Blardoni F, Maestre H, Pereda O, Pancorbo E, Ciénaga M. Long term results of the Coralline Porous Hydroxyapatite HAP 200 as bone implant’s biomaterial in Orthopedics and Traumatology. Rev Ciencias Biológicas. 2001; 32 (2): 97-101.
1-Doctor en Ciencias Médicas. Especialista de Segundo Grado en Ortopedia y Traumatología. Profesor Titular del I. S. C. M - H.
2-Especialista de Primer Grado en Ortopedia y Traumatología.
3- Doctor en Ciencias Químicas. Investigador Titular.
Correspondencia: Dr. Osvaldo Pereda Cardoso
Dirección particular: Calle 124 A # 2538 e/ 25 y 27. Marianao. Ciudad de La Habana. Cuba. CP-11500. E-mail: pereda@infomed.sld.cu
Recibido: 2 de junio de 2006
Aprobado: 11 de julio de 2006