Meu SciELO
Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Revista Cubana de Ortopedia y Traumatología
versão impressa ISSN 0864-215Xversão On-line ISSN 1561-3100
Rev Cubana Ortop Traumatol v.22 n.2 Ciudad de la Habana jul.-dez. 2008
TRABAJOS DE REVISIÓN
Regulación molecular del cartílago articular en función de las cargas mecánicas y el proceso osteoartrósico: una revisión teórica
Molecular regulation of the articular cartilage depending on the mechanical loads and the osteoarthrosic process: theoretical review
Nancy Stella Landínez ParraI; Juan Carlos Vanegas AcostaII; Diego Alexander Garzón AlvaradoIII
I Máster en Ingeniería Biomédica. Profesora Asistente. Universidad Nacional de Colombia. Facultad de Medicina. Departamento del Movimiento Corporal Humano. Grupo de Modelado y Métodos Numéricos en Ingeniería- GNUM. Carrera 30 No. 45-03, Edif. 471 - Of. 519, Bogotá, Colombia.
II Máster en Ingeniería Biomédica. Ingeniero. Universidad Nacional de Colombia. Facultad de Medicina. Grupo de Modelado y Métodos Numéricos en Ingeniería- GNUM. Carrera 30 No. 45-03, Edif. 407 - Of. 103A, Bogotá, Colombia.
III Doctor en Ciencias. Profesor Asociado. Universidad Nacional de Colombia. Facultad de Ingeniería. Departamento de Ingeniería Mecánica y Mecatrónica. Grupo de Modelado y Métodos Numéricos en Ingeniería- GNUM. Carrera 30 No. 45-03, Edif. 407 - Of. 103A, Bogotá, Colombia.
RESUMEN
Se presenta una revisión de las principales respuestas del cartílago articular frente a las cargas mecánicas. La literatura reporta que los condrocitos manifiestan cambios y expresan moléculas biológicas en respuesta a la compresión o a la presión hidrostática del fluido, lo que puede conllevar cambios bioquímicos en las células y por tanto en el cartílago. Se muestra la relación entre las cargas cíclicas mecánicas, la presión hidrostática y la expresión de un conjunto de proteínas que facilitan el proceso de consolidación del cartílago articular lo que lleva a la alteración de las propiedades características del tejido. Investigaciones actuales en el área, muestran además cómo la expresión del MMP13 y del Cbfa1/Runx2 son mecanismos que favorecen la acción del VEGF, el cual facilita el proceso de osteogénesis. Por otra parte, la expresión del SOX9 favorece la protección del cartílago. Las conclusiones obtenidas a partir del presente trabajo posibilitan futuras investigaciones en el campo de la expresión de genes y otros aspectos bioquímicos involucrados en la respuesta del tejido ante cargas, así como la influencia de estos procesos en el daño del cartílago articular. Igualmente se brindan las bases para plantear investigaciones in vivo o in vitro que profundicen sobre el tema. Este artículo se constituye sobre la base teórica para proponer un modelo matemático del comportamiento del cartílago articular, el que será objeto de otro artículo en este tema por parte de los autores.
Palabras clave: Mecanobiología, cartílago articular, condrocito, factores moleculares, cargas mecánicas, osteoartrosis.
ABSTRACT
A review of the main responses of articular cartilage to mechanical loads was presented , The literature reported that chondrocytes manifested changes and expressed biological molecules in response to compression or to fluid hydrostatic pressure, which can cause biochemical changes in cells and hence in the cartilage. The objective of this review was to present the state-of-the art in the relations between mechanical loads and the damage occurred at articular cartilage-osteoarthritis OA. The relationship among cyclic mechanical loads, the hydrostatic pressure and the expression by a set of proteins that facilitate the process of consolidation of the articular cartilage, leading to altered properties of the tissue was shown. Recent studies in this field show how the MMP13 y del Cbfa1/Runx2 expressions are mechanisms favoring VEGF action and the osteogenesis process. On the other hand, the SOX9 expression supports the cartilage protection. The conclusions of the present paper allow new research work in the field of gene expression and other biochemical aspects involved in the tissue's response to loads as well as the impact of these processes in the articular cartilage damage. Likewise, the fundamentals to plan in vivo or in vitro research works that delve into this topic were offered. This article represents the theoretical basis for a mathematical model of the articular cartilage´s behavior, which will be the subject of another article by the same authors.
Key Words: Mechanobiology, articular cartilage, chondrocyte, molecular factors, mechanical loading, osteoarthrosis.
Régulation moléculaire du cartilage articulaire en fonction des charges mécaniques et du processus ostéoarthrosique: une révision théorique
RÉSUMÉ
Une révision des principales réponses du cartilage articulaire face aux charges mécaniques est présentée dans cet article. La littérature rapporte que les chondrocytes révèlent des changements et libèrent des molécules biologiques en réponse à la compression ou à la pression hydrostatique du liquide, ce qui peut entraîner des changements biochimiques dans les cellules, et par conséquent dans le cartilage. La relation entre les charges cycliques mécaniques, la pression hydrostatique et la libération d'une série de protéines facilitant la consolidation du cartilage -ce qui provoque l'altération des propriétés particulières du tissu- est démontrée. Les recherches actuelles dans ce domaine montrent en plus que les libérations du MMP13 et du Cbfa1/Runx2 sont des mécanismes favorisant l'action du VEGF, ce qui facilite le processus de l'ostéosynthèse. D'autre part, la libération du SOX9 stimule la protection du cartilage. Les conclusions du présent travail encouragent de nouvelles recherches dans le domaine de la libération des gènes et d'autres aspects biochimiques participant à la réponse tissulaire face aux charges, ainsi que l'influence nuisible de ces processus sur le cartilage articulaire. Les bases sur lesquelles les recherches in vivo ou in vitro sont réalisées pour approfondir ce sujet sont aussi apportées ici. Cet article s'appuie sur une base théorique pour proposer un modèle mathématique de comportement du cartilage articulaire, ce qui sera l'objet d'un autre article.
Mots-clés: Biomécanique, cartilage articulaire, chondrocyte, facteurs moléculaires, charges mécaniques, ostéoarthroses.
INTRODUCCIÓN
El cartílago articular es el componente principal que recubre la mayoría de las articulaciones diartrósicas de los seres humanos1 (fig. 1). Corresponde al cartílago hialino y es un componente muy especializado que facilita los movimientos articulares, y que resiste las importantes cargas que se pueden experimentar durante las actividades normales del movimiento humano. A nivel de las articulaciones, el cartílago debe cumplir con dos funciones esenciales: 1) Distribuir las cargas articulares sobre una área amplia, y disminuir así las solicitaciones mantenidas por el contacto de las superficies articulares;2 y 2) permitir el movimiento relativo de las superficies articulares opuestas con mínima fricción y desgaste.3
El grosor de este cartílago en una persona adulta se relaciona con su ubicación. Por ejemplo a nivel de la rodilla, una de las más grandes articulaciones, puede ser de 3 a 4 mm, en tanto que mide entre 1 a 2 mm a nivel de una articulación interfalángica en la mano.4
La carga cíclica es el modo más común de carga en las articulaciones del miembro inferior del ser humano6. Recientemente, se ha despertado mucho interés por estudiar el efecto de las cargas dinámicas repetitivas sobre el cartílago articular, debido a que la fuerza de contacto articular que tiene un patrón repetitivo durante las actividades diarias, tales como caminar y correr.7-8 Seedhom y Wallbridge, reportan que las articulaciones del miembro inferior del ser humano están sujetas a un promedio de entre 1 y 4 millones de ciclos de carga por año.6
Recientes evidencias experimentales indican que estas cargas dinámicas pueden aumentar la actividad de biosíntesis de los condrocitos. De hecho, algunos investigadores han confirmado que la fuerza mecánica aplicada a una articulación puede regular las actividades metabólicas del cartílago articular en vivo.9
Por otra parte, el cartílago articular se puede modificar por diversos aspectos, por ejemplo, el desarrollo y crecimiento endocondral de los huesos. Este es un proceso de múltiples etapas, en donde la adhesión de las células mesenquimales es seguida por la formación de la condensación de células que participan en la condrogénesis.10 Estas células proliferan más tarde y se convierten en condrocitos, que pasan luego a condrocitos maduros y luego a hipertróficos los cuales sintetizan los principales componentes de la matriz extracelular (MEC) del cartílago y, en última instancia, después de su diferenciación terminal, sufren la apoptosis.10
Estos acontecimientos se producen continuamente durante toda la vida y son controlados por factores sistémicos (hormonas) y locales mediadores (citoquinas, factores de crecimiento y factores de transcripción).11 Además la regulación de la morfogénesis por parte de las moléculas biológicas, el desarrollo, mantenimiento y adaptación del tejido cartilaginoso depende en gran medida de las cargas mecánicas.10
Por eso, este artículo presenta el estado del arte de las relaciones entre las cargas mecánicas, los factores hormonales y el daño a nivel del cartílago articular. Se revisa en primera instancia, la respuesta del cartílago articular ante cargas mecánicas y su correlación con la lesión en el tejido. De igual forma se relaciona el efecto de las cargas mecánicas con la expresión del Cbfa1/Runx2 y del Sox9 y su relación para mantener el equilibrio condrogénesis/osteogénesis. Además se revisa la influencia de la metaloproteinasa MMP-13 sobre la degradación del tejido y finalmente, el papel del factor de crecimiento endotelial vascular-VEGF en el proceso del daño articular.
RESPUESTA DEL CARTÍLAGO ARTICULAR ANTE LAS CARGAS
El cartílago corresponde a los tejidos blandos denominados hidratados, los cuales tienen un comportamiento altamente compresible correspondiente a un material bifásico saturado con la posibilidad de evacuación del fluido.12,13
La circulación del fluido intersticial en estos tejidos es determinante tanto en sus propiedades visco-elásticas, como en el mecanismo de lubricación, y es necesario contemplarla en el comportamiento de este tipo de tejidos, ya que el movimiento de este fluido determina el transporte de otras sustancias producto de la actividad celular, tales como morfo-genes y proteínas que desencadenan procesos de diferenciación y mantenimiento de tejidos.14 En este contexto, el cartílago puede soportar cargas mecánicas con condiciones de flujo y desplazamiento en el contorno, de manera adecuada en tanto se le permita realizar deformación de la matriz sólida (MEC) y variaciones en su presión como resultado de la salida del fluido al exterior del tejido.
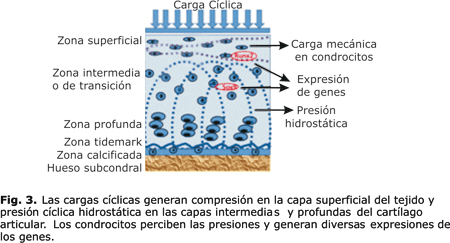
La variación topológica en la apariencia histomorfológica del cartílago articular se ve influido por la carga mecánica local de los condrocitos en las distintas zonas.15 Esta histomorfogénesis del cartílago articular está regulada durante el desarrollo esquelético por fuerzas intermitentes y movimientos impuestos a las articulaciones diartrodiales. En una articulación madura las cargas cíclicas producen una presión cíclica hidrostática de líquidos a través de todo el espesor del cartílago.15
Wong y Carter igualmente plantean, cómo una sutil diferencia en estos procesos celulares puede afectar la micro-morfología y la macro-morfología del cartílago articular al considerar estas cargas a lo largo de toda la vida. Ellos apoyan su hipótesis en experimentos in vivo y ex vivo donde se observaron las vías de transducción de las señales y las cargas que inducen cambios en la síntesis de la matriz, el catabolismo y la expresión de genes.15
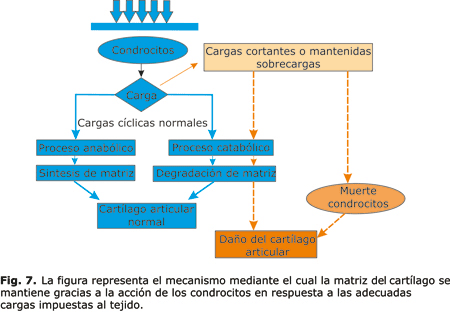
De manera general, y bajo condiciones de equilibrio fisiológico, el cartílago articular adulto está sujeto a un equilibrio entre los procesos anabólicos (síntesis de matriz extracelular) y catabólicos (degradación y pérdida de matriz), regulados, fundamentalmente, por el condrocito en respuesta a una serie de factores en el microambiente de los condrocitos, incluidas las fuerzas físicas o mecánicas, los factores de crecimiento, las citoquinas, el envejecimiento y las lesiones16-18 (fig. 2). Las cargas cíclicas son entonces necesarias para el mantenimiento normal de la función del cartílago articular en las articulaciones diartriósicas.19
En condiciones in vivo, las cargas de compresión aplicadas pueden ser resistidas mediante tensiones en la fase sólida, y también por la generación de presión de fluido. La exudación del líquido intersticial de la matriz cartilaginosa porosa es inhibida por: a) la relativa baja permeabilidad de líquido de la matriz,20 y b) el hecho de que las "superficies libres" para el flujo de fluidos están a cierta distancia del fluido presurizado. El hueso subcondral circundante el cual es impermeable al flujo de fluidos, y el cartílago adyacente confinan al cartílago en el marco de la superficie de contacto y estas fronteras, limitan la deformación mecánica.21 La presurización de fluidos en la superficie reduce la tensión impuesta a la matriz sólida y previene el excesivo desgaste y daño del cartílago.15
La rápida aplicación inicial de fuerzas de contacto articular durante la carga articular provoca un aumento inmediato en la presión del fluido. El aumento de la presión local tiende a exprimir el líquido de la matriz sólida.15 Las cargas inducen una deformación de la matriz del cartílago y causan alteraciones en la presión hidrostática, en la composición iónica y osmótica y en el fluido intersticial. Estos cambios son percibidos por los condrocitos, la respuesta a este estímulo es específica y puede coordinarse para traer cambios en el gen expresión, en la síntesis de proteínas, en la composición de la matriz y finalmente en el desempeño biomecánico del tejido.22 (fig. 3). Sin embargo, estos patrones de expresión bajo estímulos de carga mecánica cíclica y estática de los condrocitos no han sido suficientemente estudiados.22
La cuantificación y caracterización del comportamiento de la deformación del cartílago articular cuando está sometido a una carga cíclica fisiológica es, por consiguiente, de importancia fundamental.23 Es así como la respuesta del tejido ante la deformación cíclica podría ser usada en varias áreas:
1. Para entender mejor las propiedades materiales del cartílago saludable y enfermo, particularmente con referencia al flujo del fluido dentro de la matriz.
2. En el diseño de cartílago artificial como material de reemplazo.
3. Para proporcionar una visión del posible mecanismo del transducción mecánica responsable del incremento de actividad de biosíntesis del condrocito, actividad exhibida por el tejido bajo ciertas condiciones de carga cíclica.
4. Como una línea de base contra la cual comparar la calidad de las reparaciones de defectos del cartílago.23
Diversos autores han descrito valores normales de carga: Wong y otros en 2003,15 reportaron que in vivo, las zonas de carga de los cartílagos articulares están expuestos a las presiones de contacto entre 0 y 20 MPa en frecuencias que van de 0,1 a 10 Hz.; también reportaron que los períodos de carga cíclica rara vez duran más de 1 h y que estos se intercalan con períodos de recuperación parcial y de plena recuperación total de al menos 16 h por día.
Al respecto, D'Lima y otros en su artículo "Human chondrocyte apoptosis in response to mechanical injury"24 reportan como cargas por debajo de 7 MPa y no muestran muerte celular medible, pero cargas por encima de 20 MPa resultan en un extenso daño estructural del tejido. Por su parte, Suh, y otros,25 establecen que los niveles de presiones bajos son los comprendidos entre 5 y 15 MPa, mientras que reporta como altas presiones aquellas comprendidas entre 20 y 50 MPa.
En relación con la presión hidrostática, las investigaciones realizadas por Bachrach y otros, en 1998,26 demuestran que con presiones de hasta 12 MPa no se producen deformaciones de la matriz del cartílago.
Considerando estos aspectos, los condrocitos entonces mantienen y remodelan la matriz del tejido cartilaginoso por un cuidadoso equilibrio de los procesos catabólicos y anabólicos que involucra la expresión de genes como el Sox9, el Cfba1/Runx2 y su objetivo principal son las metaloproteinasas de la matriz (MMPs) y las metaloproteinasas inhibidoras de tejido (TIMPs). La preservación de estas características es crucial para que los condrocitos puedan ser utilizados como fuente celular de reparación del cartílago.27 Por esta razón a continuación se procederá a realizar una revisión detallada de los aspectos más relevantes relacionados con la expresión de estas moléculas y su acción sobre el cartílago.
EL PAPEL DEL SOX9 Y DEL CBFA1/RUNX2 EN EL PROCESO OSTEOARTRÓSICO
La expresión de Cbfa1/Runx2 y del Sox9, los cuales son considerados como los genes maestros de la osteogénesis y la condrogénesis respectivamente, es de especial interés.28 Durante la última década, dentro de los factores importantes en el control del crecimiento y desarrollo del cartílago se ha identificado el Sox-9 como un factor del transcripción expresado como condro-progenitor de las células y los condrocitos diferenciados.10
De manera general, puede decirse que los condrocitos tienen una forma característica de comportarse, ellos secretan una matriz rica en colágeno de tipo II y de proteoglicanos agrecanos, y, en general, expresan una característica genética programada impulsada por el SOX9 y otros factores de transcripción.29
Sin embargo, los niveles de proteína Sox9 han de ser estrictamente controlados para que la condrogénesis normal ocurra. Esto se da a través de un equilibrio auto-regulado entre la degradación y la síntesis de proteínas, mantenida por el K398 del residuo de la proteína Sox930.
El Sox9, regula la expresión del colágeno tipo II, IX y XI, el agrecano, y el COMP en el desarrollo del cartílago.31 La mayoría de las principales proteínas de la matriz del cartílago (tipo II, IX y XI, colágeno, agrecano, COMP) contienen sitios de unión para este factor de transcripción en sus promotores. El Sox9, junto con el Sox5 y el Sox6, son cruciales para la inducción del fenotipo del cartílago durante el desarrollo esquelético, por ejemplo, en Sox9 -/- de ratones mutantes, el cartílago no se forma.
Wong y otros, plantearon que la expresión del Sox9 se regula por presión hidrostática, sin embargo, esta hipótesis no fue confirmada por ellos.31 No obstante, otros estudios han demostrado que niveles fisiológicos de presión hidrostática resultan en una regulación del colágeno tipo II y agrecanos y son condroprotectivos.32
Por otra parte, el Cbfa1/Runx2, además de su papel directo en la formación de hueso, está involucrado en la expresión de sus objetivos sobre la MMP-13, la osteocalcina, y la fosfatasa alcalina en los condrocitos hipertróficos, así como de osteoblastos. El Cbfa1/Runx2 es un importante regulador de la diferenciación de los condrocitos. La sobreexpresión del Cbfa1/Runx2 en el cartílago de ratones transgénicos promovió la maduración de los condrocitos hipertróficos y la osificación endocondral, mientras que la inhibición o la eliminación de la actividad del Cbfa1/Runx2, retardó o bloqueó la maduración de los condrocitos hipertróficos.33,34
Los resultados de los estudios realizados por Kuboki y otros en 2003,35 reportan que los ratones adultos conservaron la expresión del Cbfa1/Runx2 en los condrocitos articulares pre-hipertróficos de la rodilla y el cartílago articular temporo mandibular que se encuentra adyacente al hueso subcondral. Igualmente los resultados a partir de los estudios de Inada y otros, muestran como el Cbfa1 -/- en ratones presentan ausencia de expresión de la MMP-13, calcificación del cartílago e invasión vascular,36 mientras que la sobreexpresión del Cbfa1 acelera la osificación endocondral debido a la maduración precoz de los condrocitos.33 Los estudios de Ueta y otros, también señalan que la activación Cbfa1 de señalización en los condrocitos inmaduros promueve la hipertrofia y la osificación endocondral precoz.33
De igual forma, los hallazgos de Wong, y otros en 200331 sugieren que la señalización Cbfa1/Runx2 podría proporcionar el vínculo molecular entre la carga mecánica y el efecto observado sobre la maduración de los condrocitos; ellos reportan que los esfuerzos de la matriz a partir de la carga cíclica mecánica aplicada a los condrocitos primarios de bovinos por espacio de tres días, incrementó significativamente la expresión de Cbfa1/RUNX2 (1,4 veces) y su objetivo MMP-13 (2,3 veces), en tanto que tres días de presión hidrostática se tradujeron en una importante disminución de la expresión del MMP-13, lo que refuerza la hipótesis de que la presión hidrostática es condroprotectora. A partir de estos resultados, ellos plantean la hipótesis de que la expresión del Sox9 y su objetivo sobre la matriz extracelular puede ser diferencialmente regulada por estos dos tipos de carga.31
Como la actividad del Cbfa1/Runx2 es un factor determinante en la maduración de los condrocitos en la placa de crecimiento, puede ser un punto de referencia de la señalización anormal de los mecanismos que promuevan la iniciación y progresión de la OA. Tomados en conjunto, estos datos indican que el FGF2 probablemente contribuya a la activación del Cbfa1/Runx2 y al aumento de la expresión de la MMP-13 en el cartílago con OA.37
Los estudios de Wong y otros, 2004,37 detectaron por inmuno-histoquímica, un mayor porcentaje de condrocitos con expresión Cbfa1/Runx2 en las articulaciones con OA en comparación con articulaciones de control de edad comparable, pero sin síntomas clínicos de OA. Se encontró que la diferencia es mayor en la zona superficial, mientras que tanto el cartílago con OA como el grupo control exhibieron condrocitos Cbfa1/RUNX2 positivos en la zona profunda adyacente al hueso subcondral.37
El relativo alto nivel de expresión del Cbfa1/Runx2, asociado con OA avanzada, puede activar un programa de gene-expresión en los condrocitos articulares similar al exhibido por los condrocitos hipertróficos en las placas de crecimiento.37 La sobreexpresión de Cbfa1/Runx2 acelera la absorción del calcio y la actividad de la fosfatasa alcalina,33 lo cual puede asociarse con el inicio y la progresión de la OA relacionada entonces, con cambios en la expresión génica de los condrocitos.37 En este sentido Wong y otros, en 2003 reportan como la osificación endocondral es regulada por varios factores entre los que se incluyen los estímulos mecánicos los cuales pueden suprimir o acelerar la maduración de los condrocitos.31
En este mismo contexto, Zelzer reporta que la sobreexpresión del Cbfa1/Runx2 en los condrocitos promueve la expresión del colágeno Tipo X y de la fosfatasa alcalina, y en los fibroblastos promueven la expresión del VEGF.38 De igual forma, durante el proceso denominado de hipertrofia o maduración condrocítica, las células que inducen la calcificación de la matriz, y la matriz calcificada es invadida por vasos sanguíneos y sustituida por hueso.33
EL MMP13 Y LA DEGRADACIÓN DEL CARTÍLAGO
La matriz extracelular es un cartílago saludable que se está remodelando continuamente, aunque de manera lenta. Como se mencionó anteriormente, se trata de un equilibrio entre la degradación enzimática de los componentes de la matriz y la nueva síntesis ejercida por los condrocitos mediante procesos catabólicos y anabólicos.27,39
Las alteraciones en la composición y en las propiedades materiales del cartílago son entonces mediadas por una familia de enzimas degradantes de la matriz, como la metaloproteinasas de la matriz MMP, los agrecanos y el colágeno.40 La MMP13 es entonces, una enzima que degrada la matriz extracelular, e incluye los componentes específicos del cartílago.41 Los miembros de la familia MMP son capaces de degradar prácticamente todos los componentes de la matriz extracelular y se incluye el colágeno y los agrecanos en sus substratos.42
Una variedad de células, entre los que se incluye los condrocitos secretan MMPs y su producción puede ser influida por varios factores, entre ellos factores de crecimiento.41 Sin embargo, esta enzima es principalmente producida por los condrocitos en el cartílago artrítico que induce la destrucción del tejido conectivo43 (fig. 4).
La MMP-13 se expresa en los osteoblastos humanos durante el desarrollo fetal y en los condrocitos hipertróficos. En condiciones normales de tejidos adultos, hay poca o ninguna expresión de MMP-13, pero la enzima es reexpresada en enfermedades donde existe una necesidad de reparación o remodelación de los tejidos. La muy restringida distribución de la MMP-13 en los tejidos normales, junto con su capacidad para degradar el colágeno tipo II y otros componentes de la matriz extracelular, hacen de esta enzima un interesante objetivo (target) en enfermedades artríticas, especialmente en la OA, que es una enfermedad caracterizada por la degradación del cartílago articular.43
Estos condrocitos maduros comienzan a hipertrofiarse y expresan Ihh, un importante factor de crecimiento que regula la expresión de las proteínas morfogenéticas óseas. En las etapas finales de hipertrofia de los condrocitos, la MEC del cartílago crea tabiques entre las columnas de los condrocitos hipertróficos calcificados.44 Se presenta un incremento en la expresión de MMPs (MMP9, MMP13), el factor de crecimiento endotelial vascular - VEGF y el colágeno X, en preparación para la angiogénesis y la osificación. Los condrocitos hipertróficos son sometidos posteriormente a apoptosis, y la invasión vascular se inicia a través de sus lagunas vacantes44 (fig. 5).
Es importante resaltar que las metaloproteinasas y los factores angiogénicos requieren de suficiente flujo sanguíneo para una regeneración ósea óptima. Durante las etapas finales de la osificación endocondral, así como durante la fase de la remodelación, las metaloproteinasas específicas de la matriz degradan el cartílago y el hueso, lo que permite la invasión de vasos sanguíneos.46
ACCIÓN DEL FACTOR DE CRECIMIENTO ENDOTELIAL VASCULAR (VEGF) SOBRE EL CARTÍLAGO ARTICULAR
La regeneración de los tejidos óseos del adulto requiere la intervención oportuna de las células progenitoras esqueléticas en el sitio de la lesión, la diferenciación de estas células en el hueso o el cartílago, y el re-establecimiento de una red vascular para mantener la viabilidad celular. La alteración en cualquiera de estos eventos celulares puede tener un efecto perjudicial sobre el proceso de la reparación esquelética.47,48
Muchos factores locales y sistémicos que se activan durante la curación de fracturas tienen directa o indirecta una función condrogénica, osteogénica y/o funciones angiogénicas.49 Estos factores incluyen miembros de las familias del factor de crecimiento fibroblástico (FGF), la transformación del factor de crecimiento (TGF), la proteína morfogénica ósea (BMP) y el factor de crecimiento endotelial vascular.49
El factor de crecimiento endotelial vascular (VEGF) es una glicoproteína homodimérica que controla la formación y la permeabilidad de los vasos sanguíneos, que actúa específicamente, como una célula mitógena endotelial.50 Los VEGFs son esenciales mediadores de la neo-angiogénesis y de las células endoteliales mitógenas específicas.51
Street y otros52 demostraron que el VEGF es esencial para la angiogénesis normal y adecuada arquitectura del callo y que la reparación de la fractura es reforzada por la administración exógena del VEGF. El VEGF endógeno es un agente clave en la reparación de los huesos, donde su expresión temporal y espacial se corresponde con el patrón observado durante el desarrollo de los huesos largos.52 Por otra parte, la inhibición del VEGF en cultivos de metatarsianos de embriones cartilaginosos retrasó el proceso de osificación.48
Estos hallazgos apoyan la hipótesis de que la invasión de los vasos sanguíneos tiene un papel clave en la reparación de los tejidos, y sugiere que es la producción de VEGF que desencadena la angiogénesis y la osteogénesis que están estrechamente unidas durante la reparación ósea.49
La expresión del VEGF en osteoblastos es inducida por diversos estímulos,49 pero a su vez, el VEGF regula el reclutamiento, la supervivencia y la actividad de los osteoclastos, las células endoteliales y los osteoblastos.52 Estudios anteriores han demostrado que el VEGF endógeno es
importante para la formación del hueso endocondral. El VEGF es expresado antes que los vasos sanguíneos se detecten en el desarrollo de los huesos de ratón, y esta expresión está estrechamente asociada con las células que participan en la formación del hueso (osteoblastos). La inhibición del VEGF conduce a la expansión de la zona hipertrófica, la pérdida de metáfisis y la alteración de los vasos sanguíneos en la formación del hueso trabecular en ratones y monos en desarrollo.49
Se ha observado que el VEGF también desempeña un papel importante en la maduración de los cartílagos y la resorción, es producida por los condrocitos hipertróficos, que inician la cascada de osificación endocondral mediante el reclutamiento y/o la diferenciación de las células osteoclásticas que resorben el cartílago por atracción de los osteoblastos.47,48
Así, durante el desarrollo, el VEGF es esencial para la invasión de los vasos sanguíneos del cartílago hialino, la morfogénesis de la placa de crecimiento, y la remodelación del cartílago.49
LESIÓN DEL CARTÍLAGO ARTICULAR-OSTEOARTROSIS
La OA es una enfermedad articular muy común en todo el mundo. En EE. UU. a comienzos de la década de los noventa se estimó que 37,9 millones de personas padecían algunas de las diversas enfermedades musculoesqueléticas existentes, lo que constituía el 15 % de la población. La OA se presentaba en 21 millones de individuos.53 La OA se caracteriza por la pérdida del cartílago articular acompañado, en cierta medida, por la síntesis de moléculas de la matriz. Estos procesos resultan en cambios morfológicos, mal funcionamiento de la articulación y morbilidad articular.17
La característica principal de la OA es un desequilibrio entre los condrocitos anabólicos y catabólicos. El proceso degenerativo puede iniciarse con la pérdida de proteoglicanos de la MEC, seguida de los trastornos de la red fibrilar colágena, lo cual lleva a la apoptosis/necrosis de la célula y al deterioro funcional del tejido.16
Kurz y otros, reportan que el contenido de proteoglicanos en el tejido, también disminuye con el tiempo en el cartílago lesionado, y el tejido entonces, pierde su capacidad de responder a los niveles fisiológicos de la estimulación mecánica con un aumento de la biosíntesis. En este sentido, el cartílago inmaduro parece ser más vulnerable a la compresión perjudicial que el tejido más adulto.54
La apoptosis parece estar mediada por la activación de la Caspase y especies reactivas del oxígeno.54 Por esa razón, la activación de los mecanismos de defensa antioxidante, así como la inhibición de los factores angiogenéticos y las MMPs podrían ser importantes para regular en la destrucción mecánicamente inducida del cartílago, y podría igualmente sugerirse como posibles intervenciones terapéuticas.54
Como se comentó anteriormente, el cartílago articular expresa el comportamiento bifásico de un material poroelástico y puede soportar cargas de manera adecuada, en tanto, se le permita realizar deformación de su componente sólido (MEC) y variaciones en su presión como resultado de la salida del fluido al exterior del tejido. Los datos obtenidos a partir de simulaciones realizadas por los autores, permiten verificar la teoría del comportamiento bifásico del cartílago articular, propuesta inicialmente por Mow y otros, en 1980,55 y respaldada por diversos autores tales como Haider y otros, 2006,56 Wilson y otros, en 200557, Haider y otros, en 2007,58 Meng y otros, en 2002,59 Wu y otros, en 1997,60 Terada y otros, en 1998,61 Donzelli y otros, en 1998,62 y Donzelli y Spilker, en 1998,63 entre otros (fig. 6).
Como el líquido es exudado, la matriz sólida de la capa superficial consolida y las células en estas regiones experimentan deformaciones de compresión. Dado que el contenido del agua del cartílago es de alrededor del 70 al 80 %, las tensiones de compresión pueden ser sustanciales. Como el agua es desplazada afuera con el líquido exudado, la porosidad de la matriz sólida se reduce, con lo que disminuye aún más la permeabilidad de la matriz sólida y proporciona un efectivo sellado para limitar el resto del líquido dentro de la zona radial del cartílago.64
Además de experimentar unas significativas tensiones normales de compresión de la superficie articular, la acción móvil de la articulación impone tensiones cíclicas de tracción tangencial a la superficie del cartílago a las afueras del área de contacto.65 Con la continuación de la carga cíclica articular puede haber una progresiva consolidación de la matriz del cartílago y una reducción general del espesor de la capa superficial.65
El cartílago articular se encuentra expuesto a una combinación de cargas de compresión, cizalla y tensión.66 Los esfuerzos cortantes incrementan la expresión de factores catabólicos como los MMPs y las interleucinas y disminuyen la de los agrecanos,67,68 lo cual hace que las lesiones mecánicas se consideren un importante inductor de la destrucción del cartílago articular y, por lo tanto, un factor de riesgo para el desarrollo de OA secundaria. La lesión mecánica induce daños en el tejido de la matriz directamente o mediada por los condrocitos de la matriz a través de la expresión de enzimas degradantes, y la reducción de la actividad de biosíntesis como consecuencia del cambio de las propiedades mecánicas del cartílago.54
Los condrocitos tienen la capacidad de detectar una serie de parámetros físicos y responder por una regulación o no regulación de diferentes conjuntos de genes. Las familias de genes que pueden tener miembros mecanosensitivos incluyen las proteínas de la MEC (colágenos, agréganos), las proteínas que regulan el crecimiento y el ciclo celular (ciclinas, Cdks), las citocinas (IL-1, IL-4, IL-6), los factores de crecimiento (TGF-, FGFs), las metaloproteinasas de la matriz (MMPs), y los factores anti-angiogénicos y angiogénicos (VEGFs, CTGF, troponina, hondromodulin).31
La matriz actúa también transmitiendo señales que resultan de fuerzas mecánicas de la superficie articular y los condrocitos responden a estas señales por alteración de la matriz posiblemente a través de la expresión de citoquinas que actúan a través de los mecanismos autocrinos y paracrinos. El mantenimiento de la composición normal del cartílago requiere por tanto, un nivel mínimo de carga y movimiento de la articulación. Sin embargo, una carga y un movimiento repetidos de la articulación de un nivel mayor de lo normal, puede aumentar la actividad sintetizadora de los condrocitos.69
Los detalles de cómo los mecanismos de carga de las articulaciones que deforman la matriz extracelular, influyen en la función de los condrocitos son aún desconocidos, pero la deformación de la matriz produce señales mecánicas, eléctricas y fisico-químicas que pueden tener un papel en la estimulación de los condrocitos.69
Los cambios en el comportamiento de los condrocitos, incluida la remodelación de la matriz, la proliferación y la apoptosis, están asociados con la progresión de la OA, y estos comportamientos son característicos de los condrocitos de maduración y de los de hipertrofia en el desarrollo de las placas de crecimiento.70
Como se expresó anteriormente, la diferenciación de los condrocitos sigue una serie de etapas de madurez que incluyen la proliferación, la pre-hipertrofia, la hipertrofia y la diferenciación terminal. Cada etapa se caracteriza por la expresión de marcadores específicos. Por ejemplo, la indian hedgehog es singularmente expresada en la zona prehipertrófica, el colágeno tipo X, la fosfatasa alcalina y el MMP-13 son marcadores de los condrocitos hipertróficos, y el VEGF y la osteocalcina son marcadores de diferenciación terminal.31
Varios marcadores hipertróficos y de diferenciación terminal proporcionan importantes funciones en la osificación endocondral, que incluyen la ruptura de la matriz del cartílago calcificado e inducen la invasión de células endoteliales y mesenquimales dentro del cartílago calcificado y regularizan la mineralización. El proceso de maduración de los condrocitos se piensa esta bajo la supresión, sobre todo por la influencia inhibitoria de la TGF y la PTHrP.31
La eliminación de las vías inhibitorias o un cambio en el dominio hacia su mejoramiento (por ejemplo, a través de BMPs) puede ser suficiente para acelerar la maduración de los condrocitos hacia la osificación endocondral. Por ejemplo, la maduración de los condrocitos en cartílago articular normal y saludable, puede ser interpretada como una pérdida del constreñimiento en la maduración de los condrocitos.31 La muerte de las células, bien sea como resultado de lesiones o del proceso de envejecimiento, y la consecuente imposibilidad de reparación y mantenimiento del cartílago desempeñan un papel importante en el desarrollo de la OA.16
Por otra parte, se ha planteado la hipótesis de que la carga cíclica mecánica puede desempeñar un importante papel en el desarrollo, y la remodelación de muchas enfermedades de los tejidos del esqueleto, se incluye el cartílago.71,72 Los datos reportados por Wong y otros, en 1999,73 evidencian que la compresión cíclica sobre el cartílago articular de bovinos resultó en una progresiva consolidación de la matriz.
Estudios recientes han informado que la carga estática y cíclica compresiva de diferentes magnitudes, así como los impactos contundentes, resultan en un aumento de la muerte de las células en el cartílago articular y daño de la matriz extracelular74-79 (fig. 7).
Diferentes autores reportan como una fuerza anormal como una inmovilización (desuso), un impacto o una carga mecánica excesiva puede llevar a daños en la matriz y muerte de los condrocitos y resulta que la degradación del cartílago eventualmente puede dar lugar a la osteoartrosis (OA)19,80,81 (fig. 8).
En la literatura se encuentran estudios que reportan efectos catabólicos y anabólicos generados por la carga compresiva, indicando un efecto de remodelando estructural de la matriz recientemente sintetizada a través de la carga.1
Waldman y otros, en el 2006,82 reportan como una sola aplicación de una carga compresiva uniaxial realizada a los condrocitos cultivados in vitro, 24 horas después de sembrados, incrementa el colágeno y la síntesis de proteoglicanos y mejora las propiedades mecánicas del tejido.82
De manera general, la degradación de la matriz extracelular está producida por tres familias de proteasas originadas en el propio condrocito: metaloproteasas, serina proteasas y tiol proteasas. La expresión de varias enzimas degradantes de la matriz entre ellas, las metaloproteinasas de matriz (MMP-1, MMP-2, MMP-3, MMP-9, MMP-13) se incrementan después de una lesión y pueden, en parte, ser reguladas por un factor autocrino vascular de crecimiento endotelial.54
La complejidad de los cambios anabólicos y catabólicos en el desarrollo de la OA ha sido demostrada por estudios in vivo. Un modelo experimental de artrosis en perros mostró que el aumento de la síntesis de proteoglicanos se produjo al inicio de la enfermedad, aunque la degradación acelerada se observó en fases posteriores.83 A partir de esto, Huang y otros, en el 2007,66 consideran que la respuesta celular ante la excesiva carga tensil semejaría los cambios vistos en el modelo animal del cartílago articular de la artritis y que la respuesta podría ser temporalmente modulada por cambios anabólicos y catabólicos exhibidos de una manera secuencial.66
Finalmente es interesante revisar el efecto de la osificación endocondral la cual también está regulada por muchos factores, entre ellos, los estímulos mecánicos, que pueden acelerar o reprimir la maduración de los condrocitos. Modelos matemáticos de la osificación endocondral han sugerido que la tensión (o cizallamiento) puede acelerar la formación de hueso endocondral, lo cual acelera el proceso osteoartrósico, mientras que la presión hidrostática preserva el fenotipo del cartílago.31
Las investigaciones realizadas por Eames y otros en el 2004,84 de ganancia-de-función desarrollados en embriones de pollo sugieren que la diferenciación del ósteo-condro-progenitor procede del equilibrio delicado en los niveles de Sox9 (gen regulador de la formación de cartílago, implicado en la transcripción del control de la diferenciación de condrocitos) y Cbfa1/Runx2, donde un Sox9 de nivel más alto lleva a la condrogénesis y un nivel más alto de Cbfa1/Runx2 lleva a la osteogénesis84 (fig. 9).
DISCUSIÓN
En un esfuerzo por comprender la mecanobiología del cartílago, múltiples investigaciones han desarrollado a lo largo de los últimos años, una variedad de protocolos experimentales in vitro e in vivo que permiten entender y confirmar el comportamiento del cartílago articular ante la imposición de cargas mecánicas.
El normal desarrollo, crecimiento y mantenimiento del tejido cartilaginoso depende de factores mecánicos de carga y bioquímicos como expresión osteoblástica o condroblástica.
Diversos estudios reportan como la deformación de la matriz generada por las cargas mecánicas impuestas facilitan una degradación de la matriz del cartílago y las presiones hidrostáticas son condroprotectoras. De igual forma, algunos autores también reportan como la aplicación de flujo de fluido modula la actividad de la biosíntesis de los condrocitos.85-87
De manera general, el flujo del fluido en el cartílago es sumamente bajo in vivo y es probable que afecte al condrocito por la vía de fenómenos electrocinéticos o del transporte de nutriente convectivo.88-91 Sin embargo, sí el nivel del flujo del fluido es supra-fisiológico también puede resultar en la deformación del condrocito y llevar a la consolidación de la matriz.92
Smith y otros, en 1996,87 observaron el incremento en la síntesis de proteoglicanos después de 48 h de flujo de fluido continuo; no obstante, Hung y otros,67 encontraron una disminución general de la expresión del la aplicación de flujo de fluido continuo. Ellos plantean como una posible explicación para esta diferencia clara, el hecho de que su estudio fue realizado durante tiempos relativamente cortos (2 h) en comparación con las 48 h de tiempo utilizados por Smith y otros, en 1996.85 De donde se puede concluir, al igual que Hall y otros, que la respuesta de los condrocitos cambia dependiendo tanto de la duración como de la magnitud de la presión hidrostática del ambiente.93
Por otra parte, a partir de los hallazgos de Wong y otros, en el 2003,31 se plantea entonces, la hipótesis de que los genes asociados con la hipertrofia y la osificación pueden ser regulados por tensión cíclica y de que los genes asociados con la condrogénesis serían regulados por la presión hidrostática.31
El adecuado equilibrio entre los factores catabólicos y anabólicos permite mantener una adecuada expresión del cartílago articular en condiciones de presión hidrostática fisiológica. Sin embargo, un incremento de la carga cíclica o de la presión hidrostática más allá de las cargas consideradas como fisiológicas a nivel articular (15 a 20 MPa para carga cíclica que genera deformación y 12 MPa para una presión hidrostática)24,26 desencadena un daño a nivel de la matriz con la consiguiente alteración del tejido (fig. 10).
Finalmente, los datos reportados a partir de estudios experimentales realizados por Bachrach y otros, en 1998,26 apoyan la hipótesis de que la matriz sólida del cartílago articular es efectivamente incompresible a niveles fisiológicos de presión. Este hallazgo tiene importantes consecuencias respecto a la capacidad del cartílago para soportar grandes cargas en la articulación y como la presión hidrostática es repartida al interior del tejido. Por último, al considerar que la presión hidrostática genera poca o ninguna deformación de la matriz extracelular y ningún flujo de fluido, se apoya la hipótesis de que los condrocitos son capaces de percibir la presión hidrostática por ellos mismos mediante mecanismos de mecanotrasducción.15,26
Por tanto se hace necesario continuar con los estudios que permitan verificar las condiciones fisiológicas, tanto para la carga cíclica como para la presión hidrostática en el cartílago, al considerar no solamente la magnitud, sino su tiempo de aplicación. Esto permitirá entender los mecanismos del daño articular en función de las cargas mecánicas y de los factores de expresión generados a partir de ellas.
REFERENCIAS BIBLIOGRÁFICAS
1. De Croos JNA, Dhaliwal SS, Grynpas MD, Pilliar RM, Kandel RA. Cyclic compressive mechanical stimulation induces sequential catabolic and anabolic gene changes in chondrocytes resulting in increased extracellular matrix accumulation. Matrix Biology. 2006;25:323-31.
2. Ateshian VC, Wang GAH. A theoretical solution for the frictionless rolling contact of cylindrical biphasic articular cartilage layers. Journal of Biomechanics. 1995;28:1341.
3. Mow VC, Ateshian GA. Lubrication and wear of diarthrodial joints. In: Mow VC, Hayes WC. Ed. Basic Biomechanics. 2nd ed. Philadelphia: Lippincott-Raven; 1997. p. 275-315.
4. Martín Hernández C. Estudio mecánico, histológico, e histomorfométrico del regenerado de cartílago a partir de injertos de periostio invertido. [Tesis Doctoral]. España: Universidad Autónoma de Barcelona; 2002.
5. Buckwalter JA, Marti J. Degenerative Joint Disease. Anatomy and physiology of sinovial joints. Clinical Symposia, Ciba. 1995;47(2).
6. Seedhom BB, Wallbridae NC. Walking activities and wear of prostheses. Annals of the Rheumatic Diseases. 1985;44:838-43.
7. Afoke NYP, Byers PD, Hutton WC. Contact pressures in the human hip joints. Journal of Bone Surgery. 1987;69B:536-41.
8. Krishnan R, Mariner EN, Ateshian GA. Effect of dynamic loading on the frictional response of bovine articular cartilage. Journal of Biomechanics. 2005;38:1665-73.
9. Kiviranta I, Tammi M, Jurvelin J, Saamanen AM, Helminen H. Moderate running exercise augments glycosaminnglycans and thickness of articular cartilage in the knee joint of young beagle dogs. Journal of Orthopaedics Research. 1988;6:188-95.
10. Papadopoulou AK, Papachristou DJ, Chatzopoulos SA, Pirttiniemi P, Papavassiliou AG, Basdra EK. Load application induces changes in the expression levels of Sox-9, FGFR-3 and VEGF in condylar chondrocytes. Federation of European Biochemical Societies. FEBS Letters. 2007;581:2041-6.
11. Takeda S. Central control of bone remodeling. Biochemical and Biophysical Research Communications. 2005;328:697-9.
12. Mow VC, Kwan MK, Lai WM, Holmes MH. A finite deformation theory for nonlinearly permeable soft hydrated biological tissues. Frontiers in Biomechanics. Ed by. Schmid-Schönbein GW, Woo SLY, Zwiefach BW. Springer-Verlag; 1986. p. 153-79.
13. Yang M, Taber LA. The possible role of poroelasticity in the apparent viscoelastic behaviour of passive cardiac muscle. Journal of Biomechanics. 1991;24(7):587-97.
14. Potts JT, Kronenberg HM, Rosenblatt M. Parathyroid hormone: chemistry, biosynthesis, and mode of action. Advances In Protein Chemistry. 1982;35:323-96.
15. Wong M, Carter D. Articular cartilage functional histomorphology and mechanobiology: a research perspective. Bone. 2003;33:1-13.
16. Nesic D, Whiteside R, Brittberg M, Wendt D, Martin I, Mainil-Varlet P. Cartilage tissue engineering for degenerative joint disease. Advanced Drug Delivery Reviews. 2006;58:300-22.
17. Bay-Jensen AC, Andersen TL, Charni-Ben Tabassi N, Kristensen PW, Kjarsgaard-Andersen P, Sandell L, et al. Biochemical markers of type II collagen breakdown and synthesis are positioned at specific sites in human osteoarthritic knee cartilage. Osteoarthritis and Cartilage; 2007.
18. Lotz M, Blanco FJ, Von Kempis J, Dudler J, Maier R, Villiger PM, Geng Y. Cytokine regulation of chondrocyte function. Journal of Rheumatology. 1995;43:104-8.
19. Chahine NO, Ateshian GA, Hung. CT. The effect of finite compressive strain on chondrocyte viability in statically loaded bovine articular cartilage. Biomechanics Model Mechanobiology. 2007;6:103-11.
20. Maroudas A, Bullough P. Permeability of articular cartilage. Nature. 1968;219:219-60.
21. Maroudas A, Bullough P, Swanson S, Freeman M. The permeability of articular cartilage. Journal of Bone and Joint Surgery. 1968;50:166-7.
22. Garima S, Saxenaa RK, Mishra P. Differential effects of cyclic and static pressure on biochemical and morphological operties of chondrocytes from articular cartilage. Clinical Biomechanics. 2007;22:248-55.
23. Barker MK, Seedhom BB. Articular cartilage deformation under physiological cyclic loading-apparatus and measurement technique. Journal of Biomechanics. 1997;30:377-81.
24. D'Lima DD, Hashimoto S, Chen PC, Colwell CW, Lotz MK. Human chondrocyte apoptosis in response to mechanical injury. C.W. Osteoarthritis and Cartilage. 2001;9:712-9.
25. Suh JK, Li SL, Woo Y. Dynamic behavior of a biphasic cartilage modelunder cyclic compressive loading. Journal of biomechanics. 1995;28:357-64.
26. Bachrach NM, Mow VC, Guilak F. Incompressibility of the solid matrix of articular cartilage under high hydrostatic presures. Journal of Biomechanics. 1998;31:445-51.
27. Chung C, Burdick JA. Engineering cartilage tissue. Advanced Drug Delivery Reviews. 2008;60:243-62.
28. Crombrugghe BD, Lefebvre V, Nakashima K. Regulatory mechanisms in the pathways of cartilage and bone formation. Current Opinion in Cell Biology. 2001;13:721-7.
29. Kronenberg HM. Developmental regulation of the growth plate. Nature. 2003;423.
30. Kawakami Y, Rodríguez-León J, Izpisúa Belmonte JC. The role of TGFbs and Sox9 during limb chondrogenesis. Current Opinion in Cell Biology. 2006;18:723-9.
31. Wong M, Siegrist M, Cao X. Cyclic compression of articular cartilage explants is associated with progressive consolidation and altered expression pattern of extracellular matrix proteins. Matrix Biology. 1999;18:391-9.
32. Lane Smith R, Carter DR, Schurman DJ. Pressure and Shear Differentially Alter Human Articular Chondrocyte Metabolism. Clinical Orthop Y aedics and Related Research. 2004;427S:89-95.
33. Ueta C, Iwamoto M, Kanatani N, Yoshida C, Liu Y, Enomoto-Iwamoto M, et al. Skeletal malformations caused by overexpression of Cbfa1 or its dominant negative form in chondrocytes. The Journal of Cell Biology. 2001;153:87-99.
34. Stricker S, Fundele R, Vortkamp A, Mundlos S. Role of Runx Genes in Chondrocyte Differentiation. Developmental Biology. 2002;245:95-108.
35. Kuboki T, Kanyama M, Nakanishi T, Akiyama K, Nawachi H, Yatani H, et al. Cbfa1/Runx2 gene expression in articular chondrocytes of the mice temporomandibular and knee joints in vivo. Archives of Oral Biology. 2003;48:519-25.
36. Inada M, Yasui T, Nomubra S, Miyake S, Deguchi K, Himeno M, et al. Maturational disturbance of chondrocytes in Cbfa1-deficient mice. Developmental Dynamics. 1999;214:279-90.
37. Wang X, Manne PA, Horner A, Shum BR, Tuan RS, Nuckolls GH. Regulation of MMP-13 expression by RUNX2 and A. FGF2. Osteoarthritic cartilage. Osteoarthritis and Cartilage. 2004;12:963-973.
38. Zelzer E, Glotzer DJ, Hartmann C, Thomas D, Fukai N, Soker S, et al. Tissue specific regulation of VEGF expression during bone development requires Cbfa1/Runx2. Mechanisms of Development. 2001;106:97-106.
39. Jenniskens YM, Koevoet W, de Bart ACW, Weinans H, Jahr H, Verhaar J, et al. Biochemical and functional modulation of the cartilage collagen network by IGF1, TGFb2 and FGF2. Osteoarthritis and Cartilage. 2006;14:1136-46.
40. Pelletier JP, Martel-Pelletier J, Malemud CJ. Canine osteoarthritis: Effects of endogenous neutral metalloproteoglycanases on articular cartilage proteoglycans. Journal of Orthopaedic Research. 1998;6:379-88.
41. Tchetina EV, Squires G, Poole AR. Increased type II collagen degradation and very early focal cartilage degeneration is associated with upregulation of chondrocyte differentiation related genes in early human articular cartilage lesions. Journal of Rheumatology. 2005;32:876-86.
42. Hansen HB, Proteolytic remodeling of extracellular matrix. Current Opinion in Cell Biology. 1995;p.7:728-35.
43. Tardif G, Reboul P, Pelletier JP, Pelletier JM. Ten years in the life of an enzyme: the story of the human MMP-13 (collagenase-3). Mod. Rheumatology. 2004;14:197-204.
44. Carter DR, Wong M. Modelling cartilage mechanobiology. Phil. Trans. Royal Society Lond. B. 2003;358:1461-71.
45. Baron R. Anatomy and ultrastructure of bone - histogenesis, growth and remodeling. 2006; [Consultado el 11 de Abril de 2008]. Disponible en: http://www.endotext.org/.../parathyroid1/index.html
46. Gerstenfeld LC, Cullinane DM, Barnes GL, Graves DT, Einhorn TA. Fracture healing as a post-natal developmental process: molecular, spatial, and temporal aspects of its regulation. Journal of Cellular Biochemistry. 2003;88:873-84.
47. Colnot C, Thompson T3, Miclau Z, Werb Z, Helms JA. Altered fracture repair in the absence of MMP9. Development. 2003;130:4123-33.
48. Maes C, Carmeliet P, Moermans K, Stockmans I, Smets N, Collen D, et al. Impaired angiogenesis and endochondral bone formation in mice lacking the vascular endothelial growth factor isoforms VEGF164 and VEGF188. Mechanisms of Development. 2002;111:61-73.
49. Carano RAD, Filvaroff EH. Angiogenesis and bone repair. Drug Discovery Today. 2003;8(21):980-9.
50. Helmlinger G, Endo M, Ferrara N, Hlatky L, Jain RK. Formation of endothelial cell networks. Nature. 2000;405:139-41.
51. Ferrara N, Davis-Smyth T. The biology of vascular endothelial growth factor. Endocrine Reviews. 1997;18:4-25.
52. Street J, Bao M, de Guzmán L, Bunting S, Peale FW, Ferrara N, et al. Vascular endothelial growth factor stimulates bone repair by promoting angiogenesis and bone turnover. Proc Natl Acad Sci. 2002;99:9656-61.
53. Lawrence RC, Helmick ChG, Arnett FC. Estimates of the prevalence of the arthritis and selected musculoskeletal disorders in the United States. Arthritis Rheum. 1998;41:2213-8.
54. Kurz B, Lemke AK, Fay J, Pufe T, Grodzinsky AJ, Schûnke M. Pathomechanisms of cartilage destruction by mechanical injury. Annals of Anatomy. 2005;187:473-85.
55. Mow UVC, Kuei SC, Lai WM, Armstrong CG. Biphasic creep and stress relaxation of articular cartilage in compression: theory and experiments. Journal of Biomechanical Engineering. 1980;102:73-84.
56. Haider RC, Schugart RC. Enumerical method for the continuous spectrum biphasic poroviscoelastic model of articular cartilage. Journal of Biomechanics. 2006;39:177-83.
57. Wilson W, van Donkelaar CC, van Rietbergen R, Huiskes R. Fibril-reinforced poroviscoelastic swelling model for articular cartilage. B Journal of Biomechanics. 2005;38:1195-1204.
58. Haider MA, Guilak F. Application of a three-dimensional poroelastic BEM to modelling the biphasic mechanics of cell-matrix interactions in articular cartilage. Computer methods in applied mechanics and engineering. 2007;196:2999-3010.
59. Meng XN, LeRoux MA, Laursen TA, Setton LA. A nonlinear finite element formulation for axisymmetric torsion of biphasic materials. International Journal of Solids and Structures. 2002;39:879-95.
60. Wu JZ, Herzog W, Epstein M. An improved solution for the contact of two biphasic cartilage layers. J. Biomechanics. 1997;30(4):371-5.
61. Terada K, Ito T, Kikuchi N. Characterization of the mechanical behaviors of solid-fluid mixture by the homogenization method. Computer methods in applied mechanics and engineering. 1998;153;223-57.
62. Donzelli PS, Spilker RL, Ateshian GA, Mow VC. Contact analysis of biphasic transversely isotropic cartilage layers and correlations with tissue failure. Journal of Biomechanics. 1998;32:1037-47.
63. Donzelli PS, Spilker RL. A contact finite element formulation for biological soft hydrated tissues. Computer methods in applied mechanics and engineering. 1998;153:63-79.
64. Setton LA, Tohyama H, Mow VC. Swelling and Curling Behaviors of Articular Cartilage. Journal of Biomechanical Engineering. 1998;120:355-361.
65. Askew MJ, Mow VC. The biomechanical function of the collagen fibril ultrastructure of articular cartilage. Journal of Biomechanics Engineering. 1978;100:105-15.
66. Huang J, Ballou LR, Hasty KA. Cyclic equibiaxial tensile strain induces both anabolic and catabolic responses in articular chondrocytes. Gene. 2007;404:101-9.
67. Hung CT, Henshaw DR, Wang CC, Mauck RL, Raia F, Palmer G, et al. Mitogen-activated protein kinase signaling in bovine articular chondrocytes in response to fluid flow does not require calcium mobilization. Journal of Biomechanics. 2000;33:73-80.
68. Jin G, Sah RL, Li YS, Lotz M, Shyy JY, Chien S. Biomechanical regulation of matrix metalloproteinase-9 in cultured chondrocytes. Journal of Orthopaedics Researh. 2000;18:899-908.
69. Buckwalter JA, Mankin MD. Articular cartilage, part I: Tissue design and chondrocyte matrix interactions. Journal of Bone and Joint Surgery; 1979;600-11(1):997.
70. Shum L, Nuckolls G. The life cycle of chondrocytes in the developing skeleton. Arthritis Research. 2002;4(94):106.
71. Carter D, Wong M. The role of mechanical loading histories in the development of diarthrodial joints. Journal of Orthopaedics Research. 1988;6:804-16.
72. Wong M, Carter D. Mechanical stress and morphogenetic endochondral ossification of the sternum. Journal of Bone Jt Surgery. 1988;70(A):992-1000.
73. Wong M, Siegrist M, Cao X. Cyclic compression of articular cartilage explants is associated with progressive consolidation and altered expression pattern of extracellular matrix proteins. Matrix Biology. 1999;18:391-9.
74. Chen CT, Burton-Wurster N, Borden C, Hueffer K, Bloom SE, Lust G. Chondrocyte necrosis and apoptosis in impact damaged to articulate cartilage. Journal of Orthopaedics Research. 2001;19(4):703-11.
75. Chen CT, Bhargava M, Lin PM, Torzilli PA. Time, stress, and location dependent chondrocyte death and collangen damage in cyclically loaded to articulate cartilage. Journal of Orthopaedics Research. 2003;21(5):888-98.
76. Torzilli PA, Grigiene R, Borrelli J, Helfet DL. Effect of impact lauds on to articulate cartilage: Cell metabolism and viability, and matrix water content. Journal of Biomechanical Engineering. 1999;121(5):433-41.
77. Ewers BJ, Dvoracek-Driksna D, Orth MW, Haut RC. The extent of matrix damage and chondrocyte death in mechanically traumatized to articulate cartilage explants depends on rate of loading. Journal of Orthopaedics Research. 2001;19(5):779-84.
78. Quinn TM, Allen RG, Schalet BJ, Perumbuli P, Hunziker EB. Matrix and cell injury due to sub-impact loading of adult bovine to articulate cartilage explants: effects of strain rate and peak stress. Journal of Orthopaedics Research. 2001;19(2):242-9.
79. Lucchinetti E, Adams CS, Horton WE Jr, Torzilli PA. Cartilage viability after repetitive loading: a preliminary report. Osteoarthritis and Cartilage. 2002;10(1):71-81.
80. Brandt KD. Insights into the natural history of osteoarthritis provided by the cruciate-deficient dog: an animal model of osteoarthritis. Annals of the New York of Sciences. 1994;732:199-205.
81. Jin G, Sah RL, Li YS, Lotz M, Shyy JY-J, Chien S. Biomechanical Regulation of Matrix Metalloproteinase-9 in Cultured Chondrocytes. Journal of Orthopaedic Research. 2000;18:899-908.
82. Waldman SD, Couto DC, Grynpas MD, Pilliar RM, Kandel RA. A single application of cyclic loading can accelerate matrix deposition and enhance the properties of tissue-engineered cartilage. Osteoarthritis and Cartilage. 2006;14:323-30.
83. Brandt KD, Braunstein EM, Visco DM, O'Connor B, Heck D, Albrecht M. Anterior (cranial) cruciate ligament transection in the dog: a bona fide model of osteoarthritis, not merely of cartilage injury and repair. Journal of Rheumatology. 1991;18:436-46.
84. Eames BF, Sharpe PT, Helms JA. Hierarchy revealed in the specification of three skeletal fates by Sox9 and Runx2. Developmental Biology. 2004;274:188-200.
85. Mohtai M, Gupta MK, Donlon B, Ellison B, Cooke J, Gibbons G, et al. Expression of interleukin-6 in osteoarthritic chondrocytes and efects of flow-induced shear on this expression in normal human chondrocytes in vitro. Journal of Orthopaedic Research. 1996;14:67-73.
86. Das P, Schurman DJ, Smith RL. Nitric oxide and G proteins mediate the response of bovine articular chondrocytes to fluid induced shear. Journal of Orthopaedic Research. 1997;15:87-93.
87. Smith RL, Donlon BS, Gupta MK, Mohtai M, Das P, Carter DR, et al. Efects of fluid-induced shear on articular chondrocyte morphology and metabolism in vitro. Journal of Orthopaedic Research. 1996;13:824-31.
88. Buschmann MD, Kim YJ, Wong M, Frank E, Hunziker EB,Grodzinsky AJ. Stimulation of aggrecan synthesis in cartilage explants by cyclic loading is localized to region of high interstitial fluid flow. Archives of biochemistry and Biophysics. 1999;366:1-7.
89. Frank EH, Grodzinsky AJ. Cartilage electromechanics-ielectrokinetic transduction and the efects of electrolyte pH and ionic strength. Journal of Biomechanics. 1987;20:615-27.
90. Frank EH, Grodzinsky AJ. Cartilage electromechanicsm-II. a continuum model of cartilage electrokinetics and correlation with experiments. Journal of Biomechanics. 1987;20:629-39.
91. García AM, Frank EH, Grimshaw PE, Grodzinsky AJ. Contributions of fluid convection and electrical migration to transport in cartilage: relevance to loading. Archives of Biochemistry and Biophysics. 1996;333:317-25.
92. Lai WM, Mow VC. Drag induced compression of articular cartilage during a permeation experiment. Biorheology. 1980;17:111-23.
93. Hall AC, Urban JPG, Gehl KA. The effects of hydrostatic pressure on matrix synthesis in articular cartilage. Journal of orthopaedics Research. 1991;9:1-10.
Recibido: 12 de septiembre de 2008.
Aprobado: 20 de octubre de 2008.
Dra. Nancy Stella Landínez Parra. Universidad Nacional de Colombia. Facultad de Medicina. Departamento de Movimiento Corporal Humano. Maestría en Ingeniería Biomédica. Grupo de Modelado y Métodos Numéricos en Ingeniería-GNUM. Carrera 30 No. 45-03, Edif. 471-Of. 519, Bogotá, Colombia. E-mail: nslandinezp@unal.edu.co