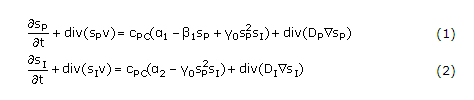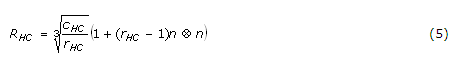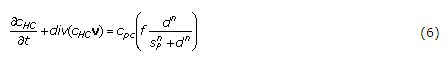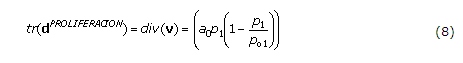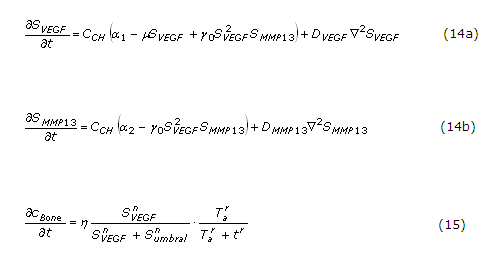Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Ortopedia y Traumatología
versión impresa ISSN 0864-215X
Rev Cubana Ortop Traumatol vol.27 no.1 Ciudad de la Habana ene.-jun. 2013
ARTÍCULO ESPECIAL
Una propuesta teórica y conceptual para el modelado de la aparición de centros de osificación en diferentes tipos de huesos planos y largos
Theoretical and conceptual proposal for appearance modeling of ossification centers in different types of flat and long bones
Une proposition théorique et conceptuelle pour le modelage des centres d'ossification dans différents types d'os plats et longs
Prof. Luis Fernando Calixto, Prof. María Lucía Gutiérrez, Prof. Diego A. Garzón Alvarado 0.
Universidad Nacional de Colombia, Colombia.
RESUMEN
Se mostró un contexto de trabajo sobre el modelado de procesos de formación endocondral en cualquier tipo de osificación presente en los huesos del cuerpo. Siguiendo la suposición de que PTHrP (hormona paratiroidea) e Ihh (proteína Indian hedgehog) forman un bucle regulatorio bioquímico para el proceso endocondral, y BMP2 (proteína morfogenética de hueso-2) y Noggin en el intramembranoso, se implementaron los mecanismos regulatorios de este proceso. Para ello se utilizó un conjunto de ecuaciones de reacción-difusión ampliamente usadas en morfogénesis, en las que los factores bioquímicos se suponen secretados por células precursoras, mesenquimales y condrocitos, en el caso intramembranoso y endocondral, respectivamente. Se concluyó que la solución condujo a patrones denominados de Turing, que representan estos procesos de osificación de una forma muy aproximada.
Palabras clave: osificación, endocondral, intramembranosa, esqueleto.
ABSTRACT
A work context on the modeling of endocondral formation process in any type of ossification present in the bones of the human body was shown. Assuming that PTHrP and Ihh form a biochemical regulatory loop for the endocondral process and BMP2 and Noggin for the intramembranous one, regulatory mechanisms for this formation process were implemented. For this purpose, a set of widely used diffusion reaction equations in morphogenesis were used in which the biochemical factors are supposed to be secreted by precursor cells, mesenchymal and chondrocytes in the case of intramembranous and chondroidal respectively. It was concluded that the solution led to the denominated Turing patterns which represent these ossification processes in a highly estimated form.
Key words: ossification, endocondral, intramembranous, skeleton.
RÉSUMÉ
Dans ce travail, un modelage du processus de formation endochondrale dans tout type d'ossification des os du corps est présenté. Supposant que PTHrP (peptide lié à l'hormone parathyroïdienne) et Ihh (protéine Indian Hedgehog) forment une boucle biochimique régulatrice pour le processus endochondral, et BMP2 (protéine morphogénétique osseuse-2) et Noggin pour le processus endomembraneux, des mécanismes régulateurs se produisent alors dans ce processus. C'est pourquoi, un groupe d'équations de réaction-diffusion largement utilisées dans la morphogenèse, où les facteurs biochimiques sont apparemment sécrétés par des cellules souches, mésenchymateuses et chondrocytes, a été utilisé. On a conclu que la solution a conduit à des modèles dits de Turing, représentant ces processus d'ossification de manière très similaire.
Mots clés: ossification, endochondral, endomembraneux, squelette.
INTRODUCCIÓN
La morfogénesis de tejidos biológicos es el resultado de interacciones complejas entre la evolución de las especies y su adaptación individual al medio.1 Las células son los principales actores de tales eventos, desempeñando una serie de procesos coordinados, entre los que se destacan la proliferación, diferenciación, migración, apoptosis y producción de tejido. Estos procesos son controlados por diferentes tipos de señales (bioquímicas, bioelectromagnéticas, biomecánicas) y su interacción entre sí, con la célula y con el medio.1
La complejidad intrínseca de los mecanismos mencionados y los agentes involucrados, junto con el conocimiento insuficiente de muchos de ellos, impiden su modelamiento computacional completo. Sin embargo, el alcance de los métodos computacionales es hoy día suficiente para comprobar hipótesis fundamentales, para entender las implicaciones de suposiciones biofísicas, proporcionar contra ejemplos y además explorar nuevas ideas que son usadas para diseñar nuevos experimentos.1
En particular, la morfogénesis del tejido óseo es un tema de constante investigación por las implicaciones científicas y clínicas que tiene el conocimiento alrededor de estos mecanismos de osificación, la cual es uno de los procesos esenciales en biología del desarrollo del hueso y en morfogénesis. Este proceso tiene características comunes con otros de cicatrización de los tejidos humanos, con la medicina regenerativa y con la ingeniería de tejidos. Existen dos tipos de osificación, la intramembranosa (o directa) y la endocondral (o indirecta).
La osificación intramembranosa (o directa) tiene lugar directamente en el tejido conectivo.2 Por este proceso se forman los huesos planos de la bóveda del cráneo: hueso frontal, hueso occipital, hueso parietal y hueso temporal. En este caso el tejido mesenquimal se condensa en conjuntivo vascularizado. En este las células están unidas por largas prolongaciones y en los espacios intercelulares se depositan haces de colágeno orientados al azar que quedan incluidos en la matriz.2
La formación de los centros de osificación y el desarrollo de los huesos provenientes del proceso intramembranoso están mediados por señales bioquímicas. Estas señales han sido ampliamente estudiadas para determinar su influencia en el desarrollo craneal. Por ejemplo, Holleville y otros,3 realizaron experimentos sobre aves para determinar los factores genéticos involucrados en la formación del neurocráneo membranoso. En especial, en aquel artículo se encontró el efecto de diferenciación a osteoblasto que tiene la proteína morfogenética de hueso-2 (BMP2).
De otro lado, la osificación endocondral consiste en el reemplazo del cartílago hialino por hueso. En huesos largos, es iniciada en el denominado centro de osificación primario ubicado en la mitad de la diáfisis. El frente de osificación avanza hacia la epífisis, simultáneamente con el crecimiento longitudinal del hueso. A continuación, se desarrollan los centros secundarios de osificación que se forman después de la natalidad dentro de cada condroepífisis.4-9
Hasta el momento, existen diferentes teorías que han sido propuestas para explicar los procesos de osificación endocondral.5,8,10-13 Algunas de ellas suponen que la hormona paratiroidea (PTHrP) y la proteína Indian hedgehog (Ihh) son los principales factores responsables para la regulación de la tasa de hipertrofia de condrocitos.5 PTHrP retarda la hipertrofia mientras que Ihh la promueve.5,13 Kronenberg,5 así como Provot y Schipani8 proponen que estos dos factores paracrinos forman un bucle regulatorio, donde Ihh promueve la producción de PTHrP mientras que PTHrP inhibe la secreción de Ihh. Por otra parte, los condrocitos hipertrofiados son las principales células reguladoras en formación ósea por estimular la mineralización en la matriz circundante y por atraer vasos sanguíneos. Con estos últimos, se atraen los precursores de las células óseas (osteoblastos y osteoclastos)14-16. Este proceso está regulado por diferentes sustancias como el factor de crecimiento endotelial vascular (VEGF).17-20 Por lo tanto, la hipertrofia de condrocitos es por consiguiente la clave para la formación de los centros primarios y secundarios de osificación.6,10
Siguiendo la suposición de que PTHrP e Ihh forman un bucle regulatorio bioquímico5,8 para el proceso endocondral, y BMP2 y Noggin en el intramembranoso, en este trabajo se implementan esos mecanismos regulatorios. Para esto se utilizó un conjunto de ecuaciones de reacción-difusión21,22 ampliamente usadas en morfogénesis, en las que los factores bioquímicos se suponen secretados por células precursoras, mesenquimales y condrocitos, en el caso intramembranoso y endocondral, respectivamente.
Los modelos aquí propuestos son similares a aquellos que utilizan ecuaciones clásicas de reacción-difusión, pero se diferencia en el hecho de que la síntesis de los factores paracrinos es debida a la población de células mesenquimales y condrocitos, en el caso de osificación intramembranosa y endocondral, respectivamente. Esta suposición implica que los parámetros no son homogéneos en el espacio, complicando el análisis matemático y el correspondiente proceso de solución.21-23 No obstante, se obtienen soluciones estables de estos conjuntos de ecuaciones bajo un rango suficientemente amplio de parámetros, condiciones iniciales y de contorno. La solución conduce a patrones denominados de Turing, que representan estos procesos de osificación de una forma muy aproximada.
Estas características permiten plantear la hipótesis en la cual los patrones (de aparición y localización) de los centros de osificación pueden ser interpretados, desde un punto de vista matemático, como los patrones espaciales asociados a las características de inestabilidad de Turing. Esto significa que son soluciones estables en el tiempo con un arreglo espacial típico asociado a cada rango de parámetros del modelo.24-26 Estas soluciones pueden ser identificadas con concentraciones locales estables de los agentes químicos que señalizan los procesos de diferenciación celular e hipertrofia en cada caso.
En adelante, se presenta el modelo matemático utilizado capaz de predecir el origen de los centros de osificación primarios y secundarios, en huesos largos, regulados por las concentraciones espaciales de PTHrP e Ihh, la población de condrocitos y la geometría de la epífisis (tamaño y forma). Adicionalmente se muestra un modelo de formación de hueso esponjoso primario a partir de la metalo-proteinasa 13 (MMP13) y factor de crecimiento endotelial vascular (VEGFS). En este modelo, el VEGF atrae la vascularización del cartílago hipertrófico y permite la colonización y formación de trabéculas primarias de hueso. Por último se muestra un modelo de formación de los centros primarios de osificación durante la formación del cráneo intramembranoso a partir de BMP2 y Noggin. Por tanto, el objetivo fundamental del trabajo es mostrar un contexto de trabajo sobre el modelado de procesos de formación endocondral en cualquier tipo de osificación presente en los huesos del cuerpo.
MÉTODOS
Simulación del desarrollo inicial de un hueso largo: osificación endocondral
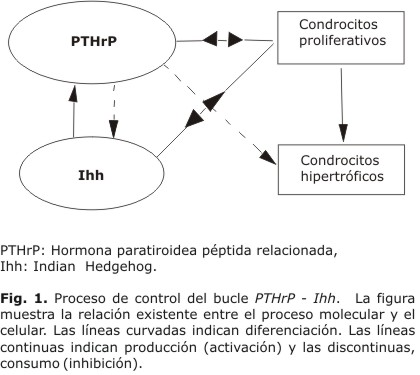
En Garzon-Alvarado y otros27 se exploraron la hipótesis de que la osificación endocondral es controlada por un proceso hormonal de reacción-difusión existente entre el Ihh y PTHrP. De esta forma se distinguen dos procesos involucrados en el crecimiento que interactúan continuamente, el proceso hormonal o molecular y el proceso celular (Fig. 1). El proceso molecular se produce en cada condrocito prehipertrofo y tiene en cuenta el bucle PTHrP-Ihh, de tal forma que en presencia de PTHrP el condrocito consume (inhibe) Ihh (linea discontinua) y en presencia de Ihh el condrocito produce (activa) PTHrP (línea continua). Además, estos factores moleculares regulan la evolución de las poblaciones celulares, a modo de señales biológicas, de manera que donde existe PTHrP e Ihh se promueve la proliferación de condrocitos (mostrado como línea continua desde el PTHrP e Ihh hacia las células proliferativas [PC]) y donde existe PTHrP se retrasa la hipertrofia (línea discontinua desde PTHrP a células hipertróficas [HC]). Además, en la situación inicial se supone que el cartílago está fundamentalmente compuesto por células proliferativas,28 y que existe una concentración inicial de PTHrP en la epífisis debida a la producción de este factor por las células pericondriales.
En aquel trabajo se consideró que el crecimiento del tejido y su cambio de forma y tamaño es consecuencia del proceso de proliferación (hiperplasia) y del aumento de tamaño de las células en su etapa hipertrófica.29-31 El cambio de forma es debido a las diferencias de crecimiento intrínsecas a los procesos de proliferación e hipertrofia y a su diferente ubicación espacial. Durante este proceso se constituye la formación columnar de células apiladas y se produce un crecimiento sobre todo isótropo. Por otro lado, el proceso de hipertrofia celular consiste en el incremento de tamaño de forma anisótropa de cada una de las células apiladas que constituye la formación columnar, lo que lleva a un crecimiento claramente anisótropo. Este proceso se produce justamente debajo de la placa de crecimiento.
Por lo tanto, el balance de los factores hormonales, Ihh y PTHrP se describe mediante las ecuaciones siguientes:
Donde:
Sp y SI: concentración de PTHrP e Ihh, respectivamente.
Dp y DI: coeficientes de difusión de PTHrP e Ihh, respectivamente.
CPC: concentración de condrocitos proliferativos.
v: velocidad de crecimiento local del hueso.
a1 y a2: términos fuente constantes.
ß1: constante que cuantifica la tasa de degradación de PTHrP.
g0: constante de reacción que indica el control no lineal existente en el interior de la célula por la presencia de los dos factores.
Cabe resaltar que todas las anteriores constantes podrían ser también consideradas funciones de las concentraciones moleculares de otros factores adicionales, como BMP (bone morphogenetic proteins), FGF, RUNX21 y otras.29,32 No obstante, esto no fue considerado en aquel trabajo. Las anteriores ecuaciones son similares a las descritas por Schnakenberg,33-35 las cuales se han utilizado ampliamente en sistemas biológicos.
Desde el punto de vista de los condrocitos proliferativos, durante el desarrollo endocondral exhiben una clara proliferación direccional.28 Esta proliferación lleva a una distribución anisotrópica de las células mitóticas en esta zona. Como una primera aproximación se supone que la distribución puede ser descrita como un tensor estructural de segundo orden, dado por:
Obsérvese que CPC= det(RPC) y rPC es la relación existente entre el número de células en la dirección de mitosis preferencial n (dirección axial del hueso en crecimiento) y cualquier dirección ortogonal a esta.
Además, se supone que el único movimiento de los condrocitos proliferantes es dado por el crecimiento del entorno local donde se encuentran. Por lo tanto, la concentración celular de células proliferativas viene dada por la expresión siguiente:
Donde:
v: velocidad local de crecimiento del hueso.
a0: frecuencia de mitosis.
P01: parámetro adimensional que representa la capacidad límite para proliferar.
a1 y a2: constantes que cuantifican la influencia del PTHrP e Ihh sobre la proliferación.
f: frecuencia de diferenciación de células proliferativas a hipertróficas.
![]() : función que especifica la concentración a la cual se produce la hipertrofia (definida por el valor umbral d), en términos de la concentración de PTHrP y de la constate n.
: función que especifica la concentración a la cual se produce la hipertrofia (definida por el valor umbral d), en términos de la concentración de PTHrP y de la constate n.
De otro lado, los condrocitos proliferativos sufren apoptosis antes de que el cartílago sea reemplazado por hueso. Durante este proceso de apoptosis, las células incrementan su tamaño y cambian su forma desde la forma cuasi ovoide de la célula proliferativa a la forma esférica de los hipertróficos.28 Este proceso implica un cambio en la concentración de este tipo de células. Para cuantificar esto de nuevo se utiliza un tensor de segundo orden definido como:
Donde:
CHC: concentración de células hipertróficas.
rHC: relación existente entre el número de células en la dirección de crecimiento preferencial n y cualquier dirección ortogonal a esta.
De forma similar al tensor RPC, la evolución temporal del tensor RHC se evalúa a través del cambio temporal de los escalares CHC y rHC de la dirección de crecimiento n. Así, se supone que la concentración de células en etapa hipertrófica viene dada por la ley:
Este conjunto de ecuaciones se complementa con el crecimiento del hueso. Se supone que el crecimiento del hueso se debe a la proliferación e hipertrofia celular durante la osificación endocondral,29,30,32,36,37 lo que se puede escribir como:
Donde:
dPROLIFERACION y dHIPERTROFICO son los tensores de velocidad de deformación debida a proliferación y a hipertrofia, respectivamente.
El proceso de crecimiento por proliferación viene dado por:
Por otra parte, el crecimiento por hipertrofia se debe a que, como se ha comentado antes, las células prehipertróficas o proliferativas apiladas en las columnas de condrocitos presentan en esta fase una forma ovoidal creciendo hacia una forma principalmente esférica,28 por lo que el crecimiento se produce fundamentalmente en la dirección preferencial de crecimiento de columnas n:
Donde:
2s28: distancia entre vértices del eje menor de la elipse (que representa a la célula) antes de alcanzar la hipertrofia.
2R(t): distancia entre vértices del eje menor de la elipse (célula) que se encuentra en crecimiento.
d1: menor concentración lineal (células/mm) de condrocitos hipertróficos en la dirección de crecimiento celular.
tALARGAMIENTO: tiempo de maduración que representa el tiempo requerido para que un condrocito proliferativo progrese a uno completamente hipertrofiado.
R(t): función de crecimiento que se define:
Se ha utilizado el método de los elementos finitos para solucionar las ecuaciones antes descritas. Suponiendo simetría rotacional sin flujo en la dirección circunferencial y simetría alrededor del centro del hueso, se simula un cuarto del cartílago hialino. Las dimensiones del modelo se obtuvieron de datos experimentales correspondientes a la forma y el tamaño de un fémur fetal.38-40 El diámetro de la diáfisis es de 9,6 mm y la longitud de 16 mm.39
El conjunto de ecuaciones presentado antes corresponde a un sistema acoplado, donde los factores moleculares se analizan de forma similar a las ecuaciones de reacción difusión33 con inestabilidad de Turing, y las ecuaciones de proliferación e hipertrofia corresponden a ecuaciones de población.
Simulación de la aparición del centro secundario de osificación
En forma semejante a lo que ocurre en el centro primario de osificación, simulado numéricamente en el apartado anterior, se supone que el PTHrP y el Ihh son responsables de la regulación de la aparición de los condrocitos hipertróficos, correspondientes a un centro de osificación secundaria. Los condrocitos hipertrofiados son los principales reguladores de la formación de hueso, debido a la mineralización de la matriz y a la atracción de vasos sanguíneos, y con ellos los precursores óseos (osteoclastos y osteoblastos), con la aportación adicional de sustancias como el factor de crecimiento endotelial vascular (VEGF).41
Con estos supuestos, se considera que la aparición del centro secundario (localización) puede ser interpretado desde un punto de vista matemático, como el patrón de estado estable asociado a una inestabilidad de Turing, característico de este tipo de ecuaciones.
Descripción del modelo matemático
Para la simulación de la aparición del centro secundario de osificación se utiliza la misma formulación que en el caso del centro primario explicado en el epígrafe anterior, pero incorporando ciertas simplificaciones que facilitan el análisis. Estas simplificaciones son:
- Se considera que en el instante temporal de análisis, la concentración de condrocitos proliferantes es constante e igual al valor de saturación definido previamente.
- Como hipótesis inicial no se considera el crecimiento de la epífisis durante este período de tiempo.
- Se supone que la distribución de condrocitos proliferantes en la epífisis es isótropa.
Todo esto hace que las anteriores ecuaciones queden simplificadas a las tres siguientes:
Las dos primeras ecuaciones hacen referencia al sistema acoplado de reacción difusión, y la tercera tiene en cuenta la hipertrofia de células en el caso de animales cuya masa de cartílago es considerable para la formación de canales sanguíneos (animales grandes), mientras que en el caso de animales pequeños se considera la ecuación como de condrocitos potenciales para la generación del centro secundario de osificación.
Se ha estudiado un fémur humano distal de un centro secundario de osificación, clasificado como un animal grande. La simulación se inicia con condiciones de población de condrocitos proliferativos uniforme, al igual que en el caso del centro primario de osificación. A su vez, la concentración de PTHrP es alta en el pericondrio y de Ihh es alta en el frente de osificación primaria.
Hipótesis sobre la formación del hueso: espongiosa primaria y osificación endocondral
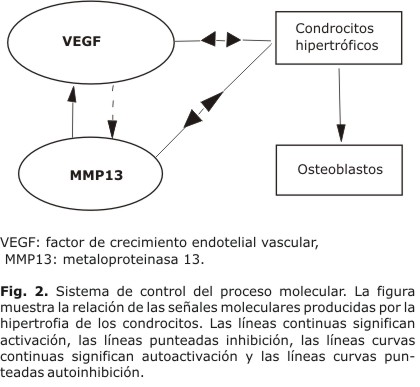
La hipótesis principal se basa en la formación de la espongiosa primaria a partir del tejido con células hipertróficas de condrocitos. En este sentido existe la interacción de dos señales moleculares que se difunden e interactúan en la matriz extracelular cartilaginosa. Para esto se supone la existencia de un sistema reacción-difusión de dos moléculas primordiales, como son el VEGF y la MMP13, que puede conducir a un patrón estable en el tiempo e inestable en el espacio; similar a los patrones presentes en la estructura del hueso trabecular durante la osificación endocondral.
La presencia de MMP13 liberado por los condrocitos hipertróficos permite la degradación de los componentes de la matriz cartilaginosa (colágeno y agrecanos) y da paso a la invasión vascular y del frente de osificación.42-44 Esta invasión vascular es facilitada por la presencia del VEGF expresado por los condrocitos hipertróficos. Esto supone que al existir MMP13 y VEGF en todas las regiones del cartílago epifisial, en aquellas zonas en donde se encuentren altas concentraciones de VEGF se producirá un oportuno control de la invasión de células endoteliales, osteoclastos, condroclastos y osteoblastos en el desarrollo la osificación primaria.45 De igual forma, en donde exista una alta concentración de MMP13 se degradará completamente el cartílago, dando origen a la arquitectura del hueso trabecular. Por lo tanto, se puede suponer que en el desarrollo de la arquitectura de la espongiosa primaria debe existir una regulación del MMP13 por parte del VEGF (mecanismo inhibidor).
Descripción del modelo
El proceso regulatorio que se propone en este modelo se esquematiza en la figura 2, y está basado en un sistema activador-sustrato. El proceso indica que existe un lazo de control entre el VEGF (factor activador) y el MMP13 (sustrato). El VEGF se autoactiva e inhibe la producción de MMP13 al detener el proceso de degradación y dando paso a la mineralización de la matriz de cartílago remanente.45 Por otro lado se supone que el MMP13 se autoinhibe pero activa la producción de VEGF. A este lazo se le conoce como sistema de retroalimentación positiva. El VEGF ayuda a la invasión vascular y traerá consigo las células osteogénicas que permiten la construcción de la espongiosa primaria. Se ha observado que este proceso genera trabéculas regulares y patrones altamente repetibles durante el proceso de osificación, similares a los hallados en los patrones de Turing.46
El mecanismo regulatorio es modelado por medio de ecuaciones de reacción-difusión, donde el término de reacción (síntesis de factores extracelulares solubles) es considerado dependiente de la concentración de los reactantes y de la presencia de los condrocitos hipertróficos. De acuerdo con esto, la hipótesis se sustenta en que el origen de los patrones presentes en la espongiosa primaria, podrían corresponder, desde un punto de vista matemático, a los patrones que ocurren en el espacio de Turing cuando dos reactantes químicos interactúan.
La definición de las relaciones indicadas en la figura 2 puede ser cuantificada por medio de ecuaciones, que establecen cambios locales de los factores extracelulares solubles, y en la concentración de sangre:
Donde:
CHC: concentración de condrocitos hipertróficos.
SVEGF, SMMP13: representan las concentraciones de VEGF y MMP13, respectivamente.Los restantes son parámetros del modelo:
a1 y a2: términos que cuantifican la producción de cada factor molecular por los condrocitos hipertróficos.
µ: constante que cuantifica la inhibición la producción de VEGF por su exceso.
g0: regula la interacción no lineal entre la concentración de MMP13-VEGF cuantificando la concentración o inhibición de cada factor molecular.
DVEGF y DMMP13: son los coeficientes de difusión del VEGF y MMP13, respectivamente.
En la interpretación biológica de las anteriores ecuaciones el término ![]() representa la activación no lineal de SVEGF (producción de VEGF por la presencia de MMP13) y el consumo no lineal de SMMP13 (por la presencia de VEGF). La ecuación (23c) representa la activación de la tasa de producción de hueso por la presencia de altas cantidades de VEGF. En esta ecuación
representa la activación no lineal de SVEGF (producción de VEGF por la presencia de MMP13) y el consumo no lineal de SMMP13 (por la presencia de VEGF). La ecuación (23c) representa la activación de la tasa de producción de hueso por la presencia de altas cantidades de VEGF. En esta ecuación ![]() es una constante que regula la producción de hueso en el tiempo,
es una constante que regula la producción de hueso en el tiempo, ![]() representa el valor de la concentración de VEGF con la cual comienza el proceso de osificación. Ta es el tiempo requerido para el proceso de calcificación del cartílago y tr representa el tiempo que limita la producción de hueso.
representa el valor de la concentración de VEGF con la cual comienza el proceso de osificación. Ta es el tiempo requerido para el proceso de calcificación del cartílago y tr representa el tiempo que limita la producción de hueso.
Hipótesis sobre el proceso de formación de los centros primarios del neurocráneo membranoso: osificacion intramembranosa
La hipótesis de este trabajo se basa en la diferenciación de los osteoblastos a partir del tejido mesenquimal mediante la acción de la proteína BMP2,3 la cual se encuentra regulada en el tejido mesenquimal. Para esto se supone la existencia de un sistema de reacción-difusión de dos moléculas primordiales, como son el BMP2 y la Noggin,3 cuya distribución en el espacio puede conducir a un patrón estable en el tiempo e inestable en el espacio, similar a los patrones de diferenciación de los osteoblastos desde células mesenquimales.
En conjunto con BMP2, se supone la acción del Noggin, que permite la regulación molecular y determina el sitio donde se diferencian las células para la formación de los centros primarios de osificación de la calvaria. Por tanto, la BMP2 y el Noggin compiten para restringir la diferenciación completa del tejido. Entre estas dos proteínas se desarrolla un proceso de competencia, del tipo activador-inhibidor o activador-sustrato. Esta regulación se supone como un bucle que está altamente acoplado y que se representa mediante ecuaciones de reacción-difusión, cuyos parámetros se encuentran en el espacio de Turing.47,48 Este modelo matemático permitirá simular patrones con especial distribución espacial, que son repetibles ante diferentes tipos de condiciones iniciales. De esta forma se asegura una alta repetitividad del proceso de formación de los centros primarios de osificación membranosa.
Descripción del modelo
El proceso regulatorio que se propone en este artículo se esquematiza en la figura 3, y está basado en un sistema de reacción-difusión (de ecuaciones diferenciales parciales) del tipo activador-sustrato (también llamado modelo de agotamiento). El proceso indica que existe un lazo de control entre el BMP2 (factor activador) y el Noggin (sustrato), donde el BMP2 se autorregula y compite con la producción de Noggin. De esta forma, se supone que el Noggin se autoinhibe pero activa la producción de BMP2; y, por su parte, el BMP2 inhibe la producción de Noggin. Esta hipótesis se basa en los resultados hallados por Zhu y otros,49 Walsh y otros,50 así como Plikus y otros,51 en donde sus hallazgos relatan el bucle regulatorio entre BMP2 y Noggin. El BMP2 permite la diferenciación celular de las células mesenquimales a osteoblastos. De esta forma los osteoblastos diferencian y desarrollan patrones altamente repetibles, similares a los hallados en los patrones de Turing.48
La definición de las relaciones indicadas en la figura 3 puede ser cuantificada por medio de ecuaciones que establecen cambios locales de los factores, los cuales están en el tejido mesenquimal que recubre la calvaria:
Donde:
C: concentración de células del tejido mesenquimal que expresan los factores BMP2 y Noggin.
SB y SN: concentraciones de BMP y Noggin, respectivamente.Los restantes son parámetros del modelo:
a1 y a2: términos que cuantifican la producción de cada factor molecular por los tejidos mesenquimal y epitelial.
µ: constante que cuantifica la inhibición en la producción de BMP2 por su exceso.
g0: regula la interacción no lineal entre la concentración de BMP2-Noggin y cuantifica la activación o inhibición de cada factor molecular.
DB y DN: coeficientes de difusión del BMP2 y Noggin, respectivamente.
En la interpretación biológica de las anteriores ecuaciones el término![]() representa la activación no lineal de SN (producción de BMP2 por la presencia de Noggin) y el consumo no lineal de SB (por la presencia de BMP2).
representa la activación no lineal de SN (producción de BMP2 por la presencia de Noggin) y el consumo no lineal de SB (por la presencia de BMP2).
Adicionalmente, se tiene en cuenta la maduración de las células mesenquimales. Esta suposición se basa en la teoría de Ruch y otros,52 quienes han postulado que solo las células que han cumplido un determinado número de ciclos celulares pueden diferenciarse. Esta suposición se confirmó por Schmitt y Ruch.53 En este artículo se supone que la posición de las células en la calvaria determina su diferenciación. Por tanto, la diferenciación depende de la concentración de BMP2 que señala el proceso y la maduración celular que depende de la posición espacial, dada por:
La ecuación (18) representa el término de diferenciación de las células mesenquimales a osteoblastos por la presencia de BMP2, y de la maduración celular que depende de la posición espacial f(Xrel). En esta ecuación ![]() es una constante que regula la diferenciación celular,
es una constante que regula la diferenciación celular, ![]() representa el valor de la concentración de BMP2 con la cual comienza el proceso de diferenciación. Ta es el tiempo requerido para que se lleve a cabo la diferenciación y tr representa el tiempo límite de acción de la BMP2.
representa el valor de la concentración de BMP2 con la cual comienza el proceso de diferenciación. Ta es el tiempo requerido para que se lleve a cabo la diferenciación y tr representa el tiempo límite de acción de la BMP2.
Por su parte, f(Xrel) depende de la posición relativa Xrel que determina la distancia entre el límite rostral y cualquier punto de la calvaria. Esta suposición se basa en que las partes rostrales y la base del cráneo diferencian con mayor rapidez (séptima semana) que la calvaria (octava a novena semana).54 Por tanto, la cercanía al rostro podría determinar la maduración celular, que está dada por:
Donde r determina el valor umbral desde el límite rostral, para el cual las células ubicadas debajo de este son lo suficiente maduras para diferenciar en el centro primario de osificación.
DISCUSIÓN
Aunque la aplicación de los modelos de Turing en biología del desarrollo han sido continuamente sujeto de controversia,26,55 ha aparecido un interés reciente como consecuencia del trabajo presentado por Sick y otros.56 En aquel trabajo se confirma la validez de las ecuaciones de reacción-difusión en un ejemplo específico de formación de patrones biológicos (crecimiento del folículo de cabello). El trabajo aquí presentado ilustra y sustenta la validación de estos modelos, para describir los procesos fundamentales que ocurren durante los eventos complejos de formación de patrones en la biología del hueso. De los resultados mostrados hasta este punto, se concluye que la retroalimentación química entre dos factores moleculares reactivos (activador-inhibidor) en los futuros huesos puede ser una razón del origen de los centros de osificación. Con estos modelos se puede observar concordancia entre los centros de osificación simulados y la realidad biológica.
Sin embargo, existen limitaciones importantes que deben ser discutidas. La hipótesis que el origen de los centros primarios y secundarios de osificación endocondral están regulados por células a través de dos reactantes bioquímicos (se han supuesto Ihh-PTHrP) en huesos largos, debe ser revisada a profundidad. Se conoce que en esa etapa de desarrollo del hueso existen otros factores moleculares actuando en este (ejemplo, BMP, TGF-â, FGFs, y otros).19 Hasta ahora, se presenta un gran esfuerzo en este trabajo por aclarar la misión de cada una de esas sustancias, su interacción completa y la regulación de sus procesos. Se debe señalar que el proceso de osificación endocondral reviste alta complejidad biológica y, por tanto, existen señales especializadas que permiten un fino balance en la proliferación, hipertrofia y osificación. Muchas de estas señales moleculares están aún en estudio y son objeto de controversia entre biólogos y médicos. Sin embargo, en este artículo se han tenido en cuenta las dos moléculas maestras según es señalado por autoridades en la materia.19 Nuevamente, bajo esta suposición y utilizando sistemas de reacción difusión se logra simular tanto los centros primarios como los secundarios de osificación endocondral. Con un modelo similar, en una escala diferente de tiempo y espacio, en el caso de MMP13 y VEGF, se logra simular, también, la formación de las trabéculas de la espongiosa primaria. En este caso, se soluciona el sistema en 3D, con lo que se obtienen patrones trabeculares similares a los hallados en el hueso en formación.
En el caso de la osificación intramembranosa se supone que el origen de la diferenciación del osteoblasto es internamente controlado por células mesenquimales. Esto se logra a través de dos señales bioquímicas: Noggin y BMP2. Se debe destacar, de igual forma que en el caso endocondral, que estos factores no son los únicos que actúan en ese proceso. Existen otros tantos, entre los que se cuenta FGF-8 y BMP4, que quizá desempenan un papel importante en la diferenciación celular. Es claro que la relación Noggin-BMP2 no es la única que controla el proceso de diferenciación. Sin embargo, la existencia de un mecanismo activador-sustrato puede garantizar la alta estabilidad para el desarrollo de este proceso biológico.
Una limitación adicional radica en que los modelos suponen, como condiciones iniciales, valores aleatorios de concentración de cada uno de los reactantes en el dominio de estudio. En la osificación endocondral, el PTHrP e Ihh son expresadas por condrocitos proliferativos y pre-hipertróficos. En la formación de la esponjosa primaria, el VEGF y MMP13 son manifestadas por condrocitos hipertróficos. En la osificación intramembranosa, el BMP2 y Noggin se formulan por células mesenquimales. Estas condiciones iniciales del proceso son complejas de hallar, debido a que estos procesos se presentan en etapa prenatal. Sin embargo, el tipo de inestabilidad espacial obtenida por patrones de Turing, es casi independiente de las condiciones iniciales. De hecho, el modelo conduce al mismo estado final estable (estado atractor), incluso si se empieza desde casi cualquier condición inicial. Por tanto, estos modelos son estables y robustos en consideración a las condiciones iniciales y a un rango de parámetros
Se debe tener en cuenta que, durante los procesos de osificación existen factores biofísicos adicionales que están fuera del alcance de estos modelos. Es posible que la influencia química no sea suficiente, y se deban tomar en cuenta las restricciones de carga y contorno (efectos mecánicos) y factores bioquímicos adicionales. Entre las cargas mecánicas se debe mencionar y tener en cuenta las cargas ejercidas por los músculos, tendones, ligamentos y el propio crecimiento, en el caso de huesos largos. En la osificación intramembranosa se deben tener en cuenta las restricciones en el útero durante el desarrollo y el efecto del crecimiento, por ejemplo, del cerebro. Este conjunto de factores debe sumarse al efecto de la función hormonal sistémica, que desempeña un papel importante a nivel embrional.
El valor numérico de algunos de los parámetros usados en la simulación es desconocido y, por lo tanto, han sido supuestos. Este es una limitación frecuente en mecanobiologìa. Muchos de los parámetros que deben ser utilizados en modelos matemáticos son complejos de hallar de modo experimental. Por lo tanto, los resultados son limitados, y de estos, lo más importante es la similitud cualitativa con la evidencia biológica. Precisamente, estos modelos pueden abrir nuevas vìas de experimentación para estudiar a profundidad las hipótesis aquí consignadas y hallar las constantes y parámetros del modelo para futuras comparaciones. De esta forma, los modelos serán comprobados, mejorados y quizá utilizados en esclarecer enfermedades de la osificación endocondral e intramembranosa.
Para concluir, a pesar de todas las simplificaciones y limitaciones antes mencionadas, los modelos matemáticos propuestos son capaces de reproducir muchas de las características del origen de los centros de osificación endocondral e intramembranoso. En adición, esta aproximación permite nuevas ideas a pruebas experimentales para demostrar no solo la validez de las suposiciones fundamentales citadas antes sino también que los parámetros en las ecuaciones de control satisfacen las restricciones del modelo.
REFERENCIAS BIBLIOGRÁFICAS
1. Van Der Meulen MC, Huikes R. Why Mechanobiology? J Biomech. 2002;35(4):401-14.
2. Sadler TW. Langman's medical embryology. 9th ed. Maryland: Lippincott Williams and Wilkins Ed. Baltimore; 2010. p. 1-534.
3. Holleville N, Quilhac A, Bontoux M, Monsoro-Burq AH. BMP signals regulate Dlx5 during early avian skull development. Dev Biol. 2003;257(1):177-89.
4. Franceschini MP. On the appearance and evolution of secondary centers of ossification in the tibia of Gallus gallus. Acta Anat. 1967;68:169-88.
5. Kronenberg HM. Development regulation of the growth plate. Nature. 2003;423:332-6.
6. Morini S, Continenza M, Ricciardi AG, Gaudio E, Pannarale L. Development of the microcirculation of the secondary ossification center in rat humeral head. Anat Rec Part A. 2004;278A:41927.
7. De Crombrugghe B, Lefebvre V, Nakashima K. Regulatory mechanisms in the pathways of cartilage and bone formation. Curr Opin Cell Biol. 2001;13(6):721-8.
8. Provot S, Schipani E. Molecular mechanisms of endochondral bone development. Biochem Bioh Res Co. 2005;328(3):658-65.
9. Karp S, Schipani E, St-Jacques B, Hunzelman J, Kronenberg H, Mcmahon AP. Indian Hedgehog coordinates endochondral bone growth and morphogenesis via parathyroid hormone related-protein -dependent and -independent pathways. Development. 2000;127:543-8.
10. Sundaramurthy S, Mao J. Modulation of endochondral development of the distal femoral condyle by mechanical loading. J Orthop Res. 2006;24:229-41.
11. Carter DR, Wong MA. Theoretical model of endochondral ossification and bone architectural construction in long bone ontogeny. Anat Embryol. 1990;181(6):523-32.
12. Henderson J, Carter DR. Mechanical induction in limb morphogenesis: The role of growth-generated strains and pressures. Bone. 2002;31(6):645-53.
13. Kobayashi T, Soegiarto DW, Yang Y, Lanske B, Schipani E, Mcmahon AP, Kronenberg HM. Indian Hedgehog stimulates periarticular chondrocyte differentiation to regulate growth plate length independently of PTHrP. J Clin Invest. 2005;115:1734-42.
14. Chung U, Schipani E, Mcmahon AP, Kronenberg HM. Indian Hedgehog couples chondrogenesis to osteogenesis in endochondral bone development. J Clin Invest. 2001;107(3):295-304.
15. Kindblom JM, Nilsson O, Hurme T, Ohlsson C, Savendah JL. Expression and localization of Indian Hedgehog (Ihh) and Parathyroid hormone related protein (PTHrP) in the human growth plate during pubertal development. J Endocrinol. 2002;174:R1-R6.
16. Kobayashi T, Chung UI, Schipani E, Starbuck M, Karsenty G, Katagiri T, et al. PTHrP and Indian Hedgehog control differentiation of growth plate chondrocytes at multiple steps. Development. 2002;129:2977-86.
17. Zelzer E, Mamluk R, Ferrara N, Johnson R, Schipani E, Olsen B. Vegfa is necessary for chondrocytes survival during bone development. Development. 2003;131:2161-71.
18. St-Jacques B, Hammerschmidt M, Mcmahon A. Indian Hedgehog signaling regulates proliferation and differentiation of chondrocytes and is essential for bone formation. Gene Dev. 1999;13:2072-86.
19. Fisher MC, Meyer C, Garber G, Dealy C. Role of IGFBP2, IGF-I and IGF-II in regulating long bone growth. Bone. 2005;37(6):741-50.
20. Vortkamp A, Lee K, Lanske B, Segre GV, Kronenberg HM, Tabin CJ. Regulation of rate of cartilage differentiation by Indian hedgehog and PTH- related protein. Science. 1996;273:613-22.
21. Madzvamuse A, Maini PK, Wathen AJ. A moving grid finite element method for the simulation of pattern generation by Turing models on growing domains. J Sci Comput. 2005;24:247-62.
22. Crampin EJ, Maini PK. Reaction-diffusion models for biological pattern formation. Methods Applications Analysis. 2001;8(3):415-28.
23. Page KM, Maini PK, Monk NAM. Complex pattern formation in reaction-diffusion systems with spatially varying parameters. Physica D: Nonlinear Phenomena. 2005;202(1-2):95-115.
24. Murray JD, Maini PK. A new approach to the generation of pattern and form in embriology. Sci Prog. 1986;70:539-53.
25. Maini PK, Baker RE, Chuong CM. The Turing model comes of molecular age. Science. 2006;314:1397-8.
26. Maini PK, Murray JD. A nonlinear analysis of a mechanical model for pattern formation. SIAM J Appl Math. 1998;48:1064-72.
27. Garzón-Alvarado DA, García-Aznar JM, Doblaré M. Appearance and location of secondary ossification centres may be explained by a reaction-diffusion mechanism. Computers Biology Medicine. 2009;39(6):554-61.
28. Farnum CE, Lee R, Ohara K, Urban JPG. Volume increase in growth plate chondrocytes during hypertrophy: the contribution of organic osmolytes. Bone. 2002;30(4):574-81.
29. Kronenberg H. Development regulation of the growth plate. Nature. 2003;423:332-6.
30. DeCrombrugghe B, Lefebvre V, Nakashima K. Regulatory mechanisms in the pathways of cartilage and bone formation. Current Opinion Cell Biology. 2001;13(6):721-8.
31. Kobayashi T, Soegiarto DW, Yang Y, Lanske B, Schipani E, McMahon AP, et al. Indian Hedgehog stimulates periarticular chondrocyte differentiation to regulate growth plate length independently of PTHrP. J Clin Invest. 2005;115:1734-42.
32. Provot S, Schipani E. Molecular mechanisms of endochondral bone development. Biochemical Biophysical Research Communications. 2005;328(3):658-65.
33. Madzvamuse AA. Numerical approach to the study of spatial pattern formation. Oxford University, UK: D. Phil Thesis; 2000. p. 1-125.
34. Madzvamuse A. Time-stepping schemes for moving grid finite elements applied to reaction-diffusion systems on fixed and growing domains. J Computational Physics. 2006;214:239-63.
35. Maini PK. Using mathematical models to help understand biological pattern formation. C R Biologies. 2004;327:225-34.
36. Chung U, Schipani E, McMahon U, Kronenberg HM. Indian Hedgehog couples chondrogenesis to osteogenesis in endochondral bone development. J Clin Invest. 2001;107(3):295-304.
37. Fisher MC, Meyer C, Garber G, Dealy C. Role of IGFBP2, IGF-I and IGF-II in regulating long bone growth. Bone. 2005;37(6):741-50.
38. Johnsen SL, Wilsgaard T, Rasmussen S, Sollien R, Kiserud T. Longitudinal reference charts for growth of the fetal head, abdomen and femur. European J Obst Gynecol Reprod Biol. 2006;85(3):286-97.
39. Zylan T, Murshid KW. An assessment of femur growth parameters in human fetuses and their relationship to gestational age. Turk J Med Sci. 2003;33:27-32.
40. Chitty LS, Altman DG. Charts of fetal size: limb bones. BJOG: International J Obst Gynecol. 2002;109:919-29.
41. Zelzer E, Mamluk R, Ferrara N, Johnson R, Schipani E, Olsen B. VEGFA is necessary for chondrocytes survival during bone development. Development. 2003;131:2161-71.
42. Mackie EJ, Ahmed YA, Tatarczuch L, Chen K-S, Mirams M. Endochondral ossification: how cartilage is converted into bone in the developing skeleton. International J Biochemistry Cell Biology. 2008;40(1):46-62.
43. Krane SM, Inada M. Matrix metalloproteinases and bone. Bone. 2008;43(1):7-18.
44. Troeberg L, Nagase H. Proteases involved in cartilage matrix degradation in osteoarthritis. Biochimica Biophysica Acta (BBA)-Proteins Proteomics. 2011;1824(1):133-45.
45. Filvaroff EH. VEGF and bone. J Musculoskeletal Neuronal Interactions. 2003;3(4):304-7.
46. Turing AM. The chemical basis of morphogenesis. Biological Sciences. 1952;237(641):37-72.
47. Garzon-Alvarado DA, Ramírez Martínez AM. A biochemical hypothesis on the formation of fingerprints using a turing patterns approach. Theor Biol Med Model. 2011;8:24.
48. Murray JD. Parameter space for turing instability in reaction diffusion mechanisms: a comparison of models. J Theor Biol. 1982;98(1):143-63.
49. Zhu W, Kim J, Cheng C, Rawlins BA, Boachie-Adjei O, Crystal RG, Hidaka C. Noggin regulation of bone morphogenetic protein (BMP) 2/7 heterodimer activity in vitro. Bone. 2006;39(1):61-71.
50. Walsh DW, Godson C, Brazil DP, Martin F. Extracellular BMP-antagonist regulation in development and disease: tied up in knots. Trends Cell Biol. 2010;20(5):244-56.
51. Plikus MV, Zeichner-David M, Mayer JA, Reyna J, Bringas P, Thewissen JG, et al. Morphoregulation of teeth: modulating the number, size, shape and differentiation by tuning Bmp activity. Evol Dev. 2005;7(5):440-57.
52. Ruch JV, Lesot H, Begue-Kirn C. Odontoblast differentiation. Int J Dev Biol. 1995;39(1):51-68.
53. Schmitt R, Ruch JV. In vitro synchronization of embryonic mouse incisor preodontoblasts and preameloblasts: repercussions on terminal differentiation. Eur J Oral Sci. 2000;108(4):311-9.
54. Tubbs RS, Bosmia AN, Cohen-Gadol A. The human calvaria: a review of embriology, anatomy, pathology, and molecular development. Childs Nerv Syst. 2012Apr;28(4):23-31.
55. Sick S, Reinker S, Timmer J, Schlake T. Wtn and Dkk determine hair follicle spacing through a reaction-diffusion mechanism. Science. 2006;314:1447-50.
56. Carter DR, Wong M. The role of mechanical loading histories in the development of diarthrodial joints. J Orthop Res. 1988;6:804-16.
Recibido: 12 de julio de 2012.
Aprobado: 20 de diciembre de 2012.
Diego A. Garzón Alvarado. Departamento de Ingeniería Mecánica y Mecatrónica. Universidad Nacional de Colombia. Colombia. Teléf.: 3165000 Ext: 11216. Correo electrónico: dagarzona@unal.edu.co