Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Ortopedia y Traumatología
versión impresa ISSN 0864-215Xversión On-line ISSN 1561-3100
Rev Cubana Ortop Traumatol vol.28 no.2 Ciudad de la Habana jul.-dic. 2014
ARTÍCULO ORIGINAL
Estudio densitométrico de diez años de remodelación femoral tras la implantación de un vástago anatómico
A Ten-Year sensitometric study of femoral remodeling after implantation of an anatomical stem
Étude densitométrique de dix ans d’un remodelage fémoral après implantation d'une tige anatomique
Dr. Andrés Aguilar Ezquerra, Dr. Juan José Panisello Sebastiá, Dr. Jesús Javier Mateo Agudo
Hospital Miguel Servet. Zaragoza, España.
RESUMEN
Introducción: la absorciometría dual con rayos X es comúnmente utilizada para cuantificar la remodelación ósea periprotésico, normalmente en seguimientos a corto plazo.
Objetivo: determinar los patrones de remodelado producidos por vástago anatómico, mediante la cuantificación de cambios en la densidad mineral ósea en las 7 zonas de Gruen, durante el seguimiento, así como analizar la influencia de otros factores en el remodelado óseo. Métodos: se realizó un estudio prospectivo (10 años de seguimiento) a un grupo de 39 pacientes a los que se implantó una prótesis total de cadera no cementada. Se utilizó la cadera sana contralateral como control. Para cuantificar la remodelación femoral periprotésica se utilizó la absorciometría dual con rayos X en las 7 zonas de Gruen. Las mediciones de masa ósea se realizaron a los 15 días, 1, 3 y 10 años tras la intervención en la cadera no operada y a los 15 días, 1, 3, 5 y 10 años de la operación en la cadera protetizada. Se analizó también la influencia de otros factores en el remodelado óseo (sexo, índice de masa corporal y masa ósea preoperatoria).
Resultados: se halló un descenso de la densidad mineral ósea del 7 % en la zona 1 de Gruen y del 24,1 % en la zona 7 de Gruen al final del décimo año. El sexo, el índice de masa corporal y la masa ósea preoperatoria no fueron estadísticamente relevantes en su influencia sobre el remodelado óseo.
Conclusión: la remodelación ósea periprotésica depende en su mayor parte del implante, no se halló correlación con sexo, índice de masa corporal o masa ósea preoperatoria.
Palabras clave: remodelado óseo, vástago no cementado, la absorciometría dual con rayos X, seguimiento de diez años.
ABSTRACT
Introduction: Dual X-ray absorptiometry is commonly used to quantify periprosthetic bone remodeling, usually for short-term follow up.
Objective: determine patterns of remodeling caused by anatomical stem, by quantifying changes in bone mineral density in the 7 Gruen zones during follow up and analyze the influence of other factors in bone remodeling.
Methods: a prospective study (10 year follow-up) was performed to a group of 39 patients undergoing uncemented total hip prosthesis. The healthy hip was used as control. Dual X-ray absorptiometry in Gruen zones 7 was used to quantify the femoral periprosthetic remodeling. Bone mass measurements were performed at 15 days, 1, 3 and 10 years after surgery on the non-operated hip, and at 15 days, 1, 3, 5 and 10 years of operation in the prosthetic hip. The influence of other factors in bone remodeling (sex, body mass index, and preoperative bone mass) was also analyzed.
Results: 7 % of decrease in bone mineral density was found in Gruen zone 1 and 24.1 % was found in Gruen zone 7 at the end of the tenth year of follow up. Sex, body mass index and preoperative bone density were not statistically significant in its influence on bone remodeling.
Conclusions: periprosthetic bone remodeling depends mainly on the implant. No correlation has been found with sex, body mass index and preoperative preoperative bone density.
Keywords: bone remodeling, non-cemented stem, DXA, ten-year follow-up, preoperative BMD.
RÉSUMÉ
Introduction: l’absorptiométrie biphotonique à rayons X est fréquemment utilisée pour évaluer le remodelage osseux péri-prothétique, notamment par des suivis à court terme.
Objectif: le but de cette étude est de déterminer les standards du remodelage osseux péri-prothétique produits par une tige anatomique, et d’analyser également l'influence d’autres facteurs sur le remodelage osseux.
Méthodes: une étude prospective (suivi de 10 ans) d’un groupe de 39 patients, ayant subi une implantation de prothèse de hanche sans ciment, a été réalisée. Afin d’évaluer le remodelage fémoral périprothétique, on a effectué une absorptiométrie biphotonique à rayons X dans les 7 zones de Gruen. On a mesuré la DMO de la hanche non-opérée aux 15 jours et 1, 3, et 10 ans après la chirurgie, ainsi que la DMO de la hanche opérée aux 15 jours et 1, 3, 5, et 10 ans après la chirurgie. On a également analysé le retentissement d’autres facteurs (sexe, indice de masse corporelle, densité osseuse préopératoire) sur le remodelage osseux.
Résultats: à la fin de la dixième année, on a trouvé une perte de la DMO de 7 % dans la zone 1, et de 24.1 % dans la zone 7. Le sexe, l’indice de masse corporelle et la masse osseuse préopératoire n’ont pas statistiquement influé sur le remodelage osseux.
Conclusions: le remodelage osseux péri-prothétique dépend notamment de l’implant ; on n’a pas trouvé de corrélation avec le sexe, l’indice de masse corporelle ou la densité osseuse préopératoire.
Mots clés: remodelage osseux, tige sans ciment, absorptiométrie biphotonique à rayons X, suivi de dix ans.
INTRODUCCIÓN
La remodelación ósea tras la artroplastia de cadera es un fenómeno comúnmente observado en todos los diseños protésicos. La cuantía de esta remodelación puede variar en función de factores relacionados tanto con el paciente (sexo, peso, masa ósea preoperatoria) como con el implante (geometría, talla, material, recubrimiento de superficie). Es aceptado que la mayoría de cambios remodelativos alrededor del vástago femoral ocurren en los primeros años tras la intervención quirúrgica,1 momento a partir del cual los cambios reflejan la respuesta biomecánica del hueso según la ley de Wolff y los cambios asociados al envejecimiento.
La absorciometría dual con rayos x (DEXA) ha sido ampliamente utilizada para cuantificar la extensión de la pérdida ósea periprotésica alrededor de implantes articulares. Este método ha demostrado ser fiable y preciso, y es considerado el ideal para exámenes repetidos en seguimientos seriados por su exactitud y baja radiación.2
Por estos motivos se ha utilizado para el estudio de diversos implantes que han manifiesto patrones de remodelación diferentes; los vástagos no cementados de primera generación mostraron pérdidas de entorno al 45 % de la masa ósea en zonas proximales,3 mientras que los vástagos anatómicos de segunda generación consiguieron descender la pérdida hasta cifras del 20-25 %.4 Los implantes personalizados, realizados a medida del paciente, mostraron pérdidas del 10-15 % al tercer año de seguimiento.5
Para conocer la remodelación producida por un vástago anatómico recubierto de hidroxiapatita, se diseñó un estudio que analizaba 39 pacientes que fueron sometidos a la implantación de una artroplastia total de cadera modelo ABG II debido a una coxopatía primaria unilateral (coxartrosis o necrosis avascular). Se realizaron determinaciones con DEXA con un seguimiento de 10 años tras la intervención. El propósito del estudio, es determinar los patrones de remodelado producidos por este vástago, cuantificando los cambios en la densidad mineral ósea en las 7 zonas de Gruen a lo largo del seguimiento, así como analizar la influencia de otros factores en el remodelado óseo (sexo, índice de masa corporal y masa ósea preoperatoria).
MÉTODOS
Se diseñó un estudio prospectivo controlado, para estudiar la remodelación periprotésica producida por la implantación del vástago ABGII no cementado. El tamaño muestral fue calculado según tablas de comparación de medias para obtener una potencia estadística de 95 % y un riesgo alfa de 0,05. La comparación de porcentajes se realizó usando la prueba chi cuadrado, la de medias empleando la prueba t de Student con un nivel de significación de 0,025. Para analizar la evolución de la densidad mineral ósea (DMO) en el fémur intervenido se utilizó la prueba t de Student para datos apareados. También se utilizó esta prueba para comparar la masa ósea entre el fémur operado y el no intervenido. Se cuantificaron las correlaciones empleando el coeficiente de correlación de Pearson.
Los criterios de inclusión fueron los siguientes: por un lado, los pacientes tenían que tener indicación de la implantación del vástago ABG II según su patología y calidad ósea; en segundo lugar la coxopatía debía ser unilateral, pues el fémur sano se utilizó como control, y, por último, no debían haber sufrido reintervenciones en la cadera a estudio, ya fuese por recambios o fracturas periprotésicas. Todos los pacientes firmaron el consentimiento informado para participar en el estudio; ratificado por el Comité Ético del centro. El grupo a estudio se compone de 39 pacientes (25 hombres y 19 mujeres), con una media de IMC de 30,2 kg/m2 (22-50,3 kg/m2) y una media de edad de 68 años (51-82 años). Todos los pacientes completaron el seguimiento satisfactoriamente.
El implante usado fue el vástago ABG II (Sryker) y un cotilo no cementado recubierto de hidroxiapatita modelo ABG II. El vástago ABG II es anatómico, no cementado, con fijación metafisaria por ajuste a presión fabricado en aleación de titanio (TM12Z6F 2) (Fig. 1). Posee un recubrimiento de hidroxiapatita de 70 micras de grosor limitado a la zona metafisaria con una pureza del 99,99 % y un diseño de escamas en las caras anterior y posterior que convierte las fuerzas de cizallamiento en fuerzas de compresión, aumentando así su estabilidad. La cola del implante es fina y pulida para evitar el contacto con el endostio diafisario.
Todos los pacientes fueron intervenidos usando una vía de abordaje posterolateral por el mismo grupo de cirujanos. El canal femoral fue preparado mediante fresado diafisario 1 mm mayor que la cola del vástago. En el posoperatorio, todos los pacientes recibieron profilaxis antitrombótica con heparina de bajo peso molecular y profilaxis antibiótica durante 48 horas tras la intervención quirúrgica. Los pacientes mantuvieron el apoyo parcial durante 6 semanas, momento en que se retiraba el bastón homolateral y se autorizaba la carga completa.
Se realizaron estudios radiológicos anuales donde no se apreciaron radiolucencias ni imágenes osteolíticas.
El estudio densitométrico se realizó dividiendo el fémur proximal en cajas de 30 x 30 mm que representaban las 7 zonas de Gruen, tanto en el fémur intervenido como en el contralateral. El densitómetro utilizado fue modelo HOLOGIC QDR 1000 (Hologic Inc, Waltham, Massachusets) durante las primeras determinaciones hasta un año post intervención quirúrgica, y un LUNAR DPX enCORE (General Electrics Healthcare, Madison) en el resto de determinaciones; utilizando un software de exclusión de metales en todas las mediciones. Los valores obtenidos por ambos densitómetros fueron estandarizados según las fórmulas propuestas por el IDSC (International Densitometry Standarization Comitee) para determinaciones en fémur, según se muestra a continuación:
| HOLOGIC | BMDN=1,008(BMDHOLOGIC+0,008) |
| LUNAR | BMDN=0,979(BMDLUNAR+0,031) |
Se consideró de capital importancia establecer un protocolo de colocación del paciente en la mesa de exploración del densitómetro para garantizar la fiabilidad de las mediciones, ya que algunos autores han publicado una alteración en la determinación de la densidad de masa ósea de en torno a un-5 %.6 Los pacientes fueron colocados en posición supina sobre la mesa del densitómetro, con las rodillas en extensión y todo el miembro estabilizado en posición neutra mediante un dispositivo rígido equipado con cintas de velcro.
La realización de determinaciones densitométricas se inició en el preoperatorio, se hicieron rastreos de la cadera afecta y de la contralateral como control. Se realizaron determinaciones adicionales en el fémur intervenido a los 6 meses, al año, a los tres, cinco y a los diez años de la intervención. En el fémur usado como control se realizaron nuevas determinaciones densitométricas al año de seguimiento y a los tres y diez años. Se tomó la cifra de densidad mineral ósea preoperatoria como referencia para establecer las variaciones densitométricas, con objeto de obviar la disminución del stock óseo debido a la intervención quirúrgica, que se ha observado que puede llegar a ser del 10 %.7
RESULTADOS
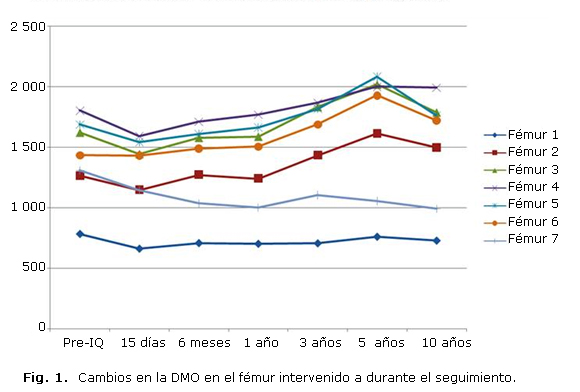
Al final del seguimiento las imágenes radiológicas demostraron que todos los vástagos eran estables, y no se hallaron líneas reactivas o radiolucencias. Se observó un descenso en la masa ósea en todas las zonas a los 6 meses de la cirugía de entre el 2,6 % y el 20,8 %; excepto en las zonas 2 y 6 de Gruen, que mostraron un pequeño incremento del 0,5 %-3,7 %. Al año de la cirugía, la masa ósea mostró una recuperación progresiva, y al final del tercer año la DMO se había incrementado en un 3,5 %-17,7 %. En el quinto año pos intervención las mediciones en las zonas 2 a 6 de Gruen mostraban un incremento del 10,95 % al 34,4 %; y al final del seguimiento se apreció un incremento del 4,3 %-19,9 %, debido al descenso de actividad física y a un género de vida más sedentario.
Sin embargo, en las zonas 1 y 7 de Gruen se apreció un descenso progresivo de la DMO desde el posoperatorio, mostrando pérdidas del 9,8 %-15,5 % a los tres años de la intervención, probablemente debidas al efecto stress-shielding. A los cinco años de la intervención, se aprecia una leve recuperación en la zona 1, con un descenso de DMO del 2,9 %; mientras que la zona 7 muestra una mayor pérdida ósea, con un descenso del 19,3 %. Al final del seguimiento, la zona 1 mostraba un descenso del 7 % en su DMO y la zona 7 un 24,1 %, debido al envejecimiento y el efecto stress-shielding. La evolución del remodelado óseo en el fémur intervenido se muestra en la tabla 1 y la figura 1.
Para el estudio de la influencia del índice de masa corporal en la remodelación ósea se dividió la muestra en dos grupos, el grupo 1 con un IMC menor o igual a 30 (19 pacientes), y el grupo 2 con un IMC superior a 30 (20 pacientes). No se halló una influencia estadísticamente significativa entre este factor y el remodelado óseo periprotésico. Datos similares se obtuvieron en el análisis del sexo como factor de influencia en el remodelado óseo, donde no se encontraron diferencias estadísticamente significativas.
Estudiando la relación entre la DMO inicial y la DMO a lo largo del seguimiento se aprecia que la DMO inicial guarda una buena correlación y se considera un buen factor predictor durante el primer año en las 1, 2, 4 y 6 (índices de correlación de Pearson entre 0,61 y 0,75). A los tres años tras la cirugía todavía muestra buen poder predictivo en las zonas 1, 4 y 5 (0,71-0,61). En las áreas 3 y 7 se apreció una baja correlación desde la determinación al año de la intervención (0,51 y 0,57 respectivamente). Al final del seguimiento se encontró una baja correlación para las siete zonas de Gruen. Los resultados se muestran en la tabla 2.
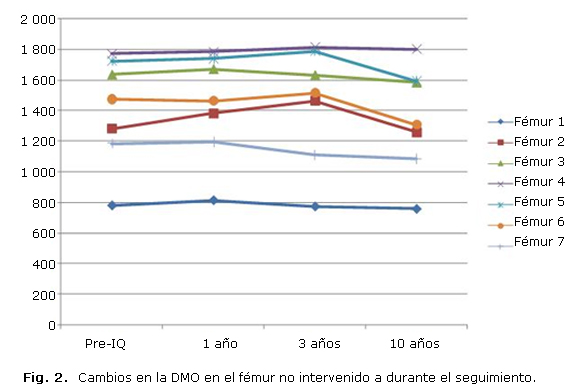
En cuanto a la evolución de la masa ósea en el fémur no intervenido, se puede apreciar que durante el primer año del seguimiento se observó un aumento generalizado de la densidad mineral ósea, hecho justificado por la mayor transferencia de cargas hacia la extremidad sana por la protección de la extremidad intervenida y al aumento progresivo de la actividad debido al alivio del dolor. En el tercer año se apreció una disminución de masa ósea en las zonas 1, 3 y 7; en contraste con un aumento de la DMO en las zonas 2, 4, 5 y 6. La DMO a los diez años de la intervención había sufrido un descenso, debido a la disminución progresiva de la actividad física y el envejecimiento. En la zona 4 de Gruen se observa un aumento progresivo de la DMO desde la determinación postoperatoria. Los resultados se muestran en la tabla 3 y la figura 2.
Comparando la variación de la masa ósea entre el fémur intervenido y el contralateral, se observó una disminución de la DMO en el fémur intervenido en todas las áreas al año de la intervención, debido al traumatismo de la intervención quirúrgica y a la disminución de actividad y protección de la extremidad afecta.
Podemos observar variaciones significativas en las zonas 1 y 7 al año y a los 3 años de la intervención (p= 0,007 al año y 0,047 a los 3 años). Sin embargo, la diferencia obtenida al final del seguimiento no se halló estadísticamente significativa.
En las zonas 3, 4 y 5 se observaron menos diferencias entre ambos grupos, probablemente debido a que la transferencia de cargas sobre el hueso es más fisiológica y provocó un estímulo en la remodelación. En estas zonas la DMO fue equivalente en el fémur operado y en el no intervenido, hallándose diferencias estadísticamente significativas solamente en el área 5 al año de seguimiento.
Las zonas 2 y 6 mostraron diferencias significativas a los 3 años de seguimiento (p= 0,015 y 0,012 respectivamente); debido a que la implantación del vástago anatómico propicia la transferencia de cargas desde estas zonas hacia las zonas más diafisarias (zonas 3, 4 y 5) haciendo que el hueso proximal quede desfuncionalizado.
Por último, cabe señalar que no hubo complicaciones médicas durante el seguimiento que pudieran ser responsables de alteraciones en la densidad mineral ósea.
DISCUSIÓN
El remodelado óseo después de una artroplastia de cadera tiene un origen multifactorial.1,3 Se puede detectar una rápida pérdida ósea durante los primeros 6 meses que puede ir del 20 % al 50 % en función del implante y la metodología del estudio. Esta pérdida ósea está influenciada por diferentes factores, como la agresión quirúrgica, el reposo en el postoperatorio inmediato y la carga parcial de peso. Las cifras de masa ósea se ven afectadas por el fresado quirúrgico y la preparación del fémur proximal, causando un descenso inmediato del stock óseo de hasta el 10 %.7
El reposo postoperatorio y la carga parcial de peso no pueden explicar completamente algunas de las pérdidas de masa ósea que ocurren en las zonas proximales del fémur. La técnica quirúrgica tiene una importante influencia en los cambios ocurridos en el período precoz. El preparado de la metáfisis y el encaje a presión del implante pueden causar microfracturas en el hueso esponjoso, produciendo nuevos descensos de masa ósea detectados en los primeros 6 meses del seguimiento. La cuantía y extensión de estos cambios son debidas a la desigual agresión quirúrgica en las diferentes zonas del fémur proximal.
La preparación femoral de las áreas media y distal causa una importante disrupción de la circulación endostal debido al fresado y puede producir necrosis ósea en la parte más interna de la cortical.8 Por el contrario, en el cálcar la exposición quirúrgica del cuello femoral en el momento de la osteotomía daña la vascularización periostal. Además, el raspado también afecta a la circulación endostal. Como resultado, al final del proceso esta área puede sufrir una denervación e importante pérdida de vascularización, causando un grado variable de necrosis ósea y resorción. La suma de factores biológicos y mecánicos puede explicar el descenso de masa ósea en esta zona, que llega hasta el 24 % en los primeros 6 meses en algunos estudios,9 recobrándose paulatinamente en controles a los 18 meses de la intervención.10
Es aceptado que la mayoría del remodelado se estabiliza al final del primer año de la intervención, cuando la densidad ósea parece alcanzar una meseta en todas las áreas alrededor de la prótesis;11,12 momento a partir del cual los cambios reflejan la respuesta biomecánica del hueso según la ley de Wolff.
En el área 7 se encuentra algún descenso adicional que se considera causado por el stress-shielding. Este descenso de la masa ósea no ha demostrado influir en la estabilidad del vástago durante seguimiento, sin embargo, el incremento de la resorción ósea puede comprometer la estabilidad del vástago a largo plazo.
Los cambios de DMO relacionados con el stress-shielding normalmente son detectados al final del primer año de la intervención. En un fémur proximal normal, la transferencia de cargas se realiza de la cabeza femoral al cálcar, que soporta fuerzas compresivas más importantes que las zonas más diafisarias del fémur.13
Tras una artroplastia total de cadera, este patrón de transferencia de cargas se invierte, y la mayoría de las fuerzas de compresión son transmitidas a las áreas diafisarias a través del vástago, lo que causa un descenso de transmisión de fuerzas en la zona proximal, provocando la resorción ósea.
En estudios densitométricos, los vástagos no cementados de primera generación se asociaron con importantes pérdidas óseas proximales atribuibles a la remodelación ósea adaptativa que alcanzaban un descenso de hasta el 45 % de la DMO. Estos cambios se estabilizaban tras el primer o segundo año de la intervención.3 Los vástagos no cementados de segunda generación, hechos de titanio y con un diseño anatómico para mejorar la fijación del vástago, mostraron un descenso de la DMO del 20-25 % al final del segundo año.4 Los componentes femorales en forma de cuña, usados frecuentemente en Europa, tienen una pérdida proximal de entre el 10 % y el 30 %. 14,15 Los implantes personalizados (custom-made) han obtenido los mejores resultados en cuanto a pérdida ósea proximal, pero aún así muestran una caída del 14-27 % al final del quinto año de seguimiento.16 Por otro lado, la implantación de prótesis con vástagos cortos o ultracortos; que pretenden desplazar la transferencia de cargas a las zonas más proximales, han obtenido unas pérdidas de masa ósea del 7-24 % en el cálcar a los 3 años de seguimiento;17 e incluso, algunos estudios recientes afirman no encontrar diferencias significativas con vástagos de longitud reducida respecto a vástagos estándar en la reducción de la masa ósea al año de seguimiento; por lo que concluyen que el pretendido objetivo de trasladar las cargas a las áreas proximales no se consigue.18 Los vástagos de baja rigidez han mostrado una reducción la pérdida ósea proximal debido al stress-shielding,19 comunicando descensos de la DMO en cálcar del 15 % al final del segundo año e incluso a los 10-15 años de seguimiento. 20
Otros estudios realizados con TAC cuantitativo21 han objetivado una disminución progresiva de la DMO en la metáfisis, con unas pérdidas del 13,8 % en trocánter mayor y del 17,8 % en trocánter menor a los 5 años, con mayor afectación en hueso esponjoso que cortical. No se ha observado correlación con factores como sexo, índice de masa corporal o lado afecto. En este estudio se concluye que los factores más importantes para la disminución de la masa ósea periprotésica son la edad, la osteolisis y el efecto stress-shielding.
El patrón de remodelado producido por el vástago objeto de este estudio, anatómico y no cementado, es similar a otros vástagos no cementados de segunda generación. Algunos estudios densitométricos con este implante11 han observado un descenso de la masa ósea entre el 20-25 % en áreas proximales y del 5-15 % en áreas intermedias, sin hallar cambios significativos en zonas distales. Estos cambios se estabilizan tras uno o dos años de la intervención.
Respecto a la influencia de otros factores como índice de masa corporal y sexo en la remodelación ósea, varios estudios21-25 han mostrado resultados en consonancia con los obtenidos en este trabajo, según la cual no se ha encontrado una diferencia significativa en el remodelado cuando se tomaban estos factores como determinantes del estudio.
En cuanto a la potencia predictiva de la masa ósea inicial para determinar la DMO a lo largo del seguimiento, varios autores han llegado a la conclusión de que la DMO preoperatoria es un factor importante para la remodelación ósea periprotésica,26,27 hecho que ha sido constatado en este estudio sólo durante el primer año de seguimiento, sugiriendo que serían necesarios estudios a más largo plazo para evaluar la capacidad de predicción de la DMO inicial sobre la remodelación periprotésica.
Somos conscientes de las limitaciones de este estudio; en primer lugar, el número de sujetos incluido podría ser insuficiente y la inclusión de un mayor número de pacientes podría aportar mayor valor a los análisis estadísticos. En segundo lugar, el periodo de seguimiento podría ser insuficiente, pues es en los pacientes más mayores en los que los cambios debidos a la remodelación ósea a largo plazo pueden tener un mayor efecto y producir mayores consecuencias para la fijación del implante.
En conclusión, consideramos que el patrón de remodelación producido por el vástago ABG II muestra un aumento de DMO en las zonas con mayor transferencia de cargas, y una resorción del hueso proximal, debido al efecto stress-shielding. Los factores valorados en este estudio, como sexo e índice de masa corporal, no mostraron tener una influencia valorable. La masa ósea preoperatoria no ha mostrado correlación con la masa ósea periprotésica al final del seguimiento.
REFERENCIAS BIBLIOGRÁFICAS
1. Braun A, Papp J, Reiter A. The periprosthetic bone remodelling process signs of vital bone reaction. Int Orthop. 2003;27(S1):7.
2. Schmidt R, Nowak T, Mueller L. Osteodensitometry after total hip replacement with uncemented taper-design stem. Int Orthop. 2004;28:74.
3. Sychterz CJ, Claus AM, Engh CA. What we have learned about long-term cementless fixation from autopsy retrieval. Clin Orthop Relat Res. 2002;405:79.
4. Tanzer M, Kantor S, Rosenthal L. Femoral remodelling after porous-coated hip arthroplasty with and without hydroxyapatite-tricalcium phosphate coating. A prospective randomized trial. J Arthroplasty. 2001;16:552.
5. Leichtle UG, Leichtle CI, Schmidt B. Periprosthetic bone density after implantation of a custom made femoral component. J Bone Joint Surg (Br). 2006;88-B:467.
6. Mortimer ES, Rosenthall L, Paterson I, Bobyn JD: Effect of rotation on periprosthetic bone mineral measurements in a hip phantom. Clin Orthop Relat Res. 1996 Mar;(324):269-74.
7. Kobayashi O, Saito N, Nawata M. Sequential changes in periprosthetic bone mineral density following total hip arthroplasty: a 3-year follow-up. J bone Miner Metab. 2003;21:9.
8. Hupel TM, Schemitsch EH, Aksenov SA. Blood flow changes to the proximal femur during total hip arthroplasty. Can J Surg. 2000;43:359.
9. nPanisello JJ, Herrero L, Canales V. Long-term remodelling in proximal femur around a hydroxyapatite-coated anatomic stem. J Arthroplasty. 2009;24(1):56-64.
10. Lerch M, Kurtz A, Windhagen H, Bouguecha A, Behrens BA, Wefstaedt P. Stukenborg-Colsman CM: The cementless Bicontact(®) stem in a prospective dual-energy X-ray absorptiometry study. Int Orthop. 2012;36(11):2211-7.
11. Kilgus D, Shimaoka E, Tipton J, Eberle R. Dual energy X-ray absorptiometry measurement of bone mineral density around porous-coated cementless femoral implants. J Bone Joint Surg (Br). 1993;75-B:279-88.
12. Theis JC, Beabel G. Changes in proximal femoral bone mineral density around a hydroxyapatite coated hip arthroplasty. J Orthop Surg. 2003;11:48.
13. Karachalios T, Tsatsaronis CH, Efraimis G. The long-term clinical relevance of calcar atrophy caused by stress-shielding in total hip arthroplasty. J Arthroplasty. 2004;19:469.
14. McGovern T, Engh C, Zettl-Schaffer K, Hootern J. Cortical bone density of the proximal femur following cementless total hip arthroplasty. Clin Orthop. 1994;306:145-154.
15. Brodner W, Bitzan P, Lomoschitz F. Changes in bone mineral density in the proximal femur after the cementless total hip arthroplasty. A five year longitudinal study. J Bone Joint surg. 2004;86:20.
16. Mona N, Pal B, Jomar K. Periprosthetic bone loss after insertion of an uncemented, customized femoral stem and an uncemented anatomical stem. Acta Orthop. 2011 Aug;82(4):410-16.
17. Albanese C, Santori F, Pavan L, Learmonth I, Passariello R. Periprosthetic DXA after total hip arthroplasty with short vs ultra-short custom-made femoral stems. Acta Orthop. 2009;80(3):291-29.
18. Götze C, Ehrebrink H. Is there a bone-preserving bone remodelling in short-stem prosthesis? Orthop Unfall. 2010 Aug;148(4):398-405.
19. Glassman AH, Crowninshield RD, Schenck R, Herberts P. A low stiffness composite biologically fixed prosthesis. Clin Orthop Relat Res. 2001 Dec;(393):128-36.
20. Nagi ON, Kumar S, Aggarwal S. The uncemented isoelastic/isotitan total hip arthroplasty. A 10-15 years follow-up with bone mineral density evaluation. Acta Orthop Belg. 2006;72:55.
21. Pitto R, Hayward A, Walter C, Shim Vb. Femoral bone density changes alter total hip arthroplasty with uncemented taper-design stem: a five year follow-up. Int Orthop. 2010 Aug;34(6):783-7.
22. Aldinger PR, Sabo D, Pritsch M. Pattern of periprosthetic bone remodelling around stable uncemented tapered hip stems: a prospective 84-month follow-up study and a median 156-month cross-sectional study with DXA. Calcif Tissue Int. 2003 Aug;73(2):115-21.
23. Horvatek I, Jovanović S, Plecko D, Radanović B, Horvateks M. Clinical importance of changes to femoral bone mineral density around the hip endoprosthesis. Coll Antropol. 2012 Sep;36(3):807-11.
24. Bergscmidt P, Bader R, Finze S. Impact of preoperative variables on the functional and radiological outcome of an uncemented femoral stem: a prospective two-year follow-up. Hip Int. 2010 Apr-Jun;20(2):187-97.
25. Lübbeke A, Garavaglia G, Barea C. Influence of obesity on femoral osteolysis five and ten years following total hip arthroplasty. J Bone Joint Surg Am. 2010 Aug 18;92(10):1964-72.
26. Aro H, Alm J, Moritz N. Low BMD affects initial stability and delays stem osteointegration in cementless total hip arthroplasty in women. Acta Orthop. 2012 Apr;83(2):107-14.
27. Rahmy AI, Gosens T, Blake GM. Periprosthetic bone remodelling of two types of uncemented femoral implant with proximal hydroxyapatite coating: a 3-year follow-up study addressing the influence of prosthesis design and preoperative bone density on periprosthetic bone loss. Osteoporos Int. 2004 Apr;15(4):281-9.
Recibido: 13 de mayo de 2014.
Aprobado: 15 de agosto de 2014.
Dr. Andrés Aguilar Ezquerra . Paseo La Mina 21 7º D 2ª esc, 50001. Zaragoza, España. Correo electrónico: aaguilarez@gmail.com