Introducción
Cada vez son implantadas más prótesis, lo que hace crecer el número de cirugías de revisión. Las artroplastias primarias son más frecuentes porque se amplían las indicaciones y porque se intervienen pacientes cada vez más jóvenes. El aumento de la esperanza de vida de la población está produciendo un incremento del número de recambios protésicos y de la complejidad de la cirugía si tenemos en cuenta el defecto óseo asociado, sobre todo a nivel acetabular, y la baja calidad del hueso pélvico remanente en pacientes generalmente ancianos.1
Variadas son las condiciones que afectan la durabilidad de las prótesis, dadas por las características individuales de las mismas, tales como: la técnica quirúrgica -especialmente en lo referente a la orientación de los componentes-, la patología causante de la intervención quirúrgica, la edad y el sexo del paciente. Los adultos jóvenes masculinos menores de 40 años presentan un mayor desgaste dado por su estilo de vida más activo.
El desgaste del polietileno de alto impacto en la artroplastia de cadera (ATC) con el que está confeccionado el componente acetabular y la subsiguiente penetración de la cabeza femoral en el componente plástico son habitualmente asintomáticos hasta la segunda década de su implantación. A partir de los diez años, el aflojamiento y la migración acetabular sintomáticos se han transformado en una complicación creciente. A este problema de índole mecánica debemos agregarle el biológico derivado de la activación de la membrana de la interfase hueso-cemento, por la acción de las partículas del desgaste del polietileno y la osteolisis que es su consecuencia.2,3,4,5,6,7) El estudio histológico de las zonas de osteolisis mostró capas de macrófagos y células gigantes de reacción a cuerpo extraño, que invadían las corticales femorales. Abundantes partículas de cemento estaban presentes en estas áreas. Este último hallazgo sugirió la importancia del cemento en la aparición de la osteolisis, desarrollándose el concepto de “enfermedad del cemento”.8
La histología de las primeras prótesis no cementadas aflojadas que se recambiaron mostraba una membrana no inflamatoria e hipocelular con una considerable reacción de colágeno y osificación en la unión del hueso y el tejido fibroso. En diferentes estudios se pudo observar la existencia de osteolisis en prótesis no cementadas y estables que se iniciaba por la presencia de partículas de polietileno y de metal.8,9) Por tanto, el cemento no era la causa del defecto óseo, y la “enfermedad del cemento” pasó a denominarse “enfermedad de las partículas”.10
La cirugía de revisión de una artroplastia de cadera tiene por objetivo aliviar el dolor y restaurar la funcionalidad de la articulación. La creciente incidencia de reemplazos articulares de cadera determina que en la actualidad la revisión del componente acetabular sea un procedimiento frecuente. Si bien la mayoría de los fracasos ocurren por aflojamiento aséptico, otras causas incluyen infección, luxación recidivante, fractura protésica y periprotésica, incompatibilidad de los componentes, desgaste y osteolisis.7
La generación de partículas en la ATC puede obedecer a dos procesos: desgaste y corrosión. El desgaste ha sido descrito como pérdida de material de la prótesis en forma de micropartículas. La corrosión se define como un proceso electroquímico en el que iones metálicos son liberados de la superficie del implante.11,12,13,14
La cirugía de ATC de revisión puede ser de sólo un componente, con evidencia de buenos resultados al conservar componentes sin aflojamiento, o puede realizarse recambio total de componentes.
El aumento en la cantidad y complejidad de las revisiones de artroplastias de cadera ha determinado el desarrollo de distintas técnicas de reconstrucción acetabular. Éstas incluyen: el uso de copas acetabulares cementadas, componentes no cementados de revestimiento poroso, componentes bilobulados, copas acetabulares roscadas, bipolares, componentes pequeños con revestimiento poroso colocados en un centro de rotación alto, impactación de injerto óseo con componentes cementados de polietileno y uso de anillos y celdas metálicas con injerto óseo o sin él.
Para defectos óseos grandes y masivos podemos encontrar revisiones con cótilos gigantes, bilobulados oblongos y aloinjertos estructurales masivos.2,3
El grado de deficiencia ósea y el grado de contacto entre el hueso huésped-implante es el principio fundamental para valorar la técnica a seguir y garantizará un buen resultado de la revisión.4 Si bien los resultados a mediano plazo de algunas de estas técnicas, que recién ahora están disponibles, los resultados a largo plazo de revisiones cementadas constituyen el parámetro con el cual deben compararse las otras técnicas.7
Los componentes acetabulares porosos no cementados pueden ser utilizados prácticamente en todos los reemplazos primarios, o en las revisiones con reconstrucción acetabular. Es de fundamental importancia lograr una fijación estable del cótilo implantado mediante un encaje a presión, siempre que esto sea posible, y mediante una sólida fijación con tornillos. La estabilidad depende fundamentalmente de la integridad o de la reconstrucción de la columna posterior. Toda nuestra atención debe ser dirigida a la preservación y/o reconstrucción de esta pared. Es fundamental lograr un íntimo contacto del componente poroso y el hueso huésped en una superficie ideal del 80 %, jamás menor del 40 %. De no darse estas circunstancias puede ser aconsejable la utilización de técnicas cementadas. La utilización de auto y aloinjerto de hueso estructural o esponjoso molido resulta imprescindible en las reconstrucciones acetabulares.
Análisis de la información
En cirugía primaria es frecuente la aparición de un aflojamiento precoz de la cúpula cuando existe un defecto óseo en el acetábulo, ya que ello hace difícil la adecuada fijación inicial del componente protésico.15,16
Medios diagnósticos imagenológicos
El aflojamiento radiológico suele preceder a la clínica, cuyo síntoma más importante es el dolor. Una prótesis dolorosa precedida de intervalo indoloro sugiere aflojamiento o infección. Si el dolor es de inicio brusco, indica fracaso o rotura de algún componente. El dolor mecánico es más propio de aflojamiento aséptico, y el dolor en reposo suele indicar origen séptico. La localización inguinal o glútea del dolor sugiere aflojamiento del componente acetabular. El dolor en el trocánter puede sugerir también tendinitis de la bandeleta ilio-tibial, debilidad del músculo glúteo medio, bursitis, pseudoartrosis del trocánter o irritación por el material de fijación de la osteotomía trocantérea.17
El diagnóstico radiológico se realiza mediante una radiografía de control AP y axial postoperatoria, y en los sucesivos controles se valora:
Cambio en el ángulo de inclinación del componente acetabular.
Migración vertical u horizontal del mismo.
Rotura del cemento.
Refuerzos corticales.
Líneas periprotésicas de lucencia. En las artroplastias cementadas, las lucencias periprotésicas pueden ser normales si miden 1-2 mm entre el cemento y el hueso, sin rodear totalmente el implante.
El diagnóstico de aflojamiento definitivo se establece si:
Las lucencias aumentan progresivamente, o si el diámetro es mayor de 2 mm, que sugieren rotura del cemento.
La migración del implante es mayor de 2-5 mm.
La radiolucencia es continua en toda la longitud del implante.17
La vista anteroposterior de pelvis resulta de gran utilidad para valorar el estado del techo y fondo acetabular. Una penetración de la cabeza femoral más interna que la línea de Köhler indica un defecto del fondo acetabular, mientras que la pérdida de la lágrima de Köhler indica una afectación de la placa cuadrilateral. Sobre el estado de las columnas acetabulares la información es más limitada debido a que se superponen entre ellas y con la imagen del implante protésico. Una zona de lisis a nivel del isquion sugiere la existencia de un defecto de la columna posterior.18
En el posoperatorio se deben realizar las siguientes mediciones en las radiografías de pelvis ósea en proyección anteroposterior: la anteversión, la inclinación de la cúpula acetabular y el centro de rotación (Figs. 1y 2).
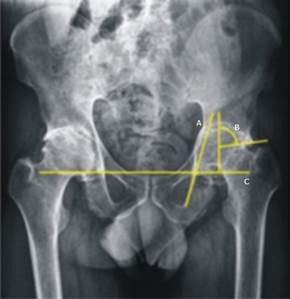
A: Línea de Köhler; B: Ángulo centro borde de Wiberg; C: Línea interlágrima de Köhler.
Fig. 1 Marcadores radiográficos utilizados en el diagnóstico de la protrusión acetabular.
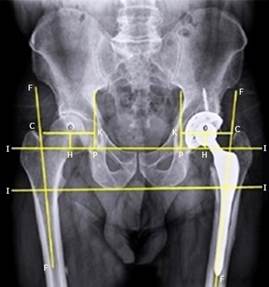
O: CR de la cadera; H-O: Altura del CR desde la línea t-t´; O-K: distancia horizontal del.CR; O-C: fuera del sitio femoral.
Fig. 2 Medición del centro de rotación.
KK’ es la línea de Kohler. La distancia del centro de rotación de la prótesis viene dada por la distancia entre el centro de la cabeza femoral del implante (CPFH), y el aproximado de la cabeza femoral (AFHC), que es el punto medio de la hipotenusa del triángulo (TAR) (Fig. 3).15
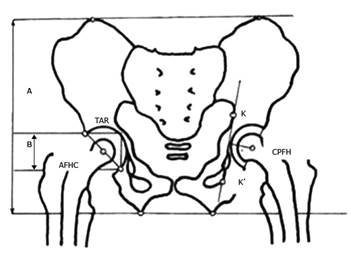
Fig. 3 Esquema que representa las mediciones realizadas para determinar la posición de la cúpula acetabular.
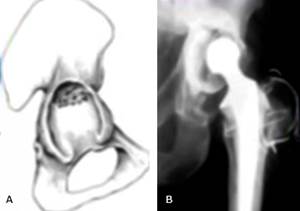
Proyecciones oblicuas: La columna anterior se puede observar en la proyección obturatriz, mientras que la columna posterior se puede analizar mejor en la proyección alar, como han descrito Judet y Letournel (Fig. 4).19
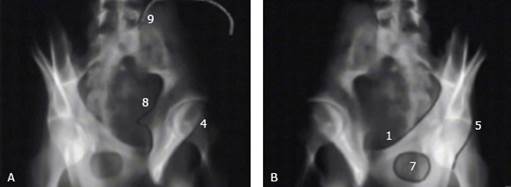
Fig. 4 A: Proyección oblicua Alar (columna posterior); B: Proyección oblicua obturatriz (columna anterior).
Ecografía: puede ser útil para detectar hematomas, derrames, patologías musculo-tendinosas, y masas de partes blandas alrededor de componentes protésicos con aflojamiento.20 También permite el diagnóstico del atrapamiento del psoas iliaco y su tratamiento sintomático mediante infiltración con corticoides.21
Artrografía: El inyectar un medio de contraste, con la finalidad de verificar su penetración en la interfase hueso-cemento resulta una prueba fidedigna de aflojamiento; aunque puede haber, a nivel del acetábulo un 15 % de falsos negativos. Es conveniente, al efectuar esta prueba, que el paciente camine unos minutos después de inyectar la sustancia radiopaca, para que se haga el bombeo de la sustancia de contraste hacia la interfase hueso-cemento. La captación combinada de tecnecio y galio o indio constituye un método útil para descartar sepsis. Puede detectar la movilización de la prótesis (paso del contraste entre los componentes y el hueso) y también colecciones periprotésicas.22
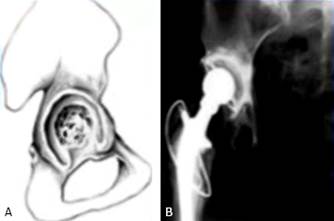
Angiografía: Puede utilizarse en ocasiones especiales en aquellos casos en que exista riesgo de lesión de vasos iliacos durante la revisión de una cúpula acetabular penetrada en la pelvis (Fig. 5). Si la angiografía mostrara un estrecho contacto entre los vasos y el implante, podría ser necesario un abordaje retroperitoneal para extraer la prótesis.2
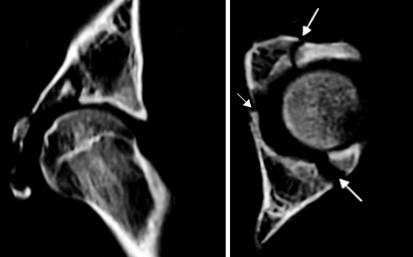
Tomografía axial computarizada (TAC): Ofrece una visión más detallada y precisa de los defectos acetabulares, que permite evaluar la posición y la anteversión de los componentes protésicos, el tamaño y la localización de la pérdida ósea y la calidad y la localización del hueso restante (Fig. 6). Hoy en día, las nuevas tecnologías nos permiten incluso obtener modelos plásticos impresos en tercera dimensión, los cuales nos brindan una perspectiva tangible del defecto óseo.23 Puede ser útil para crear modelos para reconstrucción, o para diseñar componentes protésicos a medida.
Resonancia magnética (RM): Es la prueba diagnóstica con mayor sensibilidad y capacidad de resolución para afecciones de distintos tejidos blandos. Cuenta con la ventaja de obtener imágenes en distintos planos sin perder la resolución, visualizar articulaciones sin usar contraste y de ser inocua. Si le asociamos contraste como el gadolinio, nos ofrecerá mucha información sobre la vascularización de las lesiones.20
Gammagrafía ósea: Con la introducción del SPET-CT se consigue una localización más precisa de la captación del trazador, que permite diferenciar el hueso de partes blandas, y por tanto aumentar la especificidad, lo cual ayuda en el estudio de la patología de cadera con prótesis dolorosa por sepsis, aflojamiento séptico o aséptico, fractura, metástasis, artritis inflamatoria y osteomielitis.20
La Sociedad de Medicina Nuclear de los EE.UU. ha publicado en sus Guías Prácticas (18 que fluorodeoxyglucose F-FDG es un trazador altamente sensible para detectar anomalías del esqueleto por medio de PET (tomografía por emisión de positrones). Señala además que el mecanismo de captación de la F-FDG recuerda la del tecnecio Tc-MDP99m, con mejores características farmacocinéticas y un aclaramiento sanguíneo mucho más rápido, así como dos veces mayor captación en el hueso.24
Cintigrama óseo: Es un examen de medicina nuclear que utiliza isótopos radioactivos trazadores en muy pequeñas cantidades por vía endovenosa sin efectos colaterales y permite detectar afectaciones metabólicas del esqueleto. Debido a que estas lesiones anteceden a las estructurales, los cambios pueden ser visualizados antes de que aparezcan en una radiografía.25
La evaluación de los resultados se basa en dos condiciones: la hipercaptación y la hipocaptación de los isótopos trazadores radioactivos. La mayor parte de las enfermedades que afectan al hueso producen hipercaptación del isótopo radioactivo utilizado. Esto se debe a la respuesta inflamatoria perióstica y osteoblástica normal que se genera en el tejido óseo ante una agresión, lo cual es un factor favorecedor de la captación. Las lesiones traumatológicas que generan solución de continuidad en el hueso, especialmente si existe daño vascular, pueden ocasionar hipocaptación local con hipercaptación perióstica o perivascular. Es evidente que al no haber irrigación sanguínea adecuada el isótopo no alcanza el sitio de la lesión.
Al no haber reacción osteoblástica o producción de hueso nuevo no hay captación ni generación subsecuente de rayos gamma, lo que puede indicar la falta de osteointegración de los componentes protésicos.25)
En los procesos infecciosos resulta de gran utilidad por la información que aporta, incluso antes de reflejar alteraciones en las radiografías convencionales (Fig. 7).
Medios diagnósticos de laboratorio
Diagnóstico de laboratorio: Hemograma, Eritrosedimentación, VHS y PCR.
La prueba del VHS es un indicador inespecífico de un estado inflamatorio agudo o crónico. Una VHS > 20 mm/hora debe hacer sospechar un estado inflamatorio. La concentración de proteína C reactiva es un indicador inespecífico de infección aguda. Por lo general, se normaliza a las tres semanas de una intervención quirúrgica. Un nivel de proteína C reactiva > 7 mg/l indica un proceso inflamatorio agudo. El hemograma completo con recuento diferencial puede estar alterado en presencia de una infección o una enfermedad sistémica.
La artrocentesis se diferencia en el conteo de leucocitos del pos operatorio agudo y el crónico.
Posoperatoria aguda: Cifra de leucocitos 27 000 células/ml. Más de 90 % de leucocitos polimorfonucleares.
Postoperatoria crónica: Cifra de leucocitos 2500 células/ml, y más de 90 % de leucocitos polimorfonucleares. Pueden aceptarse cifras más bajas de polimorfonucleares si el cuadro clínico es muy sospechoso de infección con VHS, o proteína C reactiva elevada.
Sistemas de clasificación basado en las radiografías
Todo sistema de clasificación de defectos óseos, basado en hallazgos radiográficos preoperatorios, debe considerar los siguientes aspectos:26
Se basará en estudios radiográficos fáciles de obtener;
Debe ser validado por la existencia de cifras bajas de error interobservador e intraobservador;
La clasificación que se utilice debe servir de guía al cirujano para facilitar la elección de la técnica quirúrgica utilizada durante la cirugía de revisión.27
La mayor parte de la pérdida ósea se produce de modo insidioso y puede originar una discontinuidad pélvica difícil de observar, incluso durante la cirugía.
La existencia de una discontinuidad pélvica requiere de su estabilización antes de proceder a la reconstrucción del defecto óseo.28
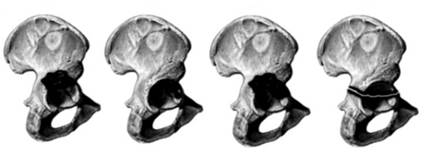
Existen diferentes clasificaciones para valorar el defecto óseo acetabular. A propuesta de la AAOS (American Academy of Orthopaedic Surgeons), D’Antonio y otros clasificaron en 1989 los defectos óseos acetabulares en 5 tipos:28
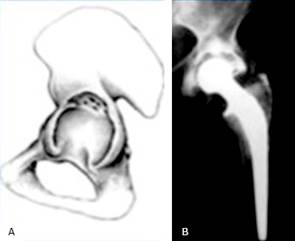
Tipo I: Defecto segmentario, definido como cualquier pérdida de hueso en la porción de soporte de la hemiesfera acetabular, incluida la parte medial (Fig. 8);
Tipo II: Defecto cavitario, definido como la pérdida volumétrica de estructura ósea de la cavidad acetabular con el borde acetabular intacto (Fig. 9);
Tipo III: Defecto combinado que se define cuando los dos defectos previamente citados coexisten (Fig. 10);
Tipo IV: Cuando existe una discontinuidad pélvica (Fig. 11);
Tipo V: Cuando existe una artrodesis de cadera. El tipo V va incluido en esta clasificación por la dificultad de su tratamiento. Aunque de gran sencillez, este sistema de clasificación no establece diferencias en relación con el grado de afectación o de pérdida de hueso en cada uno de los tipos utilizados, por lo que resulta de dudosa utilidad para el cirujano (Fig. 12).1
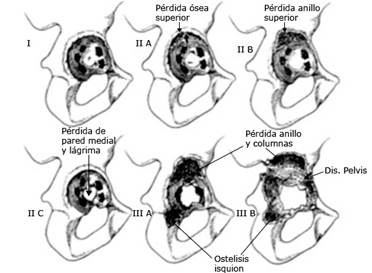
La clasificación de Paprosky es considerada más práctica y sencilla. Se basa en la posibilidad de dar estabilidad a los componentes no cementados, aunque por extensión se emplea para valorar todo tipo de defectos óseos acetabulares. Presenta tres tipos fundamentales subdivididos en varias categorías (Fig. 13)
I. Mínimo defecto óseo,
IIA. Defecto superior pequeño,
IIB. No hay cúpula superior,
IIC. Defecto de pared medial,
IIIA. Pérdida ósea grave,
IIIB. Osteolisis severa.
La clasificación de Paprosky tiene como base la radiología AP de la cadera, que genera cuatro criterios que van a determinar el grado de defecto óseo que presenta el acetábulo. Los criterios básicos son:
Migración del centro de rotación de la cadera (valora defectos superiores)
Osteolisis del isquion (defecto posteroinferior).
Destrucción de la lágrima (defecto anteroinferior).
Disrupción de la línea de Köhler (defectos de pared medial).
Los defectos de tipo I no afectan la integridad del acetábulo, de forma que son básicamente iguales a una cadera normal. En principio no están afectados los muros, ni la pared medial.
El tipo II incluye una migración superior inferior a 2 cm y/o una migración medial sin compromiso de las columnas. El tipo II a su vez se subdivide en 3 categorías:
Defecto superior pequeño, sin afección primaria del borde superior,
No hay cúpula superior, aunque el defecto no tiene que ser grande,
Defecto de pared medial (fondo acetabular).
Todos estos defectos suponen que se mantiene el anillo acetabular intacto y secundariamente podría emplearse implante no cementado para su manejo con, o sin empleo de injerto óseo asociado.28
El tipo III son los más graves y también presentan subdivisión:
IIIA presenta una lisis superior mayor de 3 cm con línea de Köhler intacta o insuflada, lisis del isquion menor de 15 mm y destrucción parcial de la lágrima.
IIIB presenta una lisis superior mayor de 3 cm, disrupción completa de la de línea de Köhler, lisis del isquion mayor de 15 mm y destrucción total de la lágrima.
Desde el punto de vista del abordaje de estas lesiones, es importante concretar que los defectos de tipo I y II mantienen al menos un 70 % del hueso acetabular y en principio no es necesario el empleo de anillos antiprotusivos. Sin embargo, el tipo III implica niveles inferiores al 70 %, o incluso menos del 50 % del stock óseo (en las IIIB) y requieren siempre la adición de injertos y colocación de anillos antiprotusivos para crear un montaje biomecánicamente estable y funcional.
Paprosky diseñó su clasificación con el fin de elegir la técnica de revisión en dependencia del grado de defecto óseo.18,28 La clasificación se basa en el estudio de cuatro criterios:
Migración superior de la cúpula,
Existencia de lisis isquiática (defecto de la columna posterior),
Ausencia de la línea de Köhler (lesión del fondo acetabular),
Existencia de lisis a nivel de la lágrima de Köhler (lesión de la columna anteroinferior).
De acuerdo con estos criterios, Paprosky divide los defectos acetabulares en diferentes grupos (Tabla),18) y en criterios radiográficos (Fig. 14).
Tabla Clasificación del defecto acetabular Paprosky
| Tipo | Migración superior* | Lisis isquion** | Migración medial*** | Lisis lágrima de Köhler**** |
|---|---|---|---|---|
| I | No significativo | No | No | No |
| IIA | No significativo | Leve | Grado I | Leve |
| IIB | No significativo a significativo | Leve | Grado II | Leve |
| IIC | No significativo | Leve | Grado III | Moderado a grave |
| IIIA | Significativo | Moderado | Grado II+ o III | Moderado |
| IIIB | Significativo | Grave | Grado III+ | Grave |
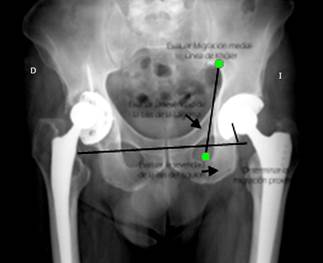
*No significativo: menor de 3 cm por encima de la línea obturatriz transversa superior; Significativo: si tiene más de 3 cm. **Leve: de O-7 mm por debajo de la línea obturatriz transversa superior; Moderado de 7-14 mm por debajo de la línea obturatriz transversa; Superior, grave > 15 mm. ***Grado I lateral a la Línea de Kölher, Grado II migración a la Línea de Kölher, Grado II + expansión medial de la línea de Kölher dentro de la pelvis, Grado III migración dentro de la pelvis que afecta a la Línea de Kölher, Grado III+ marcada migración dentro de la pelvis. **Leve pérdida mínima del borde lateral, Moderado pérdida completa del borde lateral, Grave pérdida del borde lateral y media.
Fig. 14 Componentes de los criterios radiográficos de la clasificación de Paprosky.
Para Paprosky, en los defectos del tipo I y II, la pérdida de hueso es menor del 30 % de la superficie acetabular. El tipo IIIA tiene una pérdida de hueso entre el 30 y el 50 %, mientras que el tipo IIIB tiene un defecto de hueso mayor del 50 %. El principal problema de esta clasificación es que no toma en consideración defectos específicos como la discontinuidad pélvica, que, aunque puede ser incluida en los defectos tipo IIIB, debe considerarse como un defecto diferente dadas sus características.
La clasificación de Paprosky está pensada para poder elegir la opción más adecuada en el momento de la revisión. Para Gross existen tres tipos de defectos: protrusión, defectos menores (con pérdida del reborde acetabular menor del 50 %), y defectos mayores (con pérdida mayor del 50 %) de las columnas acetabulares.31,32
Engh y otros utilizan una clasificación muy sencilla:33
Tipo I (leve): Se caracteriza por una mínima pérdida ósea con un reborde y un fondo acetabular intactos;
Tipo II (moderada): Se define cuando el reborde acetabular es deficiente, pero el fondo está intacto;
Tipo III (grave): Se caracteriza por un reborde y un fondo deficiente.
Gustilo y Pasternak refieren cuatro tipos:34
Tipo I: Cuando sólo existe un menor ensanchamiento de la pared acetabular;
Tipo II: Si existe un marcado ensanchamiento de la cavidad acetabular, pero sin llegar a perforarla;
Tipo III: Si existe un defecto local en la pared acetabular, anterior, posterior, superior o medial;
Tipo IV: Cuando se observa un colapso o defecto masivo que afecta a dos o más paredes acetabulares.
Chandler y Penenberg, dividen el acetábulo en techo, fondo y columnas:35
Tipo I: Defectos del reborde acetabular;
Tipo II: Defectos intracetabulares;
Tipo III: Protrusión de la pared medial;
Tipo IV: Perforación de la revisión acetabular pared medial;
Tipo V: Defectos combinados, con diferentes subgrupos.
El aflojamiento de la cúpula acetabular conlleva cierto grado de defecto óseo que determina la conducta a seguir en el momento de la cirugía de recambio. Todo defecto óseo debe ser evaluado tanto antes de la intervención como en el momento de la cirugía, ya que puede variar durante la misma, especialmente en presencia de componentes difíciles de extraer, pudiendo los defectos menores convertirse en grandes defectos difíciles de resolver.
La experiencia a corto plazo con componentes acetabulares cementados ha sido decepcionante. Varias series comunicaron una alta incidencia de aflojamiento radiológico y de revisiones.
Amstutz y otros36 analizaron 66 revisiones acetabulares cementadas y señalaron que el 10 % de las copas acetabulares demostraban una línea radiolúcida completa en el posoperatorio inmediato. Luego de un período de seguimiento promedio de solo 2,5 años, esta línea se había incrementado al 71 % de los cótilos revisados.
Raut y otros37) en pacientes jóvenes (de 55 años o menos), luego de 6 años de seguimiento promedio, comunicaron un índice de aflojamiento acetabular del 51 %.
Kavanagh y otros38) informaron que el 70 % de una serie de 166 revisiones acetabulares cementadas se relacionaron con radiolucencias progresivas. No obstante, la tasa de revisión por aflojamiento aséptico fue de sólo el 2 % a los 4,5 años.
Callaghan y otros,39 en una serie de pacientes operados con el uso de técnicas modernas de cementación, hallaron que la prevalencia de falla mecánica después de la revisión, no había mejorado; 9 % de las copas habían migrado y 19,4 % mostraron formación progresiva de líneas radiolúcidas a los 4 años. Cuando se incluyen los componentes acetabulares con líneas radiolúcidas continuad, se puede observar que 34,2 % de los acetábulos revisados estaban radiológicamente flojos.
Mulroy y Harris40 utilizaron técnicas de cementación de segunda generación, y hallaron que 4 % de los componentes acetabulares estaban flojos a los 14 años de seguimiento.
Franzen y otros41 observaron que 15 de los 17 componentes revisados con cemento habían migrado, y 13 de 17 migraron dentro de los primeros 4 meses. En este caso, la migración estuvo relacionada con una línea radiolúcida completa.
Garcia-Cimbrero y otros42 informaron un índice de revisión de 13 % con componentes acetabulares cementados tipo Charnley a los 16 años de seguimiento. En este caso el índice de aflojamiento radiológico fue de 24 %.
Los problemas asociados con la revisión cementada del acetábulo están relacionados en forma directa con la calidad de la reserva ósea remanente. Con grados variables de defectos óseos que producen un lecho acetabular esclerótico sin hueso trabecular, es muy difícil lograr interdigitación con el cemento acrílico.43,38
A pesar de los malos resultados obtenidos con componentes acetabulares cementados y los alentadores resultados a corto y a mediano plazo con componentes no cementados de revestimiento poroso, existe todavía un margen para la fijación cementada directa de un componente de polietileno (Fig. 15). A su vez, en casos de pérdida ósea acetabular severa (más de 50 %), en los que no puede lograrse fijación estable con una copa no cementada y se hace necesario el uso de un injerto estructural y una celda de reconstrucción acetabular, se debe cementar una copa íntegramente de polietileno, o bien una copa con revestimiento metálico posterior. Por último, en la técnica de compactación de hueso esponjoso también se utiliza cemento como método de fijación.7)
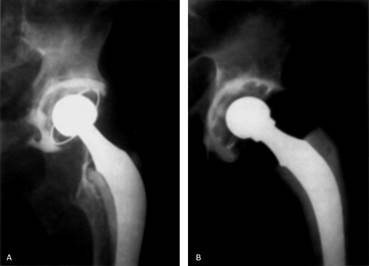
Fig. 15 A: Aflojamiento aséptico en un paciente de 80 años con osteoporosis severa y defecto óseo acetabular Cavitario tipo II de la clasificación de la AAOS y de tipo I de la clasificación de Paprosky; B: Resultado radiológico posoperatorio de la revisión con técnica de cementación moderna de un cótilo de polietileno.1
Harris describe el componente acetabular como aflojamiento definitivo cuando hay migración del componente, o cuando se evidencia fractura del cemento. Por último, describe un aflojamiento probable cuando se manifiestan líneas radiolúcidas en la interfase cemento-hueso mayores de 2 mm.44
Reconstrucción acetabular no cementada
Indicaciones y técnica quirúrgica
La indicación más frecuente de la reconstrucción acetabular no cementada es la revisión por aflojamiento aséptico de componentes cementados o no cementados. Otras indicaciones incluyen pérdida ósea periprotésica causada por osteolisis con aflojamiento del implante o sin él, mala posición del componente, fricción entre los componentes que produzca disfunción articular e infección.
La técnica quirúrgica comprende la obtención de la máxima cobertura ósea con un componente acetabular de revestimiento poroso hemiesférico y el relleno de defectos con injerto óseo esponjoso.7 El substrato óseo ideal será aquel que cubra completamente la cúpula acetabular mediante hueso sano por la parte craneal, medial y posterior, y casi completamente por la parte anterior, al estar el centro de rotación en su lugar anatómico. Cualquiera que sea el abordaje utilizado, el cirujano debe ser capaz de obtener una exposición adecuada de la pelvis. La osteotomía del trocánter facilita obviamente una mejor exposición del sector acetabular.7 Es preciso un manejo atraumático de los tejidos blandos. Las estructuras blandas son menos traumatizadas al seccionarlas con bisturí que por disección roma. Insistimos en el manejo atraumático de las partes blandas y en avanzar con la disección desde lo conocido a lo desconocido, especialmente en presencia de planos tisulares cicatriciales.
Los principios de reconstrucción que deben seguirse en la cirugía de revisión son los siguientes:2
Se debe restituir la mecánica articular ubicando el centro de rotación en una locación compatible con una buena función.
Se debe restituir la integridad anatómica del cótilo.
Se debe asegurar la cobertura del componente acetabular con no menos del 60% de hueso-huésped.
Se debe obtener una fijación estable del injerto con una adecuada compresión interfragmentaria.
Se debe lograr una fijación protésica estable.
La estabilidad de la cadera operada se debe lograr en la mesa de cirugía.
La orientación del componente acetabular debe ser de 40o a 45o de inclinación y de 10o a 20o de anteversión.
El éxito depende de la estabilidad inicial, la cual se encuentra íntimamente relacionada con la obtención de un buen calce a presión, y/o con la fijación rígida del implante con tornillos.7 En el momento de la extracción del implante es fundamental reducir la pérdida ósea y evitar la destrucción ósea iatrogénica. Para esto, cuando se extrae un componente acetabular no cementado osteointegrado, se debe liberar el implante primero en toda su circunferencia, sobre todo en la región inferior, donde la fijación biológica suele ser extensa, y el acceso con osteótomos curvos, difícil.45
Luego de una limpieza cuidadosa de las partes blandas se debe realizar una evaluación de la reserva ósea remanente. En este momento, es esencial identificar la presencia y ubicación del defecto óseo y establecer si es contenido o no. Los defectos contenidos y los no contenidos de ubicación medial son tratados con partículas de autoinjerto y/o aloinjerto.46 Los defectos segmentarios de mayor tamaño podrían requerir el uso de injerto óseo estructural. En este caso, si la reserva ósea es adecuada (50 % de contacto entre la superficie de crecimiento óseo del implante y el hueso huésped) y el componente es mecánicamente estable, es posible proceder a la colocación de un componente acetabular no cementado de revestimiento poroso.
A continuación, se comienza el fresado de la cavidad acetabular. El objetivo del fresado es quitar inicialmente el hueso esclerótico hasta obtener una superficie hemiesférica uniforme. Al principio se utilizan fresas de menor tamaño con la aplicación de poca fuerza. Después, en forma progresiva se utilizan fresas de mayor tamaño hasta hacer contacto con el ísquion, el pubis y el íleon. El fresado debe realizarse en la dirección deseada de inserción del implante, en general en 40o de abducción y 20o de anteversión. La decisión de usar un componente 1mm o 2 mm mayor que el último fresado para obtener un calce a presión óptimo debe basarse en la calidad ósea remanente y en la presencia de defectos óseos. Si se decide utilizar un componente mayor que el último fresado, y obtener calce a presión, se debe considerar que el hueso esclerótico puede fracturarse durante la inserción del componente. Con el componente de prueba, o la última fresa como guía, se coloca injerto óseo según se requiera.
El defecto acetabular más comúnmente hallado es el contenido. En este tipo de defectos se introduce autoinjerto o aloinjerto de hueso esponjoso, y luego se compacta con las fresas hemiesféricas en posición inversa.
El uso de tornillos cuando se utiliza un componente hemiesférico poroso mejora la estabilidad inicial y se asocia con una mejor fijación biológica. La colocación de los tornillos debe efectuarse en los cuadrantes seguros de la pelvis.47 Luego, se coloca el inserto de polietileno apropiado. Es fundamental confirmar la estabilidad del inserto y la ausencia de fricción del cuello protésico sobre él (Fig. 16).
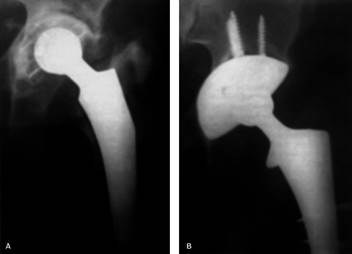
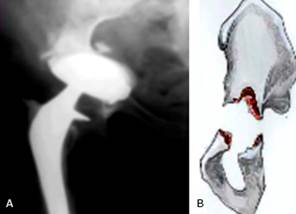
Fig. 16 A: Aflojamiento aséptico en un paciente de 71 años, con defecto óseo acetabular de tipo III de la clasificación de la AAOS (defecto segmentario pósteromedial, con compromiso segmentario parcial de la pared anterior), y de tipo IIA de la clasificación de Paprosky. Se encuentra conservada por lo menos el 80 % de la superficie ósea acetabular. B: Resultado radiológico de la reconstrucción acetabular realizada con un cótilo hemiesférico de superficie porosa no cementado fijado con tornillos.7
Las instrucciones para el período posoperatorio dependen de factores tales como: estabilidad del montaje, uso de aloinjerto estructural y fijación del trocánter. En general, se sugiere descarga de peso del 50 % durante las primeras 6 semanas, seguida de incremento progresivo según la tolerancia, y uso de bastón durante las siguientes 4 a 6 semanas.7
En la ATC, los biomateriales de los componentes de reemplazo deben atender altas solicitudes mecánicas para las cuales solo los materiales metálicos satisfacen este requisito. Es necesaria la funcionalización de la superficie para promover la osteointegración y evitar el aflojamiento de la prótesis y su consecuente falla.47)
Existen dos tipos de interacción celular, la célula-célula y célula-sustrato. En la adhesión célula-sustrato, las células tienden a vincularse a través de las proteínas de la matriz extracelular adsorbidas sobre la superficie del sustrato. Los fibroblastos, las células madre mesenquimales, y los osteoblastos son dependientes de este tipo de anclaje, y requieren la formación de tales sitios de adhesión para sobrevivir.
La adhesión celular es mediada por varios tipos de proteínas asociadas con el citoesqueleto de la célula, tales como las integrinas. Uno de los mecanismos de la adhesión celular implica su adhesión a las proteínas utilizando pequeños complejos altamente organizados conocidos como contactos focales, centros de adherencias, o placas de adhesión.48
Actualmente, se consideran dos enfoques que se pueden aplicar de manera aislada, o en combinación, para bioactivar las superficies metálicas. Estos son los tratamientos superficiales para modificar la topografía y la aplicación de recubrimientos bioactivos. La modificación de la topografía de la superficie es una técnica utilizada actualmente no solo para las prótesis no cementadas, sino también para las cementadas. En esta última modalidad, una superficie con mayor rugosidad aumenta el área de contacto entre la prótesis y el cemento óseo lo cual garantiza una mejor fijación del componente al hueso. Sin embargo, en las prótesis cuya fijación es no cementada, la topografía de la superficie determina el éxito del reemplazo articular.
Entre los polímeros más novedosos y de mayor uso en aplicaciones de regeneración de tejidos se encuentra el quitosano (QT). Éste es un polisacárido de origen natural obtenido principalmente de la desacetilación de la quitina, biopolímero abundante que se encuentra en el exoesqueleto (concha) de crustáceos marinos y paredes celulares de hongos.49,50 Los estudios sobre QT como biomaterial se han intensificado en los últimos 25 años. En ingeniería de tejido óseo, éste ha sido ampliamente utilizado debido a una bioactividad relacionada con la presencia de fracciones de N-acetilglucosamina en el QT. De hecho, los oligosacáridos del QT tienen un efecto estimulante sobre los macrófagos y son quimiotácticos para los neutrófilos tanto in vitro como in vivo.50,51 De igual manera, el QT posee una alta capacidad antibacterial, adecuada degradabilidad, la posibilidad de funcionalización con diversas moléculas bioactivas debido a la disponibilidad de diferentes grupos funcionales (aminas e hidroxilos) en su estructura molecular y la facilidad de ajustar perfiles de liberación controlada de estas biomoléculas.52) Un enfoque prometedor es la introducción de proteínas de señalización tales como las proteínas morfogenéticas (BMP) que juegan un papel importante en la formación de hueso y cartílago, en el QT. Entre los miembros de la familia BMP, la BMP-2 ha demostrado ser uno de los factores de crecimiento más eficaces para mejorar la formación de hueso in vivo.53
Resultados de la revisión acetabular no cementada
Los resultados más alentadores en cirugía de revisión acetabular se han dado con el uso de componentes hemiesféricos no cementados de revestimiento poroso, con injerto óseo o sin él.7)
Tanzer y otros54 informaron los resultados de una serie de 140 revisiones acetabulares con la utilización de componentes no cementados de revestimiento poroso en un período de seguimiento de 41 meses. El porcentaje de falla mecánica fue de sólo el 1 % (2 caderas), ambas con pérdida ósea acetabular severa y discontinuidad pelviana. En este estudio, en 11 caderas se colocó injerto en bloque (3 aloinjertos y 9 autoinjertos). No obstante, ninguno de los injertos se utilizó para brindar mayor soporte estructural al componente acetabular.
En un estudio realizado por Lachiewicz y otros55 la prevalencia de aflojamiento del componente acetabular con el uso de componentes no cementados en revisiones fue de 0 % a los 5 años.
Weber y otros56 informaron una prevalencia de 0 % de revisión por aflojamiento aséptico y 2 % de aflojamiento radiológico del componente acetabular en una serie de 61 artroplastias de revisión híbridas con un seguimiento promedio de 6 años. Estos resultados se compararon con los de un grupo de 74 artroplastias de cadera realizadas con técnicas modernas de cementación por el mismo cirujano en el mismo período de seguimiento. La incidencia de re-revisión del componente acetabular cementado fue del 9 %, y el índice de aflojamiento radiológico, del 21 %. En este estudio los resultados obtenidos fueron significativamente mejores con componentes acetabulares no cementados que con componentes cementados durante un período de seguimiento comparable.
Paprosky y Sekundiak57 informaron la ausencia de aflojamientos asépticos en una serie de 125 pacientes con defectos óseos Paprosky tipo I y tipo II con un seguimiento promedio de 6,6 años.
Gross y otros58,59 comunicaron una tasa de éxito del 76 % (sin signos de aflojamiento radiológico) con copas acetabulares no cementadas utilizadas conjuntamente con injerto óseo estructural para casos de revisión con pérdida ósea segmentaria, y con un seguimiento promedio de 7,1 años.
Se han utilizado diferentes formas de medición del aflojamiento acetabular en las ATC con componentes no cementados. 60) Judet R y otros19 proponen realizar una serie de mediciones radiológicas en los estudios tomados para el seguimiento del paciente, tanto en la radiografía anteroposterior como en la lateral, para identificar líneas radiolúcidas mayores de 2 milímetros, cambios en la inclinación acetabular mayores de 3° grados como índice de migración, líneas radiolúcidas alrededor de los tornillos y fatiga de éste material de fijación en el componente acetabular.
En el Rush-Presbyterian-St Luke's Medical Center los resultados de revisiones por aflojamiento aséptico con componentes acetabulares no cementados fueron informados a corto plazo (promedio 3,5 años de seguimiento),61 y a largo plazo (promedio 10,5 años de seguimiento). Ambos estudios muestran los resultados clínicos y radiológicos de 138 revisiones acetabulares no cementadas consecutivas realizadas en 131 pacientes por aflojamiento aséptico. Los defectos óseos se clasificaron de acuerdo con el sistema de la AAOS.18) Hubo 9 de tipo I (7 %), 102 de tipo II (74 %), 14 de tipo III (10 %), 2 de tipo IV (1 %) y ninguno de tipo V. Once caderas (8 %) tenían mínima deficiencia ósea y no pudieron ubicarse dentro de ninguno de estos grupos. A corto plazo, el índice total de revisión del componente acetabular fue de 5 %, 3 % por infección y 2 % por luxación, y fue esta última la complicación más frecuente (6 %). El índice de aflojamiento aséptico fue de 0 %, y en 5 % de los casos se revisó el componente femoral. Si bien se observó con frecuencia el desarrollo de líneas radiolúcidas, ninguna fue mayor de 2 mm y ningún componente migró en ausencia de infección. El seguimiento a largo plazo de esta serie (promedio 10,5 años) confirmó los excelentes resultados obtenidos a corto plazo. En este estudio se observó un índice de revisión acetabular total de 10,7 %, 4,6 % por luxación, 3,8 % por infección y tres componentes fueron revisados en otra institución en cirugías indicadas para revisión del componente femoral (2,3 %). Ningún componente acetabular de esta serie fue revisado por aflojamiento aséptico, pero dos (1,8 %) reunieron los criterios radiológicos, con radiolucencias completas de más de 2 mm. La tasa de revisión femoral fue de 27 % después de la revisión acetabular original.
El índice de supervivencia de Meier para revisión acetabular o aflojamiento radiológico a los 11,5 años fue de 84 %, y al utilizar los criterios de aflojamiento aséptico este fue de 98 % en igual período. Si bien se observaron diferentes grados de osteolisis pelviana en 17 % de los pacientes, en comparación con 0 % del primer estudio, éste no es un dato sorprendente dada la edad de los pacientes en el momento de la cirugía (promedio 50 años). La incidencia de osteolisis en componentes en los que la porción de fibras metálicas se había separado o fragmentado de la copa acetabular fue del 44 %, lo cual es mucho más alto que la incidencia total en el grupo. Aunque estas lesiones osteolíticas son pequeñas y no se relacionan con la zona retroacetabular, este hecho sugiere el inicio de una complicación relacionada con el implante, hasta ahora no observada, y obliga al estudio directo de este fenómeno durante la segunda década de seguimiento de estos pacientes. Por último, con la utilización de esta técnica, se observó una relación directa entre los fracasos y las caderas con mayor grado de deficiencia ósea en la pelvis, por ejemplo, en diástasis pelviana.62
Conclusiones
La artroplastia total de cadera ha demostrado mejorar significativamente la calidad de vida en pacientes, con una baja tasa de complicaciones. Para prevenir el aflojamiento aséptico es necesario ser cuidadosos en la técnica de colocación de los componentes protésicos y utilizar el tipo de material más adecuado según la edad, la demanda funcional y la reserva ósea de cada paciente.