Introducción
Las lesiones tendinosas son muy comunes en medicina deportiva y ortopedia, de hecho, suponen un 30 % de las consultas musculoesqueléticas. La actividad deportiva es la principal fuente de tendinopatías. El 30 % de los corredores presentan tendinopatía aquilea y la tendinopatía rotuliana representa el 55 % de las afectaciones en deportes que implican salto. También aparece en diferentes trastornos como pueden ser enfermedades metabólicas o patología inflamatoria articular.1,2 Esta afectación cursa con dolor considerable, discapacidad y está asociada a una gran carga socioeconómica.2,3 La causa de la afectación en el tendón es multifactorial y se proponen múltiples mecanismos como: hipoxia, isquemia, estrés oxidativo, hipertermia o sobrecarga tendinosa.1,4,5
En la tendinopatía se observan cambios histológicos del tendón que afectan de forma negativa la capacidad del tejido de tolerar carga. La carga a la que se somete al tendón puede tener consecuencias negativas cuando es excesiva, o positivas cuando es tolerable. Actualmente el abordaje principal de esta patología se centra en una correcta gestión de la carga tendinosa y el trabajo muscular excéntrico.5,6
En función de los diferentes cambios histológicos en la patología del tendón se han descrito varios estados como la degradación/rotura del colágeno, la inflamación y las respuestas de la célula tendinosa. Otros modelos han intentado integrar el sistema nervioso central y el dolor con la patología.1,5 Actualmente el modelo que presenta mayor aceptación es el modelo continuo de tendinopatía.7 En este modelo se explica la tendinopatía como un proceso continuo basado en las características de los tres estados tisulares:
Tendinopatía reactiva, que se produce por una sobrecarga aguda de fuerzas de compresión o tensionales y no tiene respuesta inflamatoria.
Tendón desestructurado que se describe como una recuperación fallida donde se produce el desarrollo y progresión de la desestructuración fibrilar.
Tendinopatía degenerativa que hace referencia a la progresión de la desorganización de la matriz y el colágeno, cambios en la célula y aparición de neovascularización.5,7
Antiguamente el término “tendinitis” era empleado para describir el dolor y la disfunción del tendón, pero a finales de los 90 se sugirió que tendinopatía era un término más adecuado para describir el dolor y la disminución de la función. También, el uso de tendinitis para describir lesiones crónicas era confuso, ya que ciertos tendones presentaban una lesión degenerativa con ausencia de células inflamatorias. Aunque en estudios recientes estos hallazgos han sido puestos en duda.8
Aunque el término “tendinitis” era utilizado para designar la mayoría de patologías que afectan al tendón, éste solo alude a lesiones agudas y por lo tanto su sintomatología no debería durar más de tres semanas.9,10 Los estudios histológicos básicos mostraron ausencia de células inflamatorias, tales como leucocitos polimorfonucleares, monocitos, macrófagos y células T, por lo cual el término se consideró inapropiado, y pasó a llamarse “tendinosis”.9,10 Del mismo modo, los avances en la biología del tendón han puesto de manifiesto que la ausencia de infiltrado inflamatorio agudo no necesariamente permite descartar un posible papel de la inflamación en la patogenia de tendinopatía. La respuesta inflamatoria protege el cuerpo contra la lesión y puede promover la curación, pero en sí misma puede desregularse y provocar consecuencias perjudiciales. Es cada vez más aceptado que los mecanismos inflamatorios y el sistema inmunológico innato se activan dentro del microambiente de la matriz del tendón durante la lesión tisular y probablemente contribuyan a la homeostasis alterada. Sin embargo, todavía se aprecia una carencia de estudios que esclarezcan este debate.1,10
Los antiinflamatorios no esteroideos (AINEs) constituyen el grupo de medicamentos más prescrito, solo en 2018 se recetaron en 11,5 millones de ocasiones. Los AINEs presentan múltiples usos terapéuticos tanto en el tratamiento de dolencias musculoesqueléticas como en otras enfermedades debido a su actividad antipirética, antiinflamatoria, analgésica, y como antiagregante plaquetario. La acción de los AINEs consiste en la inhibición de la ciclooxigenasa -1 (COX-1), ciclooxigenasa -2 (COX-2) y la inhibición de la síntesis de prostaglandinas y tromboxanos. Los AINEs se clasifican en tradicionales (no selectivos para la COX-2) donde destacan el ibuprofeno, naproxeno o diclofenaco y los selectivos (inhibidores selectivos de la COX-2, denominados coxibs) como el celecoxib y etoricoxib.11
Los AINEs son comúnmente utilizados para el tratamiento de la tendinopatía, pero la evidencia sobre el efecto de estos fármacos es escasa y todavía persiste el debate sobre la presencia de inflamación activa en este proceso degenerativo crónico y es considerada una lesión por sobreuso,2,7,9,10,12 la cual puede generar una cronificación de la patología por enmascaramiento del dolor o un retraso en el proceso regenerativo.5,7
El objetivo de este estudio consistió en realizar una revisión sistemática que analizara los efectos de los AINEs sobre el dolor, el rango de movimiento (ROM) y la funcionalidad de sujetos con tendinopatía por sobreuso. De manera específica, se buscó determinar el nivel de evidencia científica sobre el uso de estos fármacos en la lesión tendinosa.
Métodos
Para la realización de este trabajo se llevó a cabo una búsqueda en las siguientes bases de datos científicas durante los meses de enero y febrero de 2021: PubMed, Web Of Science (WOS), Scopus, Physiotherapy Evidence Database (PEDro) y búsqueda conjunta en Medline, Cumulative Index to Nursing & Allied Health Literature (Cinahl) y SPORTDiscus. Para ello se utilizaron varios descriptores MeSH y términos libres relacionados: “Anti-inflammatory Agents”, “Non-steroideal”, “NSAIDs”, “Tendon injuries”, “Tendinopathy”, “Patellar ligament”, “Elbow tendon”, “Achilles tendon”, “Shoulder impingement syndrome”, “Elbow tendinopathy”. En la estrategia de búsqueda se combinaron los términos referentes al concepto de los AINEs con los términos del concepto de tendinopatía por medio del operador booleano “AND”, y dentro de cada concepto los términos se combinaron con el operador “OR”. No se establecieron límites en el rango temporal de las publicaciones.
Con el objetivo de delimitar las búsquedas para obtener los resultados necesarios, se establecieron criterios de selección para los estudios.
Como criterios de inclusión, se añadieron todos aquellos trabajos en español, inglés y portugués que fueran ensayos clínicos aleatorizados (ECAs) en humanos con diseño paralelo y que utilizaran los AINEs como estrategia terapéutica en tendinopatías.
Como criterios de exclusión, se descartaron aquellos estudios cuyo mecanismo lesional no fuera el sobreuso.
La calidad metodológica se evaluó mediante la escala PEDro (Physiotherapy Evidence Database). En esta escala la validez externa se evalúa con un único criterio, la elegibilidad, pero este criterio no computa para calificar la calidad metodológica y el riesgo de sesgo, que se basa en los 10 criterios definidos para medir la validez interna. A cada criterio se le proporciona un punto en caso de cumplirse. Los criterios que valora son: asignación aleatoria, asignación oculta, cegamiento del terapeuta, cegamiento del evaluador, seguimiento adecuado, intención de tratar, comparación entre grupos y estimaciones puntuales y variabilidad. La puntuación varía de un mínimo de 0 a un máximo de 10.13
Para analizar el nivel de evidencia científica se usaron los criterios de Van Tulder, que determinan el nivel de evidencia en base a la puntuación de la calidad metodológica de la escala PEDro. De acuerdo a esto establece cinco niveles en los cuales clasifica los diferentes estudios según la evidencia:14
Evidencia sólida: proporcionada por hallazgos generalmente consistentes en 3 o más ECAs de alta calidad metodológica.
Evidencia moderada: proporcionada por resultados generalmente consistentes en 1 ECA de alta calidad metodológica o en múltiples ECAs con moderada calidad metodológica. Evidencia limitada: proporcionada por hallazgos consistentes en 1 o más ECAs de baja calidad metodológica.
Evidencia contradictoria: hallazgos no coherentes o inconsistentes en múltiples ECAs. Ninguna evidencia: ningún ECA encontrado.
Análisis y síntesis de la información
La estrategia de búsqueda proporcionó un total de 463 resultados y finalmente 13 ECAs fueron incluidos en esta revisión. En la figura 1 se muestra el diagrama de flujo de acuerdo con la última actualización de la declaración PRISMA (Preferred Reporting Items for Systematic reviews and Meta-Analyses).15
En cuanto a la calidad metodológica, la puntuación media obtenida en la escala PEDro fue de 7,15 sobre 10. A continuación se muestra la puntuación asignada a cada criterio (Tabla 1).
Tabla 1 Calidad metodológica evaluada mediante la escala PEDro
| Autores ( Año) | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | T |
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Hay et al. (1999)16 | + | + | + | + | - | - | - | - | - | + | + | 5/10 |
| Petri et al. (2004)17 | + | + | + | - | + | + | + | - | + | + | + | 8/10 |
| Lewis et al. (2005) 18 | + | + | + | - | - | - | - | + | + | + | + | 6/10 |
| Mazières et al. (2005)19 | + | + | + | + | + | + | + | + | + | + | + | 10/10 |
| May et al. (2007)20 | + | + | + | + | + | + | + | - | - | + | + | 8/10 |
| Karthikeyan et al. (2010)21 | + | + | + | + | + | - | + | + | + | + | + | 9/10 |
| Shakeel y Ahmad (2012) 22 | + | + | - | - | + | + | + | + | - | + | + | 7/10 |
| Min et al. (2013)23 | + | + | + | + | + | + | + | - | - | + | + | 8/10 |
| Pingel et al. (2013)24 | + | + | + | - | + | + | + | + | + | + | + | 9/10 |
| Deveraux et al. (2016)25 | + | + | - | + | - | - | + | - | - | + | + | 5/10 |
| Aksakal et al. (2017)26 | + | + | + | + | - | - | - | + | - | + | + | 6/10 |
| Heinemeier et al. (2017)27 | + | + | + | - | + | + | - | + | - | + | + | 7/10 |
| Goyal et al. (2020)28 | + | + | + | + | - | - | - | - | - | + | + | 5/10 |
T: puntuación total; +: criterio cumplido; -: criterio no cumplido
Características de los estudios
En la tabla 2 se muestran las características principales de los estudios incluidos, y en la tabla 3 los pacientes y las intervenciones realizadas. Las muestras analizadas se encontraron en un rango de 26-306 sujetos con un total de 1384 sujetos. Las pérdidas sumaron un total de 282 sujetos y fue el estudio de Petri y otros17 el que contó con más pérdidas para un total de 52 pacientes que no continuaron con el ensayo, mientras que cinco de los ensayos no reportaron pérdidas.18,20,26,27,28 La edad media fue de 51,05 años, con un rango entre 18-70 años.
En lo referente al tratamiento, la vía de administración más común de los AINEs fue la oral. El tiempo de tratamiento o seguimiento del estudio difiere bastante entre los ECAs con un rango temporal desde 5 días hasta 12 meses. La duración de los síntomas de los sujetos al inicio de los estudios fue de 165,3 días de media, con un rango temporal entre 7 días y 1 año. Dos de los estudios, Shakeel y otros 22) y Min y otros23 no hacen referencia a este dato y en el caso del ensayo de May y otros20 se incluyen si hay dolor al finalizar la carrera en la que participan.
Tabla 2 Características de los estudios
| Estudio | Duración |
|
Rangos de edades | Tiempo de evolución de tendinopatía |
|---|---|---|---|---|
| Hay et al. (1999)16 | 12 meses | 182 (151) | 18-70 | Más de 12 meses |
| Petri et al. (2004)17 | 14 días | 306 (254) | 48,8 | Episodio en los 7 días previos al tratamiento |
| Lewis et al. (2005) 18 | 5 días | 164 (151) | 18-70 | 12 meses |
| Mazières et al. (2005)19 | 21 días | 173 (150) | 18-70 | ≤ 15 días |
| May et al. (2007)20 | 5 días | 44 (42) | 18-60 | Dolor al finalizar la carrera |
| Karthikeyan et al. (2010)21 | 6 semanas | 58 (56) | 59 | 3 meses |
| Shakeel y Ahmad (2012)22 | 3 meses | 110 (100) | 57,5 | - |
| Min et al. (2013)23 | 4 semanas | 48 (32) | 39,3 | - |
| Pingel et al. (2013)24 | 1 semana | 27 | 48,5 | < 6 meses |
| Deveraux et al. (2016)25 | 2 semanas | 106 (100) | 48 | < 12 meses |
| Aksakal et al. (2017)26 | 6 semanas | 70 | 53 | 2-8 semanas |
| Heinemeier et al. (2017)27 | 1 semana | 26 | 53,5 | 3 meses |
| Goyal et al. (2020)28 | 3 meses | 70 (67) | 52 | < 4 meses |
Tabla 3 Pacientes y tratamiento
| Autores | Región anatómica | Grupo | Pacientes analizados (h/m) | Tratamiento |
|---|---|---|---|---|
| Hay et al. (1999)16 | Codo | Corticosteroide | 53 (31/22) | Metilprednisolona 20 mg y 0,5 mL de lidocaína al 1 % (inyectable). Una única dosis. |
| AINEs | 53 (25/28) | Naproxeno de 500 mg (oral). Dos veces al día durante dos semanas. | ||
| Placebo | 58 (30/28) | Pastillas placebo de vitamina C (oral). Dos veces al día durante dos semanas. | ||
| Petri et al. (2004)17 | Hombro | AINE inhibidor específico de COX-2 | 98 (63/35) | Celecoxib 200 mg (oral). Primera dosis de 400 mg y a las 8 h 200 mg, después una pastilla de 200 mg al día durante 14 días. |
| AINEs | 100 (62/38) | Naproxeno 500 mg (oral). Una pastilla al día durante 14 días. | ||
| Placebo | 108 (72/36) | Pastillas placebo (oral). Una pastilla al día durante 14 días. | ||
| Lewis et al. (2005) 18 | Codo | Corticosteroide | 53 | Metilprednisolona 20 mg y 0,5 mL de lidocaína al 1 % (inyectable). Una única dosis. |
| AINEs | 53 | Naproxeno 500 mg (oral). Dos veces al día durante dos semanas. | ||
| Placebo | 58 | Pastillas placebo de vitamina C (oral). Dos veces a la semana durante dos semanas. | ||
| Mazières et al. (2005)19 | Extremidades | AINEs | 87 ( 42/45) | Parche de 100 mg de ketoprofeno (tópico). 1 vez al día durante 14 días. |
| Placebo | 85 ( 33/52) | Parche sin ingredientes (tópico). 1 vez al día durante 14 días. | ||
| May et al. (2007)20 | Muñeca | AINEs | 22 (20/2) | Gel de diclofenaco 1 % (tópico). Previo a la carrera los 5 días de la carrera. |
| Placebo | 20 (16/4) | Gel placebo (tópico). Previo a la carrera los 5 días de la carrera. | ||
| Karthikeyan et al. (2010)21 | Hombro | Corticosteroide | 27 (16/11) | 40 mg metilprednisolona mezclada con 5 mL de lidocaína al 1 % (inyectable). Una única inyección. |
| AINEs | 31 (16/15) | 20 mg de tenoxicam mezclada con 5 mL de lidocaína al 1 % (inyectable). Una única inyección. | ||
| Shakeel y Ahmad (2012)22 | Dedo | Corticosteroide | 50 (12/38) | 20 mg de triamcinolona (inyectable). Una única inyección. |
| AINEs | 50 (18/32) | 12,5 mg de diclofenaco sódico (inyectable). Una única inyección. | ||
| Min et al. (2013)23 | Hombro | Corticosteroide | 15 (12/3) | 6 cc de lidocaína al 1 % con epinefrina y 40 mg de triamcinolona (inyectable). Una única inyección. |
| AINEs | 17 (13/4) | 6 cc de lidocaína al 1 % con epinefrina y 60 mg de ketoloraco (inyectable). Una única inyección. | ||
| Pingel et al. (2013)24 | Tendón de Aquiles | AINEs | 13 (10/3) | 600 mg de ibuprofeno (oral). 3 días a la semana durante 1 semana. |
| Placebo | 14 (9/5) | Pastillas placebo (oral). 3 días a la semana durante 1 semana. | ||
| Deveraux et al. (2016) 25 | Hombro | KT + ejercicio | 33 (22/11) | Uso del KT hasta la siguiente visita a los 3-5 días y se reaplica + ejercicios (core, estiramientos y estabilización postural.) 2 semanas. |
| AINEs + ejercicio | 29 (21/8) | 2 pastillas al día durante dos semanas de 500 mg de naproxeno de liberación retardada + ejercicios (core, estiramientos y estabilización postural) (oral). Una pastilla dos veces al día durante dos semanas. | ||
| Ejercicio (GC) | 38 (18/20) | Core, estiramientos y estabilización postural. 2 semanas. | ||
| Aksakal et al. (2017)26 | Hombro | Corticosteroide | 35 (14/21) | 1 mL de betamethasona (inyectable). Una única inyección. |
| AINEs | 35 (12/23) | 2 mL de lornoxicam (inyectable). Una única inyección. | ||
| Heinemeier et al. (2017) 27 | Tendón de Aquiles | AINEs | 13 (8/5) | 600 mg de ibuprofeno (oral). 3 veces a la semana durante 1 semana. |
| Placebo | 13 (8/5) | Píldoras placebo (oral). 3 veces a la semana durante 1 semana. | ||
| Goyal et al. (2020)28 | Hombro | Corticosteroide | 33 (13/20) | Infiltración con metilprednisolona-40 mg con 2 % de lidocaína (inyectable). Una única inyección. |
| AINEs | 34 (11/23) | Infiltración con ketoloraco (60 mg con 2 % de lidocaína) subacromial (inyectable). Una única inyección. |
mg: miligramos, ml: mililitros, AINEs: Antiinflamatorios no esteroideos, KT: kinesiotape, GC: grupo control, COX-2: Ciclooxigenasa-2, cc: centímetros cúbicos. h/m: hombres/mujeres.
Las principales variables analizadas en los diferentes estudios fueron el dolor, el rango articular (ROM) y la mejora de la función. Estas variables, así como los resultados del tratamiento se muestran a continuación (Tabla 4). La principal herramienta para la obtención de datos fue la utilización de escalas tanto auto administradas (uso de un diario como seguimiento), como mediante entrevista.
Tabla 4 Variables analizadas
| Estudio | Grupo | Dolor | ROM/ Función | Necesidad de medicamento de rescate (%) | Conclusión principal sobre las variables analizadas |
|---|---|---|---|---|---|
| Hay et al. (1999)16 | Corticosteroides | ↓ | ↑a | Analgésicos (33,6) | Los corticosteroides muestran efecto significativamente diferente. Los AINEs no muestran efecto significativamente diferente al placebo. |
| AINEs | ↓ | ↑ | Analgésicos (34,6) | ||
| Placebo | ↓ | ↑ | Analgésicos (39,3) | ||
| Petri et al. (2004)17 | AINEs inhib COX-2 | ↓a | ↑ | Analgésicos (6) | Los dos grupos de AINEs muestran efecto significativamente diferente respecto al placebo pero no hay diferencias significativas entre ellos. |
| AINEs | ↓a | ↑a | Analgésicos (4) | ||
| Placebo | ↓ | ↑ | Analgésicos (7) | ||
| Lewis et al. (2005)18 | Corticosteroides | ↓b | x | Analgésicos (23,4) | Los corticosteroides muestran efecto significativamente diferente. Los AINEs no muestran efecto significativamente diferente al placebo. |
| AINEs | ↓ | x | Analgésicos (20) | ||
| Placebo | ↓ | x | Analgésicos (31,4) | ||
| Mazières et al. (2005)19 | AINEs | ↓a | x | 590 mg de paracetamol | Efecto de AINEs sobre placebo significativamente diferente. |
| Placebo | ↓ | x | 895 mg de paracetamol | ||
| May et al. (2007)20 | AINEs | ↓ | x | Paracetamol (45) y diclofenaco (10) | Los AINEs no muestran efecto significativamente diferente al control. |
| Placebo | ↓ | x | Paracetamol (38) y diclofenaco (25) | ||
| Karthikeyan et al. (2010)21 | Corticosteroides | x | ↑a | x | Los corticosteroides muestran efecto significativamente diferente a loa AINEs en la variable de funcionalidad. Los AINEs no muestran efecto significativamente diferente al control. |
| AINEs | x | ↑ | x | ||
| Shakeel et al. (2012) 22 | Corticosteroides | x | ↑ | x | Los AINEs no muestran efecto significativamente diferente al control. |
| AINEs | x | ↑ | x | ||
| Min et al. (2013)23 | Corticosteroides | ↓ | ↓ | x | Efecto de AINEs sobre control significativamente diferente. |
| AINEs | ↓ | ↑a | x | ||
| Pingel et al. (2013)24 | AINEs | ↓ | x | x | 1 semana de tratamiento con ibuprofeno no cambia la expresión de los genes del colágeno ni está relacionada con los factores de crecimiento. Los AINEs no muestran efecto significativamente diferente al control. |
| Placebo | ↓ | x | x | ||
| Deveraux et al. (2016)25 | KT + ejercicio | ↓ | ↑ | x | Los AINEs no muestran efecto significativamente diferente al control. |
| AINEs + ejercicio | ↓ | ↑ | x | ||
| Ejercicio | ↓ | ↑ | x | ||
| Aksakal et al. (2017)26 | Corticosteroides | ↓ | ↑b | x | Los corticosteroides muestran efecto significativamente diferente a loa AINEs en la variable de funcionalidad. Los AINEs no muestran efecto significativamente diferente al control. |
| AINEs | ↓ | ↑ | x | ||
| Heinemeier et al. (2017) 27 | AINEs | ↓ | x | x | 1 semana de tratamiento con ibuprofeno no cambia la expresión de los genes del colágeno ni está relacionada con los factores de crecimiento. Los AINEs no muestran efecto significativamente diferente al control. |
| Placebo | ↓ | x | x | ||
| Goyal et al. (2020)28 | Corticosteroides | ↓ | ↑ | x | Los AINEs no muestran efecto significativamente diferente al control. |
| AINEs | ↓ | ↑ | x |
a y b Representan diferencias significativas entre grupos; p < 0,05 y p < 0,01, respectivamente. ↑ y ↓ representan, respectivamente, incrementos y reducciones significativas entre pre y post tratamiento.
x= datos no disponibles, KT= Kinesiotape, ROM= rango de movimiento, AINEs = Antiinflamatorios no esteroideos
En lo referente a la medida del dolor, la más utilizada fue la escala visual analógica (EVA). Sin embargo, hay pequeñas diferencias entre las investigaciones realizadas por Goyal y otros,28Mazières, y otros19Lewis y otros,18Petri y otros 17) y Hay y otros16 las cuales se centran en la medición del dolor en reposo, o mientras realiza sus actividades diarias, y en el caso de May y otros,20Heinemeier y otros27 y Pingel y otros24 miden el dolor pre y posentrenamiento.
También se usaron otras escalas como la escala de hombro de The University of California, Los Angeles (UCLA shoulder scale), que es una escala específica para la evaluación del dolor y funcionalidad en el hombro, 22,25) o la escala numérica del dolor (NRS, por sus siglas en inglés numeric rating scale).24
Para la valoración de la funcionalidad de la región anatómica a tratar, investigadores como Goyal y otros,28Min y otros 23) y Petri y otros17 valoran el rango de movilidad articular. En algunas zonas concretas como a nivel digital se usa la escala de Quinell, que valora el grado de función del dedo en gatillo y en los estudios de hombro de Karthikeyan y otros21 y Aksakal y otros26 hacen uso de la constante de Murley que sirve para medir la funcionalidad del hombro, al igual que el test simple de hombro (SST, simple shoulder test) utilizado por Deveraux y otros.25
El ROM mejoró con todos los tratamientos excepto el grupo de corticosteroides en el ensayo de Min y otros,23 que obtuvo un empeoramiento del ROM.
May y otros,20Min y otros,23Pingel y otros,24Deveraux y otros,25Heinemeier y otros27 y Goyal y otros,28 determinaron que en lo referente al dolor y a otras variables los resultados eran equivalentes sin diferencias estadísticamente significativas con respecto a los grupos con los que se comparan. En el resto, los AINEs muestran un mejor efecto respecto al placebo, pero peores resultados a corto plazo en comparación con los corticosteroides.
También se valoró el uso de medicamentos de rescate (necesidad de administración de analgésicos o en algún caso, como May y otros, 20) antiinflamatorios no esteroideos orales. El uso de estos medicamentos puede deberse a un dolor excesivo que puede ser causado por una falta de eficacia por parte del tratamiento administrado. La necesidad de medicamentos de rescate fue observada en 5 de los 13 estudios,16,17,18,19,20 y lo más frecuente fue el uso de analgésicos como paracetamol.
Pingel y otros24 y Heinemeier y otros 27) realizaron pruebas histológicas sobre una biopsia del tendón, técnicas de ultrasonido, ecografía Doppler y pruebas de proteína C reactiva (PCR) a tiempo real pre y posejercicio para investigar los efectos de los AINEs en la tendinopatía.
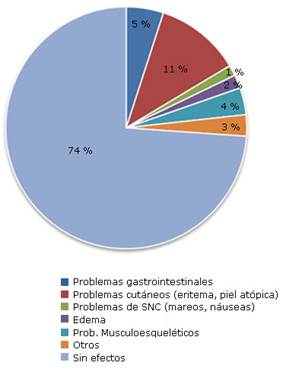
Algunos estudios describen efectos adversos o secundarios a la medicación en el grupo de los AINEs, que aglutina a una muestra total de 280 sujetos. De estos 280, el 26,12 % (73 sujetos) han experimentado algún efecto secundario al tratamiento (AINEs). En la figura 2 se muestran los principales efectos adversos experimentados.16,17,18,19,22,23
Los principales resultados obtenidos en esta revisión sistemática muestran que el uso de AINEs disminuye el dolor y mejoran la funcionalidad respecto al tratamiento placebo, pero únicamente a corto plazo.
Con respecto a la variable de dolor, en todos los artículos se muestra una mejoría con los AINEs respecto al grupo placebo, sobre todo en estadios iniciales. Esto concuerda con lo encontrado por Lewis y otros,18 quienes destacan una mejoría en el 5º día respecto al placebo. Sin embargo, Hay y otros16 a las 4 semanas reportan que los efectos son similares a los del grupo placebo y esa diferencia entre grupos deja de observarse. Labelle y Guilbert (29) tampoco encontraron beneficio clínico de importancia en el uso de los AINEs frente al placebo en el codo de tenista (epicondilalgia).
Solo dos investigaciones muestran cambios significativos en la variable de dolor: Petri y otros17 y Mazières y otros,19 que muestran un valor de p < 0,05 con respecto al grupo control. Estos dos estudios cuentan con una alta calidad metodológica (8 y 10 sobre 10, respectivamente). Sus resultados discrepan del resto de los estudios, lo que puede ser debido a que el tiempo de evolución de la patología es diferente (< 3 semanas).
En esta revisión solo 2 de los 13 artículos17,23 muestran una diferencia estadísticamente relevante al finalizar el período de estudio en la variable de funcionalidad de la región anatómica (p <0,05).
Si nos detenemos a analizar los AINEs incluidos en estos estudios podemos destacar el uso de Naproxeno de 500 mg en 4 de los 13 estudios,16,17,18,25 que consumen este medicamento de forma oral dos veces al día durante dos semanas. No se observa una relación de la posología con los resultados finales de los estudios. Además, tanto el tipo de AINE como su dosificación son muy diversos.
La utilización de analgésicos como medicamento de rescate se describió en 5 de los 13 estudios.16,17,18,19,20 El uso de este tipo de medicamentos, en casi todos los casos, fue mayor en el grupo placebo, excepto en el grupo de tratamiento con AINEs de May y otros.20 Destaca en este estudio el consumo de diclofenaco oral (un AINE tradicional) como medicamento de rescate, lo que implica que el grupo placebo también recibe el mismo principio activo que el grupo a estudiar, simplemente con el cambio del método de aplicación. Por tanto, el grupo control diseñado desde el inicio del ECA perdería validez. La dosis administrada de medicamentos de rescate en el grupo de corticoesteroides fue similar al grupo de AINEs. La diferencia más relevante fue en el estudio de Lewis y otros, 18) con 3,4 % más de consumo en el grupo que recibió corticoesteroides.
La necesidad de analgésicos complementarios en estos estudios varía desde 4 % en el grupo AINEs de Petri y otros17 a 45 % en el grupo AINEs de May y otros,20 lo cual puede haber sido porque en este último, los sujetos participaban en una carrera de kayak y el tendón se ve expuesto a condiciones de tensión más agresivas. Mazières y otros19 también refieren un consumo de analgésicos por los pacientes de cada grupo a los 14 días, sin especificar cuántos recurren a ellos.
En cuanto a la vía de aplicación de los AINES, la principal es la oral, seguida de la inyectable y tópica. En el consumo oral de AINEs, se destaca que Petri y otros17 presentan el único estudio que usa esta vía de administración con resultados significativos. En el caso de la administración subcutánea encontramos hallazgos contradictorios. Mientras Min y otros23 concluyen que los AINEs generan resultados significativos en la función con respecto a los corticoesteroides, Aksakal y otros26 y Karthikeyan y otros21 refieren que el tratamiento con corticoesteroides da resultados significativos en la función con respecto a los AINEs. Sin embargo Goyal y otros28 y Shakeel y otros 22) no encontraron diferencias significativas entre las dos intervenciones.
Estas discrepancias son visibles también en el uso tópico del fármaco, ya que mientras Mazières y otros19 concluyen que los AINEs disminuyen significativamente el dolor, May y otros20 no encuentran diferencias entre los dos grupos de estudio y durante los días 2 a 4 de carrera se refleja un aumento de dolor por parte del grupo AINEs al finalizar la misma.
El tiempo de evolución de los síntomas fue tenido en cuenta en 11 de los 13 artículos16-21,24-28 y solo en 4 de ellos encontramos un tiempo de evolución menor a 3 semanas,17,19,20,26 que indica que la patología está en una etapa aguda, lo que podría llevar a pensar que esto implicara la presencia de inflamación. La posible implicación de la misma en la tendinopatía está todavía en debate, lo que pone en entredicho la utilización de los AINEs.12,30,31 Estos suelen prescribirse en tendinopatías reactivas debido a que esta fase es la que presenta dolor en el modelo continuo, pero podrían tener un efecto perjudicial en la reparación definitiva del tendón por retrasar el proceso de regeneración de los tejidos blandos y un efecto negativo en el proceso de normalización del tendón.5 Esto coincide con el estudio de May y otros20 en el cual los participantes de la carrera de kayak tratados con gel de 1 % de diclofenaco entre el segundo y cuarto día experimentaban un efecto analgésico ese día, lo que permitía que remasen más fuerte, pero esto agravaba su condición durante el avance de la jornada, con peores resultados en la escala EVA. Por otra parte, se podría considerar que la vía de administración podría interferir con los resultados. Sin embargo, los estudios farmacocinéticos han demostrado que la concentración alcanzada por parte de los tejidos blandos subcutáneos durante el uso de geles de AINEs es suficiente para proporcionar beneficio terapéutico. La penetración local puede ocurrir hasta 3-4 mm por debajo del sitio de aplicación.20
Estudios anteriores también han demostrado que los tratamientos antiinflamatorios (como la inyección de corticoesteroides) son eficaces, al menos a corto plazo,32 como se refleja en las investigaciones conducidas por Hay y otros16 y Lewis y otros,18 que concluyen que los corticoesteroides dan mejores resultados a corto plazo, pero a la larga estos insignificantes.
Al evaluar la inflamación, los resultados de Pingel y otros24 indican que un tendón humano después del ejercicio no muestra inflamación aguda. A pesar de esto, había parámetros como el colágeno, la decorina y la interleucina 6, que mostraron una disminución significativa en la señalización de áreas afectadas del tendón, en comparación con las partes sanas de este.
Pingel y otros24 afirman que debido a la ausencia de inflamación observada en el tejido después de una carrera intensa no estaría indicado el uso de antiinflamatorios. De acuerdo con esto, la ingesta de AINEs durante una semana antes del estudio no afectó la expresión de ninguna de las dianas analizadas, al comparar la zona dañada con la zona sana del mismo tendón. Al igual que Heinemeir y otros,27 y Pingel y otros24 quienes no observaron cambios en la expresión del ácido ribonucleico mensajero (ARNm) del colágeno y del factor de crecimiento beta (transforming growth factor beta, TFG-β), lo que apoya la conclusión que el tratamiento a corto plazo (1 semana) con ibuprofeno no influye en la expresión de estos genes en la tendinopatía.
Los datos de anteriores estudios in vitro32,33,34 indican que el tratamiento con AINEs puede afectar la expresión del colágeno y del TGF-β. Este factor de crecimiento es un regulador en la curación del tendón, que juega un papel importante en la formación de colágeno, angiogénesis y creación de adherencias y lo liberan algunos tipos de linfocitos ante una lesión. 35) Estos estudios descubrieron que la prostaglandina E2 (PGE2) inhibe la expresión de colágeno de tipo I (el más abundante en los tendones) y el tipo III (colágeno con función reparadora) en varios tipos de fibroblastos.36,37 Por lo tanto, la disminución de la PGE2 con el tratamiento con AINEs da lugar a una mayor tasa de transcripción de colágeno.33,34 A pesar de esta afirmación Heinemeier y otros27 no encontraron ninguna modificación de la expresión de los genes del colágeno, ni se relacionó el uso de AINEs con los factores de crecimiento del mismo.
Por el contrario, Díaz y otros 38) mostraron una interacción entre la acción del TGF-β y los niveles de PGE2, lo que demostró que el tratamiento con indometacina aumentaba la expresión de colágeno inducida por el TGF-β. En general, los estudios sobre células primarias del tendón revelan que estas son sensibles a los AINEs y que la proliferación celular disminuye en respuesta al tratamiento.38,39,40,41 Sin embargo, Heinemeier y otros27 no encuentran indicios de cambios en la actividad celular como respuesta al tratamiento. Debido a la discrepancia entre investigaciones todavía no se puede afirmar de forma clara el efecto de los AINES sobre el colágeno.
Para proporcionar un posible control positivo del ibuprofeno presente en las células después del tratamiento, Heinemeier y otros27 miden los niveles de expresión de la Angiopoyetina 4 (Angiopoietin-like 4, ANGPTL4) y el activador del factor de transcripción 3 (Activating Transcription Factor 3, ATF3), que son dos dianas que aparecen inducidas por el ibuprofeno en las células de carcinoma humano in vitro (para ANGPTL4, incluso a niveles bajos de fármaco- 0,1 mM).42 Sin embargo, ninguna de estas fueron inducidas en el tejido del tendón, aunque ambas se expresaron a niveles detectables en todas las muestras de plasma recogidas de los participantes. La falta de cambio en la expresión de estos genes in vivo podría reflejar que las células del tendón no responden al fármaco, sino que responden de forma diferente a las del carcinoma o, por último, que el fármaco no llega a las células in vivo.
Independientemente de la causa, las presentes observaciones subrayan el hecho de que las células del tendón se comportan de forma muy diferente in vitro en comparación con in vivo. Esto limita a la hora de comparar los resultados de los estudios analizados con estudios histológicos previos ya que la mayoría se realizan en tendón in vitro y esta revisión está centrada en tendón in vivo. Los pocos estudios in vivo existentes sobre el efecto de los AINEs en el tejido tendinoso no lesionado muestran resultados divergentes. Un estudio sobre el tendón rotuliano humano sugirió que el tratamiento con AINEs estimula la síntesis de colágeno inducida por una carrera de 36 km.43 Sin embargo, en ese estudio la síntesis de colágeno se midió en el espacio peritendinoso y puede que no refleje la síntesis real de colágeno del tendón. Además, sus resultados por ser en tejido sano no son totalmente extrapolables a lo patológico.
En otro estudio sobre el tendón rotuliano sano de hombres de edad avanzada, se observó que la síntesis de colágeno y la expresión de ARNm, medidos en biopsias de tejido del tendón tras un período de inmovilización de 2 semanas, no se veían afectadas por el tratamiento con ibuprofeno administrado durante la inmovilización.44 Otro estudio reciente en el tendón del supraespinoso de rata no encontró ningún efecto perjudicial del tratamiento con ibuprofeno en la respuesta adaptativa al entrenamiento.45
Entre los estudios que reportan efectos secundarios, los más comunes son los problemas de piel, con un 11,43 % de incidencia. Aunque este dato puede estar influenciado por el hecho de que el 31 % de la muestra de efectos secundarios procede del artículo de Mazières y otros19 en el cual el tratamiento es administrado por vía cutánea mediante el uso de parches. En total un 26,12 % de los pacientes asignados a los grupos de AINEs en estos 6 estudios experimentaron algún efecto secundario. El siguiente efecto más común fueron los problemas gastrointestinales con una prevalencia del 5 %, lo que concuerda con la revisión de Green y otros,46 que concluye que el tratamiento con antiinflamatorios puede incurrir en estos efectos adversos en algunos sujetos. El efecto adverso menos común es el SNC (1,43 %) y el más común en aquellos casos que utilizaban tratamiento inyectable.18,22
Heinemeier y otros27, a diferencia de Pingel y otros,28 observan un aumento de la señal Doppler de la ecografía (lo que implica un incremento de la neovascularización en la zona de la lesión) en el grupo de los AINEs con respecto al grupo placebo, donde disminuye considerablemente después del período de tratamiento. La presencia de señal Doppler dentro del tendón, así como en la zona ventral del mismo, es indicativa de tendinopatía en fase degenerativa por lo cual una disminución de esta señal es un indicador de mejora.47 Según los autores puede ser debido a un cambio en el comportamiento de los participantes. En el caso del grupo placebo, debido a una reducción en la carga por dolor y en el grupo de ibuprofeno debido al mantenimiento o aumento de la carga de sus tendones por enmascaramiento del dolor por encima de la carga adecuada, lo que puede generar daño y aumentar la vascularización. Los artículos anteriores que investigan el efecto agudo de ejercicio sobre la actividad Doppler son contradictorios. Estos han demostrado que tanto el ejercicio agudo aumenta la actividad Doppler,48 como la disminuye.49
En referencia a la calidad metodológica, el valor medio obtenido fue 7,15/10 en la Escala PEDro por lo que se podría considerar que la calidad metodológica es alta. Los ensayos de menor calidad metodológica fueron los de Hay y otros,16Deveraux y otros,25 y Goyal y otros,28 con un 5/10 en la Escala PEDro y el que más calidad metodológica presentó fue el de Mazières y otros, 19) que cumplió todos los puntos de esta escala. El criterio menos presente en los artículos fue el 9 (se presentaron resultados de todos los sujetos que recibieron el tratamiento o fueron asignados al grupo control, o cuando no pudo ser, los datos, al menos para un resultado clave fueron analizados por “intención de tratar”) y todos cumplían los puntos 10 y 11, mostraron los resultados de comparaciones estadísticas y proporcionaron medidas puntuales y de variabilidad al menos para un resultado clave.13
En 5 de los estudios analizados16,18,25,26,28 los pacientes no estaban cegados y en 6 no había cegamiento en las personas que aplicaban el tratamiento, ya que aunque en algunos indicasen cegamiento los medicamentos tenían dos formas de aplicación diferentes (inyectable y oral) y eso rompía el cegamiento. Esto puede repercutir en los resultados que aportan y muestra un posible sesgo de realización.
Se consideraron los riesgos de otros sesgos descritos por “The Cochrane Collaboration”50 entre los cuales destacan: sesgos de selección por ocultamiento de la asignación en los artículos de Shakeel y otros22 y Deveraux y otros 25) y sesgo de detección por falta de cegamiento de los evaluadores de los resultados en 5 de los 10 artículos analizados.16,18,26,27,28 También se pueden describir otras fuentes de sesgos, como no indicar el instrumento de medida del ROM en el estudio de Goyal y otros.28
En cuanto a la evidencia científica sobre el uso de AINEs en las tendinopatías, según criterios Van Tulder,14 esta revisión contaría con un nivel de evidencia contradictoria proporcionada por hallazgos generalmente contradictorios en múltiples ECAs (3 o más) de alta calidad metodológica.
Durante la realización de esta revisión se han apreciado ciertas limitaciones en los estudios analizados, tales como: ensayos sin enmascaramiento, falta de homogeneidad en los sistemas de medición de variables y no indicar los instrumentos de medida de las mismas, las escalas, el tiempo de seguimiento o la vía de administración de los AINEs. Además, la comparativa de funcionalidad abarca desde diferentes escalas hasta el ROM, por lo que no se dispone de una única medida estándar objetiva.
El problema más importante a la hora de realizar la comparativa en el rango articular/función es que la mayoría de los artículos utilizaba escalas diferentes sobre actividades de la vida diaria o limitaciones y otros medían el ROM sin especificar el método empleado para este fin. Una limitación del ROM no implica una repercusión directa sobre las actividades de la vida diaria siempre que se tengan rangos funcionales.
En cuanto a las principales limitaciones de la presente revisión encontramos la escasez de estudios que midan la diferencia entre placebo y AINEs. También el hecho de que muchos de los estudios comparaban el uso de AINEs con corticosteroides sin la presencia de un grupo sin tratamiento. Esto proporciona menos datos útiles en la presente revisión debido a que los dos tratamientos administrados eran antiinflamatorios. Entre otras limitaciones se deben mencionar la incapacidad de extrapolación de los hallazgos a una patología traumática de tendón, que las búsquedas están restringidas solo a bases de datos, o que los tratamientos se limitan a fármacos sin comparar otras intervenciones.
Por otra parte, esta revisión analiza datos subjetivos como pueden ser el dolor o la funcionalidad medida mediante escalas en gran parte autoadministradas que pueden incurrir en una mala toma de información o un mal seguimiento de los resultados, como el estudio de Deveraux y otros,25 que indica que el seguimiento mediante un diario solo fue completado por un 75,3 % de los pacientes.
Igualmente, Petri y otros17 cuentan con un 17 % de pérdida muestral, la pérdida de sujetos podría deberse a la dificultad de seguir el tratamiento con AINEs y esto podría deberse a una falta de eficacia.
En lo referente al nivel de evidencia científica según los criterios Van Tulder14 hay evidencia moderada de que el celecoxib 200 mg por vía oral disminuye el dolor en la tendinopatía, ya que existe un estudio de alta calidad metodológica que encuentra una mejoría significativa del dolor con este tratamiento. Sin embargo, para el uso tópico e inyectable de los AINEs la evidencia es contradictoria, debido a hallazgos no coherentes o inconsistentes en múltiples ECAs.
Para la variable de funcionalidad se observa evidencia moderada apoyada por 2 ECAs de alta calidad metodológica que encuentran una mejoría significativa respecto al control.16,23
Los datos disponibles actualmente sugieren una evidencia moderada proporcionada por 2 ECAs de alta calidad metodológica: 24,27) el tejido del tendón no se ve afectado, ni en sentido positivo ni negativo por el tratamiento con los AINEs. Por tanto, se concluye que en los estudios incluidos esta revisión, los AINEs no afectan a la estructura tendinosa.
Actualmente el tratamiento de las tendinopatías se basa en ejercicio terapéutico (principalmente con trabajo excéntrico) y el control de cargas, que son considerados fundamentales para el tratamiento de tendinopatías ya que los tratamientos dirigidos solo a la remisión del dolor (como los AINEs) tienen un efecto mínimo en los factores asociados a la lesión, como alteraciones de la cadena cinética o la capacidad del tejido de soportar cargas, que aumentan consecuentemente el riesgo de recurrencia de la lesión.5
Si comparamos los datos observados en esta investigación con revisiones anteriores sobre tendinopatía, esta revisión al igual que la de Boudreaut y otros51 encuentra evidencia limitada para el uso de AINEs en tendinopatía. Se observa también que los AINEs son tan efectivos como los corticosteroides en moderar el dolor a corto plazo, aunque inicialmente estos últimos proporcionan mejores resultados. La presente revisión concluye que todavía no está claro el rol de la inflamación en la tendinopatía y que son necesarios más estudios, lo que coincide con revisiones previas.9,10 Estas dos revisiones afirman que la inflamación tiene un rol en procesos crónicos por el aumento de células inflamatorias, pero indican también que hay falta de evidencia de alta calidad.
La relevancia de este trabajo reside en analizar el efecto de los AINEs, no únicamente desde la perspectiva sintomatológica, sino teniendo en cuenta el componente inflamatorio en la tendinopatía, ya que su papel en esta patología todavía está en debate.
No obstante, futuras investigaciones deberían analizar los cambios histológicos para determinar el efecto sobre la estructura tendinosa y no únicamente en la sintomatología, ya que el enmascaramiento del dolor en un tendón degenerado podría afectar su capacidad para soportar cargas y en consecuencia, aumentar el riesgo de recidiva.5 Sería necesario considerar el efecto de los AINEs a largo plazo, ya que la falta de afectación a corto plazo no significa que pueda aparecer a larga en una lesión por sobreuso.
Para posteriores investigaciones sería interesante analizar como los AINEs afectan concretamente la reparación del tendón in vivo y, no centrarse tanto en el efecto analgésico y si este produce un enmascaramiento del dolor que pudiera incurrir en una cronificación de la lesión.
Consideraciones finales
La literatura actual no permite confirmar los beneficios de los AINEs en sujetos con tendinopatía por sobreuso. Los efectos sobre las variables analizadas no difieren del efecto del placebo, o se presentan resultados contradictorios entre los estudios. El nivel de evidencia científica es moderado o contradictorio, lo que no permite establecer una pauta de prescripción clara. Se requieren más estudios que determinen el papel de la inflamación en la tendinopatía, que justifiquen el uso de AINEs en el proceso de curación.