Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Oftalmología
versión On-line ISSN 1561-3070
Rev Cubana Oftalmol v.22 n.1 Ciudad de la Habana ene.-jun. 2009
REVISIÓN BIBLIOGRÁFICA
Síndrome de dispersión pigmentaria y glaucoma pigmentario
Pigmentary dispersion syndrome and pigmentary glaucoma
Liamet Fernández ArgonesI; Maritza Miqueli RodríguezII; Ibrain Piloto DíazI; Marerneda Domínguez RandulfeI; Janet Cabañas PiñeiroI
I Especialista de I Grado en Oftalmología. Instituto Cubano de Oftalmología "Ramón Pando Ferrer", La Habana, Cuba.
II Especialista de II Grado en Oftalmología. Instituto Cubano de Oftalmología "Ramón Pando Ferrer", La Habana, Cuba.
RESUMEN
El glaucoma pigmentario es el más frecuente de los glaucomas secundarios. Se presenta en pacientes jóvenes durante la tercera o cuarta década de la vida y el diagnóstico se realiza en una etapa de daño glaucomatoso avanzado con graves secuelas visuales, por lo que genera un gran impacto social. El propósito de este trabajo es realizar una actualización del tema a fin de perfeccionar el manejo y el tratamiento del síndrome de dispersión pigmentaria/glaucoma pigmentario, e incidir satisfactoriamente en la evolución de los pacientes.
Palabras clave: Glaucoma pigmentario, síndrome de dispersión pigmentaria, evolución de los pacientes.
ABSTRACT
Pigmentary glaucoma is the most frequent of secondary glaucoma. It occurs in young patients in the third or fourth decade of life and the diagnosis is made in an advanced stage of glaucomatous damage with serious visual sequelae and a great social impact. The purpose of this paper was to update this topic in order to improve the management and treatment of pigmentary dispersion syndrome and pigmentary glaucoma, and to have a positive effect on the recovery of these patients.
Key words: Pigmentary glaucoma, pigmentary dispersion syndrome, patient recovery.
El síndrome de dispersión pigmentaria (SDP) se presenta con una frecuencia entre 2 y 4 % de la población joven de 20 a 40 años de edad. Es más frecuente en varones miopes de la raza blanca. Se caracteriza por una disgregación de los pigmentos provenientes del epitelio pigmentario del iris (EPI) y su depósito en las estructuras del segmento anterior ocular (SAO).1-3
Se han propuesto varios factores que favorecen la dispersión pigmentaria: herencia autosómica dominante, etiología genética, anomalía congénita del epitelio pigmentario del iris (EPI), alteraciones en el brazo largo del cromosoma 7, entre otros.1-6
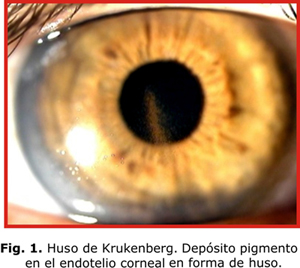
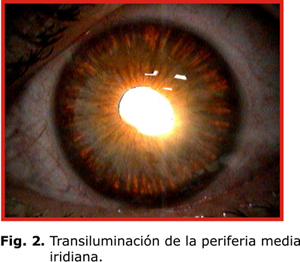
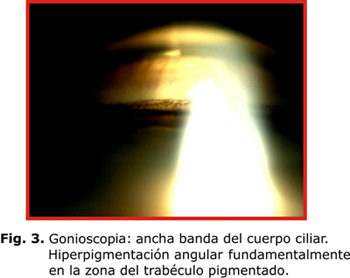
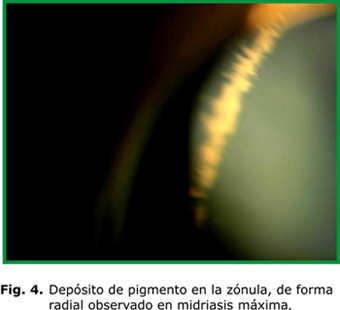
Típicamente aparece el huso de Krukenberg (HK), depósito endotelial de pigmentos que adoptan la forma de huso debido a las corrientes convectivas de flujo del humor acuoso; aunque se plantea que hasta un 50 % de los casos pueden carecer de este signo (fig. 1). Existe atrofia de la periferia media iridiana, la cual se evidencia por defectos de transiluminación en forma lineal o de rueda de carro (fig. 2). En la gonioscopia se aprecia concavidad iridiana con una ancha banda del cuerpo ciliar visible y pigmentación aumentada de las estructuras angulares, fundamentalmente, del trabéculo pigmentado (fig. 3). El depósito de pigmentos se observa, además, en la periferia posterior del cristalino como una doble línea discontinua, continua o como una banda gruesa (banda de Scheie).7 En los haces de fibras zonulares pueden presentarse depósitos radiales aislados o múltiples2-4 (fig. 4).
Desde el punto de vista fisiopatológico se ha descrito que la concavidad iridiana existe a partir de un bloqueo pupilar inverso. Durante el parpadeo, en el ejercicio de la acomodación, pulsos cíclicos del acuoso pasan a la cámara anterior y se crea una presión positiva que empuja el iris hacia detrás e impide que el acuoso regrese a la cámara posterior. Esta concavidad favorece el roce entre la superficie posterior de la periferia media de iris y los haces zonulares anteriores, lo cual disgrega el pigmento iridiano. Este mecanismo fue propuesto por Campbell en 1979 como principal factor de riesgo.1-4,8-9 Se ha descrito que existen fluctuaciones importantes de la presión intraocular (PIO), con picos hipertensivos secundarios a una gran dispersión del pigmento como ocurre, por ejemplo, durante el ejercicio físico intenso. El paciente experimenta dolor ocular e incluso puede asociarse a visión borrosa transitoria.3,8
Aproximadamente entre 30 y 50 % de los pacientes con SDP pueden evolucionar a un glaucoma primario (GP) debido a la obstrucción de los pigmentos del sistema trabecular.10 Una vez establecido, suele ser rápidamente progresivo. El tratamiento hipotensor ocular tópico y los procederes del tratamiento láser (trabeculoplastia) resultan insuficientes para el adecuado control de la progresión del daño glaucomatoso y es necesaria la cirugía filtrante.11 Con frecuencia, ha evolucionado de forma asintomática en pacientes miopes jóvenes que procuran cambio de cristales y consultan a un técnico de refracción. Pocas veces se sospecha de un glaucoma y se obvia la visita al médico especialista. Esta afección es causa de ceguera en pacientes jóvenes por lo que genera un gran impacto social.
El huso de Krukenberg (HK) es el signo que con frecuencia alerta al oftalmólogo general sobre la presencia de un SDP. Es necesario evaluar el resto de las características oculares descritas previamente que constituyen el síndrome. En ocasiones, los depósitos retroqueráticos (RK) se observan en pacientes con distrofias endoteliales en cuyas guttas se acumulan pigmentos. Es frecuente además, encontrar estos depósitos en pacientes sometidos a procederes quirúrgicos intraoculares (láser o vía incisional), traumatismos, así como en cuadros de uveítis anterior secundarios a melanomas y quistes epiteliales pigmentarios. Acompañan también al síndrome de pseudoexfoliación del cristalino, el cual, por lo general, se presenta momentos más tardíos de la vida de un individuo. La atrofia del iris se localiza hacia la zona del esfínter pupilar y se observa el depósito de material blanco grisáceo en el SAO fundamentalmente, sobre el reborde pupilar en el ángulo camerular y en forma de diana sobre la cápsula anterior del cristalino.
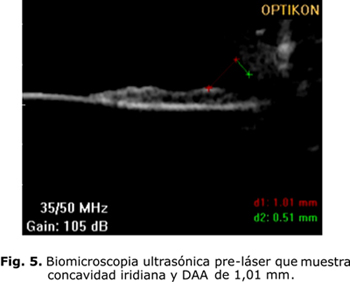
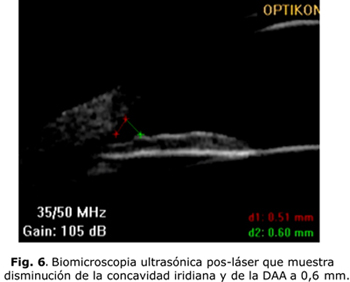
Después de haberse diagnosticado el SDP, a partir de sus características clínicas, es necesario evaluar las características del SAO a través del examen de biomicroscopia ultrasónica (BMU) y la tomografía de coherencia óptica (OCT). Ambos brindan información sobre las características iridianas y del ángulo camerular. La BMU permite además, evaluar la presencia de contactos iridociliar, iridozonular e iridocristaliniano al permitir la visualización de las estructuras retroiridianas (figs. 5 y 6).
Se examinan también, las características del disco óptico (DO) y la capa de fibras neurorretinianas (CFNR) a través de la oftalmoscopia directa y con la lámpara de hendidura con lente de polo posterior de 90 D. Se utilizan la luz blanca y la luz aneritra, fotografías, tomografía confocal láser (HRT), polarimetría láser con compensador corneal variable (conocida como GDx VCC por sus siglas en inglés) y tomografía de coherencia óptica.12
El examen de las características del disco óptico asociado a los niveles de presión intraocular (PIO) por tonometría de contorno dinámico preferentemente, y el examen del campo visual (CV), ayudan a determinar la existencia de un glaucoma pigmentario. Una PIO corneo-compensada mayor de 21 mm Hg establece la presencia de un GP a pesar de la presencia de un disco aparentemente sano con CV normal (diagnóstico precoz). Si se utiliza la tonometría de aplanación se debe realizar además, la paquimetría con el objetivo de obtener la PIO ajustada (valor más cercano a la PIO real).
En los casos diagnosticados como SDP se procede a realizar la iridotomía láser periférica. En el año 1984, Kurwa planteó que la iridotomía láser podría ser el tratamiento profiláctico del glaucoma pigmentario al romper el bloqueo pupilar inverso. Luego corroboraron su teoría Campbell en el año 1991 y Karickhoff en el 1992.1-4,8-9 En las últimas dos décadas, los estudios bioultrasónicos han permitido conocer, aún más, los mecanismos fisiopatológicos y ellos han demostrado el efecto beneficioso de la iridotomía al disminuir la concavidad iridiana y el rozamiento irido-zonular. Breingan y otros plantearon un 100 % de iris cóncavos con aplanación en todos ellos. Potash y otros encontraron un 56 % de iris cóncavos e igualmente la aplanación en 100 % de los casos. Méndez Hernández y otros, por su parte, reportaron el 85,71 % de iris cóncavos y de aplanación iridiana en el 83,3 % de los pacientes.8 No obstante, la mayoría de los autores coinciden en plantear que se requieren estudios a largo plazo para verificar su efectividad como profilaxis del glaucoma pigmentario.13-14 La BMU y la OCT de SA deben realizarse después del tratamiento con láser para evaluar el efecto obtenido en cada paciente.
Algunos autores prefieren diferir el uso de la iridotomía láser hasta evaluar si existe un aumento de la PIO, de la pigmentación angular, o cambios a nivel del disco óptico que confirmen un diagnóstico precoz de glaucoma, teniendo en cuenta que no todos los casos evolucionarán al GP. En presencia de dolor ocular durante el ejercicio físico puede utilizarse 1 gota de pilocarpina al 2 % media hora antes de realizar el ejercicio. No obstante, los efectos adversos relacionados con la pilocarpina como dolor ocular, cambios refractivos, entre otros, hacen que no sea posible su uso de forma habitual en la mayoría de los pacientes.15
Los casos con SDP deben ser evaluados cada 6 meses. Al año se deben monitorear el grado de la dispersión del pigmento, la PIO, el examen fundoscópico y los exámenes imagenológicos computarizados del DO y las capas de fibras neurorretinianas (CFNR) mediante los exámenes de HRT- OCT-GDx.
Los pacientes con GP precoz-moderado deben ser tratados con iridotomía láser periférica con el objetivo de evitar la progresión del GP una vez que se disminuya la dispersión de los pigmentos. El tratamiento inicial se basa en los hipotensores oculares tópicos. Se prefieren de primera línea las prostaglandinas ya que actúan facilitando el flujo del acuoso al espacio supracoroideo a través de la vía uveoescleral. De esta manera se crea una vía alternativa de eliminación del pigmento más efectiva y su acúmulo en la malla trabecular puede disminuir. Los betabloqueadores y los inhibidores de la anhidrasa carbónica (IAC) pueden utilizarse combinados con las prostaglandinas, aunque no se prefieren por su efecto en la disminución de la producción de humor acuoso, por lo que disminuyen el aclaramiento de los pigmentos dispersos en la cámara anterior.10 La trabeculoplastia selectiva (SLT) generalmente es efectiva en lograr el control inicial de la PIO en más o menos 7 mm Hg, pero el efecto dura muy poco. Estos pacientes deben ser evaluados cada 2 o 3 meses con toma de la PIO y un examen fundoscópico, así como examen evolutivo cada 5 o 6 meses de HRT-OCT-GDx. En el caso de constatarse una progresión del daño glaucomatoso, a pesar de utilizar medicación hipotensora tópica máxima y la SLT está indicada la cirugía filtrante, de preferencia la trabeculectomía.16
Los casos diagnosticados de GP en estadio avanzado deben ser sometidos rápidamente a la intervención quirúrgica en aras de preservar la visión. Teniendo en cuenta el limitado efecto de la medicación tópica máxima (uso de 3 colirios de diferentes grupos farmacológicos)17 y de la SLT, se indica la TBT como primera opción. Pueden considerarse el uso de los antimetabolitos y/o de los implantes valvulares si ocurre fallo de la filtrante. En aquellos casos que preserven visión tubular (10º) en menos de dos cuadrantes, el riesgo de pérdida visual transoperatoria es máxima por lo que se prefiere realizar la ciclofotocoagulación de un cuadrante, lo cual puede utilizarse en más de una ocasión para lograr el control tensional asociado a los colirios hipotensores.18,19
REFERENCIAS BIBLIOGRÁFICAS
1. Zimmerman J, Kooner S. Pigmentary glaucoma in: Clinical pathways in glaucoma. New York: Ed. Theme Medical Publishers, Inc.; 2001. p. 173-83.
2. Allingham R, Daniji K, Freedman S, Moroi S. Shields' Textbook of glaucoma. Lippincott: Williams and Wilkins; 2005.
3. Aguirre R, Pongo V, Parra JC, Rueda JC. Glaucoma pigmentario. MedUNAB. 2007;10(2):106-9.
4. García González F, Novoa Sánchez E, Martínez Cruz C. La iridotomía periférica con Nd YAG láser en el síndrome de dispersión pigmentaria/glaucoma pigmentario. Rev Cubana Oftalmol. 2002;15(1):49-56.
5. Andersen JS, Pralea AM, Del Bono EA, Haines JL, Gorin MB, Schuman JS, et al. A gene responsible for the pigment dispersion syndrome maps to chromosome 7q35-q36. Arch Ophthalmol. 1997;115:384-8.
6. Farrar SM, Shields MB, Miller KN, Stoup CM. Risk factors for the development and severity of glaucoma in the pigment dispersion syndrome. Am J Ophthalmol. 1989;108:223-9.
7. Scheie HG, Cameron JD. Pigment dispersion syndrome: a clinical study. Br J Ophthalmol. 1981;65:264-9.
8. Méndez Hernández C, García Feijoo, Cuiña Sardiña R, García Sánchez J. Estudio de glaucoma pigmentario mediante biomicroscopia ultrasónica. Arh Soc Esp Oft. 2003;78(3):137-42.
9. Jensen PK, Nissen O, Kessin SV. Exercise and reversed pupillary block in pigmentary glaucoma. Am J Ophthalmol. 1995;120(1):110-2.
10. Carasssa R. Iridotomía láser en el glaucoma pigmentario. 1997;5. Disponible en: http://www.glaucomaworld.net
11. Maul E. Los glaucomas secundarios. En: Arruda de Mello PA. Brasil: CIBA Vision; 1999. p. 127-43.
12. Albis O. Nuevas tecnologías en la detección del glaucoma: GDx VCC y HRTII. Rewiew of Ophthalmology. 2004:5:12-6.
13. Potash SD, Tello C, Liebmann J, Richt R. Ultrasound biomicroscopy in pigment dispersion syndrome. Ophthalmol. 1994;101:332-9.
14. Fernández L, Piloto I, Miqueli M. Experiencia bioultrasónica en el síndrome de dispersión pigmentaria/glaucoma pigmentario, antes y después de la iridotomía láser. Rev Cubana Invest Biomed [serie en internet]. 2007;26(3). Disponible en: http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S086403002007000300008&lng=en&nrm=iso.
15. Peyret A. Maestría glaucomas pigmentarios y pseudoexfoliativos. Disponible en: http://www.oftalmólogos.org.ar/mo/set07-maestría.pdf
16. Fabián S, Parrish R. Cirugía del glaucoma. Barcelona: EDIKA MED; 2000.
17. Casiraghi J. Hay tantas, pero tantas gotas para el glaucoma. Rewiew of Ophthalmol. 2004;5:24-8.
18. Cantos LB. Basic and clinical science course. Glaucoma. San Francisco: American Academy of Ophthalmology; 2003-2004.
19. Dada T, Mandall S. Cyclophotocoagulation. In: Mastering the techniques of glaucoma. Diagnosis and Management. New Delhi: Jaypee Brothers; 2006. p. 485-96.
Recibido: 10 de febrero de 2008.
Aprobado: 20 abril de 2008.
Dra. Liamet Fernández Argones. Ave. 76 No. 3104 entre 31 y 41 Marianao, Ciudad de La Habana, Cuba. E-mail: lianetfa@infomed.sld.cu