Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Oftalmología
versión impresa ISSN 0864-2176
Rev Cubana Oftalmol vol.25 no.2 Ciudad de la Habana oct.-dic. 2012
Personalización de las constantes en las fórmulas de cálculo de la lente intraocular
Personalization of constants in the intraocular lens calculation formulas
Dra. Anneé Miranda Carracedo, Dr. C. Juan Raúl Hernández Silva, Dra. Imalvet Santiesteban García, Dra. C. Meisy Ramos López, Dra. Yanay Ramos Pereira, Dra. Carmen Padilla González
Instituto Cubano de Oftalmología "Ramón Pando Ferrer". La Habana, Cuba.
RESUMEN
Objetivo: personalizar las constantes A, factor cirujano y profundidad de la cámara anterior para las fórmulas de cálculo de la lente intraocular en la cirugía de catarata en el Instituto Cubano de Oftalmología "Ramón Pando Ferrer" de mayo de 2007 a enero de 2011.
Métodos: se realizó un estudio descriptivo retrospectivo donde se estudiaron las constantes A, factor cirujano y profundidad de la cámara anterior. También se evaluó la longitud axial preoperatoria por IOL Master, la mejor agudeza visual sin corrección, el componente esférico esperado, el componente esférico obtenido y los resultados refractivos.
Resultados: las constantes optimizadas por interferometría de coherencia parcial son diferentes a las propuestas por los fabricantes de las lentes intraoculares. Estas constantes personalizadas para cada cirujano no mostraron diferencias significativas. Las constantes optimizadas según las longitudes axiales, tienen diferencias significativas en los 3 grupos de estudio. La diferencia entre la lente intraocular implantada y la propuesta con las nuevas constantes resultó menor de 1 D de error en 83,1 % de los pacientes. El 75,4 % quedó bien corregido en relación con la diferencia entre la refracción esperada y la obtenida.
Conclusiones: las constantes optimizadas por interferometría de coherencia parcial resultan más elevadas que las propuestas por el fabricante. La optimización de estas en el cálculo de la lente permite, de acuerdo a las características individuales de cada ojo (longitud axial), usar la fórmula adecuada e incrementa la predictibilidad de los resultados refractivos posoperatorios.
Palabras clave: cálculo de la lente intraocular, IOL Master, constante A, factor cirujano, profundidad de la cámara anterior.
ABSTRACT
Objective: to personalize the A, surgeon factor and anterior chamber depth constants for intraocular lens calculation formulas in the cataract surgery at the “Ramón Pando Ferrer” Cuban Ophthalmological Institute from May 2007 to January 2011.
Method: a retrospective and descriptive study was made to study the A constant, the surgeon factor and the anterior chamber depth. Additionally, the preoperative axial length was evaluated by IOL Master, as well as the best uncorrected visual acuity, the expected and the obtained spherical component, and the refractive results.
Results: the constants optimized by the partial coherence interferometry were different from those suggested by the intraocular lens manufacturers. These customized constants for each surgeon did not show significant differences among them. The optimized constants according to the axial lengths showed significant differences in the three study groups. The difference between the implanted lens and the estimated lens based on the new constants was lower than one dioptre of error in 83.1 % of patients. Good visual correction in relation with the difference between the expected and the final refractions was attained in 75.4 % of patients.
Conclusions: the partial coherence interferometry-optimized constants showed higher values than those suggested by the manufacturer. The constant optimization for the intraocular lens calculation by IOL Master allows, according to the ocular individual features (axial length), using the adequate formula and increasing the predictability of postoperative refractive results.
Key words: intraocular lens calculation, IOL Master, A constant, surgeon factor, anterior chamber depth.
INTRODUCCIÓN
Hace más de 50 años, para operar las cataratas se realizaba una extracción intracapsular del cristalino y se dejaba al paciente afáquico. Por esto, el paciente necesitaba una corrección óptica elevada para poder desarrollar una vida normal.1 La técnica quirúrgica se perfeccionó hasta poder realizar extracciones extracristalineanas y fue el oftalmólogo inglés Harold Ridley, quien implantó por primera vez una lente intraocular (LIO), el 29 de noviembre de 1949, luego de una extracción extracapsular de catarata.2
Desafortunadamente, después de la operación la refracción del paciente fue de -24+6x30°.3 Ridley intentó emular la curvatura y forma del cristalino, asumió una potencia estándar de +18 D para calcular la potencia de la LIO, en aquel entonces de soporte iridiano y dependió de la refracción del paciente previa al desarrollo de la catarata. El método era tan impreciso que se producían errores en 50 % de los casos mayores a 1 D. Estos fueron en ocasiones tan elevados que dieron lugar a la "sorpresa refractiva de las nueve dioptrías", como consecuencia directa de la dificultad para determinar el estado refractivo del paciente y la gran variabilidad de la potencia del cristalino humano. Esta técnica no fue aceptada hasta la década del 60 del pasado siglo por el alto número de complicaciones que presentó,4 y en la década del 70 tuvo un refinamiento posterior.5 En esta década apareció la primera generación de fórmulas y se introducen las primeras fórmulas teóricas que no consideraban el análisis de las características clínicas del individuo.
De este modo, Fyodorov (1967) fue el primero en publicar su fórmula de vergencia teórica,6 seguido por Colenbrander (1972), Hoffer (1974), Thijissen y Vander Heijde (1975) y Binkhorst (1976); estas emplearon una constante (C) con un valor fijo de 4,5 al posicionarse el implante, en aquella época, a nivel del iris o con un soporte angular.7 A su vez en 1980, Sanders, Retzlaff y Kraff estudiaron 2 500 lentes intraoculares implantadas y al utilizar métodos empíricos basados en un análisis de regresión lineal posoperatorio crearon la fórmula SRK, que constituyó la primera generación de fórmulas de regresión. Eventualmente se encontró que la fórmula SRK, entonces usada por más del 80 % de los cirujanos para los cálculos del poder de la LIO, tenía una exactitud aceptable para ojos considerados de tamaño promedio.8
El problema de las fórmulas de primera generación es que asumían que la posición efectiva de la lente (ELP, por sus siglas en inglés) o la profundidad de la cámara anterior posoperatoria era igual en todos los ojos. Por esto, algunos autores como Hoffer observaron que los ojos largos quedaban hipercorregidos y los cortos hipocorregidos. En el Welsh Cataract Congress, en Houston, Hoffer demostró la directa relación entre la posición de una LIO de cámara posterior de polimetilmetacrilato (PMMA) y la longitud axial (ALX, por sus siglas en inglés), esto dio lugar a la aparición de la segunda generación.9 Dentro de estas se encuentran: Binkhorst II (1981), Shammas (1982) y Hoffer (1984).10 Además, consideró que la profundidad anatómica o preoperatoria de la cámara anterior (AACD, por sus siglas en inglés) se debía calcular en función de la ALX del paciente. De este modo la ELP se convirtió en una variable que cambiaba en función de la ALX; cuanto mayor era esta, mayor la ELP y viceversa. Forma parte de esta generación la fórmula SRK II, entre 1987 y 1988, que también es de regresión lineal pero con algunos ajustes hechos para ojos cortos y largos. Esta utilizó un factor de refracción diferente a la fórmula original de SRK y estuvo basada en el análisis de 2 068 pacientes.11
En 1988, Holladay propuso una relación directa entre la ALX y la curvatura corneal (K), modificó la fórmula de Binkhorst para introducir esta última variable. A pesar de la AACD, la fórmula emplea un nuevo término "factor cirujano" (SF). Retzlaff (1990) a su vez, modificó la fórmula Holladay I para permitir el uso de la constante A, con la intención de reemplazar las fórmulas de regresión (SRK) y emplearla en la fórmula teórica SRK/T. Esta es una fórmula adaptativa que utiliza los conceptos de las fórmulas teóricas optimizadas por metodología de regresión y además por la ELP, grosor retinal e índice refractivo corneal. Hoffer (1992) desarrolló la fórmula Q, la cual depende de la ALX, K, ACD personalizada (ACDP) y el poder corneal (P). Estas constituyen la tercera generación, de amplio uso en la actualidad dada su elevada predictibilidad.12
Aparece entonces la cuarta generación, su característica más distintiva es que emplea más de dos variables para predecir la posición efectiva de la lente. Hasta ese momento las fórmulas que empleaban dos variables, asumían que la distancia de la córnea a la lente, era directamente proporcional a la ALX; lo que era igual que decir que los ojos cortos, siempre tenían cámaras estrechas y viceversa. Esto ocasionaba una hipocorrección en ojos cortos e hipercorrección en ojos largos y fue refutado por Holladay en 1997, al exponer la posibilidad de 9 combinaciones clínicas entre el tamaño del polo anterior y la longitud axial. Sus creadores al utilizar la ACD preoperatoria estima la ELP a partir de 4 variables (ALX, K, ACD y AACD). Usa la ACD de forma similar a Hoffer y Holladay.13 Holladay (1996), tras demostrar que su fórmula no es tan segura como la Hoffer Q en ojos con ALX menor de 22 mm propone la fórmula Holladay II, esta emplea 7 variables que por orden de importancia son ALX, K, distancia blanco - blanco corneal o índice white to white (WTW), refracción posoperatoria, ACD, grosor del cristalino y edad del paciente. Esta se puede emplear en un amplio rango de ALX y es altamente precisa, presenta el inconveniente de no estar disponible ni publicada en los biómetros convencionales, solo se dispone de ella previo pago del software comercial o paquete informático (Holladay IOL Consultant).14
Por último, aparece la quinta generación y en 1991 Wolfgang Haigis (Wuerzburg, Alemania) creó la fórmula que designara con su nombre. Esta se publicó en 1999 y usó la misma estructura matemática que las otras fórmulas.15
Aparejado al perfeccionamiento de las técnicas quirúrgicas en la cirugía de catarata se han desarrollado evolutivamente las fórmulas biométricas empleadas en el proceso de cálculo de la lente intraocular. Los cálculos biométricos de las lentes se realizan con programas computarizados que trabajan con dos grupos de fórmulas: las teóricas que se basan en dos sistemas de lentes y aplican la geometría óptica a un ojo esquemático, y las empíricas o de regresión que realizan el análisis retrospectivo de la refracción posoperatoria de múltiples intervenciones y relacionan los resultados con la longitud axial y la queratometría.
En la actualidad, a pesar de poseer una tecnología sofisticada y softwares inteligentes, frecuentemente los resultados refractivos finales distan de los esperados.2 Tiende a ser la correcta selección de la fórmula biométrica de cálculo y su personalización, un pilar indispensable para lograr la emetropía en los pacientes. Este último término se refiere al ajuste de nuestros resultados, al emplear nuevas lentes intraoculares o equipos de medición, para adecuar la constante dada por el fabricante a la que mejor resulte en nuestra práctica personal (basada en la experiencia pasada de un cirujano y los datos previos). Las constantes empleadas son absolutamente esenciales para el cálculo del poder efectivo del implante.16
La optimización de las constantes de las fórmulas para el cálculo de la LIO es recomendada por muchos autores de las fórmulas modernas.17-19 El error de realizar este proceso para la interferometía de coherencia parcial (PCI) con el IOL Master ofrece resultados refractivos subóptimos que pueden ser peores que cuando el ultrasonido de contacto es usado para las mediciones de longitud axial.20
En Cuba, la primera operación de catarata se realizó el 12 de septiembre de 1813, por el oftalmólogo alemán J.F. Nissen, a través de la extracción extracapsular del cristalino propuesta por Daviel.21 Los primeros implantes de lentes intraoculares en el país se remontan al año 1953, y fueron revelados durante una sesión del Congreso Itinerante de la Asociación Panamericana de Oftalmología, por los oftalmólogos cubanos Yanes, Alfonso, Anton y Duarte quienes expusieron sus experiencias e innovaciones al respecto. A partir de esta fecha la cirugía de catarata se efectuó en hospitales con mayor o menor especialización en Cuba y se fue perfeccionando paralelamente a los adelantos mundiales.
En 1988 en Cuba se funda el Centro de Microcirugía, con vasta experiencia en implantología ocular. Aquí por espacio de 10 años se usó la fórmula de Fyodorov en el cálculo de la lente. No es hasta 1999, que se introducen las fórmulas de tercera generación. No obstante a la utilización de estas, un porcentaje elevado de pacientes quedan hipercorregidos e hipocorregidos, según los resultados analizados de un período de 15 años, que incluyó 12 866 pacientes.22-24 Las constantes utilizadas en los procesos de cálculo de las lentes fueron las proporcionadas por el fabricante para cada modelo, medidas mediante biometría ultrasónica.
Se ha demostrado que estas para la biometría óptica son típicamente más elevadas y es necesario su compensación.25 La estandarización de las constantes para el cálculo de la LIO puede mejorar significativamente la predictibilidad de los resultados refractivos en la cirugía de catarata. A pesar de los estudios de los resultados refractivos posteriores a la cirugía de catarata, existen pocas publicaciones que evalúan los beneficios de la optimización de las constantes de las lentes intraoculares, al comparalas con el uso de su valor manufacturado.26 Se estudió lo antes mencionado tras el uso del IOL Master en el Instituto Cubano de Oftalmología "Ramón Pando Ferrer", no se contaba a su llegada (2005) con otras investigaciones al respecto en nuestro país.
MÉTODOS
Se realizó un estudio descriptivo retrospectivo de serie de casos, en el período de mayo de 2007 a enero de 2011. El universo estuvo constituido por 8 643 pacientes. Se seleccionó una muestra aleatoria de 1 088 pacientes, a los cuales se les realizó la técnica de faco chop por 12 cirujanos, e implante de lente flexible (modelo PCF60). Se excluyeron los pacientes que presentaron alguna o varias de las siguientes condiciones: diagnóstico de catarata traumática, complicada o secundaria; técnica quirúrgica realizada diferente a faco chop e implante de otro modelo de lente o que no se haya colocado en cámara posterior; aquellos que presentaron complicaciones transquirúrgicas; en el posoperatorio, esfera o cilindro mayor o igual a 3 D, mejor agudeza visual corregida (MAVC) menor o igual a 0,5, longitud axial entre 20 y 30 mm o diferencia de + 1 D entre la refracción programada y la obtenida.
Se evaluaron los resultados de la aplicación de las constantes A, factor cirujano y profundidad de la cámara anterior, personalizadas en el programa para el cálculo de la LIO por interferometría de coherencia parcial (IOL Master). Este contiene fórmulas de tercera generación (Holladay, SRK/T y Hoffer Q) y de cuarta generación (Haigis). Los pacientes fueron distribuidos aleatoriamente en 3 grupos para su estudio según las mediciones preoperatorias de la longitud axial: grupo I (ALX menor de 22 mm), grupo II (ALX entre 22 y 25,9 mm) y grupo III (mayor de 26 mm).
Para la investigación se utilizaron las siguientes variables: constante A, factor cirujano, ACD, longitud axial preoperatoria por IOL Master, lente intraocular implantado, lente intraocular propuesto, componente esférico esperado, componente esférico obtenido, resultados refractivos, mejor agudeza visual sin corrección, mejor agudeza visual corregida. A todos los pacientes se les realizó un examen oftalmológico completo preoperatorio con medición de la longitud axial, queratometría y profundidad de cámara anterior por interferometría de coherencia parcial (IOL Master). El cálculo de la LIO se realizó por IOL Master según rango de ALX y fórmula biométrica predeterminada previamente para cada grupo.
El examen oftalmológico posoperatorio se realizó al día siguiente de la cirugía, a la semana, al mes y a los tres meses. A los tres meses de la cirugía se evaluó la agudeza visual sin corrección, la mejor agudeza visual corregida y la posición efectiva de la LIO por biomicroscopia ultrasónica.
En el procesamiento estadístico se realizó análisis de varianza (ANOVA) para la comparación entre los cirujanos de las constantes personalizadas, prueba t de comparación de medias para datos pareados en las variables cuantitativas y chi cuadrado para las cualitativas. Se utilizó 95 % como nivel de confiabilidad. La investigación desde el punto de vista ético se realizó de acuerdo con lo establecido por el Sistema Nacional de Salud y previsto en la Ley No. 41 de Salud Pública. También se aprobó por el Consejo Científico y el Comité de Ética del centro donde se realizó la investigación.
RESULTADOS
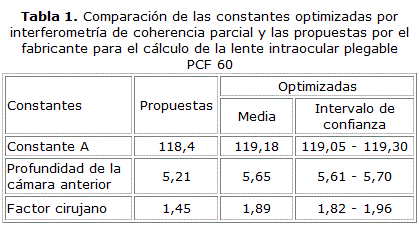
Los valores de las constantes optimizadas por interferometría de coherencia parcial fueron: constante A, 119,18; constante ACD, 5,65; y 1,89 en el factor cirujano. Las propuestas por el fabricante de la lente intraocular plegable PCF 60 eran: constante A, 118,4; constante ACD, 5,21; y 1,45 en el factor cirujano (tabla 1).
Al realizar una comparación de estas constantes optimizadas entre los cirujanos no hubo diferencias significativas. El factor cirujano fue la constante que mostró mayor variabilidad (1,75 a 2,40; p=0,091) (tabla 2). Cuando se agrupó las constantes optimizadas según las longitudes axiales se demostró la existencia de diferencias significativas entre estas (tabla 3).
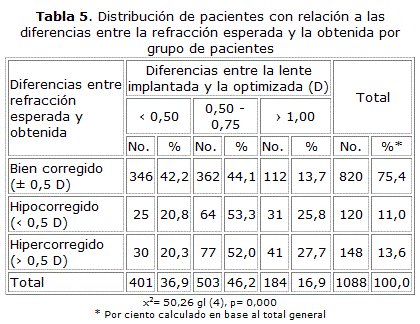
Al analizar las diferencias entre la lente intraocular implantada y la propuesta con las nuevas constantes, se apreció que 83,1 % de los pacientes tuvo menos de 1 D de error. Es importante destacar que 46,2 % de ellos se encontró en el rango de 0,5 a 0,75 dioptrías (tabla 4). Se comparó la refracción esperada y la obtenida según grupos de pacientes y se demostró que 75,4 % de los casos quedaron bien corregidos (tabla 5).
DISCUSIÓN
El concepto de "arte en la cirugía de catarata", significa controlar por parte del cirujano una serie de eventos relacionados con el proceso de diagnóstico y tratamiento quirúrgico de esta discapacidad visual; además que el cirujano sea capaz de predecir, previo acuerdo con el paciente, el resultado refractivo final. Así se podrá definir este evento como implanto-refractivo. En este proceso juega un papel importante la predictibilidad del cálculo de la lente intraocular a implantar en cada caso, para que al final el paciente se encuentre satisfecho con su mejor agudeza visual corregida y sin corrección óptica.
Múltiples son los trabajos científicos que proponen en cada caso un factor corrector para compensar las constantes que refiere cada fabricante de lente intraocular. También se refieren a las características propias y adquiridas con la cirugía de la anatomía ocular, además del resultado de la posición efectiva de la lente intraocular final. Este conjunto de factores determinarán si finalmente habrá sorpresa refractiva o un resultado no deseado.
Las constantes optimizadas por interferometría de coherencia parcial para este grupo de estudio fueron diferentes a las propuestas por el fabricante. Aristodemou y otros23 reportaron diferencias significativas entre las constantes propuestas para las lentes intraoculares Sofport AO IOL y Akreos con las personalizadas en su estudio. Hernández y otros24 en un estudio anterior realizado en el Instituto Cubano de Oftalmología concluyó que al inicio de los resultados, la ACD estimada con que se trabajaba (que era la propuesta por el fabricante de la lente según la constante A) presentaba valores muy superiores a la personalizada.
Las constantes optimizadas A, SF y ACD no tuvieron diferencias significativas entre los médicos, aunque la constante SF fue la de mayor variabilidad. Esto se explica por las características individuales de cada cirujano en la realización de la facoemulsificación, así como el lugar donde habitualmente colocan la lente intraocular. Al optimizar estas constantes se mejora el error medio absoluto.
Cuando se agruparon las constantes optimizadas según las longitudes axiales, se demostró que existen diferencias significativas entre estas. Esto fue demostrado por Hoffer y Binkhorst25 que observaron una relación entre la profundidad de la cámara anterior y la longitud axial del ojo. Holladay26 y Olsen27 utilizaron el concepto de altura corneal y la computaron al plano del iris y encontraron un valor del plano del iris a la posición efectiva del centro óptico de la LIO, denominado factor cirujano.
La fórmula de cálculo de la lente intraocular SRK/T28 utilizó la altura corneal para predecir la profundidad de la cámara anterior posoperatoria y un factor de corrección para la longitud axial el cual varió con el tamaño del ojo. Hoffer optimizó su fórmula personalizando la ACD con el propósito de predecirla en ojos pseudofáquicos y pequeños con resultados muy eficientes.29 Holladay mejoró su fórmula original y comprobó que si se utilizan dos variables de predicción, la medida de la longitud axial y la queratometría, mejora la predicción de la posición efectiva del lente y el error medio absoluto en ojos cortos pero similar a Hoffer Q.30,31 La fórmula de Haigis es efectiva en todos los rangos de longitudes axiales.32
Con relación a las diferencias entre la lente intraocular implantada y la propuesta con las nuevas constantes, se aprecia que 83,1 % del total de los pacientes tuvieron menos de 1 D de error entre ambos lentes y el 36,9 % quedó bien corregido. Ballate33 reporta 86,7 % de pacientes con diferencias menor a una dioptría en un estudio en el Hospital "Hermanos Ameijeiras". Santiesteban y otros,34 reportó 90 % de emetropía en el grupo de estudio por IOL Master y 48 % mediante técnica de contacto por Cinescan. Sánchez y otros35 presentaron 45 % de error refractivo residual; mientras que Curbelo y otros36 obtuvieron 65 % de emetropía.
Hoffer37 y Haigis38 reportan resultados similares a los de este estudio. Montes-Micó,39 Alfonso,40 y Landers41 obtuvieron resultados cercanos a la emetropía y resaltan la importancia de la precisión en la medida de la longitud axial para obtener la potencia de la LIO a implantar. Algo similar expresó Alio42 quien concluyó que la biometría correcta era el aspecto fundamental en el cálculo de la lente intraocular.
La distribución de pacientes en relación con las diferencias entre la refracción esperada y la obtenida demostró que 75,4 % quedaron bien corregidos. Ballate33 y otros reportaron 13,3 % de defecto refractivo miópico en un grupo de pacientes operados por facoemulsificación y 81,2 % para la técnica de Blumenthal. Aristodemou y otros recomiendan que para tener un defecto residual lo más cercano a la emetropía se debe estudiar entre 148 y 257 cirugías no complicadas.43
Para lograr la excelencia en el resultado refractivo final de los pacientes operados de catarata, es importante tener en cuenta la personalización del cálculo de la LIO y la técnica quirúrgica. Se ha demostrado por los resultados en múltiples estudios que la facoemulsificación es la más efectiva, con implante en el saco capsular de una LIO plegable a través de una incisión menor de 3 mm, sin complicaciones.
Concluimos que las constantes optimizadas por interferometría de coherencia parcial resultan más elevadas que las propuestas por el fabricante a pesar de no mostrar resultados significativos. Para la mayoría de los cirujanos las diferencias entre las constantes personalizadas no son clínicamente significativas y la mayor variabilidad se evidencia en el factor cirujano. Por esto la optimización de las constantes para el cálculo de la LIO permite, de acuerdo a las características individuales de cada ojo según longitud axial, usar la fórmula adecuada. Se demuestra que con las constantes personalizadas no hay diferencias importantes entre la LIO implantada y la recomendada en cada caso, por lo que la optimización de las constantes por IOL Master incrementó la predictibilidad de los resultados refractivos.
REFERENCIAS BIBLIOGRÁFICAS
1. Apple DJ, Trivedi RH. Sir Nicholas Harold Ridley, Kt, MD, FRCS, FRS: contributions in addition to the intraocular lens. Arch Ophthalmol. 2002;120(9):1198-1202.
2. Astbury N, Ramamurthy R. ¿Cómo evitar errores en biometría? Salud Ocular Comunitaria. 2007;2(3):17-8.
3. Escobar-Gomez M, Apple D, Vargas L. Tribute for Sir Nicholas Harold Ridley: inventor of intraocular lenses. Arch Soc Esp Oftalmol. 2011;86(11):687-8.
4. Serrano Prado A, Nava Hernández GN. Cálculo del poder dióptrico de las lentes intraoculares. ¿Cómo evitar la sorpresa refractiva? Rev Méx Oftalmol. 2009;83(5):272-80.
5. Barraquer J. Cataract surgery and IOL implantation. Documenta Ophthalmologica. 1992;81(3):267-80.
6. Fyodorov SN, Kolina AN, Kolinko AL. Estimation of optical power of the intraocular lens. Vestn Ophthalmol. 1967;80(4):27-31.
7. Hoffer KJ, Mortensen J. An update on IOL Power Calculation Formulas. En: Garg A, Lin JT, Latkany R, Bovet J, Haigis W, editores. Mastering in the Techniques of IOL Power Calculations. New Delhi: Jaypee Brothers Medical Publishers; 2009. p. 51-6.
8. Retzlaff JA, Sanders DR, Kraff MC. Development of the SRK/T intraocular lens implants power calculation formula. J Cataract Refract Surg. 1990;16(3):333-40.
9. Hoffer KJ. Reply: Errata in printed Hoffer Q formula. J Cataract Refractive Surg. 2007;33(1):2-3.
10. Shammas HJ, Hoffer KJ, Shammas MC. Scheimpflug photography keratometry readings for routine intraocular lens power calculation. J Cataract Refract Surg. 2009;35(2):330-4.
11. Thijssen JM. The emmetropic and the iseikonic implant lens: computer calculation of the refractive power and its accuracy. Ophthalmologica. 1975;171(6):467-86.
12. Holladay JT. Standardizing constants for ultrasonic biometry, keratometry, and intraocular lens power calculations. J Cataract Refract Surg. 1997;23(9):1356-70.
13. Olsen T. Prediction of the effective postoperative (intraocular lens) anterior chamber depth. J Cataract Refract Surg. 2006;32(3):419-24.
14. Holladay JT, Prager TC, Chandler TY, Musgrove KH, Lewis JW, Ruiz RS. A three-part system for refining intraocular lens power calculations. J Cataract Refract Surg. 1988;14(1):17-24.
15. Haigis W. IOL Calculation in long and short eyes. In: Garg A, Lin JT, editores. Mastering intraocular lenses (IOLs). New Delhi: Jaypee Brothers Medical Publisher; 2007. p. 92-9.
16. Hoffer KJ, Mortensen J. Customization of IOL formulas. En: Garg A, Lin JT. Latkany R, Bovet J, Haigis W, editores. Mastering in the Techniques of IOL Power Calculations. New Delhi: Jaypee Brothers Medical Publishers; 2009. p. 121-4.
17. Zuberbuhler B, Morrell AJ. Errata in printed Hoffer Q formula. J Cataract Refract Surg. 2007;33(2):2_3.
18. Petermeier K, Gekeler F, Messias A, Spitzer MS, Haigis W, Szurman P. Intraocular lens power calculation and optimized constants for highly myopic eyes. J Cataract Refract Surg. 2009;35(9):1575-81.
19. Olsen T. Improved accuracy of intraocular lens power calculation with the Zeiss IOL Master. Acta Ophthalmol Scandinava. 2007;85(1):84-7.
20. Madge SN, Khong CH, Lamont M, Bansal A, Antcliff RJ. Optimization of biometry for intraocular lens implantation using the Zeiss IOL Master. Acta Ophthalmologica Scandinava. 2005;83(4):436-8.
21. Santiesteban FR. Historia de la Oftalmología en Cuba. 2da. ed. La Habana: Editorial Ciencias Médicas; 2006. p. 96-189.
22. Gale RP, Saldana M, Johnston RL, Zuberbuhler B, McKibbin M. Benchmark standards for refractive outcomes after NHS cataract surgery. Eye. 2009;23(1):149-52.
23. Aristodemou P, Knox Cartwright NE, Sparrow JM, Johnston RL. Intraocular lens formula constant optimization and partial coherence interferometry biometry: Refractive outcomes in 8108 eyes after cataract surgery. J Cataract Refract Surg. 2011;37(1):50-62.
24. Hernández Silva JR, Padilla González CM, Ramos López M, Rios Cazo R, Río Torres M. Personalización de las fórmulas de cálculo de la lente intraocular. Rev Cubana Oftalmol. 2004 [citado 13 de diciembre de 2011];17(2). Disponible en: http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S0864-21762004000200007
25. Binkhorst RD. Intraocular lens power calculation manual: A guide to the author´s. Ticc-40 programs. 3ra. ed. New York: R.D. Binkhorts; 1984.
26. Holladay JT, Prager TC, Chandler TY, Musgrove KH, Lewis JW, Ruiz RS. A three-part system for refining intraocular lens power calculation. J Cataract Refract Surg. 1988;14(1):17-24.
27. Olsen T. Prediction of intraocular lens position after cataract extraction. J Cataract Refract Surg. 1986;12(4):376-9.
28. Sanders DR, Retzlaff J, Kraff MC. Comparison of the SRKII formula and other second generation formulas. J Cataract Refract Surg. 1990;16(3):136-41.
29. Retzlaff J, Sanders DR, Kraff MC. Development of the SRK/T intraocular lens implants power calculation formula. J Cataract Refractive Surg. 1990;16(3):333-40.
30. Hoffer KJ. The Hoffer Q formula: A comparison of theoretic and regression formulas. J Cataract Refract Surg. 1993;19(6):700-11.
31. Holladay JT. Resultados clínicos con el uso de la fórmula de Holladay 2 para el cálculo de LIO. J Cataract Refractive Surg. 2000;26(8):1233-7.
32. Haigis W. IOL Calculation according to Haigis. Graefes Arch Clin Exp Ophthalmol. 2004;238(9):765-73.
33. Ballate E, Márquez M, Rankin L, Salazar M. Errores en el cálculo del poder dióptrico del lente intraocular. Rev Cubana Oftalmol. 1998 [citado: 13 de diciembre de 2011];11(1):32-8. Disponible en: http://bvs.sld.cu/revistas/oft/vol11_1_98/oft05198.htm
34. Santiesteban I, Pérez EC, Capote A, Montero E, Pedroso A, Rodríguez B. Efectividad del cálculo del poder dióptrico de la lente intraocular con interferometría parcialmente coherente. Rev Cubana Oftalmol. 2010 [citado: 13 de diciembre de 2011];23(1). Disponible en: http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S0864-21762010000100009&lng=es&nrm=iso&tlng=es
35. Sánchez-León F. LASIK post cirugía del cristalino: En: Sánchez Galeana C. Lasik-Lasek. Nuevos horizontes en la calidad de la visión. Panamá: Highlights of Ophthalmology; 2003. p. 201-5.
36. Curbelo Cunill L, Hernández Silva JR, Lanz L, Ramos López M, Río Torres M, Fernández Vázquez G, et al. Resultados de la cirugía de cataratas por la técnica de Facoemulsificación con Quick Chop. Rev Cubana Oftalmol. 2007 [citado: 13 de diciembre de 2011];20(2). Disponible en: http://bvs.sld.cu/revistas/oft/vol20_2_07/oft02207.html
37. Hoffer KJ, Shammas HJ, Savini G. Comparison of 2 laser instruments for measuring axial length. J Cataract Refract Surg. 2010;36(4):644-8.
38. Haigis W, Lege B, Miller N, Schneider B. Comparison of immersion ultrasound biometry and partial coherence interferometry for IOL calculation according to Haigis. Graefe´s Arch Clin Exp Ophthalmol. 2000;238(9):765-3.
39. Montés-Micó R, Ferrer-Blasco T, Charman WN, Cerviño A, Alfonso JF, Fernández _Vega L. Optical quality of the eye after lens replacement with a psedoaccommodating intraocular lens. J Cataract Refract Surg. 2008;34(5):763-8.
40. Alfonso JF, Fernández-Vega L, Señaris A, Montes-Micó R. Prospective study of the Acri.LISA bifocal intraocular lens. J Cataract Refract Surg. 2007;33(11):1930-5.
41. Landers J, Gogging M. An inter-eye comparison of refractive outcomes following cataract surgery. J Refract Surg. 2010;26(3):197-200.
42. Alió JL, Montés-Micó R. Wavefront-guided versus standard LASIK enhancement for residual refractive errors. Ophthalmology. 2006;113(2):191-7.
43. Orts P, Devesa P, Tañá P. Interferometría de coherencia parcial: estudio comparativo entre la interferometría de coherencia parcial y la biometría ultrasónica para el cálculo de la LIO. Microcirugía ocular. 2001 [citado: 13 de diciembre de 2011];(1). Disponible en: http://www.oftalmo.com/secoir/secoir2001/rev01-1/01a-02.htm
Recibido: 23 de septiembre de 2011.
Aprobado: 15 de mayo de 2012.
Dr. C. Juan Raúl Hernández Silva. Instituto Cubano de Oftalmología "Ramón Pando Ferrer". Ave. 76 No. 3104 entre 31 y 41, Marianao. La Habana, Cuba. Correo electrónico: jrhs@infomed.sld.cu