Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Oftalmología
versión impresa ISSN 0864-2176
Rev Cubana Oftalmol vol.25 no.2 Ciudad de la Habana oct.-dic. 2012
REVISIONES
Alteraciones del polo posterior en la miopía degenerativa
Alterations of the posterior pole in degenerative myopia patients
Dra. Suzel Ivón Lapido Polanco,I Dr. Rafael Ernesto González Díaz,I Dra. Violeta Rodríguez Rodríguez,I Dr. Yorlandis González Arias,I Dr. Waldemar Baldoquín Rodríguez,II Dra. Madelaine López GonzálezIII
I Instituto Cubano de Oftalmología "Ramón Pando Ferrer". La Habana, Cuba.
II Departamento de Investigación y Desarrollo de Servicios Médicos Cubanos. La Habana, Cuba.
III Hospital Pediátrico "Juan Manuel Márquez". La Habana, Cuba.
RESUMEN
La miopía degenerativa constituye una de las causas fundamentales de pérdida de la visión. Esto está relacionado con las alteraciones del polo posterior, que afectan la retina neurosensorial, el epitelio pigmentario de la retina y las capas más internas de la coroides. Su curso lento y progresivo demanda una exploración integral, con seguimiento en el tiempo y constituye un reto para el oftalmólogo. Se realizó una revisión de artículos publicados e indexados en la base de datos de PubMed que se refirieran a las características clínicas del fondo de ojo en pacientes con miopía degenerativa, para describir las principales alteraciones del polo posterior del globo ocular en esta entidad. Se encontró entre las lesiones típicas de la alta miopía, al estafiloma posterior como un signo patognomónico de la enfermedad, asociado a la atrofia coriorretiniana en parches o difusa, así como las estrías de laca y las hemorragias maculares secundarias a ellas o provenientes de membranas neovasculares coroideas. La tomografía de coherencia óptica ha permitido un diagnóstico más preciso de otras lesiones maculares como la foveosquisis, el agujero macular y, más recientemente, la mácula en domo. Los cambios degenerativos del polo posterior parecen guardar relación unos con otros pero la patogenia no ha sido bien esclarecida a pesar de los avances tecnológicos.
Palabras clave: miopía degenerativa, estafiloma posterior, neovascularización coroidea, foveosquisis.
ABSTRACT
Degenerative myopia is one of the main causes of visual impairment. This is related to disorders in the posterior pole, affecting the neurosensorial retina, the retinal pigmented epithelium and the inner choroidal layers. The slow and progressive course of this condition demands comprehensive assessment and long follow-up, which is a challenging task for ophthalmologists. A review of the articles indexed in PubMed regarding the clinical characteristics of the fundus in patients with degenerative myopia was made to describe the main disorders of the posterior pole of the eyeball. Posterior staphyloma was found among the typical lesions of high myopia, associated with patchy or diffuse chorioretinal atrophy, lacker cracks, choroidal neovascular membranes and macular hemorrhages secondary to them or stemmed from choroidal neovascular membranes. More accurate diagnosis of foveoschisis, macular holes, and more recently dome-shaped macula has been achieved with optical coherence tomography. The degenerative changes of posterior pole seem to be associated each other, but pathogenesis of myopic retinopathy has not been clearly stated, despite the recent technological advances.
Key words: degenerative myopia, posterior staphyloma, choroidal neovascularization, foveoschisis.
INTRODUCCIÓN
La miopía es un defecto refractivo en el que existe dificultad para la visión de lejos. Se debe a que los rayos de luz que inciden en el ojo se enfocan por delante de la retina, ya sea por aumento de la curvatura corneal, por aumento del índice de refracción de los medios refringentes o por una longitud axial del globo ocular incrementada. Estos errores de la refracción se corrigen con lentes negativas, o cóncavas o divergentes, como también se les llama.
Se denomina miopía alta, magna, patológica o degenerativa (MD) al defecto refractivo con equivalente esférico igual o mayor a - 6,00 dioptrías (D). Este suele acompañarse de longitud axial de 26 mm o más y degeneración progresiva retinocoroidea en el polo posterior.1
Es de mucho interés profundizar en este tema de la MD que constituye una de las causas fundamentales de pérdida de la visión, se considera una enfermedad ocular y no un simple trastorno refractivo. Las alteraciones estructurales presentes en su cuadro clínico y la evolución natural se han descrito a lo largo de los años, pero su etiopatogenia y el tratamiento adecuado de las lesiones que se presentan, son un reto para el oftalmólogo actual.
Se conoce que en esta entidad se desarrollan lesiones degenerativas de la retina periférica, que predisponen a complicaciones graves como el desprendimiento de retina (DR) regmatógeno. De ahí que los exámenes de los pacientes miopes se enfoquen generalmente en el examen minucioso de la periferia. Sin embargo, la principal causa de pérdida visual se relaciona con las alteraciones del polo posterior, que afectan la retina neurosensorial, el epitelio pigmentario de la retina (EPR) y las capas más internas de la coroides. Su curso suele ser lento y progresivo, lo cual demanda una exploración integral, con seguimiento en el tiempo, por parte del retinólogo.
Motivados por la necesidad de profundizar en esta temática, debido a la gran cantidad de pacientes miopes atendidos en consulta se realizó esta revisión sobre las alteraciones clínicas del polo posterior de los pacientes con miopía degenerativa.
DESARROLLO
Se realizó una revisión de artículos publicados e indexados en la base de datos de PubMed hasta el 2011, que se refirieran a las características clínicas del fondo de ojo en pacientes con miopía degenerativa, para describir las principales alteraciones del polo posterior del globo ocular en esta entidad. Las búsquedas se realizaron utilizando los términos en inglés: degenerative myopia, posterior staphyloma y choroidal neovascularization. Los resultados se filtraron para tener en cuenta los estudios de revisión, las investigaciones clínicas o experimentales y originales sobre fisiopatología, histología, epidemiología, métodos diagnósticos y otros relacionados con las alteraciones del polo posterior en la miopía degenerativa.
Epidemiología
La miopía degenerativa es una entidad que se presenta desde edades muy tempranas en la vida y progresa con el paso de los años. También varía según la etnia del paciente.2,3
Esta enfermedad se encuentra en el séptimo lugar de las causas de ceguera en adultos en los Estados Unidos.4 Se ha informado que en dicho país, tiene una prevalencia de 2 % en la población blanca,2 sin embargo, en Europa es de 0,5 %.5 En los adultos asiáticos es más frecuente y se ha descrito una prevalencia de 9 %,3 otros refieren que puede variar de 5 a 10 %.6
Etiopatogenia
La patogénesis de la MD es muy incierta, algunas teorías se basan en que el aumento de la longitud del ojo produce un estiramiento de las capas oculares.7 Se refiere que la esclera, en estos casos, es muy distensible y se elonga como consecuencia de la presión intraocular y las fuerzas de los músculos extraoculares. Sin embargo, otros han planteado que existen evidencias de alteraciones abiotróficas, codificadas genéticamente e independientes de las fuerzas mecánicas. En algunos casos se ha demostrado un patrón de herencia autosómica dominante en miopes magnos.8
Manifestaciones clínicas
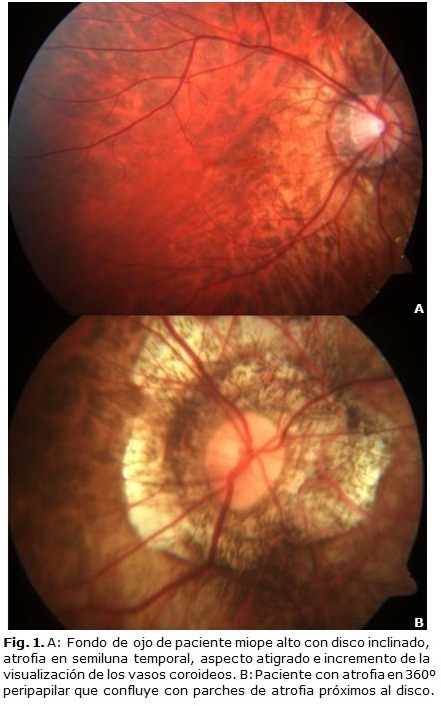
El fondo de ojo de un paciente con MD es muy singular (Fig. 1). Al realizar la oftalmoscopia lo primero que se observa es el disco óptico, cuya apariencia puede ser normal, pero con frecuencia se presenta típicamente inclinado y oblicuo o en ciclotorsión, con el lado temporal aplanado y el nasal más elevado. Es frecuente su forma oval en sentido vertical aunque también puede serlo en el eje horizontal. Puede estar rodeado por un área concéntrica de despigmentación por atrofia coriorretiniana, más común en el borde temporal, denominada cono miópico, semiluna o creciente temporal. En algunos ojos se presenta en otras localizaciones (nasal o inferior) o una atrofia peripapilar en 360°, también conocida como anular, que en un 10 % de los ojos1 y en etapas avanzadas confluye con placas de atrofia que inicialmente estaban próximas al disco, pero separadas por tejido no dañado. Curtin describió el signo de la "T" de la bifurcación de los vasos retinianos centrales asociado con la eversión del disco óptico en la retinopatía miópica.7
Recientemente se han descrito los desprendimientos peripapilares, que oftalmoscópicamente se ven como lesiones amarillo-naranja localizadas alrededor del disco en ojos con alta miopía, con incidencia de hasta 9,4 % en este tipo de ojos. Mediante la tomografía de coherencia óptica (OCT, por sus siglas en inglés) aparecen como desprendimientos del EPR localizados. En la región peripapilar también aparecen micropliegues vasculares que se asocian a la formación de retinosquisis.9
El estafiloma posterior (EP) es un rasgo distintivo de los ojos miopes altos, constituye el área de protrusión de la pared ocular posterior, por adelgazamiento y expansión de la misma, lo cual ocurre de forma gradual. Se ha descrito que en estos casos existe una disposición alterada de las fibras de colágeno de la esclera, además de inmadurez de sus estructuras histológicas.10 La ectasia de la pared posterior se presenta con mayor frecuencia en ojos con gran longitud axial.11
El desarrollo de un EP va ligado a un estiramiento del polo posterior del globo ocular, que se asocia a varios tipos de lesiones como: atrofia coriorretiniana, rupturas de la membrana de Bruch (estrías de laca), neovacularización coroidea (NVC), retinosquisis macular y agujero macular (AM). Estas lesiones, por su localización tienen una importante repercusión en la visión del paciente.6,12
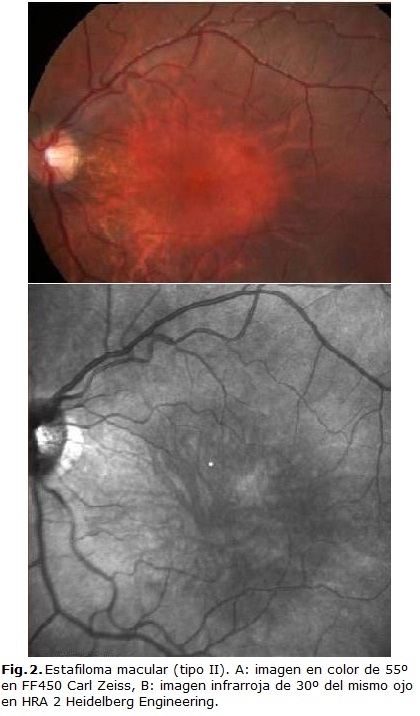
Curtin ha sido uno de los principales investigadores sobre la miopía degenerativa. En el siglo pasado publicó una clasificación de las características clínicas del EP, que ha sido poco difundida en nuestro medio, pero hoy traza las pautas para los seguidores del tema. Los criterios de Curtin describen 10 tipos diferentes de EP: del I al V son estafilomas primarios y del VI al X son formas de estafilomas compuestos. Para su descripción tuvo en cuenta el área del fondo en el que se localizaba la ectasia, además de la forma, tamaño, profundidad, márgenes y los cambios en la apariencia del disco y de los vasos (Fig. 2). De estos, el EP tipo I fue el más común de los primarios (76 %) y el que más se presentó como base de los tipos compuestos. Los más raramente encontrados fueron los peripapilares (tipo III) y los inferiores (tipo V).13
Los estafilomas posteriores más profundos tienen bordes agudos. El área de adelgazamiento muestra palidez, muy marcada a veces, lo que contrasta con otras zonas no comprometidas. En las áreas afectadas la visibilidad de los vasos coroideos está incrementada por la delgadez de la retina, cambios del EPR, la coriocapilar y que pueden llegar a la atrofia y producir un defecto en ventana. Las arterias coroideas se reducen en número y calibre en la región macular, mientras que las venas sólo son atenuadas en el área del estafiloma. Se dificulta la localización de la fóvea y puede ayudar en esto la orientación de las arteriolas maculares. El pigmento lúteo puede hacerse visible.1,13 Ayudados por la OCT, se ha descrito los agujeros paravasculares, que son de difícil percepción clínicamente.12
Ecográficamente los estafilomas miópicos aparecen como elongaciones de mayor o menor tamaño localizadas en la pared posterior, o bien como un hueco que está en la concavidad del polo posterior, aunque la morfología general del globo ocular no está alterada. La profundidad de los EP puede ser medida a través de este importante medio de diagnóstico. En el modo B se realiza un corte transversal del polo posterior y se mide la distancia desde la superficie interna del disco hasta la parte más profunda del estafiloma. El dato obtenido permite clasificarlo en grados, siguiendo los criterios plasmados por Steidl y Pruett:14
- Grado 0: la curva de la zona de ectasia es muy suave (imposible medirlo).
- Grado 1: profundidad es de 2 mm o menos.
- Grado 2: profundidad mayor de 2 mm y menor de 4 mm.
- Grado 3: profundidad mayor o igual a 4 mm pero menor de 6 mm.
- Grado 4: profundidad de 6 mm o más.
Macarro y otros analizaron el comportamiento de las imágenes ultrasónicas de los estafilomas posteriores en un grupo de pacientes con deformidades en la pared ocular, aunque no todos eran altos miopes. En su serie encontraron 4 tipos fundamentales: el primero que afecta al polo posterior pero no al nervio óptico (34,48 %); segundo, estafiloma que cubre al polo posterior y la cabeza del nervio óptico (48,28 %); tercero, estafiloma peripapilar que afecta el polo posterior, cabeza del nervio óptico, las arcadas vasculares y gran parte del eje anteroposterior del ojo (13,79 %); cuarto, estafiloma peripapilar gigante, similar al descrito anteriormente pero de un tamaño muy grande, este se presentó en solo un caso (3,45 %).15
El modo A del ultrasonido es de muchísima utilidad en estos pacientes para realizar mensuraciones de las estructuras oculares. La distancia anteroposterior del ojo es una de las principales medidas a tener en cuenta para diagnosticar la retinopatía miópica, sin dejar de mencionar su importancia en el cálculo del poder de la lente intraocular, junto a la profundidad de la cámara anterior y el grosor del cristalino.
En un estudio desarrollado en la Clínica de Miopía Alta de la Tokyo Medical and Dental University se analizaron 209 ojos con MD de 108 pacientes y se encontró que 90 % de los ojos examinados presentaba estafiloma posterior. Para la estratificación de los grupos se tuvieron en cuenta los criterios de Curtin y la clasificación ecográfica publicada por Steidl y Pruett. El grado II fue el que predominó de modo general, pero en el grupo de mayores de 50 años se fue incrementando la incidencia del tipo IX. La prevalencia y los grados más avanzados (mayor del grado 2 medido por ultrasonido) de EP fueron más frecuentes en el grupo de más edad, con significación estadística.
Los mayores grados de estafiloma se asociaron con una miopía más elevada. Los casos que fueron seguidos en el tiempo evidenciaron la progresión de tipo II a IX con el incremento de la edad. En los que tenían EP tipo IX se observó mayor grado de degeneración retiniana miópica que en los tipos II.16
En la valoración integral del EP es casi obligado realizar los cortes tomográficos que nos permiten los modernos equipos de tomografía de coherencia óptica. Los tomogramas hechos con el dominio espectral (SD-OCT, por sus siglas en inglés) han superado la calidad de las generaciones anteriores de la OCT (dominio del tiempo). En la actualidad algunos trabajos describen no solo las características estructurales de la mácula, sino que utilizan avanzados softwares para la medición de estratos oculares, más allá del epitelio pigmentario de la retina, y pueden llegar a determinar el grosor coroideo. Ikuno y Tano realizaron un estudio de una serie de ojos con MD pero sin alteraciones posteriores, a través de las imágenes de SD-OCT, para evaluar las características morfológicas. Entre sus principales resultados obtuvieron un grosor retinal medio de 200,9 ±39,3 µm. El grosor coroideo medio en la fóvea fue de 100,5 ±56,9 µm y existió diferencia significativa en la medición de la coroides en la zona temporal (125,4 ±59,7 µm), nasal (81,9 ±35,0 µm) y superior (129,4 ±57,5 µm) (p< 0,01). Se encontró asociación significativa entre el grosor coroideo central y el defecto refractivo (p< 0,05), así como la altura del estafiloma posterior (p< 0,01). La altura del estafiloma posterior tuvo significativa correlación con el error refractivo y la longitud axial (p< 0,01). Los autores concluyeron que la formación del estafiloma posterior en los ojos altos miopes tiene mucha importancia en el adelgazamiento de la coroides.17
Varios autores han descrito los cambios coriorretinianos del fondo que acompañan a la miopía patológica (M). Avila y otros establecieron una escala de incremento de la severidad de 0 a 5, de la siguiente forma:18
- M0: apariencia normal del polo posterior.
- M1: palidez coroidea y fondo atigrado (se define como la condición en la cual, los vasos de la coroides pueden ser vistos a través de la retina por la hipopigmentación o hipoplasia del epitelio pigmentario).
- M2: palidez coroidea y fondo atigrado con estafiloma posterior.
- M3: palidez coroidea y fondo atigrado con estafiloma posterior y estrías de laca.
- M4: palidez coroidea y fondo atigrado con estafiloma posterior, estrías de laca y áreas focales de atrofia coroidea profunda.
- M5: polo posterior con grandes áreas de atrofia coroidea "esclera desnuda".
Esta clasificación fue establecida hace más de un cuarto de siglo y todavía hay quienes la tienen en cuenta para estudiar los casos con miopía degenerativa. No obstante, estudios profundos y más recientes como el del equipo de Hayashi, plantean que la de Avila tiene limitaciones porque no se basa en los patrones de progresión de la enfermedad. En ella está incluido el estafiloma posterior, sin embargo, sus críticos aseguran que la ectasia es la causa de la maculopatía miópica y no su consecuencia. Estos argumentos se basan en las evidencias obtenidas después de varias décadas de estudio de pacientes miopes magnos. También están en desacuerdo con el lugar que ocupan las estrías de laca en la categoría M3 (al traducirse como signo de una etapa avanzada) sin tener en cuenta que estas lesiones con frecuencia se observan en individuos jóvenes, sin estafiloma posterior o atrofia coriorretiniana.19
Otros como Vongphanit establecieron sus criterios para clasificar los signos clínicos. En su estudio, Prevalence and progression of myopic retinopathy in an older population, caracterizó la alta miopía en una población caucásica, mayor de 49 años de edad, residente en Australia, en la que describió la retinoptía miópica con la presencia de: estrías de laca, manchas de Fuchs, atrofia coriorretiniana y el estafiloma posterior, y consideró para este último la clasificación de Curtin.11
En el Atlas of posterior fundus changes in pathologic myopia publicado por Tokoro,20 se describe otra clasificación de la maculopatía miópica, la cual incluye: fondo atigrado, atrofia coriorretiniana difusa, atrofia coriorretiniana en parches y hemorragia macular.
Los autores de esta clasificación incluyeron inicialmente las estrías de laca (rupturas de la membrana de Bruch) en la atrofia coriorretiniana difusa, pero se conoce que no siempre progresan a ese tipo de lesión, por lo que en otro estudio se han tenido en cuenta como lesiones independientes.19
Las áreas de atrofia coriorretiniana son redondeadas o irregulares, pequeñas o extensas, aisladas o múltiples, y como ya se mencionó, crean un defecto en ventana. Estas suelen progresar y confluir en estadios avanzados de la enfermedad. Se presentan además, acúmulos variables de pigmentos, por migración de células del epitelio pigmentario de la retina.
Hayashi y su equipo describieron varios patrones en la formación de la atrofia en parches: el primero, a partir del aumento del ancho de las estrías de laca, en estos casos las placas atróficas suelen disponerse horizontal o verticalmente y se localizan cerca de la fóvea; segundo, debido a la progresión de la atrofia difusa, que pueden formar parches circulares, más profundos, con mayor deterioro de la visión, sobre todo cuando afectan el área central, en estos casos se les denomina "atrofia macular"; el tercero ocurre en el margen de un estafiloma posterior.19
En este mismo estudio longitudinal para evaluar la progresión de la maculopatía miópica, se observó con mayor frecuencia el estafiloma posterior en los ojos que tuvieron progresión desde un fondo atigrado, atrofia difusa y atrofia en parches, que en aquellos ojos sin progresión de las lesiones del polo posterior. Encontraron avance del daño en 40 % de los miopes altos y un patrón de progresión que afectó el pronóstico visual. Los daños se incrementaron con la edad, aunque esto no se comportó uniformemente.19
Recientemente Chen y otros caracterizaron una serie de ojos miopes altos con desprendimiento de retina regmatógeno, en los que las causas fueron pequeñas roturas lineales posteriores a lo largo de las arcadas vasculares, en el borde de parches de atrofia coriorretiniana. Las lesiones guardaban estrecha relación con los bordes del estafiloma posterior. Para su detección fue necesario un minucioso examen durante la vitrectomía pars plana pues eran prácticamente imperceptibles en la consulta preoperatoria. Los autores plantearon la hipótesis de que en la patogénesis de estas roturas se combinan: la elongación axial, la tracción vitreorretiniana, la tensión tangencial desde los vasos adyacentes y los cambios atróficos coriorretinianos, para crear esa forma única y localización particular de las roturas.21
Las hemorragias maculares fueron divididas en 2 subtipos: primero las simples, asociadas con la formación de nuevas estrías de laca, que resuelven espontáneamente y en el segundo las que se deben a neovascularizaciones coroideas.19 Las hemorragias simples se asocian con estrías de laca en 96 % de los casos, aún en ausencia de neovascularización coroidea. Son focales, de forma redondeada, subretinianas, se localizan en el área macular generalmente y pueden causar disminución de la visión aunque mejora una vez que se haya reabsorbido. El signo conocido como mancha de Forster-Fuchs se ha atribuido a cualquier mancha de coloración oscura que se presente en el área foveal, pues Forster describió su origen hemorrágico,22 mientras que Fuchs se refirió a cambios pigmentarios.23 Se conoce que las células del EPR migran hacia el espacio subretinal o al interior de la retina cuando existe una neovascularización coroidea. Por esto se considera que estas alteraciones son signos de un mismo proceso.1
En un trabajo publicado recientemente, se estudiaron pacientes miopes altos con hemorragia macular sin NVC asociada. Se tuvo en cuenta la agudeza visual al debut de la lesión y después de la reabsorción espontánea, así como la autofluorescencia de fondo y las características de la OCT en ambos momentos. Se encontró hipoautofluorescencia persistente en el sitio de la hemorragia aún cuando esta había desaparecido, en los ojos con menor recuperación visual, lo que traduce daño a nivel del epitelio pigmentario retiniano. Se observó que aquellos con pobre recuperación de la visión presentaban un defecto en la línea IS/OS (segunda banda hiperreflectiva en las imágenes de SD-OCT de la retina externa, que se corresponde con el límite de los segmentos externos e internos de los fotorreceptores), mientras que la línea IS/OS intacta al inicio, permanecía así después de la resolución de la lesión. Concluyeron que la ausencia de la línea IS/OS bajo la zona del sangramiento, en la OCT, puede ser de gran utilidad para predecir una limitada recuperación visual.24 Hay que considerar que en algunos pacientes con MD comienzan a establecerse cambios muy sutiles en las estructuras retinianas, que afectan la función visual, incluso en ausencia de NVC o atrofia evidente.25
La miopía es la segunda causa de NVC y la primera en menores de 50 años.26 Se presenta con disminución de la visión aguda y/o metamorfopsia, fundamentalmente. La lesión es grisácea, redondeada o elíptica, pequeña, elevada, centrada en la fóvea o próxima a ella. Puede haber hemorragia subretiniana profunda, pequeño desprendimiento de retina seroso o edema intrarretiniano, los exudados son raros. Puede evolucionar hacia la remisión espontánea, con recidivas en muchas ocasiones y formación de una cicatriz fibrosa que conduce a la "atrofia macular" que lleva al deterioro severo de la función visual. Debido a estas observaciones se ha determinado que el curso natural de la neovascularización coroidea miópica (NVCM) se divide en 3 estadios: activo, de cicatriz y el atrófico.20
Gracias al desarrollo de la angiografía fluoresceínica (AGF) y más recientemente la angiografía con indocianina verde (ICGA, por sus siglas en inglés), realizadas simultáneamente con modernos angiógrafos digitales, se han podido estudiar mejor los cambios vasculares en enfermedades que como la miopía, afectan la circulación coroidea. La neovascularización coroidea en estos casos muestra un patrón clásico en la angiografía fluoresceínica.
Este medio de diagnóstico es de gran utilidad para identificar signos, que muchas veces son difíciles de diagnosticar clínicamente o quedan ocultos bajo hemorragias o la neovascularización coroidea. Se puede encontrar enlentecimiento de la circulación coroidea, con adelgazamiento de la red vascular, zonas de isquemia, formación de un complejo neovascular con características de una membrana clásica pequeña, subfoveal o extrafoveal, que causa hiperfluorescencia desde las primeras fases de la angiografía fluoresceínica. Se precisan además las zonas de atrofia que dejan un defecto en ventana con hiperfluorescencia por aumento de la visualización de los vasos coroideos. Sin embargo, las hemorragias o exudados, así como los pigmentos se corresponden con zonas de hipofluorescencia por bloqueo.
La angiografía con indocianina verde brinda una valiosa información sobre las características de la circulación coroidea. En fases tardías se ven mejor las estrías de laca. También es posible identificar la atrofia coroidea peripapilar y determinar su mayor diámetro, además de los anillos oscuros alrededor de la NVC, en etapas iniciales, así como hiperfluorescencia en las fases tardías.
En un estudio clínico realizado en Korea y publicado recientemente, se analizaron retrospectivamente ojos con NVCM, sometidos a terapia fotodinámica y/o inyección de drogas inhibidoras de factor de crecimiento endotelial vascular (VEGF, por sus siglas en inglés), los cuales fueron estudiados mediante AGF e ICGA simultáneas. La presencia de estrías de laca se asoció con un grado relativamente grande (mayor o igual a 3 000 µm) de atrofia peripapilar coroidea (p <0,001); sin embargo, la NVCM con un anillo oscuro alrededor mostró menor extensión de dicha atrofia (menor de 3 000 µm). Las estrías de laca se suelen subdividir en dos grupos morfológicos fundamentales: las lineales y las estrelladas. En este trabajo se comprobó que cada estría de laca consistió en una colección de pequeños fragmentos de estrías en forma de puntos. Cuando la estría de laca lineal descansaba sobre la fóvea, la NVCM asociada se desarrolló usualmente en el centro. Cuando la estría de laca descansaba fuera de la fóvea, la NVCM surgió en el extremo de la estría de laca que estaba más cercano de la fóvea. Cuando era de forma estrellada, la NVCM se localizó en la esquina más interna del brazo que se irradiaba de la estría de laca y estaba más próximo al centro. La progresión de estas lesiones fue descrita en tres formas: elongación, ramificación y patrón en puente; las dos últimas podían progresar a neovascularización miópica.27
El anillo oscuro fue el único factor predictivo de la no ocurrencia de nueva NVCM (estadísticamente significativo).27 Histopatológicamente el anillo refleja proliferación de las células del EPR en multicapas, en el espacio subretinal, alrededor de la NVC y se dice que puede ser potencialmente favorecedor de la regeneración.28 Estos pacientes con NVCM y anillos oscuros pudieran beneficiarse de tratamientos como la terapia fotodinámica y las inyecciones de antiangiogénicos intravítreos.27
En el diagnóstico de la NVCM, la OCT es una herramienta útil, permite determinar la localización y forma de la neovascularización, así como los signos de actividad y su seguimiento en el tiempo. También ha sido posible documentar otros cambios en la mácula de estos ojos, de difícil diagnóstico clínico. En este aspecto es necesario comentar sobre la esquisis foveal, que se presenta con elevada frecuencia en la MD y altera la función visual. Se presenta tanto en capas internas de la retina como en las externas, incluso con ambos patrones en un mismo ojo. Se han reportado casos con agujeros maculares lamelares o totales, asociados a la formación de espacios quísticos en la retina, que causan deterioro visual y pueden acompañarse de otros cambios maculares.29,30 La ya mencionada línea hiperreflectiva IS/OS, que traduce daño de los fotorreceptores, muestra defectos en la zonas de foveosquisis.31 Estas alteraciones se atribuyen a varios mecanismos que actúan y favorecen su formación, que incluyen las fuerzas traccionales de la hialoides posterior y las características intrínsecas de los tejidos de ojos miopes altos que llevan a su estiramiento.32
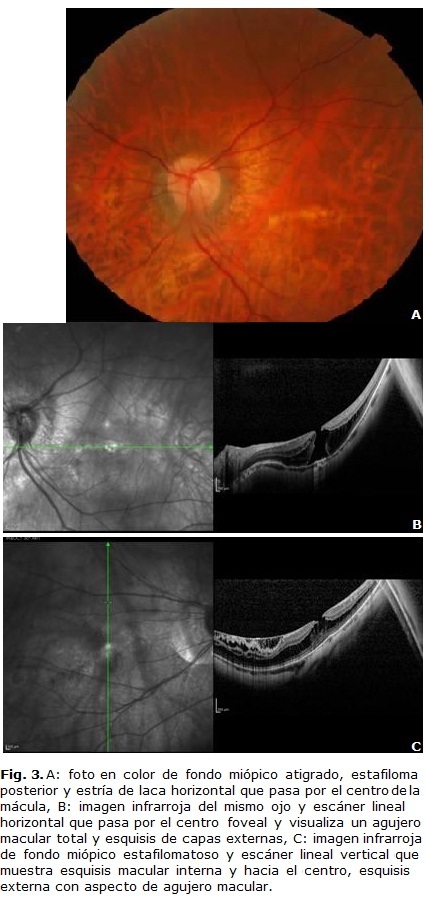
En algunas series estudiadas los AM lamelares parecen permanecer bastante estables en el tiempo, con poca progresión a AM totales.33 Estos últimos frecuentemente requieren tratamiento quirúrgico mediante vitrectomía pars plana con pelado de la membrana limitante interna, dejando gas en la cavidad vítrea. Sun y otros estudiaron la evolución natural de un pequeño grupo de miopes con esquisis macular que desarrollaron AM total (Fig. 3). Se identificaron dos patrones. En el primero aparece un área de esquisis focal de las capas retinianas externas que se elevó, seguido del desarrollo de AM lamelar externo con desprendimiento de retina, luego se fue alargando horizontalmente y elevando verticalmente hasta que el AM lamelar externo se unió a la retina suprayacente. Cuando la raíz del desprendimiento de retina se abrió, se formó el AM de grosor total. En el segundo grupo, la apertura de la raíz de la esquisis macular o sus espacios quísticos causaron un AM lamelar interno. Paulatinamente se fue resolviendo la esquisis macular excepto bajo el AM lamelar. En esa zona las capas retinianas continuaron dividiéndose posteriormente hasta alcanzar el EPR y dar lugar al AM total.34
La fuerte adhesión vitreorretiniana se asocia, tanto a maculopatía traccional como a severas complicaciones que de ella se derivan, el desprendimiento de retina regmatógeno con agujero macular es una de gran relevancia porque produce pérdida visual. En los ojos contralaterales de estos casos, también con alta miopía, se han encontrado hallazgos peculiares en la interfase vitreorretiniana: esquisis vítrea posterior, membranas epirretinianas maculares, estafiloma posterior severo y atrofia coriorretiniana. Los ojos con desprendimiento de vítreo posterior tienen menor grado de complicaciones retinianas que afecten la función visual que aquellos con esquisis vítrea sin desprendimiento de vítreo posterior.35
En otros casos se ha encontrado una elevada incidencia de AM (14 %) en ojos altos miopes, en el estadio atrófico de una neovascularización coroidea miópica. Se conoce que en la zona de atrofia hay pérdida del EPR y de tejido de las capas retinianas externas. Se ha sugerido que en esa área existe fuerte adhesión entre la retina neural y la neovascularización coroidea miópica. Debido a eso la regresión de la membrana y el agrandamiento de la atrofia pueden causar estiramiento centrífugo y tangencial de una retina extremadamente atrófica, dando lugar a un agujero macular que secundariamente puede causar un desprendimiento de retina.36
Se reportan ojos con mácula en forma de domo dentro de un estafiloma posterior. Se caracteriza por un abombamiento de la retina macular, el EPR y la coroides, en la concavidad de un estafiloma posterior moderado (tipo I o II según la clasificación de Curtin), comprobados en la ecografía en modo B y la tomografía de coherencia óptica. Esta alteración puede ser unilateral o bilateral y frecuentemente causa disminución de la agudeza visual acompañada de metamorfopsia. Se ha observado concomitancia con un estrecho desprendimiento de retina y zonas de atrofia que explican la afectación visual. Aunque no se conoce la causa de estos hallazgos, se piensa que pueden deberse a la resistencia de la esclera ante la deformación estafilomatosa o a un engrosamiento coroideo localizado.37
Lo cierto es que los modernos medios de diagnóstico permiten detectar con precisión cada vez mayor, las alteraciones anatomofuncionales de los pacientes con entidades tan frecuentes como la miopía degenerativa. De estas surgen las teorías que hasta hoy, tratan de explicar su patogenia.
CONCLUSIONES
La miopía degenerativa es una enfermedad que si bien afecta a varias estructuras del globo ocular, tiene signos distintivos en el polo posterior.
El estafiloma posterior miópico constituye una de las principales alteraciones y se presenta con gran frecuencia. Está relacionado con la atrofia coriorretiniana en parches o difusa y las estrías de laca. El estafiloma puede variar en su forma e incrementar la profundidad en relación con la edad del paciente, el defecto refractivo y la longitud axial.
Las hemorragias maculares simples o secundarias a neovascularizaciones coroideas miópicas también son signos de diferentes etapas del mismo proceso degenerativo. Las primeras aunque afectan la función visual, evolucionan hacia la resolución espontánea generalmente. Las neovascularizaciones coroideas miópicas disminuyen la agudeza visual y pueden llevar a un daño permanente por la cicatriz fibrótica y la atrofia del tejido macular.
Otras alteraciones que deben considerarse por la disminución visual significativa que producen son la foveosquisis, el agujero macular miópico que puede causar desprendimiento de retina regmatógeno y la más recientemente descrita mácula en domo.
REFERENCIAS BIBLIOGRÁFICAS
1. Soubrane G, Coscas GJ. Choroidal Neovascular Membrane in Degenerative Myopia. En: Ryan SJ, Schachat AP, eds. Retina. 4ta. ed. Philadelphia: Elsevier-Mosby; 2006. p. 1115-31.
2. Sperduto RD, Seigel D, Roberts J, Rowland M. Prevalence of myopia in the United States. Arch Ophthalmol. 1983;101(3):405-7.
3. Xu L, Wang Y, Li Y. Causes of blindness and visual impairment in urban and rural areas in Beijng. The Beijing Eye Study. Ophthalmology. 2006;113(7):1134-41.
4. National Society for the prevention of Blindness: NSPB Fact Book. Estimated Statistics of Blindness and Vision Problems. New York: NSPB; 1966.
5. Gómez-Ulla F, Grallón R, Corcóstegui B. Miopía degenerativa. En: Gómez-Ulla F, Corcóstegui B, eds. Angiografía Fluoresceínica y Láser. Madrid: Servicio de publicaciones e intercambio científico; 1988. p. 213-8.
6. Ikuno Y. Choroidal Neovascularization Due to Pathologic Myopia. Retina Today. 2010;5(6):28-30.
7. Curtin BJ. Basic science and clinical management En: Curtin BJ, ed. The Myopias. Philadelphia: Harper & Row; 1985. p. 237-45.
8. Blach RK. Degenerative myopia. En: Krill AE, Archer D, eds. Hereditary retinal and choroidal diseases. Hagerstown: Harper & Row; 1977. p. 911-37.
9. Shimada N, Ohno-Matsui K, Nishimuta A, Tokoro T, Mochizuki M. Peripapillary changes detected by optical coherence tomography in eyes with high myopia. Ophthalmology. 2007;114(11):2070-6.
10. McBrien NA, Norton TT. Prevention of collagen crosslinking increases form deprivation myopia in tree shrew. Exp Eye Res. 1994;59(4):475-86.
11. Vongphanit J, Mitchell P, Wang JJ. Prevalence and progression of myopic retinopathy in an older population. Ophthalmology. 2002;109(4):704-11.
12. Shimada N, Ohno-Matsui K, Nishimuta A. Detection of paravascular lamellar holes and other paravascular abnormalities by optical coherence tomography in eyes with high myopia. Ophthalmology. 2008;115(4):708-17.
13. Curtin BJ. The posterior staphyloma of pathologic myopia. Trans Am Ophthal Soc. 1977;75:67-86.
14. Steidl SM, Pruett RC. Macular complications associated with posterior staphyloma. Am J Ophthalmol. 1997;123(2):181-7.
15. Macarro A, Fernandez Perianes J, Fernandez-Vigo J. Evaluación ecográfica de los estafilomas posteriores. Studium Oftalmológico. 1997 [citado 20 abril 2012];26(3). Disponible en: http://www.oftalmo.com/studium/studium1997/stud97-3/c-06.htm
16. Hsiang HW, Ohno-Matsui K, Shimada N, Hayashi K, Moriyama M, Yoshida T, et al. Clinical characteristics of posterior staphyloma in eyes with pathologic myopet alia. Am J Ophthalmol. 2008;146(1):102-10.
17. Ikuno Y, Tano Y. Retinal and Choroidal Biometry in Highly Myopic Eyes with Spectral-Domain Optical Coherence Tomography. Invest Ophthalmol Vis Sci. 2009;50(8):3876-80.
18. Avila MP, Weiter JJ, Jalkh AE, Trempe CL, Pruett RC, Schepens CL. Natural history of choroidal neovascularization in degenerative myopia. Ophthalmology. 1984;91(12):1573-81.
19. Hayashi K, Ohno-Matsui K, Shimada N, Moriyama M, Kojima A, Hayashi W, et al. Long-term pattern of progression of myopic maculopathy: a natural history study. Ophthalmology. 2010;117(8):1595-611.
20. Tokoro T. Types of fundus changes in the posterior pole. En: Tokoro T, ed. Atlas of Posterior Fundus Changes in Pathologic Myopia. Tokyo: Springer-Verlag; 1998. p. 5-22.
21. Chen L, Wang K, Esmaili DD, Xu G. Rhegmatogenous Retinal Detachment Due to Paravascular Linear Retinal Breaks Over Patchy Chorioretinal Atrophy in Pathologic Myopia. Arch Ophthalmol. 2010;128(12):1551-4.
22. Forster R. Ophthalmologiscche Beitrage. Berlin: Enslin; 1862. p. 55.
23. Fuchs E. Der centrale schwarze fleck bei myopie. Z Augenheilkd. 1901;5:171-8.
24. Moriyama M, Ohno-Matsui K, Shimada N, Hayashi K, Kojima A, Yoshida T, et al. Correlation between visual prognosis and fundus autofluorescence and optical coherence tomographic findings in highly myopic eyes with submacular hemorrhage and without choroidal neovascularization. Retina. 2011;31(1):74-80.
25. Spaide RF, Curcio CA. Anatomical correlates to the bands seen in the outer retina by optical coherence tomography. Retina. 2011;31(8):1609-19.
26. Cohen SY, Laroche A. Etiology of choroidal neovascularization in young patients. Ophthalmology. 1996;103(8):1241-4.
27. Kim YM, Yoon JU, Koh HJ. The analysis of lacquer crack in the assessment of myopic choroidal neovascularization. Eye. 2011;25(7):937-46.
28. Fukushima I, Takahashi K, Nishimura T, Ohkuma H, Uyama M. Dark rim around choroidal neovascularization in indocyanine green angiography. Nippon Ganka Gakkai Zasshi. 1995;99(11):1262-70.
29. Robichaud JL, Besada E, Basler L, Frauens BJ. Spectral domain optical coherence tomography of myopic traction maculopathy. Optometry. 2011;82(10):607-13.
30. Jiang C, Wang W, Xu G, Wang L. Retinoschisis at macular area in highly myopic eye by optic coherence tomography. Yan Ke Xue Bao. 2006;22(3):190-4.
31. Sayanagi K, Ikuno Y, Soga K, Tano Y. Photoreceptor inner and outer segment defects in myopic foveoschisis. Am J Ophthalmol. 2008;145(5):902-8.
32. Smiddy WE, Kim SS, Lujan BJ, Gregori G. Myopic traction maculopathy: spectral domain optical coherence tomographic imaging and a hypothesized mechanism. Ophthalmic Surg Lasers Imaging. 2009;40(2):169-73.
33. Tanaka Y, Shimada N, Moriyama M, Hayashi K, Yoshida T, Tokoro T, et al. Natural history of lamellar macular holes in highly myopic eyes. Am J Ophthalmol. 2011;152(1):96-9.
34. Sun CB, Liu Z, Xue AQ, Yao K. Natural evolution from macular retinoschisis to full-thickness macular hole in highly myopic eyes. Eye. 2010;24(12):1787-91.
35. Ripandelli G, Coppe AM, Parisi V, Stirpe M. Fellow eye findings of highly myopic subjects operated for retinal detachment associated with a macular hole. Ophthalmology. 2008;115(9):1489-93.
36. Shimada N, Ohno-Matsui K, Yoshida T, Futagami S, Tokoro T, Mochizuki M. Development of macular hole and macular retinoschisis in eyes with myopic choroidal neovascularization. Am J Ophthalmol. 2008;145(1):155-61.
37. Gaucher D, Erginay A, Lecleire-Collet A, Haouchine B, Puech M, Cohen SY, et al. Dome-shaped macula in eyes with myopic posterior staphyloma. Am J Ophthalmol. 2008;145(5):909-14.
Recibido: 20 de mayo de 2012.
Aprobado: 21 de junio de 2012.
Dra. Suzel Ivón Lapido Polanco. Instituto Cubano de Oftalmología "Ramón Pando Ferrer". Ave. 76 No. 3104 entre 31 y 41, Marianao. La Habana, Cuba. Correo electrónico: suzellp@infomed.sld.cu