Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Oftalmología
versión impresa ISSN 0864-2176
Rev Cubana Oftalmol vol.26 no.1 Ciudad de la Habana ene.-abr. 2013
PRESENTACIÓN DE CASO
Endoftalmitis endógena secundaria a un absceso renal
Endogenous endophthalmitis secondary to a renal abcess
Dr. Yosvani García Real, Dra. Zenia Rosabal Rondón, Dra. Beatriz Zozaya Aldana, Dra. Antonieta Castilla Selva, Dra. María Isabel Rodríguez González, Dra. Isabel Medina Rodríguez
Hospital Universitario «Miguel Enríquez». La Habana, Cuba.
RESUMEN
La endoftalmitis endógena puede ocurrir en aquellos casos de inflamación de los tejidos oculares internos secundaria a infección intraocular, resultado de la diseminación hematógena de los microorganismos desde un foco distal al ojo. Es el grupo menos frecuente de todas las endoftalmitis (5 %), es preferentemente unilateral, y en la mayoría de los pacientes se aprecia al menos un foco extraocular infeccioso. Aunque puede darse en pacientes sanos inmunocompetentes, esta enfoftalmitis afecta fundamentalmente a pacientes con uno o más factores de riesgo, entre ellos, enfermedades crónicas, procedimientos quirúrgicos, neoplasias, usuarios de drogas administradas por vía parenteral, inmunodeficiencias, catéteres intravenosos. Se presenta un caso de una paciente diabética con una endoftalmitis endógena secundaria a un tumor renal, cuyo cuadro inicial apuntaba hacia un coma diabético y en la medida que evolucionó y a través del estudio oftalmológico se logró un completo diagnóstico y tratamiento de su problema de salud.
Palabras clave: endoftalmitis endógena, absceso renal, uveítis.
ABSTRACT
The endogenous endophthalmitis may occur in cases of internal tissue inflammation secondary to intraocular infection, as a result of the hematogenous dissemination of microorganisms from a distal focus to the eye. It is the less frequent group of all types of endophthalmitis (5 %), preferably unilateral, and most of the cases present with an extraocular infectious focus. Although it may appear in healthy immuno competent patients, this endophthalmitis mainly affects patients with one or more risk factors such as chronic illnesses, surgical procedures, neoplasias, parenterally administered drug users, immunodeficiencies and intravenous catheters. A case of a diabetic female patient with endogenous endophthalmitis secondary to a renal tumor was presented. Her initial clinical picture pointed to diabetic coma, but as the disease evolved and based on the ophthalmological study, it was possible to reach a complete diagnosis and to apply a treatment for her health problem.
Keywords: endogenous endophthalmitis, renal abscess, uveitis.
INTRODUCCIÓN
El término endoftalmitis hace referencia a una reacción inflamatoria intraocular severa que afecta a las estructuras anterior y posterior del ojo, aunque en ocasiones también pueden verse afectadas las estructuras adyacentes como la retina o la coroides. El término se suele reservar para los procesos inflamatorios infecciosos, una rara pero potencialmente devastadora inflamación provocada por agentes exógenos o endógenos.
Básicamente podemos decir que existen dos grandes grupos de endoftalmitis según su origen, las formas exógenas, causadas por la siembra de agentes infecciosos a través de una penetración desde el exterior hacia el ojo; y las formas endógenas, originadas a partir de un nicho primario de microorganismos situados en otro lugar del cuerpo y que se diseminan hasta el ojo.1
Las endoftalmitis endógenas (EE) están causadas básicamente por hongos y bacterias, las endoftalmitis fúngicas endógenas (EFE) son las EE más frecuentes y son debidas sobre todo a Candida albicans (85 %) y Aspergillus fumigatus.2 Ambos gérmenes tienen diferencias en cuanto a los factores predisponentes y las formas de presentación clínica en el segmento posterior, lo que puede ayudar en el diagnóstico y tratamiento.3,4
Las EE son una infección intraocular rara, cuya incidencia ha ido en aumento en la última década, secundaria a una septicemia asociada a valvulopatías cardiacas, osteomielitis, pielonefritis, catéteres intravenosos, entre otros. En las endoftalmitis bacterianas endógenas (EBE), los estreptococos, estafilococos (aureus) y los bacillus son los grampositivos más frecuentes; entre los gramnegativos están meningococos, hemophilus, coli y klebsiella.
Muchos de los pacientes tienen procesos sistémicos predisponentes asociados (diabetes mellitus, cáncer, inmunodepresión) o son adictos a las drogas intravenosas. En los pacientes drogadictos son más frecuentes los hongos, en particular, las especies Candida y B. cereus.5
El origen de la infección en este caso es a partir del propio organismo. La infección sucede cuando los microorganismos que se encuentran en el sistema sanguíneo atraviesan la barrera hemato-ocular e infectan los tejidos intraoculares. Es una forma relativamente rara, representa aproximadamente el 5 % de todas las endoftalmitis. Su forma de presentación dificulta el diagnóstico; los errores de diagnóstico inicial se evalúan entre 16 % y 63 %, en la mayoría de los casos se confunde con uveítis.1,5,6
PRESENTACIÓN DEL CASO
Se trata de una paciente mestiza de 73 años de edad, con antecedentes de diabetes mellitus tipo II que ingresó en el servicio de cuidados intensivos del Hospital Clinicoquirúrgico Docente "Miguel Enríquez" de La Habana, por presentar fiebre de 38°, astenia, anorexia, pérdida de peso, disociación, e insomnio.
Al examen físico general se encontraron los siguientes datos. Las mucosas estaban húmedas pero con un ligero tinte ictérico. Presentaba taquicardia supraventicular. Los puntos pielorrenoureterales fueron ligeramente dolorosos a la palpación. El panículo adiposo estaba disminuido.
Algunos resultados de los exámenes de laboratorio realizados son:
_ Hemoglobina: 10,5 g/dL.
_ Conteo de plaquetas: 82 000 plaquetas/µL.
_ Leucocitos: 5 020 leucocitos/µL, con 82 % de neutrófilos.
_ Glucemia: 602 mg/dL.
_ Velocidad de sedimentación glomerular: 133 mm en la primera hora.
_ Proteína C reactiva: 165 U/L.
_ Parcial de orina: 30-40 leucocitos/campo.
El diagnóstico clínico inicial fue el de coma diabético en evolución. Por esto se decide ingreso en la sala de cuidados intensivos de medicina, tratamiento insulínico según el perfil glicémico y estabilización de los valores hemodinámicos.
Al día siguiente, la paciente refiere pérdida de la visión en el ojo izquierdo, con ligero dolor y se solicita interconsulta con oftalmología. Al examen oftalmológico presentó una agudeza visual corregida con sus cristales de 0,7 ojo derecho (OD) y 0,2 ojo izquierdo (OI). En el OI tenía ligero edema y enrojecimiento palpebral, inyección cilioconjuntival moderada y celularidad en cámara anterior de dos cruces, tensión ocular de 11 mmHg, opacidad del cristalino que impidió el examen de fondo de ojo. En el OD tenía esclerosis del cristalino y el resto del examen fue normal. El diagnóstico presuntivo inicial fue de uveítis anterior aguda en OI. El tratamiento indicado para este ojo fue atropina 1 % (1 gota cada 8 h), prednisolona 0,5 % (1 gota cada 4 h) y ciprofloxacina 0,3 % (1 gota cada 4 h). Esta terapia exclusivamente tópica y no agresiva se decidió por el estado general de la paciente y sus cifras de glicemia.
Al cuarto día de ingreso la agudeza visual del OI había disminuido a percepción luminosa. En este ojo se encontró un edema palpebral marcado, quémosis conjuntival, abundante secreción amarillo verdosa, reblandecimiento de la pared ocular con determinadas zonas de aspecto abscedado en la esclera e inyección cilioconjuntival severa. En el segmento anterior, el hipopion ocupaba toda la cámara anterior e impedía la visualización del resto de las estructuras (Fig. 1).
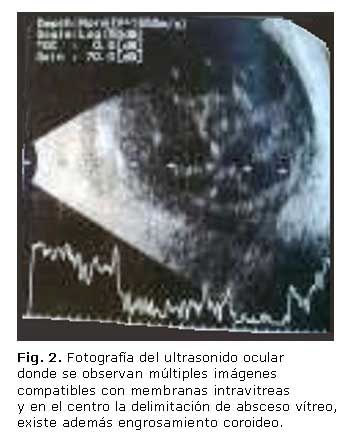
Se realizó ultrasonido ocular modo B para valorar el estado del segmento posterior del ojo. Se observaron múltiples imágenes compatibles con membranas inflamatorias intravítreas, absceso vítreo y engrosamiento coroideo (Fig. 2).
Se realizó toma de muestra de secreciones oculares, humor acuoso, humor vítreo y sangre para cultivo y antibiograma. El cultivo de humor vítreo resultó positivo para Klebsiella sp. Se interpreta como una endoftalmitis endógena y se decide tratamiento: colirios fortificados de vancomicina y ceftazidima (1 gota cada 1 h), vancomicina 500 mg (1 bulbo endovenoso cada 12 h) y ceftazidima (1 g endovenoso cada 12 h); se mantuvo la atropina 1 % (1 gota cada 8 h).
Se solicitó una consulta conjunta entre Medicina Interna, Urología y Oftalmología, porque el cuadro de la paciente apuntaba hacia algún proceso infeccioso que estaba provocando la descompensación sistémica y la toma ocular. Se realizaron estudios ultrasonográficos renales y se detectó un absceso en riñón derecho e imagen compatible con tumor intraparenquimatoso. Se completó el tratamiento por 21 días con una notable mejoría sistémica y ocular. El examen oftalmológico del OI mostró una córnea transparente, CA formada, no celularidad, opacidad parcial del cristalino y pigmentos iridianos en la cápsula anterior. En el fondo de ojo se observó retina aplicada, vítreo normal y transparente, papila y vasos normales. La agudeza visual corregida era de 0,5.
Al mes y medio se realizó nefrectomía derecha y el diagnóstico anatomopatológico confirmó una neoplasia renal, se decidió comenzar terapia citostática.
COMENTARIOS
Los pacientes con EE presentan sintomatología ocular (disminución de agudeza visual, miodesopsias, ojo rojo, dolor ocular), pero la mayoría se asocia con sintomatología sistémica derivada de la afectación extraocular (fiebre, malestar general, tos, artralgias, dolor abdominal, alteración del nivel de consciencia entre otros).6,7
La exploración ocular de segmento anterior es similar a la de los pacientes con endoftalmitis posquirúrgica aguda o endoftalmitis traumática, con la diferencia de que no tienen antecedente quirúrgico o traumático previos. En segmento posterior, destaca la vitritis en grado variable y, en aquellos casos en los que pueda visualizarse el fondo de ojo, observaremos focos de corrioretinitis, hemorragias retinianas, abscesos subretinianos, obstrucciones vasculares, entre otros. En los casos más severos puede ocurrir una diseminación orbitaria con restricción de la motilidad ocular y proptosis.
Existe una amplia variabilidad entre los agentes causales predominantes dependiendo del área geográfica. Wong y otros,8 realizan una revisión de los casos publicados desde 1986 a 1998 y analizan por separado los casos publicados en el Este de Asia, encuentran que los gérmenes gramnegativos son los más frecuentes, entre ellos, la Klebsiella sp, dato que se repite en una serie propia sobre 27 pacientes. En Occidente, los gérmenes grampositivos son los más frecuentes, lo que se confirma en otras series publicadas, como la de Okada y otros9 realizada en EE. UU. donde en 28 pacientes, los gérmenes gramnegativos solo fueron el 32 %, o la de Jackson y otros,5 en Europa, donde en 19 pacientes el 37 % eran gramnegativos.
La Escherichia coli es el segundo germen gramnegativo más implicado en EBE y se relaciona frecuentemente con un foco urinario.10 La Pseudomona spp. emerge entre los pacientes más graves.11 Los principales focos extraoculares pueden estar en el tracto urinario o deberse a endocarditis, meningitis, neumonía, infección de piel y partes blandas, y a los catéteres intravenosos. El absceso hepático se encuentra como foco primario de EBE en el continente asiático. Binder y otros4 en una serie de 27 pacientes, no encuentra un foco extraocular hasta en el 44 % de los casos, por lo que defiende que una bacteriemia transitoria puede ser causa de endoftalmitis. Sin embargo, solo 33,3 % tienen hemocultivos positivos y la mayoría (70,5 %) se diagnosticó a través de cultivos de muestras de humor vítreo o acuoso. Esto contrasta con otras series en las que los hemocultivos ayudan al diagnóstico en un mayor porcentaje de casos (60-90 %), mientras que el rendimiento de las muestras intraoculares más bajo (56 %).5,8,9
Como consecuencia de la baja frecuencia de esta afección, la inespecificidad de los hallazgos que inicialmente puede observarse en la exploración y la falta de relación con sintomatología sistémica (tanto por parte del paciente como del oftalmólogo), hacen que el índice de diagnósticos iniciales erróneos sea muy elevado.1,6,7,12 Esto conlleva importantes retrasos en el inicio del tratamiento y finalmente malos pronósticos visuales. Para la realización del diagnóstico de EE se requiere, por tanto, un alto grado de sospecha, los datos de la exploración ocular, la sintomatología extraocular con presencia de focos infecciosos extraoculares y el aislamiento del germen en muestras oculares (humor acuoso, vítreo, biopsia retiniana),13 extraoculares o sangre.2 El análisis de las muestras se puede realizar por técnicas convencionales, como microscopia y cultivo, o bien por reacción en cadena de la polimerasa (PCR), de utilidad sobre todo en casos de cultivos negativos y gérmenes inusuales.14,15
El pronóstico visual de los pacientes con EE depende de factores como la virulencia del germen, localización de las lesiones, agudeza visual, estado del globo ocular en el momento del diagnóstico, tiempo transcurrido desde el comienzo de los síntomas hasta la instauración del tratamiento correcto y la presencia de complicaciones posteriores.3-6,12,16 No hay que olvidar, por otro lado, el pronóstico vital de estos pacientes, ya que nos encontramos ante personas con una o más enfermedades de base, sometidos a tratamientos quirúrgicos o farmacológicos y que pueden tener uno o más focos infecciosos extraoculares. La mortalidad de los pacientes con EE también varía en función del germen causal.1,6,13
El tratamiento de las EE se realiza con tratamiento antibiótico sistémico y se puede asociar antibióticos intravítreos o vitrectomía pars plana (VPP). La VPP, además de utilizarse en la fase aguda del proceso, puede utilizarse también para posteriores complicaciones.2,6,7,13-15,17-20
Es fundamental el tratamiento con antimicrobianos intravenosos ya que estamos ante una infección endovascular diseminada y resulta más discutible el tratamiento antibiótico intravítreo y la vitrectomía posterior. En cuanto a la elección de antibióticos parece que vancomicina es de elección para cubrir grampositivos y ha de asociarse con amikacina o ceftazidima para los gramnegativos.5,21 Comparando los gérmenes causales, los ojos con infección por gramnegativos tienen menos posibilidades de visión útil (contar dedos o mejor) que por grampositivos, aunque ambos grupos tienen la misma tasa de enucleación o evisceración. En cuanto a los ojos que reciben antibióticos intravítreos, mantienen la misma visión útil que los que no tratados, pero el análisis univariable muestra que tienen menos posibilidades de enucleación o evisceración.5 Parece que los ojos tratados con esteroides intravítreos tienen cuatro veces más posibilidades de mantener una visión útil que los no tratados, pero se recomienda precaución en su uso. En cuanto a la realización de vitrectomía posterior, parece que puede triplicar la posibilidad de mantener una visión útil y reducir por tres la probabilidad de enucleación o evisceración.5
Dada la escasa incidencia de EBE, es difícil realizar ensayos clínicos aleatorizados que incluyan un número amplio de pacientes. Por ello es importante prestar atención a los distintos casos clínicos bien documentados que nos ayuden a entender mejor la clínica, administración terapéutica y pronóstico en estos pacientes. La mayoría de los estudios importantes en relación con la EBE confirman que es una enfermedad grave, a menudo diagnosticada tardíamente y con un pronóstico visual pobre que conduce a la ceguera en muchos pacientes. 5,6,8,9,13,21-26
La mayoría de los afectados tienen una enfermedad subyacente que les predispone a la infección, fundamentalmente diabetes, inmunodepresión, drogadicción, enfermedades autoinmunes, enfermedades cardiovasculares o neoplasias.5,6,8,9
La EE se ha de considerar una infección metastásica que ocurre cuando las bacterias alcanzan el ojo vía hematógena, cruzando la barrera hematorretiniana. Las manchas de Roth son émbolos sépticos y suceden en el 1 % de todos los pacientes con bacteriemia,27 aunque no todos los pacientes con estas manchas evolucionarán a una EE. Los hemocultivos son claves para el diagnóstico pero también se han de cultivar todos los focos posibles de infección incluyendo catéteres y heridas supurantes. No es infrecuente que los cultivos oculares sean negativos.
El pronóstico visual de la EBE no ha mejorado en los últimos 55 años. Los factores de peor pronóstico son el retraso en el diagnóstico, uso incorrecto de antibióticos, panoftalmía, microorganismos muy virulentos, infección por gramnegativos y mala agudeza visual en el momento del diagnóstico. 5,8,13,26
Además hay una mortalidad asociada apreciable de 5 %. Una revisión de la literatura desde 1976 a 1985 muestra que el 41 % de los pacientes tienen una visión de cuenta dedos o mejor, el 26 % quedó ciegos y el 29 % precisó enucleación o evisceración.26
En cuanto a la revisión de lo publicado desde 1986, se observa que el pronóstico sigue siendo sombrío con porcentajes de 32 % de visión útil, 44 % de ceguera y 25 % de enucleaciones o evisceraciones.5
Ante una endoftalmitis tener siempre presente la posibilidad de algún foco séptico extraocular. Hay varias razones para intentar explicar por qué el pronóstico visual de la EBE no ha mejorado en el último medio siglo. Primero, es una enfermedad infrecuente que puede enmascararse con otras afecciones oculares, lo que explicaría que muchos pacientes sean mal diagnosticados inicialmente con una progresión rápida de la enfermedad y un retraso en el tratamiento que condicionaría una peor evolución visual. En segundo lugar, muchos médicos internistas pueden desestimar la relación íntima entre la enfermedad sistémica y la ocular, lo que retrasa el diagnóstico. Actualmente se realizan estudios para determinar el beneficio del empleo de los antibióticos intravítreos, los esteroides intravítreos o la vitrectomía.
REFERENCIAS BIBLIOGRÁFICAS
1. Ciprés MC, Folch J, Romero Rubiols B. Generalidades de las endoftalmitis. Annals d'Oftalmologia. 2008;16(5):264-74.
2. Yang CS, Tsai HY, Sung CS, Lin KH, Lee FL, Hsu WM. Endogenous Klebsiella endophthalmitis associated with pyogenic liver abscess. Ophthalmology. 2007;114(5):876-80.
3. Essman TF, Flynn HW Jr, Smiddy WE, Brod RD, Murray TG, Davis JL, et al. Treatment outcomes in a 10-year study of endogenous fungal endophthalmitis. Ophthalmic Surg Lasers. 1997;28(3):185-94.
4. Binder MI, Chua J, Kaiser PK, Procop GW, Isada CM. Endogenous endophthalmitis: a 18-year review of culture-positive cases at a tertiary care center. Medicine (Baltimore). 2003;82(2):97-105.
5. Jackson TL, Eykyn SJ, Graham EM, Stanford MR. Endogenous bacterial endophthalmitis: a 17 year prospective series and review of 267 reported cases. Surv Ophthalmol. 2003;48(4):403-23.
6. Leibovitch I, Lai T, Raymond G, Zadeh R, Nathan F, Selva D. Endogenous endophthalmitis: a 13 year review at a tertiary hospital in South Australia. Scand J Infect Dis. 2005;37(3):184-9.
7. Ness T, Pelz K, Hansen LL. Endogenous endophthalmitis: microorganisms, disposition and prognosis. Acta Ophthalmol Scand. 2007;85(8):852-6.
8. Wong JS, Chan TK, Lee HM, Chee SP. Endogenous bacterial endophthalmitis: An East Asian experience and reappraisal of a severe ocular affliction. Ophthalmology. 2000;107(8):1483-91.
9. Okada AA, Johnson RP, Liles WC, D'Amico DJ, Baker AS. Endogenous bacterial endophthalmitis. Report of a ten-year retrospective study. Ophthalmology. 1994;101(5):832-8.
10. Rahav G, Levinger S, Fruncht-Pery J. Escherichia coli endophthalmitis secondary to pyelonephritis: another complication of diabetes?. Clin Infect Dis. 1994;18(1):117-8.
11. Reedy JS, Wood KE. Endogenous pseudomonas aeruginosa endophthalmitis: a case report and literature review. Intens Care Med. 2000;26:1386-9.
12. Rao NA, Hidayat AA. A comparative clinicopathologic study of endogenous mycotic endophthalmitis: variations in clinical and histopathologic changes in candidiasis compared to aspergillosis. Trans Am Ophthalmol Soc. 2000;98:183-93.
13. Schiedler V, Scott IU, Flynn HW Jr, Davis JL, Bens MS, Miller D. Cultureproven endogenous endophthalmitis: clinical features and visual acuity outcomes. Am J Ophthalmol. 2004;137(4):725-31.
14. Gerkowicz M, Pietras-Trzpiel M, Koziol-Montewka M, Kosior-Jarecka E, Latalska M, Paluch-Olés J. Application of polymerase chain reaction method (PCR) in diagnosis of endophthalmitis. Klin Oczna. 2006;108(7-9):319-22.
15. Ness T, Serr A. Diagnostic for endophthalmitis. Klin Monatsbi Augenheilkd. 2008;225(1):44-9.
16. Endophthalmitis Vitrectomy Study Group. Results of the Endophthalmitis Vitrectomy Study. A randomized trial of inmediate vitrectomy and intravenous antibiotics for the treatment of posoperative bacterial endophthalmitis. Arch Ophthalmol. 1995;113(12):1479-96.
17. Khan A, Okhravi N, Lightman S. The eye in systemic sepsis. Cliniclal Medicine. J Royal College Physicians. 2002;2(5):444-8.
18. Takebayashi H, Mizota A, Tanaka M. Relation between stage of endogenous fungal endophthalmitis and prognosis. Graefes Arch Clin Exp Ophthalmol. 2006;244(7):816-20.
19. Chen SC, Sorrell TC. Antifungal agents. Med J Aust. 2007;187(7):404-9.
20. Horcajada JP, Fernández-Sampedro M, García-Palomo D, Cañal J, Salesa R, Farinas MC. Endogenous ocular candidiasis: changes in epidemiology and factors associated with poor functional outcome. Scand J Infect Dis. 2007;39(3):225-30.
21. Benz MS, Scott IU, Flynn HW Jr, Unonius N, Miller D. Endophthalmitis isolates and antibiotic sensitivities: a 6-year review of culture-proven cases. Am J Ophthalmol. 2004;137(1): 38-42.
22. Breit SM, Hariprasad SM, Mieler WF, Shah GK, Mills MD, Grand MG. Management of endogenous fungal endophthalmitis with voriconazole and caspofungin. Am J Ophthalmol. 2005;139(1):135-40.
23. Khan FA, Slain D, Khakoo RA. Candida endophthalmitis: focus on current and future antifungal treatment options. Pharmacotherapy. 2007;27(12):1711-21.
24. Osthoff M, Hilge R, Schulze-Döbold C, Bogner JR. Endogenous endophthalmitis with azole- resistant Candida albicansCase report and review of the literature. Infection. 2006;34(5):285-8.
25. Hariprasad SM, Mieler WF, Holz ER, Gao H, Kim JE, Chi J, et al. Determination of vitreous, aqueous, and plasma concentration of orally administered voriconazol in humans. Arch Ophthalmol. 2004;122(1):42-7.
26. Mensa J, Gatell JM, Azanza JR. Guía de terapéutica antimicrobiana. 17ma ed. Barcelona: Elsevier Masson; 2007.
27. Greenwald MJ, Wohl LG, Sell CH. Metastatic bacterial endophthalmitis: a contemporary reappraisal. Surv Ophthalmol. 1986;31(2):81-101.
28. Bouza E, Cobo-Soriano R, Rodriguez-Creixems M, Muñoz P, Suárez-Leoz M, Cortés C. A prospective search for ocular lesions in hospitalized patients with significant bacteremia. Clin Infect Dis. 2000;30(2):306-312.
Recibido: 1 de marzo de 2012.
Aprobado: 14 de junio de 2012.
Yosvani García Real. Hospital Universitario "Miguel Enríquez". Ramón Pinto No. 202, 10 de octubre. La Habana, Cuba.
Correo electrónico: yosvanigr@infomed.sld.cu