My SciELO
Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista Cubana de Oftalmología
Print version ISSN 0864-2176
Rev Cubana Oftalmol vol.26 no.3 Ciudad de la Habana Sept.-Dec. 2013
ARTICULO ORIGINAL
Intravítrea de acetato de triamcinolona en el edema macular secundario a oclusión venosa de rama retiniana
Intravitreal injection of triamcinolone acetonide for treament of macular edema secondary to branch retinal vein occlusion
Dr. Silvio Llanes Domínguez,I Dra. Caridad Chiang Rodríguez,II Dr. Raúl Rúa Martínez,II Dra. Yusimik Toledo González,II Dra. Maritza Pérez PérezII
I Hospital Clínico Quirúrgico "General Calixto García". La Habana, Cuba.
II Instituto Cubano de Oftalmología "Ramón Pando Ferrer". La Habana, Cuba.
RESUMEN
Objetivos: evaluar los resultados del tratamiento de intravítrea de acetato de triamcinolona, en el edema macular secundario a oclusión de rama venosa retiniana.
Métodos: estudio prospectivo, intervencional, no comparativo, que incluyó a 16 pacientes con edema macular secundario a oclusión de rama venosa retiniana. El tratamiento consistió en inyección intravítrea de triamcinolona (hasta 3 dosis) y, de ponerse tercer retratamiento se realizó grid macular. La primera dosis se puso a los 3 meses de ocurrido el evento oclusivo y se les dio seguimiento por 12 meses. Se determinaron la mejor agudeza visual corregida, grosor foveal retinal y complicaciones.
Resultados: se estudiaron 11 hombres (68,75 %) y 5 mujeres (31,25 %), con promedio de 60,1 años de edad. Del total de pacientes, 8 requirieron 1 dosis (50 %), 5 necesitaron de 2 dosis (31,25 %) y a 3 hubo de aplicarle 3 dosis (18,75 %) más grid macular. La mejor agudeza visual con corrección inicial promedio fue de 0,29 (0,05-0,5) con una mejoría a 0,64 (0,05-1,0) a los 12 meses. El grosor foveal retinal inicial promedio fue de 551,38 (346-967) µm y disminuyó a 204,06 (112-449) µm, a los 12 meses. La complicación más frecuente fue la hipertensión ocular en 4 pacientes (25,0 %)
Conclusión: la inyección intravítrea de triamcinolona constituyó un tratamiento eficaz en el edema macular secundario a oclusión de rama venosa retiniana.
Palabras clave: oclusión de rama venosa retiniana, edema macular, triamcinolona, retina.
ABSTRACT
Objectives: to evaluate the results of the treatment with intravitreal injection of triamcinolone acetonide of a macular edema secondary to branch retinal vein occlusion.
Methods: prospective, interventional and non-comparative study of 16 patients with macular edema secondary to branch retinal vein occlusion. The treatment consisted of intravitreal injection of triamcinolone (up to three doses) and if third retreatment was necessary, then macular grid was performed. The first dose was injected three months after occlusive event and followed-up for 12 months. The best corrected visual acuity, the retinal foveal thickness and the complications were determined.
Results: eleven men (68.75%) and 5 women (31.25%) with average age of 60.1 years were studied. Of the total number of patients, 8 required one dose (50%), 5 needed two doses (31.25%) and 3 required three doses (18.75%) plus macular grid. The best initial corrected average visual acuity was 0.29 (0.05-0.5), which improved to 0.64(0.05-1.0) after 12 months. The initial average retinal foveal thickness was 551.38 (346-967) µm and decreased to 204.06 (112-449) µm after 12 months. The most frequent complication was ocular hypertension in 4 patients (25%).
Conclusion: the intravitreal injection of triamcinolone acetonide was an effective treatment of the macular edema secondary to the branch retinal vein occlusion.
Keywords: branch retinal vein occlusion, macular edema, triamcinolone, retina.
INTRODUCCION
La oclusión venosa retinal (OVR) constituye la segunda causa más frecuente de enfermedad vascular retinal, después de la retinopatía diabética, igualmente ocupa un lugar significativo como causa de pérdida visual, secundaria principalmente al edema macular desencadenado por el fenómeno vascular.1-4
Estudios poblacionales recientes han reportado un promedio de 16,4 millones de personas afectadas con OVR a nivel mundial, de ellas el 1,6 % son mayores de 40 años, con una prevalencia de oclusión venosa de rama retinal (OVRR) de 4,42 x 1000 personas (3,65-5,19) contra el 0,80 x 1000 personas (0,61-0,99) con oclusión de vena central de la retina (OVCR). Es decir, 13,9 (OVRR) y 2,5 (OVCR) millones de personas afectadas.5-9
En 1877 Leber reportó el primer caso de OVRR. Se subdivide en su forma isquémica y no isquémica; en el 95 % de los casos la oclusión ocurre en un cruce arteriovenoso y en el 66 % de las veces este cruce se ubica en el cuadrante temporal superior.10
Al analizar su patogénesis, hay que mencionar los mecanismos primarios que desencadenan este fenómeno oclusivo.6, 11-13
- Compresión de la vena en el cruce arteriovenoso reportada desde 1928 por Koyanagi):
- Arteria y vena comparten una vaina adventicia común.
- Delgada pared de la vénula comprimida entre la rígida pared arteriolar y la retina altamente celular.
- En el 80 % de los cruces arteriovenosos, la arteriola se sitúa por encima de la vénula.
- Cambios degenerativos de las paredes vasculares que desencadenan disminución intraluminal y flujo sanguíneo turbulento:
- Alteración del endotelio y la íntima vascular.
- Hipertrofia de la capa íntima media.
- Esclerosis de las arteriolas retinales.
- Alteraciones hematológicas:
- Hiperviscosidad.
- Cuadro inflamatorio:
- Alteración de la regulación del factor de crecimiento vascular endotelial (VEGF).
Pese a que su historia natural evoluciona hacia un 50-60 % de pacientes con resolución espontánea y agudeza visual de 20/40 o más, debemos tener en cuenta ese otro 40-50 % desencadenante de mal pronóstico visual, propiciado fundamentalmente por el edema macular (EM) secundario a la enfermedad oclusiva vascular, presente en un 60 % de los casos y por las hemorragias vítreas secundarias a neovascularización en un 25 %. En dependencia del sitio y grado de oclusión vascular, de la integridad de la perfusión arteriolar en el sector afectado y la eficiencia del desarrollo de circulación colateral, será mayor o menor el daño de la hipoxia retinal, con su consecuente cascada de fenómenos vasculares, que van a propiciar el desarrollo y progresión del EM vasogénico en la OVRR.11
La fotocoagulación grid macular ha sido el tratamiento standard para la resolución del EM secundario a la OVRR,4,6,8,11,14 pero debido a sus posibles efectos secundarios, después de 1990 se han evaluado los beneficios de nuevas modalidades terapéuticas con resultados alentadores en la recuperación anatómica y funcional.11,14-16
Entre estas modalidades terapéuticas se encuentran:
- Inyección intravítrea de esteroides (SCORE).17
- Implantes liberadores de agentes esteroideos activos (Ozurdex, Allergan, Inc.). Aprobado por la Food and Drugs Administration (FDA) en junio de 2009 para el tratamiento del EM secundario a la OVRR u OVCR.18,19
- Rol de los anti-VEGF (BRAVO, CRUISE, RAVE).7,20-22
Hasta el momento, continúa siendo la fotocoagulación grid macular la primera línea de tratamiento, mientras que la terapia medicamentosa con esteroides y/o antiangiogénicos (anti-VEGF) es la segunda línea, siendo aprobada por la FDA la combinación de estrategias para dicha complicación vascular como son:11,15
- Inmediata inyección de una o varias dosis de Ranibizumab seguidas de grid macular, cuando se aclaran las hemorragias.
- Inyección del implante de dexametazona seguida de grid macular.
- Combinación de inyección de anti-VEF e implante de dexametazona con/sin grid macular.
Múltiples estudios han revisado y demostrado los beneficios y efectividad del uso de la terapia medicamentosa esteroidea en la regresión del EM secundario a las OVRR, aunque por un corto período de tiempo, con necesidad de retratamientos y ciertas complicaciones oftalmológicas.23-34
Saleh y colaboradores en un estudio efectuado en 44 pacientes con EM secundario a OVR durante 6 meses, evaluaron la misma dosis de 4 mg de inyección intravítrea de triamcinolona (IV TA) subdivididos en 2 subgrupos, el primero de diagnóstico y terapéutica precoz antes de las 6 semanas y el segundo de más de 6 semanas entre el diagnóstico y el proceder terapéutico. Al evaluar fundamentalmente la ganancia visual y la disminución del grosor retinal foveal, fueron estadísticamente significativos en el grupo 1, no así en el grupo 2 (no mejoría significativa de la agudeza visual ni de la reaplicación anatómica).35
Por su parte Shukla y colaboradores en un estudio prospectivo de 16 ojos de pacientes afectos de EM secundario a OVRR, evalúan el uso de IV TA durante un período de 3 meses, concluyendo que su efecto se relaciona directamente con la altura del desprendimiento seroso, comenzando a fallar después de los 3 meses, de ahí que aumente su efectividad cuando se asocia al grid macular.36
En el 2009 se dan a conocer los resultados del SCORE-BRVO Trial, estudio clínico, multicéntrico, randomizado, intervencional, comparativo, prospectivo y open label, ejecutado desde Octubre del 2004 hasta Febrero del 2009 y que incluyó un total de 411 pacientes con EM secundario a OVRR y oclusión venosa hemiretinal, el cual compara dos dosis diferentes de TA sin preservo (1mg/4mg) con respecto al tratamiento estándar del grid macular. En un primer corte a los 12 meses no se encuentran diferencias estadísticamente significativas entre los 3 grupos, con respecto a la ganancia visual de 15 o más letras, pero se destaca la aparición de mayores complicaciones (progresión de catarata e hipertensión ocular) en el grupo de 4 mg. Se concluye que la terapia estándar con fotocoagulación grid macular continúa siendo la primera línea de elección terapéutica para el EM secundario a la OVRR, y que de ser necesaria la aplicación de IV TA, debe realizarse a dosis de 1 mg, por desencadenar menos efectos adversos. 17, 37
Otros estudios son SCOREBRVO y el SCORE-CRVO (Trivaris, Allegan Inc.) que identifican al grid macular como tratamiento de elección en el EM secundario a las OVRR y a la IV TA como tratamiento de elección en el EM a la OVCR. Además de lo anterior, otro extenso estudio control, el GENEVA, evaluó el uso de intravítreas de implantes liberadores de esteroides (Ozurdex, Allergan, Inc.), al comparar dosis de 0,35 mg, 0,7 mg y placebo. Ambos implantes activos reportaron beneficios estadísticamente significativos al compararlos con el placebo, cuando se evaluó la ganancia visual, la reducción de pérdida de más de 15 letras y la disminución del GRF.6, 8
Por la existencia de diferencias en los esquemas de tratamiento en las OVRR se decide realizar este estudio con intravítrea de acetato de triamcinolona para determinar sus resultados a los 12 meses de seguimiento.
MÉTODOS
Se realizó un estudio prospectivo, intervencional, no comparativo, que incluyó a 16 pacientes con edema macular secundario a OVRR para evaluar el tratamiento de intravítrea de acetato de triamcinolona. Se determinó la recuperación funcional, anatómica y la ocurrencia de efectos adversos y/o complicaciones Los pacientes fueron seleccionados en el cuerpo de guardia y se examinaron en la consulta especializada de Retina Vítreo del Instituto Cubano de Oftalmología «Ramón Pando Ferrer» y ofrecieron su consentimiento para participar en la investigación.
Los pacientes cumplieron los criterios de inclusión: deseo manifiesto de participar en el estudio, mayor de 18 años de edad, tiempo de 1 año o menos de iniciado los síntomas y tensión ocular inferior a 21 mmHg. Se excluyeron los que presentaban patología retiniana concomitante que comprometiese la visión del paciente, patología ocular que impidiese la visualización del fondo de ojo y como consecuencia un diagnóstico temprano de la patología en estudio, también los que presentaban antecedentes de tratamiento previo de esteroides orales menor de 4 meses, intravítrea de acetato de triamcinolona, subtenoneana de esteroides menor de 6 meses, grid macular, vitrectomía pars plana, panfotocoagulación menor de 4 meses, tratamiento con Nd yag láser menor de 2 meses y aquellos cuya condición física y/o mental imposibilitase la correcta y completa evaluación. Se les dio salida del estudio a los pacientes en los que fue imposible un seguimiento mayor de 6 meses, se le realizó panfotocoagulación en los próximos 4 meses de la primera dosis y los que no acudieron más a consulta de seguimiento o no desearon continuar.
En la consulta diagnóstica inicial se realizó: toma de la mejor agudeza visual corregida (MAVC) con cartilla de Snellen, tensión ocular (TO) con tonómetro de aplanación Goldman, biomicroscopía del segmento anterior y posterior, oftalmoscopía indirecta, retinografías y medición del grosor retinal foveal (GRF) mediante tomografía de coherencia óptica (OCT-TOPCON).
A las 12 semanas de iniciado el evento vascular se les realizó a los pacientes angiografía fluoresceínica (AGF). Esto permitió valorar las características del EM, el grado de perfusión de los capilares retinales (fundamentalmente foveales) y fijar el proceder para el EM. En esta fecha se realizó la terapia en una unidad quirúrgica, previa asepsia y antisepsia según normas de procederes terapéuticos, se administró dosis de 4mg/0,1ml de TA. En todos los casos se realizó una profilaxis antibiótica tópica los tres días previos y posteriores a la inyección intravítrea.
Al día siguiente de la inyección se realizó examen oftalmológico y toma de la TO. Se les dio seguimiento cada 4 semanas repitiéndose los exámenes de la consulta diagnóstica. De no existir recuperación en la MAVC y en el GRF o regresión de estas, pasadas 4 semanas de la terapia se administró una 2da dosis o 3ra dosis si era necesaria, esta última combinada con fotocoagulación grid macular en el plazo de una semana. Los pacientes fueron evaluados durante 12 meses.
RESULTADOS
Se estudiaron 16 ojos de 16 pacientes con diagnóstico de edema macular secundario a OVRR, 11 hombres (68,75 %) y 5 mujeres (31,25 %). La edad promedio fue de 60,1 años (rango 43 a 73 años). De éstos, 9 (56,25 %) tenían diagnósticos de hipertensión arterial; 1 (6,25 %) de Diabetes mellitus tipo II, 1 (6,25 %) de cardiopatía isquémica.
El principal período de tiempo de inicio del tratamiento, desde el comienzo de los síntomas fue de 3,3 (3-6) meses. Del total de pacientes, 8 (50,0%) requirieron una dosis única de IV TA, 5 pacientes (31,25%) 2 dosis de tratamiento y 3 pacientes (18,75%) requirieron 3 dosis de IV TA más fotocoagulación grid macular. El promedio de dosis de inyección por ojo fue de 1,6. (Tabla 1).
La MAVC inicial fue de 0,29 (0,05-0,5) con una mejoría evidente a 0,64 (0,05-1.0) a los 12 meses de seguimiento (Gráfico 1) con una ganancia igual o mayor de 4 líneas de Snellen en 9 pacientes (56,25 %), 4 pacientes (25,0 %) tuvieron una ganancia inferior a 4 líneas, mientras que 2 pacientes (12,5 %) y 1 paciente (6,25 %) perdieron líneas de visión o se mantuvieron igual respectivamente con respecto a la inicial (Tabla 1).
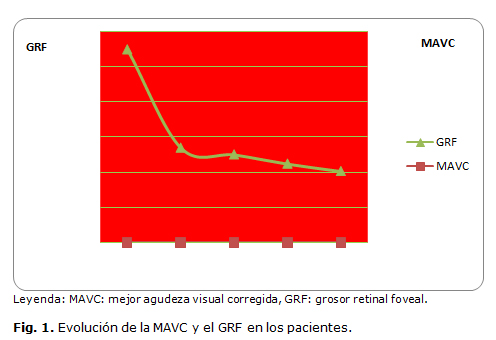
El GRF inicial fue de 551,38 µm (346-967 µm) y tuvo una reducción significativa en los 12 meses de seguimiento a 204,06 µm (112-449 µm) (Fig. 1), alcanzando el 81,25% de los pacientes, valores normales de grosor retinal foveal. Según los resultados expuestos existió una correspondencia entre la recuperación visual y anatómica en 12 de los 16 pacientes evaluados, para un 75,0% (Tabla 1).
Los pacientes que recibieron una dosis única de IV TA tuvieron una MAVC inicial de 0,29 con un GRF de 527,75 µm, alcanzando a los 12 meses una MAVC de 0,79 y un GRF de 171,13 µm. Los que requirieron 2 dosis de tratamiento lograron una MAVC de 0,57 y GRF de 193,20 µm, en este subgrupo 3 pacientes (18,75 %) ganaron líneas de visión y disminución del GRF en los 12 meses de seguimiento y 2 pacientes (12,5 %) no obtuvieron resultados satisfactorios por la aparición de complicaciones. Mientras que los pacientes que requirieron 3 dosis de IV TA más fotocoagulación grid macular no obtuvieron mejoría de la visión final y solo una disminución no significativa del GRF debido a la aparición de complicaciones propias de la enfermedad y el tratamiento (tabla 2).
En relación a la ocurrencia de efectos adversos y/o complicaciones, 4 pacientes (25,0 %) presentaron hipertensión ocular, 3 (18,75 %) membrana epirretinal, 2 pacientes (12,50 %) desarrollaron catarata y por estudios angiográficos 3 pacientes (18,75 %) evolucionaron a isquemia macular y 1 paciente (6,25 %) a edema macular crónico, imposibilitando la recuperación de la agudeza visual y del grosor foveal retinal.
DISCUSIÓN
La patogénesis de las OVR no está bien aclarada, pero se considera que la trombosis juega un papel fundamental, seguido del incremento de la presión microvascular y alteración de la permeabilidad vascular, con el consiguiente edema macular, que se agrava con un cuadro inflamatorio crónico de bajo grado, a través del aumento de la liberación de mediadores inflamatorios (prostaglandinas) y factores de la permeabilidad vascular.11,38
El uso de esteroides intraoculares (intravítreas o implantes biodegradables) altera en un 5 % la expresión de los genes retinales alrededor de 1 semana post-tratamiento, con dosis de TA de 1mg/ml o de dexametazona implante de 0,1mg/ml; pero determinados genes son los únicos que modifican sus efectos reguladores sobre la inflamación, angiogénesis, apoptosis, neuroprotección o la vía del stress oxidativo. Estas vías de expresión génica son afectadas extensamente después que los esteroides son metabolizados intraocularmente, logrando quizás un balance de la homeostasis tisular. 39,40
Estas evidencias de que los corticosteroides tienen propiedades antiangiogénicas, antiedematosas, neuroprotectoras, antinflamatorias, reguladoras del stress oxidativo y de la apoptosis, 41,42 se manifiestan a través de:
- Infra regulación de la expresión del Factor de crecimiento del endotelio vascular (VEGF).
- Inhibición de la neovascularización corneal, coroidea y pre-retiniana.
- Acción genómica: activando los receptores intracelulares de glucocorticoides al modular la transcripción de un número de genes e influyendo en la remoción y post-remoción celular a través de la síntesis proteica, al reprimir la transcripción del factor nuclear KB y por ende se suprime la producción de citoquinas inflamatorias.
- Acciones no genómicas: estabilizando la membrana basal y endotelial.
- En humanos la inyección intravítrea de acetato de triamcinolona ha demostrado reducir la rotura de la barrera hematoacuosa tras la fotocoagulación, disminuir la inflamación tras la vitrectomía e inducir la regresión de neovasos.43
Los estudios internacionales coinciden con este en demostrar la asociación de forma significativa de la hipertensión arterial y la diabetes mellitus, con la mayor presentación de OVRR. 44,45
Cekic y Cakir mostraron una reducción significativa del grosor macular (p=0,02) y mejoría de la agudeza visual (p=0,02) un mes después de la inyección intravítrea de triamcinolona.46
En una revisión retrospectiva de 13 ojos de 13 pacientes, Cekiç y colaboradores informaron que después de la administración de 4mg de IV TA, todos los ojos mostraron mejoría biomicroscopica del edema macular cistoideo. Comparado con la basal, 7 ojos tuvieron mejoría visual en un rango 26 líneas de Snellen, 4 ojos permanecieron en el rango 01 líneas de Snellen, y empeoraron 2 ojos en el rango 1-4 líneas de Snellen al final del seguimiento.47 Krepler y colaboradores evaluaron el efecto terapéutico de 4mg de IV TA en 9 pacientes con el edema macular secundario a OVRR revelando un beneficio funcional significativo, así como la mejora anatómica del edema macular.48
Cheng y colaboradores reportaron que tras la administración de IV TA, la MAVC mejoró significativamente (p<0.001) durante el período de seguimiento comparado con la media basal, 11 ojos (68.75 %) mostraron una mejora por lo menos de dos o más líneas de Snellen. También el examen de OCT demostró la mejoría clínica en el edema macular (p<0.001) postoperatoriamente. El grosor macular antes del tratamiento fue de 533,63±163,75 y el último grosor medido fue de 254,00±80,06. 33
Recientes estudios clínicos y experimentales no han mostrado evidencias de toxicidad de la retina por IV TA; el riesgo de elevación de la presión intraocular a corto plazo es la complicación más común reportada. Cheng y colaboradores reportaron 3 pacientes (18,75 %) con hipertensión ocular después del tratamiento, mientras que Chen reportó 8 ojos (32 %) que fueron controlados con agentes antiglaucomatosos tópicos. 33,49 Otros autores han descrito la presencia de efectos adversos y/o complicaciones como son el desarrollo de cataratas, edema macular recurrente y crónico, isquemia macular, membranas epirretinianas, coincidiendo con este estudio. 50,51,52
En resumen, la utilización de la IV TA pone en evidencia sus efectos beneficiosos, obteniendo una recuperación anatómica y funcional tras la resolución del edema macular secundario a las OVRR.
REFERENCIAS BIBLIOGRÁFICAS
1. Scott IV. Macular Edema Associated With Retinal Vein Occlusion. Retina Today. 2010;(4):54-5.
2. Rogers SL, McIntosh RL, Lim L, Mitchell P, Cheung N, Kowalski JW, et al. Natural history of branch retinal vein occlusion: Evidence based systematic review. Ophthalmology. 2010;117(6):1094-1101.
3. Chan A, Leung LS, Blumenkranz MS. Critical appraisal of the clinical utility of the dexamethasone intravitreal implant (Ozurdex) for the treatment of macular edema related to branch retinal vein occlusion or central retinal vein occlusion. Clin Ophthalmol 2011;5:1043-9.
4. Shak GK. Treatment of Retinal Vein Occlusion. Individualized therapy is crucial to good patient outcomes. Retina Today [revista en Internet]. 2012 [citada 2012 abril 23];(3). Disponible en: http://www.bmctoday.net/retinatoday/2012/03/article.asp?f=treatment-of -retinal-vein-occlusion
5. Rogers S, McIntosh RL, Cheung N, Lim L, Wang JJ, Mitchell P, et al. The Prevalence of Retinal Vein Occlusion Pooled Data from Population Studies from the United States, Europe, Asia and Australia. Ophthalmology. 2010;117(2):313-9.
6. Haller JA, Brown DM. Evaluating and Integrating New Evidence in the Treatment of RVO. Retina Today [revista en Internet]. 2010 [citada 2012 abril 23];(10)Sup. 1. Disponible en: http://www.bmctoday.net/retinatoday/2010/10/supplement/article.asp?f=evaluating-and -integrating-new-evidence-in-the-treatment-of-rvo
7. Brown DM. New Directions in RVO Treatment. Retina Today [revista en Internet]. 2010 [citada 2012 abril 23];(4) Sup. 1. Disponible en: http://www.bmctoday.net/retinatoday/2010 /04/supplement/article.asp?f=new-directions-in-rvo-treatment
8. Ho AC, Ip MS. An Evidence-based Approach for RVO: Corticosteroids, Implants and Anti- VEGF Therapies. Retina Today [revista en Internet]. 2011 [citada 2012 abril 23];(6). Disponible en: http://www.bmctoday.net/retinatoday/2011/06/supplement/article.asp?f=an-evidence -based-approach-for-rvocorticosteroids-implants-and-anti-vegf-therapies
9. Schutze C, Schmidt-Erfurt U. Imaging for BRVO and CRVO. Retina Today [revista en Internet]. 2011 [citada 2012 abril 23];(6). Disponible en: http://www.bmctoday.net/retinatoday/2011/06/article.asp?f=imaging-for-brvo-and-crvo
10. Rehak J, Rehak M. Branch retinal vein occlusion: Pathogenesis, visual prognosis and treatment modalities. Current Eye Research Feb 2008,33(2):111-31.
11. Hariprasad SM. Combination Therapy for RVO. Retina Today [revista en Internet]. 2010 [citada 2012 abril 23];(5-6). Disponible en: http://www.bmctoday.net/retinatoday/2010/06 /article.asp?f=combination-therapy-for-rvo
12. Boyer DS. The Pathophysiology of Macular Edema. Retina Today [revista en Internet]. 2011 [citada 2012 abril 23];(9) Sup. 1. Disponible en: http://www.bmctoday.net/retinatoday /2011/09/supplement/article.asp?f=the-pathophysiology-of-macular-edema
13. Noma H, Funatsu H, Mimura T, Tatsugawa M, Shimada K, Eguchi S. Vitreous inflammatory factors and serous macular Detachment in Branch Retinal Vein Occlusion. Retina. 2012;32(1):86-91.
14. Cousins SW, Boyer DS. New and Emerging Treatment Paradigms for Macular Edema in Retinal Vein Occlusions and Diabetic Retinopathy. Retina Today [revista en Internet]. 2010 [citada 2012 abril 23];10. Disponible en: http://www.bmctoday.net/retinatoday/2010/10 /supplement/article.asp?f=evaluating-and-integrating-new-evidence-in-the-treatment-of-rvo
15. Holekamp NM, Ip MS. Point Counteroint Early vs Late Pharmaologic Therapy for RVO. Retina Today [revista en Internet]. 2010 [citada 2012 abril 23];(8):. http://www.bmctoday.net/retinatoday/2010/08/article.asp?f=pointcounterpoint-early-vs-late-pharmacologic-therapy-for -rvo
16. Herrero-Vanrell R, Cardillo JA, Kuppermann BD. Clinical applications of the sustained- release dexamethasone implant for treatment of macular edema. Clin Ophthalmol. 2011;5:139-46.
17. The SCORE Study Research Group. A randomized trial comparing the efficacy and safety of intravitreal triamcinolone with standard care to treat vision loss associated with macular edema secondary to branch retinal vein occlusion: the Standard Care vs Corticosteroid for Retinal Vein Occlusion (SCORE) Study Report 6. Arch Ophthalmol. 2009; 127(9):1115-1128.
18. Haller JA, Bandello F, Belfort R Jr, Blumenkranz MS, Gillies M, Heier J, et al. Randomized, sham- controlled trial of Dexamethasone intravitreal implant in patients with macular edema due to retinal vein occlusion. Ophthalmology. 2010;117(6):1134-46.
19. Haller JA, Bandello F, Belfort R Jr, Blumenkranz MS, Gillies M, Heier J, et al. Dexamethasone intravitreal implant in patients with macular edema related to branch or central retinal vein occlusion, twelve- month study results. Ophthalmology, 2011;118(12):2453-60.
20. Campochiaro PA, Heier JS, Feiner L, Gray S, Saroj N, Rundle AC, et al. Ranibizumab for macular edema following Branch retinal vein occlusion: six month primary end point results of a phase III study. Ophthalmology 2010;117(6):1102-12.
21. Brown DM. Clinical Implications of the BRAVO and CRUISE Trials. Retina Today. 2010;(4):38-40.
22. Kitchens J. Baseline predictors of the number of Ranibizumab retreatment injections in the BRAVO study during months 6-11. Poster presented at: American Academy of Ophthalmology Annual Meeting; October 16-19, 2010; Chicago.
23. Cekic O, Chang S, Tseng J, Barile G, Weissman H, Del Priore L, et al. Intravitreal Triamcinolone injection for treatment of macular edema secondary of branch retinal vein occlusions. Retina. 2005;25(7):851-5.
24. Lee H, Shah G. Intravitreal triamcinolone as primary treatment of cystoids macular edema secondary to branch retinal vein occlusion. Retina. 2005;25(5):551-555.
25. Ozdek S, Dern YT, Gurelik G, Hasanreisoglu B. Posterior subtenon triamcinolona, intravitreal triamcinolona and grid laser photocoagulation or the treatment of macular edema in branch retinal vein occlusion. Ophthalmic Res. 2008;40(1):26-31.
26. Jonas JB, Kayan AK, Kamppeter B. Branch retinal vein occlusion treated by intravitreal triamcinolone acetonide. Eye. 2005;19(1):65-71.
27. Hayashi K, Hayashi H. Intravitreal versus retrobulbar injections of Triamcinolone for Macular edema associated with Branch Retinal Vein Occlusion. Am J Ophthalmol. 2005;139(6):972-82.
28. Yepremyan M. Early treatment of cystoids macular edema secondary to branch retinal vein occlusion with intravitreal triamcinolona acetónida. Ophthalmic Surg Lasers Imaging. 2005;36(1):30-6.
29. Chen S, Sudarom V, LochheddJ, Patel C. Intravitreal triamcinolona for treatment of ischemic macular edema associated with branch retinal vein occlusion. Am J Ophthalmol. 2006;141(5):876-83.
30. Cakir M, Dogan M, Bayraktar Z, Bayraktar S, Acar N, Altan T, et al. Efficacy of intravitreal triamcinolona for the treatment of macular edema secondary to branch retinal vein occlusion in eye with or without grid laser photocoagulation. Retina. 2008;28(3):465-72.
31. Battaglia P, Iacono P, Ravalico G. Intravitreal triamcinolone acetonide combined with subthresshold grid laser treatment for macular edema in branch retinal vein occlusion: a pilot study. Br J Ophthalmol. 2008;92(8):1046-50.
32. Jonas JB. Intravitreal injection of Triamcinolone acetónida. Essential in ophthalmology. Medical Retina. 2007;(9):142-65.
33. Cheng KC. Intravitreal triamcinolone acetonide vs Bevacizumab for treatment of macular oedema secondary to branch retinal vein occlusion. Eye. 2009;23(11):2023-33.
34. Kim JY, Park SP. Comparison Between Intravitreal Bevacizumab and Triamcinolone for Macular Edema Secondary to Branch Retinal Vein Occlusion. Korean J Ophthalmol. 2009;23(4):259-65.
35. Saleh M Gaucher D, Letsch J, Bourcier T, Speeg-Schatz C. Efficacy of Early Injection of intravitreal triamcinolone acetonide (IV TA) versus delayed Injection for macular edema resulting from retinal vein occlusion. J Fr Ophthalmol. 2011;34(6):355-61.
36. Shukla D, Behera UC, Chakraborty S, Mahalakshmi R, Prasad NM. Serous Macular Detachment as a Predictor of Resolution of Macular Edema with Intravitreal Triamcinolone. Ophthalmic Surg Lasers Imaging. 2009;40(2):115-9.
37. Benson W B. A Randomized Trial comparing the efficacy and safety of intravitreal triamcinolone with standard care to treat vision loss associated with macular edema secondary to branch retinal vein occlusion. Evidence-Based Ophthalmology. 2010;11(1):22-3.
38. Blumenkranz M, Whitcup SM. Implant a First for ME after RVO. Benefits possible from Drug Delivery, effect on inflammation. Ophthalmology Times. 2009;34(14):50-4.
39. Morse LS, Modjjtahedi S. Use of Intravitreal Steroids in the Clinic. Retina Today [revista en Internet]. 2010 [citada 2012 abril 23];(6) Sup. 1. Disponible en: http://www.bmctoday.net/retinatoday/2010/06/supplement/article.asp?f=use-of-intravitreal-steroids-in-the-clinic
40. Oakley RH, Cidlowski JA. Evolving Science: The Pharmacology of Steroids. Retina Today [revista en Internet]. 2010 [citada 2012 abril 23];(5) Sup. 1. Disponible en: http://www.bmctoday.net/retinatoday/2010/06/supplement/
41. W L, Evans T. Brach Retinal Vein Occlusion: Treatment and Medication. MEDSCAPE Articles; Feb 19, 2010.
42. Yasushi S et al. Early change of central macular Thickness after intravitreous triamcinolone or bevacizumab in Diabetic macular edema or retinal vein occlusion. Retina. 2011;31(2): 290-7.
43. Karacorlu M, Ozdemir H Karacorlu S, Alacali N. Regression of optic nerve head neovascularization in proliferative diabetic retinopathy after intravitreal triamcinolona. Int Ophthalmol. 2004;25(2):113-116.
44. 37Jaulim A, Badia A, Ahmed B, Khanam T, Chatziralli IP. Branch retinal vein occlusion: Epidemiology, Pathogenesis, Risk Factors, Clinical Features, Diagnosis and Complications. An Update of the Literature. Retina. 2013;13(5):901-10.
45. Bertelsen M, Linneberg A, Rosenberg T, Christoffersen N, Vorum H, Gade E, et al. Comorbidity in patients with Branch retinal vein Occlusion: case-control Study. BMJ. 2012; 345:e7885.
46. Cekic O, Cakir M. A comparison of three different intravitreal treatment modalities of macular edema due to branch retinal vein occlusion. Curr Eye Res. 2010;35(10):925-9.
47. Cekiç O, Chang S, Tseng JJ, Barile GR, Del Priore LV, Weissman H, et al. Intravitreal triamcinolone injection for treatment of macular edema secondary to branch retinal vein occlusion. Retina. 2005;25(7):8515.
48. Krepler K, Ergun E, Sacu S, Richter-Müksch S, Wagner J, Stur M, et al. Intravitreal triamcinolone acetonide in patients with macular oedema due to branch retinal vein occlusion: a pilot study. Acta Ophthalmol Scand. 2005; 83(5):600-4.
49. Chen CH, Chen YH,Wu PC, Chen YJ, Lee JJ, Liu YC, et al. Treatment of branch retinal vein occlusion induced macular edema in treatment-naïve cases with a single intravitreal triamcinolone or bevacizumab injection. Chang Gung Med J.2010 Jul-Aug;33(4):424-35.
50. Guthoff R, Meigen T, Hennemann K, Schrader W. Comparison of Bevacizumab and triamcinolone for treatment of macular edema secondary to branch retinal vein occlusion in a pair-matched analysis. Ophthalmologica. 2010;224(5):319-24.
51. Chuang LH, Yeung L. Secondary ocular hypertension after intravitreal injection with 2mg or 4 mg of triamcinolone in retinal vein occlusion. J Ocul Pharmacol Ther. 2010;26(4):325-8.
52. Gallemare RP, Wallsh J. Management of Retinal Vein Occlusion: What the Clinical Trials Tell Us. Retina Today [revista en Internet]. 2013 [citada 2013 may 05];(4). Disponible en: http://www.bmctoday.net/retinatoday /2013/04/article.asp?f=management-of-retinal-vein-occlusion-what-the-clinical-trials-tell-us
Recibido: 18 de mayo de 2012.
Aprobado: 19 de junio de 2013.
Dra. Caridad Chiang Rodríguez. Instituto Cubano de Oftalmología "Ramón Pando Ferrer". Ave. 76 No. 3104 entre 31 y 41 Marianao, La Habana, Cuba. Correo electrónico: chiang@infomed.sld.cu