Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Oftalmología
versión impresa ISSN 0864-2176versión On-line ISSN 1561-3070
Rev Cubana Oftalmol vol.29 no.2 Ciudad de la Habana abr.-jun. 2016
INVESTIGACIÓN
Facoemulsificación del cristalino transparente en pacientes con alta miopía
Phacoemulsification applied to transparent crystalline lens in high myopic patients
Lizet Sánchez Acosta,I Raúl Hernández Silva,I Ana María Méndez Duque de Estrada,I Eneida Pérez Candelaria,I Aimé Broche HernándezII
I Instituto Cubano de Oftalmología "Ramón Pando Ferrer". La Habana, Cuba.
II Hospital "Enrique Cabrera". La Habana, Cuba.
RESUMEN
Objetivo: evaluar los resultados de la facoemulsificación del cristalino transparente en pacientes con alta miopía.
Métodos: se realizó un estudio descriptivo, longitudinal y prospectivo en el Hospital "Enrique Cabrera", entre agosto del año 2006 y agosto de 2009. El universo estuvo constituido por pacientes altos miopes (³ 6 dioptrías) quienes acudieron a la consulta de Oftalmología durante el período señalado. La muestra fue de 110 ojos de 61 pacientes a quienes se le realizó extracción del cristalino transparente por la técnica de facoemulsificación con implante de lente intraocular, igual o mayores de 40 años, que cumplían con los criterios de inclusión y exclusión y que dieron su consentimiento informado.
Resultados: el 60 % de los ojos intervenidos mejoraron la agudeza visual sin corrección. De los 110 ojos intervenidos, 108 conservaron una mejor agudeza visual corregida posoperatoria igual o superior a la preoperatoria. El equivalente esférico obtenido en más del 95 % de los ojos quedó en el rango esperado, lo que demostró una elevada predictibilidad de la fórmula (SRK/T) utilizada para el cálculo de la potencia del lente intraocular implantado. El astigmatismo inducido fue mínimo. No se registraron complicaciones transoperatorias y las posoperatorias fueron pocas.
Conclusión: la facoemulsificación del cristalino transparente en pacientes con alta miopía es una alternativa de tratamiento quirúrgico segura y eficaz.
Palabras clave: facoemulsificación; alta miopía; cristalino.
Objective: to evaluate the results of phacoemulsification technique in treating high myopic patients.
Methods: a prospective, longitudinal and descriptive study was conducted in "Enrique Cabrera" hospital in the period of August 2006 to August 2009. The universe was made up of high myopic patients (³ 6 dioptries), who went to the ophthalmology service in this period. The sample was 110 eyes from 61 forty years-old and older patients who had undergone transparent crystalline lens extraction by the phacoemulsificación technique with intraocular lens implantation, met the inclusion criteria and given their informed consent.
Results: sixty percent of surgical eyes improved their uncorrected visual acuity. Of 110 operated eyes, 108 kept best corrected visual acuity equal or better than preoperative one after the surgery. The spheral equivalent obtained in more than 95 % of the eyes was within expected range, showing high predictability of the formula (SRK/T) used for the calculation of the intraocular lens power. Induced astigmatism was minimal. No perioperative complications were reported whereas postoperative ones were few.
Conclusions: it can be concluded that phacoemulsification in high myopic patients is a safe and effective surgical treatment option.
Key words: phacoemulsification; high myopia; crystalline lens.
INTRODUCCIÓN
En la secuencia de acontecimientos que hacen posible la visión, es condición imprescindible que los rayos luminosos que llegan a la retina formen una imagen nítida y enfocada para que, una vez transformada por los fotorreceptores en energía bioeléctrica, progrese a lo largo de la vía óptica hasta la corteza occipital cerebral y se haga consciente. Cuando el sistema de enfoque no funciona —lo que sucede en las llamadas ametropías o defectos de refracción miopía, hipermetropía, astigmatismo y presbicias— las imágenes percibidas son borrosas, o incluso imperceptibles, con lo que disminuye la agudeza visual.1
La corrección tradicional con gafas soluciona satisfactoriamente la mayor parte de las ametropías. A veces, por la cuantía de la ametropía o por otras circunstancias, la visión mejora cualitativamente con la aplicación de una corrección en el plano de la córnea (lente de contacto), por la modificación del poder dióptrico de la córnea (cirugía refractiva de la córnea) o mediante la introducción quirúrgicamente de una lente intraocular, prescindiendo o conservando el cristalino opaco o transparente.2 Los defectos refractivos han constituido desde siempre, y constituyen hoy en día, una de las patologías oftálmicas más frecuentes entre la población en general. De todos los defectos de refracción, probablemente por su elevada prevalencia, la miopía ha acaparado una mayor atención y ha permitido el desarrollo de procedimientos correctores innovadores y alternativos a las clásicas gafas y/o lentes de contacto.2
La miopía es una patología que afecta al 15-20 % de la población y se define como aquellas condiciones ópticas que hacen que con la acomodación relajada la imagen de un objeto lejano quede enfocada por delante de la retina. Se trata pues de un globo ocular excesivamente convergente, o con excesivo poder dióptrico en su conjunto. El resultado es una mala visión lejana, que mejora en visión próxima a medida que los rayos llegan divergentes y pueden ser enfocados sobre la retina.3 Existen múltiples clasificaciones de la miopía, pero ninguna parece útil; aunque sí parece aceptado en el momento actual que cuando se habla de alta miopía se refiere a errores refractivos superiores a –6,00 dioptrías.4
Las gafas suelen producir mala calidad visual, especialmente si el defecto refractivo es alto, resultado de la formación de una imagen sobre la retina de menor tamaño, las aberraciones ópticas originadas por el cristal (distorsión provocada por el borde de la lente, efecto prismático), y la disminución del campo visual periférico. Además, suelen producir inhibición psicológica y una gran limitación para el desarrollo de numerosas actividades profesionales y deportivas.4 Las lentes de contacto solucionan todos estos problemas. Sin embargo, además de exigir un mantenimiento adecuado, pueden originar intolerancia a su uso y serias complicaciones oculares.7 En los últimos años, la cirugía refractiva ha constituido una verdadera revolución de la práctica oftalmológica, a partir del surgimiento de nuevas técnicas, cada vez más simples, seguras y precisas, que permiten alcanzar excelentes resultados visuales en la mayoría de los pacientes operados. Esto ha motivado la liberación de su indicación que, siendo inicialmente por intolerancia óptica o rechazo a los lentes de contacto, acepta también hoy las motivaciones estéticas y de comodidad del paciente.2
Uno de los grandes retos de la oftalmología actual es hallar un tratamiento satisfactorio para los pacientes con alta miopía. No hay uniformidad de criterios en cuanto a cuál es el tratamiento idóneo de estos pacientes, por lo que las actitudes adoptadas por los oftalmólogos son diversas. Para la cirugía de la alta miopía, actualmente son utilizadas numerosas técnicas, lo que indica que ninguna de ellas es la ideal. Fundamentalmente las podemos clasificar en tres grupos según el lugar en que actúan:8
1. Cirugía refractiva corneal asistida por Excímer láser (LASIK, LASEK, PRK) con el que disminuimos el poder refractivo de la córnea.
2. Implantación de lentes fáquicas, que a su vez pueden ser de cámara anterior (lente de Artisan/Artiflex) o de cámara posterior (ICL).
3. Extracción del cristalino transparente con implantación de lente de cámara posterior que será la que ocupa nuestro trabajo.
La extracción del cristalino transparente es una técnica relativamente sencilla para el cirujano que realiza habitualmente facoemulsificación. En la corrección de la miopía elevada, cuando se asocia a un implante de LIO, su eficacia es, en general, adecuada. Las series reportan que el 88,5 % de los pacientes alcanza una capacidad visual de 20/40, en la que el 63,4 % mejora su visión respecto a la que tenían preoperatoria, y el 36,5 % la mantiene igual. Como ventajas fundamentales se plantea que -a diferencia de las técnicas de cirugía refractiva corneal- en este procedimiento no influyen los procesos de cicatrización corneal central, por lo que el resultado es estable sin que aparezcan problemas de regresión. Al no actuar sobre la córnea no se produce adelgazamiento, ni debilitamiento a ese nivel, y se consigue una calidad visual posoperatoria excelente, sin riesgo de astigmatismo irregular.10
Entre las contraindicaciones se encuentran los pacientes con antecedente de desprendimiento de retina o pacientes con visión funcional en un solo ojo, en los cuales no debería indicarse la técnica quirúrgica. La presión intraocular elevada constituye una contraindicación relativa.11 Paralelamente con esta técnica, se ha conseguido disminuir de manera importante la incidencia de complicaciones intra y posoperatorias, e igualmente se ha mejorado la eficacia en el tratamiento de estas. La complicación intraoperatoria más frecuente es la rotura de la cápsula posterior con pérdida de vítreo, que predispone claramente a la aparición de desprendimiento de retina posoperatorio.12 La principal complicación posoperatoria es la opacidad de la cápsula posterior, que llega a 40 % a los 4 años y que requiere de capsulotomía con láser Nd: YAG el cual aumenta el riesgo, ya existente, de desprendimiento de retina.11,12,22
Consideramos que esta técnica innovadora es prometedora no solo para la corrección de la alta miopía, sino —lo que es más importante— para mejorar la calidad de visión y, fundamentalmente, la calidad de vida de nuestros pacientes. De hecho, las estadísticas actuales recogen resultados muy alentadores en los pacientes sometidos a este proceder.9 Estamos conscientes de que tratamos un tema sometido a constante evolución y evaluación, sobre el que sería temerario establecer criterios de certeza absoluta.
Nuestro objetivo fue evaluar los resultados de la facoemulsificación del cristalino transparente en pacientes con alta miopía, en el Hospital "Enrique Cabrera", del año 2006 al 2009, así como caracterizar los casos en el preoperatorio según sexo, localización de la miopía, agudeza visual y equivalente esférico; evaluar la eficacia, la predictibilidad y la seguridad de la técnica empleada, determinar el astigmatismo inducido por la intervención e identificar las complicaciones trans y posoperatorias.
MÉTODOS
Se realizó un estudio descriptivo, longitudinal, prospectivo, de evaluación tecnológica en el Hospital General Docente "Enrique Cabrera" entre los meses de agosto del año 2006 y agosto del 2009. El universo lo constituyeron todos los pacientes con alta miopía (³ 6 dioptrías) que acudieron a consulta externa del Centro de Oftalmología durante el período señalado. La muestra fue conformada con 110 ojos de 61 pacientes a quienes se decidió aplicar la extracción del cristalino transparente por la técnica de facoemulsificación con implante de lente intraocular, que cumplían con los criterios de inclusión, que fueron diagnóstico de alta miopía (³ 6 dioptrías) no clasificable para cirugía refractiva con cristalino transparente, edad igual o superior a los 40 años, aprobación del paciente a participar en la investigación y excluimos pacientes con antecedentes de cirugías oculares previa de córnea y/o vítreo retina, presencia de una patología ocular asociada que afectara al cálculo preoperatorio o los resultados refractivos posoperatorios y presencia de patología sistémica grave o no controlada. Todos los pacientes dieron su consentimiento informado para participar en este estudio.
Las intervenciones quirúrgicas fueron realizadas por un equipo de médicos, formado por una residente y un especialista de Oftalmología. Los pacientes se mantuvieron en consulta de seguimiento durante 6 meses después de la cirugía. Se realizaron evaluaciones de las variables de interés en preoperatorio y posoperatorio (45 días, 3 y 6 meses). Para desarrollar los objetivos específicos, evaluamos las variables, edad, sexo, ojo operado, mejor agudeza visual (MAV) con y sin cristales, índice de eficacia, equivalente esférico preoperatorio, obtenido y esperado, astigmatismo inducido y complicaciones trans y posoperatorias.
Como variables principales de respuesta analizamos el éxito, el fracaso y la tasa de eficacia global, la evaluación de seguridad y la evaluación de predictibilidad. Para el desarrollo del estudio fue necesario realizar un examen oftalmológico completo que incluyó toma de la MAV con y sin cristales según cartilla de snellen en valores decimales; biomicroscopia, por lámpara de hendidura y sistema de magnificación de imágenes marca Carl Zeiss, en preoperatorio y posoperatorio a los 3 y 6 meses respectivamente. Tonometría de aplanación por medio de un tonómetro de Goldman fijo a la lámpara de hendidura (marca Carl Zeiss); oftalmoscopia directa e indirecta; queratometría con el autorrefractómetro/queratómetro, marca TOPCON RK-8800, y microscopia endotelial mediante microscopia especular cálculo de LIO por IOL Master. Para este estudio se empleó la SRK/T, fórmula de tercera generación de elección para pacientes con longitud axial mayores de 24,5 mm.6
Como técnica quirúrgica se realizó la facoemulsificación coaxial, chip and flip, donde primeramente dilatamos al paciente con tropicamida 1 % y a continuación se instaló anestesia tópica con tetracaína cada mL/5,0 mg;aplicamos las medidas de asepsia y antisepsia previas a la cirugía ocular, realizamos incisión principal en córnea clara en 3 planos, de 3,2 mm de ancho en el meridiano más curvo con querátomo trapezoidal de diamante e incisión auxiliar de 1 mm con cuchillete de diamante, ambas vías de acceso ortogonales; se colocó 0,5 cc de anestesia intracraneal (lidocaína 2 %) sin preservo, y se pasó luego a la formación de la cámara anterior con viscoelástico (OV-GEL 1,4 % sodium hyaluronate) para continuar con la realización de la capsulorrexis de 5,5 a 6 mm utilizando un cistótomo de aguja (26 G), seguida de la hidrodisección, la hidrodelineación y la hidrodelaminación (opcional), para realizar la técnica de facoemulsificación con máquina NIDEK CV-7000, mediante el modo APL lineal microtipo ABS 30 grados.
Antes de iniciar la facoemulsificación del núcleo se aspiró la corteza y el epinúcleo anterior; a continuación se esculpó un cráter central en el núcleo hasta que quedó una delgada placa central. Con una paleta fina introducida por la incisión auxiliar se levantó el borde del núcleo debajo del cráter y se movió hacia el centro del saco capsular comenzando a emulsificar el borde de este. Luego pasamos a la remoción del epinúcleo, realizamos bimanualmente la aspiración de corteza con pulido de cápsula posterior y del borde de la rexis y finalmente colocamos viscoelástico; ampliamos la incisión principal hasta 3,5 mm con cuchillete correspondiente, se implantó LIO (plegable), marca (IOL Focus) modelo (PCF60), se aspiró viscoelástico y para concluir la cirugía se sellaron las paracentesis y se aplicó inyección de betametazona (0,5 cc) subconjuntival.
La información fue recogida en un modelo de registro oftalmológico. Los datos se registraron caso a caso en tabulador EXCEL y se procesaron para análisis de los resultados en el programa SPSS versión 11,5. Para las variables cuantitativas se resumieron los resultados en mínimo, máximo, media y desviación estándar. En el caso de la agudeza visual se elaboró una escala de valores y se calcularon las frecuencias y los porcentajes. Para las variables cualitativas se determinó la frecuencia absoluta y el porcentaje.
Las comparaciones de medias se realizaron a través de t-student para muestras pareadas. La prueba se efectuó para un nivel de confianza del 95 %. La hipótesis nula (Ho) se basó en la igualdad de las medias comparadas y la hipótesis alternativa en la existencia de diferencias en uno u otro sentido (dos colas). Se desestimó la hipótesis nula siempre que el valor de p asociado a la t obtenida fuera inferior a 0,05. Se confeccionaron tablas y gráficos para la presentación de los resultados. Se confeccionó un modelo de consentimiento informado para obtener la aprobación del paciente a participar en la investigación y se garantizó la confidencialidad de la información registrada, así como su uso exclusivo con fines científicos.
RESULTADOS
Para este estudio fueron incluidos 61 pacientes y un total de 110 (ojos); existió un ligero predominio de los ojos izquierdos (52,7 %) sobre los derechos (47,3 %) y una discreta prevalencia del sexo femenino 67 (60,9), sobre el masculino 43 (39,1), lo cual se considera guarde relación con el total de la muestra mayor del 50 % que corresponde con pacientes del sexo femenino. Los valores preoperatorios de la agudeza visual muestran que la totalidad de los pacientes (ojos) presentaban una agudeza visual preoperatoria sin corrección (AVPSC) menor o igual a 0,5 estando el 50,9 % entre 0,05 y 0,2, en cuanto a la agudeza visual preoperatoria con cristales (AVPCC) el mayor porcentaje (48,2 %) alcanzaban entre 0,8 y 1,0 (tabla 1).
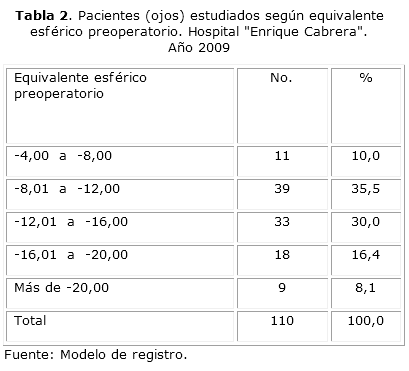
La tabla 2, resume el comportamiento del equivalente esférico preoperatorio de la muestra, donde se evidencia que el mayor porcentaje (35,5 %) de pacientes (ojos) estaba en el rango de -8 a -12 dioptrías seguido por un 30,0 % en el rango de -12,01 a -16,4. Este comportamiento guarda relación con la muestra escogida para realizar el estudio en la cual todos eran miopes mayores de menos 6 dioptrías.
Para evaluar la eficacia en este estudio se utilizaron dos vías, el comportamiento de la agudeza visual y el cálculo del índice de eficacia. Una primera aproximación a los resultados obtenidos a partir de la aplicación de la cirugía facorrefractiva es la descripción de cómo evoluciona la agudeza visual sin corrección (AVPSC) en los diferentes momentos. Los resultados se muestran en la tabla 3.
Los valores de las medias para cada momento (tabla 4) fueron de 0,64 para la AVPCC, 0,62 para la AVSC3M y de 0,63 para la AVSC6M, donde se comprobó que las diferencias entre las medias no eran estadísticamente significativas porque en ambos casos los valores de t-student obtenidos se asociaron a una probabilidad de azar superior a 0,05 (0,081 y 0,475 respectivamente). Por tanto, es posible afirmar que no existe evidencia de que los valores de agudeza visual comparados difieran entre sí, o sea, la técnica resultó eficaz. No obstante, es imposible desconocer que la probabilidad de azar obtenida de la diferencia entre la AVPCC y la AVSC3m se acercó bastante a la significación estadística, no así a los 6 meses. Esto puede estar relacionado con la mayor proximidad a la intervención, lo que podría condicionar que algunos casos con recuperación lenta aún no hayan alcanzado el máximo de la agudeza visual posible. En caso contrario se relaciona con un fracaso según los términos para la eficacia como muestra la tabla 5.
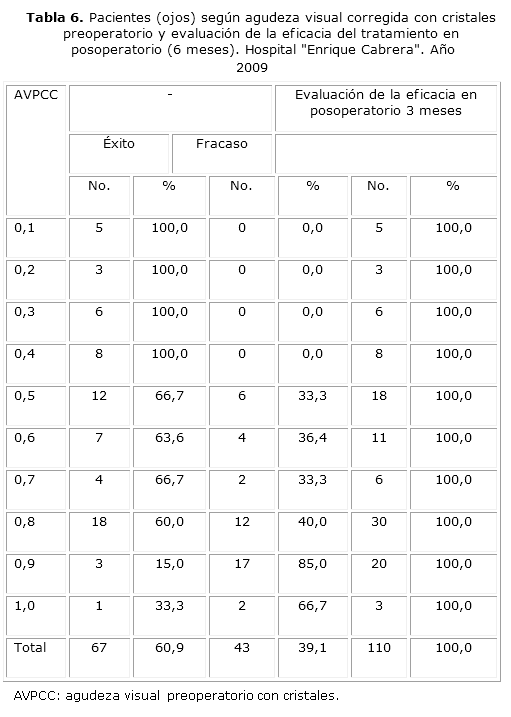
Más allá de este resultado global, es de interés evaluar la eficacia teniendo en consideración cada uno de los valores obtenidos para la AVPCC y conocer qué grado de éxito se obtuvo en cada caso. Para valores de la AVPCC inferiores a 0,5 se obtuvieron tasas de eficacia (éxito) del 100 %. A partir de 0,5 se reduce la tasa pero aún se mantiene entre 60 y 70 % hasta llegar a una AVPCC de 0,9 y 1, donde el porcentaje de éxito se reduce a 15,0 % y 33,3 % respectivamente. En estos casos se invierte el comportamiento y es mucho más probable que se obtenga un fracaso que un éxito bajo los términos de idoneidad que se exigen con el índice de eficacia. Solo tres pacientes (ojos) cambiaron de categoría: 2 de ellos de fracaso a éxito (con AVPCC de 0,5 y 0,7 cada uno) y 1 caso de éxito a fracaso con AVPCC de 0,8. Este último corresponde a un paciente que presentó una complicación tardía. Es evidente que los resultados son muy similares en los dos momentos por lo que se desestima aplicar pruebas estadísticas para evaluar las diferencias (tabla 6).
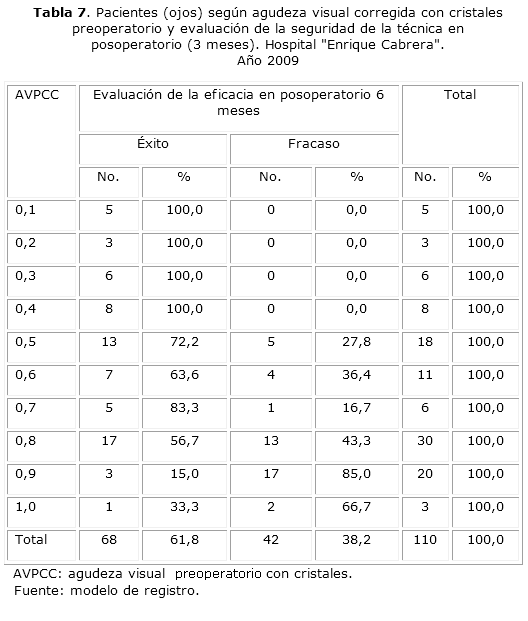
Para la evaluación de la seguridad la AVCC es un parámetro funcional que ayuda a valorar la seguridad de la técnica independientemente de si se ha conseguido el valor refractivo esperado. Su incremento indica que no ha habido deterioro funcional provocado por la cirugía. La seguridad de la técnica se calcula a partir de la diferencia entre la AVPCC y la AVCC posoperatoria y se espera que su valor sea 0 o un número negativo. La pérdida de una línea de agudeza visual corregida con cristales en el posoperatorio implica que la técnica no resultó segura para ese paciente (ojo). A los 3 meses de realizada la intervención fue posible comprobar que la técnica fue segura: de un total de 110 pacientes (ojos) a los que se aplicó la técnica, el 98,2 % conservó una AVCC3m igual o superior a la AVPCC. Uno de los dos casos para los que la técnica no resultó segura es un paciente (ojo) que desarrolló una complicación en el período posoperatorio (tabla 7).
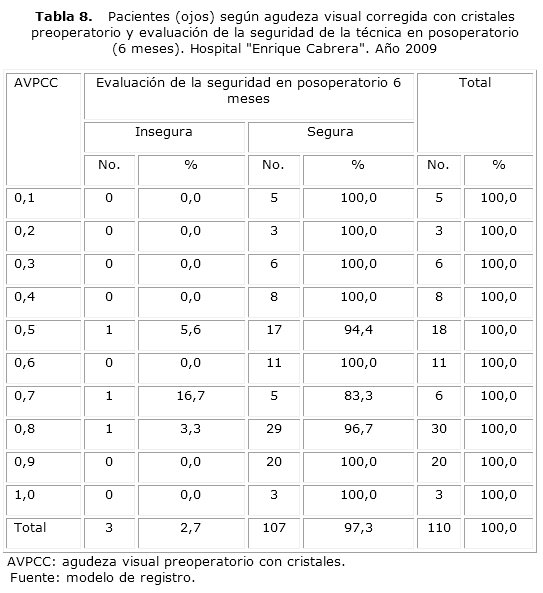
La seguridad de la técnica se redujo discretamente en este segundo momento de evaluación cuando se detectaron 3 casos con AVCC6m inferior a la AVPCC. No obstante, la seguridad aún representó un 97,3 %, valor significativamente alto. Los 3 casos para los que la técnica resultó insegura no se correspondieron con los 2 detectados a los 3 meses (en estos la técnica fue evaluada como segura en el segundo momento) y en los tres estaban presentes complicaciones posoperatorias, que se desarrollaron entre los 3 y los 6 meses posteriores a la intervención (tabla 8)
Las diferencias entre la evaluación del equivalente Esférico preoperatorio (EEP) y el Equivalente Esférico Obtenido (EEO) en ambos momentos del posoperatorio se mantuvieron por encima de las 13 dioptrías y resultó significativa en todos los casos. Los valores de la p asociado a la t-student obtenida fueron prácticamente iguales a 0. Es decir, existió suficiente evidencia estadística para afirmar que eran completamente diferentes antes y después de la intervención. Posteriormente a la comprobación antes descrita se evaluó el resultado del EEO según la EEP. De este modo, se consideró que las fórmulas biométricas poseían una adecuada predictibilidad cuando el EEO alcanzó valores que oscilaba entre -1,00 y +1,00 dioptrías.23 A los 3 meses de realizada la cirugía en los 110 ojos estudiados, el EEO fue adecuado en 108 ojos, lo que representó el 98,2 %, y a los 6 meses en 106 pacientes, lo que representó el 96,4 % poniendo de manifiesto la alta predictibilidad de la fórmula empleada para calcular la potencia del lente intraocular (tabla 9).
El astigmatismo inducido (AI) fue calculado de forma automatizada mediante el programa SIAC Versión 1,04 para dos momentos del posoperatorio: 45 días y 3 meses. Los valores del AI a los 45 días de realizada la intervención oscilaron entre 0 y 3,08 dioptrías, con una media de 0,72 dioptrías. A los 3 meses se observó una reducción de la media de AI a 0,48 dioptrías y se redujo discretamente la dispersión (valor máximo 2,86 y la desviación estándar se redujo a 0,55). Los expertos consideran que un AI igual o inferior a 0,75 dioptrías se encuentra en valores óptimos, por lo que basados en este planteamiento y posteriormente de realizado el cálculo vectorialmente, se conformó el análisis de los resultados, teniendo en cuenta los rangos para evaluar el astigmatismo inducido, donde se puede afirmar que en un momento temprano (45 días después de la intervención) el porcentaje de pacientes (ojos) con un AI en el rango prestablecido era de 61,8 % (68 casos) y se incrementó considerablemente en la evaluación a los 3 meses a un 79,1 % respectivamente.
Se ha descrito una gran variedad de complicaciones trans y posoperatorias asociadas al uso de esta técnica. En el presente estudio no ocurrió ninguna complicación transoperatoria. En el posoperatorio fueron detectadas 6 complicaciones y se apreció que el 94,6 % de pacientes (ojos) intervenidos no presentó complicaciones. Hubo un ligero predominio de la opacidad de cápsula posterior (3 casos) seguida por edema macular cistoide (2 casos). En solo un caso se presentó una uveítis que recuperó su agudeza visual.
DISCUSIÓN
Para este estudio fueron incluidos un total de 110 pacientes (ojos). Existió un ligero predominio de los ojos izquierdos (52,7 %) sobre los derechos (47,3 %). No encontramos trabajos realizados al respecto que nos permitieran establecer parámetros de comparación. Asimismo, existió una prevalencia del sexo femenino sobre el masculino, lo cual se considera guarde relación con el total de la muestra mayor del 50 % que corresponde con pacientes del sexo femenino, sin que exista otro factor que pueda tener relación con esto. En trabajos revisados no existe distinción de la miopía por ningún sexo.23-28
En la AVPSC se consideró con fines matemáticos como 0,0 la visión de movimiento de manos y cuenta dedos. Se observa que las medias de la AVSC en el posoperatorio se mantienen en 0,6 lo que representa un cambio sustancial con el 0,1 existente en el grupo como promedio en el preoperatorio. Las diferencias entre ambos momentos del posoperatorio y el preoperatorio son de -0,5 y el valor de t-student obtenido (-32) se asocia a una probabilidad de azar de 0,000. Es decir, las diferencias son estadísticamente significativas; los promedios de agudeza visual sin corrección difieren sin ninguna duda. La AVSC nos informa de la eficacia de la técnica quirúrgica como procedimiento refractivo y para mejorar la visión del paciente sin ayuda de gafas. Por tanto, es posible afirmar que la intervención realizada logra un efecto positivo sobre la agudeza visual sin corrección y la mejora.
Resultados similares son dados por otros autores. Algunos realizaron técnicas análogas en estudios del tema, aunque las muestras han sido menores. Colin y otros señalan en su estudio que para el 69 % de sus pacientes fueron satisfactorios los resultados, con mejoría de la agudeza visual a 0,5; o mejor y de estos, el 38,5 % sin corrección.29 Lyle reporta que en el 77 % de sus pacientes obtuvo AVSC posoperatoria de 0,5 o mejor, y Hun Lee reporta resultados similares en el 37,5 % sin corrección y en el 62,5 % con corrección.30 De igual manera, en estudio realizado por autores cubanos en el Hospital Clínico quirúrgico "Hermanos Ameijeiras" (2003) en una muestra de 64 ojos se obtuvieron resultados similares relacionados con la AVSC.31
El objetivo primordial de la intervención en pacientes con alta miopía es la corrección del grave defecto refractivo y conservar la capacidad funcional; es decir, una agudeza visual igual o superior a la que poseía mediante la corrección con cristales previo a la aplicación del proceder. En el cumplimiento de este objetivo radica la eficacia de la intervención. Se espera entonces que no exista diferencia entre la AVPCC y la AVSC, ya sea a los 3 o a los 6 meses. En la amplia serie de Zaldívar,32 124 ojos con técnica y un seguimiento igual presenta resultados comparativamente similares y de esta misma manera se comporta el estudio de Carreras Díaz14 para 21 ojos altos miopes.
La mejoría de la AVSC posoperatoria puede explicarse por la magnificación de la imagen en la retina inducida por la lente convergente intraocular, así como por la mayor cercanía al punto nodal del sistema refractivo ocular, además de otras limitaciones ópticas de las gafas para altas miopías, como son la reducción del campo visual, la reducción del tamaño de las imágenes y las aberraciones ópticas.32 El cálculo del índice de eficacia (IE) es la prueba que se utiliza comúnmente en cirugía refractiva, que resulta del cociente de la AVSC posoperatoria entre la AVPCC, para informar de la eficacia en otorgar al paciente una AVSC similar o mejor que la que tenía con el uso de gafas o lentes de contacto. Cuando su valor es igual o superior a 1 expresa éxito de la cirugía.
El cálculo del índice de eficacia se efectuó para cada unos de los pacientes (ojos) incluidos en el estudio, el que mostró que el IE3m ofrece valores extremos 0,2 y 6; sin embargo, la media o promedio es de 1,12, por encima de la unidad que expresa la eficacia del tratamiento. Por su parte, el IE6m oscila entre valores extremos 0 y 6 y la media es discretamente superior (1,16) con la obtención de 67 éxitos a los 3 meses y 68 a los 6 meses. Posteriormente, se obtuvo la tasa de eficacia global de la técnica a los 3 y 6 meses del posoperatorio que mostraron resultados por encima del 60 % (60,9 y 61,8 %) respectivamente, discretamente superior a los 6 meses, lo que demuestra que más de la mitad de los pacientes (ojos) mejoraron su AVSC posoperatoria, lo cual demostró lo eficaz que resulta la cirugía realizada. Resultados similares de índice de eficacia muestra el estudio realizado por Jiménez-Alfaro en su serie de 20 ojos, donde obtiene una tasa de eficacia de 63,15 %.33 Pérez-Santonja18 obtiene unos resultados sobre IE de 78,3 % superior a los nuestros, y Lyle30 obtiene un 72 %. A pesar de estas diferencias, consideramos nuestros resultados dentro de los límites de eficacia aceptable y tolerable en estos rangos de miopía.
Según los resultados expuestos, podemos apreciar que para la AVPCC entre 0,8 y 1,0 la posibilidad de alcanzar estos mismos resultados sin corrección en el posoperatorio se reduce, lo cual consideramos justificado en que el ojo no pierde su condición de miope con la cirugía, y destacamos que estos resultados no interfieren en la calidad de la visión percibida por el paciente, pues la AVSC posoperatoria mejora individualmente. Estos mismos resultados los expone Jiménez-Alfaro en su trabajo sobre corrección quirúrgica de la alta miopía mediante implante de lentes en cámara posterior,33 al igual que Güell,34 quien obtiene en su muestra resultados muy alentadores, al resumir que la técnica resulta altamente eficaz, particularmente en los casos con AVPCC iguales o inferiores a 0,7. En la amplia serie de Zaldívar y otros,32 124 ojos con un seguimiento medio de 11 meses, con un rango de miopía preoperatoria muy similar a la nuestra, obtuvieron un índice de seguridad de 68 %, inferior al de este estudio (97,3 %), lo que se explica porque hubo mejor predictibilidad.
Sousa,32 al añadir incisiones arqueadas al procedimiento quirúrgico para corregir el astigmatismo prexistente, obtuvo porcentajes de seguridad similares al de esta serie (97,2 %). En este estudio, el rango de la miopía preoperatoria era de -7,25 a -9,37 dioptrías, defectos que en nuestra opinión son indicación de cirugía refractiva corneal. Estos pacientes presentan una muy buena AVSC preoperatoria y un defecto refractivo que puede ser determinado con gran exactitud. Jiménez Alfaro33 obtuvo un 98,03 % de seguridad, valor similar a este estudio con iguales rangos de miopía. Güell34 evalúa la seguridad con resultados de un 84 %, e Iribarne et al35 con un 82 % respectivamente, que -aunque son algo inferiores a los que se obtuvieron en este estudio- son elevados, pues para más de la mitad de los pacientes estudiados se mantuvo o hubo un incremento de la AVCC posoperatoria, lo que indica que no ocurrió deterioro funcional por la cirugía.
Con los resultados expuestos se afirma que es esta una técnica segura para los pacientes que se someten a ella. Sería conveniente entonces evaluar la estabilidad de esta, pero resulta imposible en este estudio por el poco tiempo de seguimiento con que cuentan estos pacientes. La evaluación de la predictibilidad es una de las características más importantes de la cirugía refractiva intraocular, la cual debe ser elevada. El cálculo de la potencia dióptrica de la lente debe ser exacta, ya que el paciente refractivo desea quedar libre de corrección óptica tras la cirugía; por tanto, parte esencial del éxito radica en el valor del EEO lo más próximo posible a cero.
En ambos momentos de la evaluación, el EEO (3 y 6 meses) pone de manifiesto la alta predictibilidad de la fórmula empleada para calcular la potencia del lente intraocular, ya que el 98,2 % y el 96,4 % respectivamente quedan en el rango de EEE. El EEE no es siempre igual a 0, ya sea porque se programa intencionalmente una subcorrección a fin de preservar la visión próxima en pacientes présbitas, o porque las dioptrías de las lentes no contemplan correcciones decimales de 0,50 D. El haber obtenido un resultado satisfactorio en el estudio guarda relación con el cálculo correcto del poder dióptrico de la lente intraocular (LIO) colocada al paciente y el proceder quirúrgico, lo que asegura su posición correcta dentro del saco.35-38
Para calcular la potencia del LIO a introducir se han desarrollado diferentes fórmulas matemáticas basadas en la queratometría y la longitud axial (AXL) del ojo, calculadas mediante biometría ultrasónica (de contacto o de inmersión), o más recientemente óptica (Zeiss IOL Máster), técnica de no contacto de elevada precisión que alcanza gran tolerancia y rapidez, yque realiza todas las mediciones para el cálculo de potencia del LIO en el mismo instrumento sobre la base de fórmulas internacionalmente usuales y la selección del tipo de lente en un banco de datos.40 Las fórmulas que existen para este fin han ido evolucionando y son cada vez más precisas, ya que exigen una medición exacta de los distintos parámetros. Escogimos la fórmula más recomendada en la bibliografía consultada, que es la SRK/T,39 la cual, según expertos, es para los pacientes de longitud axial mayores de 24 mm. En la serie encontramos una predictibilidad mayor a la de otros autores para el mismo rango de miopía. Assetto et al40 encuentran un 31 % de pacientes con menos de 1,0 dioptría de defecto refractivo residual, y en 3 casos de una serie de 15 tiene que explantar la lente y cambiarla por otra de potencia adecuada al encontrar defectos residuales mayores de 3,0 dioptrías.
Rosen y otros41 obtienen una predictibilidad del 95 % similar a este estudio, pero combina el implante de la lente con la realización de incisiones arqueadas para corregir el astigmatismo preoperatorio, hecho que no ha sido considerado en nuestro estudio. Zaldívar y otros32 encuentran una predictibilidad del 69 % dentro de ± 1,0 dioptrías de refracción por debajo de la nuestra. Aunque dominar la técnica realizada es esencial, no serviría de nada si no se logra una elevada predictibilidad, lo que se traduce en calidad visual y de vida de estos pacientes, parámetro que es logrado en un porcentaje elevado en este estudio.
El cálculo del astigmatismo inducido como resultantes de la diferencia de las lecturas queratométricas pre y posoperatorias es una tarea compleja, ya que el astigmatismo es una magnitud vectorial definida por dos parámetros: orientación del eje y potencia.42 Existen varios métodos para el cálculo del astigmatismo inducido; los más utilizados son los de sustracción simple y el método vectorial. Se utiliza en el estudio el programa SIAC 104 (2008), el cual hace un análisis vectorial matemático para calcularlo.
El astigmatismo inducido es aquel que se produce principalmente en la córnea como consecuencia directa de la manipulación quirúrgica, que nos informa la variación astigmática que ha sufrido el ojo durante el acto quirúrgico, pero describe la bibliografía revisada en la que no es hasta los tres meses de realizada la cirugía que los valores pueden evaluarse, pues es en ese momento donde se estabiliza la refracción al no influir el astigmatismo residual de la cirugía.42 De esta forma, los resultados en este estudio se comportan de acuerdo con lo señalado anteriormente, donde se aprecia una disminución de la media de AI a los 3 meses de operados, con la obtención de una media de 0,48 dioptrías respecto a 0,72 dioptrías a los 45 días.
En trabajos realizados en el Instituto cubano de Oftalmología "Ramón Pando Ferrer" por el Dr. Hernández Silva,43 el astigmatismo inducido fue menor (0,15 dioptrías) en relación con el nuestro. Esto puede estar condicionado por el método empleado para calcular el AI, no así en el estudio realizado sobre el tema en el Hospital Docente Clinicoquirúrgico "Hermanos Ameijeiras", donde en la serie analizada se recogen resultados de (0,67 dioptrías) de astigmatismo inducido.31. El haber obtenido un AI menor de una dioptría en el 79,1 % (a los 3 meses) de los pacientes (ojos), habla a favor de la efectividad de las pequeñas incisiones tunelizadas realizadas por córnea clara por el lado temporal (vía menos astigmatógena).43 Resultados similares a los obtenidos se recogen en los trabajos de Hernández Silva43 y de autores mexicanos como Ibáñez y otros.44
Es importante entender que, de acuerdo con el modo en que se construya una incisión, esta se verá reflejada en el resultado final del astigmatismo. Las incisiones quirúrgicas pequeñas son fáciles de realizar; producen menos reacción inflamatoria en el posoperatorio y es poco el astigmatismo que inducen; permiten obtener una mejor AV en etapas más tempranas y un estado refractivo más estable;44 sin embargo, la tendencia a realizar cada día incisiones mucho más pequeñas deberá reflejarse en mejores resultados a corto plazo.44 Este estudio confirma las bondades de incisiones pequeñas con astigmatismos prácticamente neutros que no influyen en el deterioro visual de los pacientes.
Los importantes avances en la facoemulsificación permiten brindar una técnica muy segura, con una escasa incidencia de complicaciones. No obstante, y como en toda cirugía intraocular, se requiere un cirujano experimentado y una técnica depurada, que se acompañe de un buen estudio previo y de un estrecho seguimiento, además de una adecuada motivación por parte del paciente para minimizar los riesgos inherentes a todo acto quirúrgico.44 En el posoperatorio fueron detectadas seis complicaciones, lo que equivale a un porcentaje realmente bajo de complicaciones que se corresponde con la literatura cubana revisada relacionada con la baja incidencia de complicaciones de esta técnica de los autores Hernández Silva y otros en el Instituto Cubano de Oftalmología "Ramón Pando Ferrer",20,43 y de la doctora Borges y otros, del Hospital Clínico Quirúrgico "Hermanos Ameijeiras".31
La opacidad de la cápsula posterior fue la complicación posoperatoria más frecuente, lo que coincide con la de los otros autores.45 Se dice que existe una proliferación y metaplasia de las células del epitelio capsular anterior y migración de las células epiteliales a la región ecuatorial para adherirse a la cápsula posterior, que da origen a una zona opaca en ella y puede tener diferentes formas. Por lo general cursa con respuesta inflamatoria en forma de fibrosis anular (anillo de Sommering) en forma de perlas (perlas de Elsching) y lineal con estrella formando pliegues.45 Como consecuencia de esta frecuente complicación existen autores que recomiendan su ruptura en el acto quirúrgico, criterio no muy acertado, pues provocaría la invasión vítrea a la cámara anterior.45 Además, en estos pacientes miopes altos con vítreo, con frecuencia patológico, el hecho de quitar la barrera capsular posterior favorece la irido y la vitreodonesis.45
El edema macular cistoide (que se presentó en 2 casos de la serie) se define como la acumulación de líquido en la capa plexiforme externa y nuclear interna de la retina, que por su disposición anatómica en la región foveal tiende a formar espacios quísticos.46 Su incidencia, luego de una cirugía no complicada, ha disminuido gracias a la mejora de la técnica quirúrgica y a la incorporación de modernos equipamientos para llevarlas a efecto. Sin embargo, suele existir una evidencia angiográfica en el 19 % de los casos y pueden provocar una disminución transitoria de la agudeza visual en el 8 % luego de una facoemulsificación realizada sin complicaciones.46 Típicamente el cuadro suele presentarse de 4 a 12 semanas luego de una cirugía no complicada, donde el pico máximo de presentación es entre las cuatro a seis semanas. En el estudio se describe como momento de aparición un caso a los 3 y otro a los 6 meses que consideramos se relacione con los momentos en que se evalúa el caso. Puede aparecer en momentos antes y no tener que acudir el paciente a consulta. Luego de 6 meses de la cirugía, el edema macular cistoide se resuelve espontáneamente en la mayoría de los casos, y queda con un edema crónico solo en 1 a 3 % de las cirugías. En la etiología se consideran factores mecánicos, fototóxicos e inflamatorios; tal vez es la inflamación la vía final común para el desarrollo ulterior del edema. La inflamación producida por la cirugía liberaría mediadores inflamatorios como prostaglandinas y leucotrienos sintetizados a partir del ácido araquidónico, que serían los responsables de la ruptura hemato-ocular interna y externa.47 Es de aparición poco frecuente según la bibliografía revisada y coincide con la serie estudiada.47
Se recoge en las complicaciones un caso de uveítis, la cual —según la bibliografía revisada— es una complicación de la cirugía ocular poco frecuente,47 y consiste en una reacción fibrinoide exagerada en cámara anterior como consecuencia de una rotura de la barrera hemato acuosa ocular.47 El riesgo más temido por el oftalmólogo tras la cirugía de un miope es el desprendimiento de retina, el cual no apareció en los casos de la serie estudiada, lo que coincide con lo que se recoge en las bibliografías actuales sobre la poca aparición de esta con el desarrollo de la técnica de facoemulsificación.48
Güell35 no observó desprendimiento de retina en su serie de 44 ojos, pertenecientes a pacientes con edades comprendidas entre los 30 a 49 años y con miopía elevada intervenidos con facoemulsificación de cristalino e implante de LIO. Lyle,30 tras realizar 138 cirugías facorrefractivas en ojos miopes, presenta una incidencia de desprendimiento de retina del 0,7 %. Zaldívar32 determina en una serie de 526 ojos la incidencia de desprendimiento de retina tras facoemulsificación de 0,4 % (y cuando excluía los pacientes con lesiones predisponentes era del 0 %). Concluimos que la facoemulsificación del cristalino trasparente en la alta miopía produce una tasa de complicaciones muy baja, y consigue resultados funcionales excelentes.
Conflictos de intereses
No existen según los autores.
REFERENCIAS BIBLIOGRÁFICAS
1. Duke E. Refracción: teoría y práctica. Barcelona: Editorial JIMS, S.A.; 1995.
2. Centurión V, Nicoli C, Villar Kuri J. El libro del cristalino de las Américas. Editoral Livraria Santos; 2007. p. 25-32.
3. Grave Wiechers F. El ojo miope. Bogotá: Franj Ocul. 2000;2(7):33.
4. Menezo JL. Corrección quirúrgica de la alta miopía. Barcelona: Publicaciones médicas; 2001. p. 285-9.
5. Curtin BJ. The etiology of miopía. En: Curtin BJ, editor. The myopias: basic science and clinical management. Philadelphia: Harper & Row; 2000. p. 113-24.
6. Vázquez M. Evaluación preoperatoria en cirugía refractiva. En: Menezo JL, Güell JL. Corrección quirúrgica de la alta miopía. Barcelona: Ediciones Espaxs; 2001. p. 199.
7. Benítez del Castillo Sánchez JM. Cirugía refractiva. Facoemulsificación. 2002;9(10):746-55.
8. Barraquer J, Rutllán R. Cirugía del segmento anterior del ojo. Barcelona: Distribuidora Continental; 1984. p. 81-91.
9. Fernández-Vega L, Alfonso JF. Facoemulsificación y emetropía. Cap. 1. Monografías de la Sociedad Española de Cirugía Implanto-Refractiva; 2001. p. 19-27.
10. Hofman RS, Fine IH. Packer M. New phacoemulsification technology. Curr Opin Ophthalmol. 2005;16:38-43.
11. Rodríguez Enríquez M, Maíz Cal D, Sayagués Gómez A, Iglesias García E, Santamarina Pernas R. Complicaciones intraoperatorias y resultados visuales en la transición a la facoemulsificación. Arch Soc Esp Oftalmol. 2012;73(5):279-83.
12. Hurtado M, Martínez-Costa R. Cisneros AL. Complicaciones preoperatorias. En: Cisneros AL, Martínez-Costa R. Complicaciones de la cirugía refractiva intraocular. Madrid: MacLine; 2003. p. 19-30.
13. Salz JJ, Trattler WB. Preoperative evaluation for refractive surgery. Cornea. 2005. p. 1897-908.
14. Carreras Díaz H, Rodríguez Hernández JV. Cirugía del cristalino transparente. Balance de resultados de 2001. Archivo de la Sociedad Canaria de Oftalmología; 2002.
15. Barraquer JI. Keratomileusis for the correction of myopia. Ann Inst Barraquer. 1964;5:209-29.
16. Boyd BF. Cirugía refractiva. Las últimas técnicas. Panamá: Highl Ophthalmol. 1999;2(27):14-22.
17. Marco Martín M. Lentes fáquicas y alta miopía. Ann Oftalmol. 2001;9(4):195-7.
18. Pérez-Santonja JJ, Alió JL, Jiménez-Alfaro I, Zato MA. Surgical correction of severe myopia with an angle-supported phakic intraocular lens. J Cataract Refract Surg. 2000;26:1288-302.
19. Boyd BF. Nuevos adelantos permitirán realizar una facoemulsificación más efectiva. Highl Ophthalmol. 2002;30(2):19.
20. Hernández JR, Río M, Ramos M, Curbelo L, Capote A, Pérez E. Técnica de extracción extracapsular del cristalino por túnel córneo-escleral en el Instituto Cubano de Oftalmología "Ramón Pando Ferrer", años 1999-2006. Rev Cubana Oftalmol. 2006;19(1):225-29.
21. Lucio Buratto MD. Phacoemulsification. Principles and Techniques. Roma: Slakt; 2003.
22. Koch DD, Kohnen T, Obstbaum SA, Rosen ES. Format for reporting refractive surgical data [editorial]. J Cataract Refract Surg. 2006;24:285-7.
23. Singer HW. For accuracy, compare preoperatory BCVA with postUCVA. Ocul Surg News Internat. 2005;8(4):52.
24. Peña García L. Apuntes de Oftalmología. Arch Soc Esp Oftalmol. 2005;70:333-4.
25. Fernández L. Clear Lens extraction for the correction of high myopia. Ophthalmology. 2003;110:2349-54.
26. Cristóbal A, Faus F, Mínguez E, Mateo A: Bases del astigmatismo. En: Cristóbal JA: Corrección del astigmatismo Editorial MacLine; 2006. p. 33-40.
27. Felipe Ooyons EM. EECC transparente en pacientes miopes [Tesis de grado]. La Habana: Hospital Docente "Ramón Pando Ferrer"; 1992.
28. Castiella JC, Pastor JC. La refracción en el niño. Madrid: Mc Graw Hill lnteramericana; 1997. p. 25.
29. Colin J, Robinet A, Cochener B. Retinal detachment after clear lens extraction for high myopia: seven year follow-up. Ophthalmology. 2000;106:2281-4.
30. Lyle WA. Phacoemulsification with intraocular lens implantation in high myopia. J Cataract Refract Surg. 2001;22:238-42.
31. Borges Pérez. Extracción extracapsular del cristalino transparente en pacientes con alta miopía. Rev Cubana Oftalmol. 2003;16(2):220.
32. Zaldívar R, Davidorf JM, Oscherow S. Posterior chamber phakic intraocular lens for myopia of -8 to -19 D. J Refract Surg. 2001;14:294-305.
33. Jiménez-Alfaro I, Miguelez S, Bueno JL, Puy P. Clear lens extraction and implantation of negative-power posterior chamber intraocular lenses to correct extreme myopia. J Cataract Refract Surg. 2008;24(10):1310-6.
34. Güell JL. Phacoemulsification of the crystalline lens and implantation of an intraocular lens for the correction of moderate and high myopia: four-year follow-up. J Cataract Refract Surg. 2003;29:34-8.
35. Iribarne Y, Ortega Usobiaga J, Sedó S, Fossas M, Martínez Lehmann P, Vendrell C. Cálculo del poder dióptrico de lentes intraoculares. Ann Oftalmol. 2003;11(3):152-65.
36. Orts Vila P, Devesa Torregrosa P, Tañá Rivero P. Estudio comparativo entre la interferometría de coherencia parcial y la biometría ultrasónica para el cálculo de la lente intraocular. Microcir Ocul. 2001;24(3):251-62.
37. Assetto V, Benedetti V, Pesando P. Gollamer intraocular contact lens to correct high myopia. J Cataract Refract Surg. 2004;22:551-6.
38. Rosen E, Core G. Staar Collamer posterior chamber phakic intraocular lens to correct myopia and hyperopia. Cataract Refract Surg. 2003;24:596-606.
39. Centurión V, Nicoli C, Villar-Kury J. El libro del Cristalino las Américas. Livraria Santos; 2007. p. 585-96.
40. Hernández Silva J. Facoemulsificación y queratometría astigmática. Rev Cubana Oftalmol. 2007 [citado 22 de marzo de 2016];20(2). Disponible en: http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S0864-21762007000200008&lng=es
41. Ibáñez Hernández MA, Ramos Espinoza K. Astigmatismo inducido en facoemulsificación con incisiones de 3,0 mm ampliadas a 3,75 mm. Rev Mex Oftalmol. 2004;78(5):245-9.
42. Hayashi K, Hayashi H, Nakao F, Hayashi F. In vivo quantitative, measurement of posterior capsule opacification after extracapsular cataract surgery. Am J Ophthalmol. 2000;126(6):837-4.
43. Nakashima Y, Yoshitomi F, Oshika T. Regression of Elsching pearls on the posterior capsule in a pseudophakic eye. Arch Ophthalmol. 2002;120:397-8.
44. Heier JS, Topping TM. Ketorolac versus prednisolone versus combination therapy in the treatment of acute pseudophakic cystoid macular edema. Ophthalmology. 2000;107:2034-8.
45. Martidis A, Duker JS. Intravitreal triamcinolone for refractory cystoid macular edema secondary to birdshot retinochoroidopathy. Arch Ophthalmol. 2001;119:1380-3.
46. Arntz A, Arango M, Durán JA. Corrección de la alta miopía con lentes de fijación en el iris. Resultados visuales y refractivos. Madrid: Arch Soc Esp Oftalmol. 2003;78(5):220.
47. Javitt JC. Extracción del cristalino transparente en la miopía alta. Arch Ophthalmol Ed Esp. 2009;5:203-4.
48. Nazmiye E, Ahmet O, Seghan T, Nilgün Y, Sumuru Y. Treatment of intracameral firbrinous membranes with tissue plasmnogne activator. Ophthal Surg Las Imag. 2003;34:451-6.
Recibido: 9 de junio de 2015.
Aprobado: 21 de diciembre de 2015.
Lizet Sánchez Acosta. Instituto Cubano de Oftalmología "Ramón Pando Ferrer". Ave. 76 No. 3104 entre 31 y 41 Marianao, La Habana, Cuba. Correo electrónico: michguerra@infomed.sld.cu