Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Oftalmología
versión On-line ISSN 1561-3070
Rev Cubana Oftalmol vol.29 no.2 Ciudad de la Habana abr.-jun. 2016
REVISIÓN
Aplicaciones de la toxina botulínica en afecciones palpebrales
Uses of botulinum toxin in eyelid diseases
Irene Rojas-Rondón,I Jarleis Llamas-Meriño,II Lázara Ramírez-García,I Clara Gómez-Cabrera,I Gustavo Rodríguez Salinas,I Nelsy Álvarez MesaIII
I Instituto Cubano de Oftalmología "Ramón Pando Ferrer". La Habana, Cuba.
II Hospital Clínico Quirúrgico de Holguín, Cuba.
III Hospital Docente Clínico quirúrgico "Joaquín Albarrán". La Habana, Cuba.
RESUMEN
La toxina botulínica es un potente inhibidor neuromuscular altamente específico que produce una denervación química al bloquear la liberación de acetilcolina en la placa motora. Es sintetizada por Clostridium botulinum. Es un fármaco de alto valor terapéutico en las alteraciones de los anexos oculares; puede indicarse con muy buenos resultados en afecciones como el blefarospasmo primario, el espasmo hemifacial, el chalazión, el entropion espasmódico, la retracción palpebral, la ptosis de la ceja, la mioquimia palpebral y en el tratamiento de líneas de expresión facial, con muy buenos resultados estéticos. Se realizó una búsqueda bibliográfica y en Internet utilizando distintas bases de datos como Medline, Google, Bireme, PubMed.gov, así como artículos relevantes de la Academia americana de Oftalmología y Neurología con el objetivo de describir las aplicaciones de la neurotóxica botulínica en las afecciones de los anexos oculares.
Palabras clave: toxina botulínica; distonías focales; blefarospasmo.
Botulinum toxin is a highly specific potent neuromuscular inhibitor that produces a chemical denervation when blocking the release of acetylcholine in the motor plaque. It is synthesized by clostridium botulinum. It is a drug with high therapeutic value to treat ocular adnexas and may be indicated for primary blepharospasm, hemifacial spasm, chalazion, spasmodic entropion, palpebral retraction, eye brow ptosis, palpebral myokymia and in treating expression lines of the face, all with very good esthetic results. Literature search was made in Internet by using databases such as Medline, Google, Bireme, PubMed.gov, as well as outstanding articles of the American Academy of Ophthalmology and Neurology with the objective of describing the uses of botulinum toxin for ocular adnexa diseases.
Key words: botulinum toxin; focal dystonias; blepharospasm.
INTRODUCCIÓN
La toxina botulínica (TB) es un potente inhibidor neuromuscular altamente específico que produce una denervación química al bloquear la liberación de acetilcolina en la placa motora. Es sintetizada por Clostridium botulinum. 1-2 Existen ocho serotipos diferentes de toxina botulínica (A, B, C1, C2, D, E, F y G),1-4 que varían en estructura química y tamaño.3-4 Los tipos A, B, E y F son los principales serotipos que afectan a los seres humanos.5 Los estudios sobre esta toxina se remontan desde 1820 con las investigaciones realizadas por Justinus Kerner acerca de los envenenamientos por salsas elaboradas con carnes producidas en el reino alemán de Wunterburg. En 1870 Muller acuñó el término de botulismo (del latin botulus: embutido); publicó extensos trabajos sobre el tema y registró hasta 400 casos entre 1793 y 1853. Todos los pacientes experimentaban los mismos síntomas en las siguientes 24 horas tras la ingesta de los alimentos contaminados: diplopia, ptosis, afonía, disfagia, incluso asfixia y la muerte en una décima parte de los enfermos.6
Desde que se aisló por primera vez el Clostridium botulinum y desde su primera aplicación clínica por Scott en 1977, el uso de la toxina botulínica se ha acrecentado en la medicina.5 En 1973, Alan Scott comenzó a utilizar toxina botulínica tipo A en el tratamiento del estrabismo, al principio en primates y en 1980 en humanos. También describió su uso en la miopatía orbital endocrina y en la parálisis del recto lateral. En 1984, Frueh describió el uso de la toxina A en el blefarospasmo. En años subsiguientes las inyecciones de toxina se transformaron en el tratamiento de primera línea para el blefarospasmo con resultados de mejoría espectacular en más del 80 % de pacientes inyectados. Entre 1986 y 1991, Tsui,7 Jankovic,8 Kranz9 y Cliff10 realizaron varios estudios, doblemente ciegos con control de placebo, centrados en la toxina A para las distonías cervicales. Más adelante, se estudió su uso en las distonías oromandibular, laríngea y de miembros, y se confirmó su utilidad, particularmente para la distonía mandibular de cierre, la distonía laríngea en aducción y el calambre del escritor.
Posee una fracción neurotóxica consistente en una proteína con un peso molecular de aproximadamente 900 000 daltons.11,12 El tipo A fue la primera aislada y purificada y es la más frecuentemente usada en la clínica por varias razones: disponibilidad, aspecto inmunológico, seguridad y eficacia. Su mecanismo de actuación es bloquear la liberación de acetilcolina a nivel de las terminaciones nerviosas colinérgicas periféricas por escindir del complejo SNAP-25, proteína necesaria para la fijación y la liberación de acetilcolina de las vesículas situadas en las terminaciones nerviosas.13,14
El mecanismo de acción consiste en la disociación casi instantáneamente del complejo tóxico bajo condiciones fisiológicas. La serotipo A bloquea diferentes proteínas del complejo dentro de las terminaciones nerviosas colinérgicas; produce un bloqueo de las sinapsis neuromusculares y autonómicas colinérgicas e inhibe la fusión del factor sensitivo a su proteína receptora en la placa neuromuscular. La mayor acción bloqueadora la tiene la neurotoxina A, seguida por los tipos B, F y E. Pero —aunque se produzca una denervación química localizada— el músculo químicamente denervado y atrofiado desarrolla uniones adicionales a receptores de acetilcolina, así que el nervio puede crecer y reinervar el músculo, por lo que se considera un proceso reversible con una restructuración de nuevos terminales axonales, lo que resulta en el restablecimiento de la transmisión neuromuscular.12 El inicio del efecto tiene lugar entre las 6-36 horas tras la inyección; la debilidad muscular inicia entre las 48 y 72 horas posteriores a la inyección, y logra su efecto máximo entre los 5 y los 14 días. La recuperación de la parálisis ocurre aproximadamente a los 90 días posaplicación y se necesita una reaplicación a los cuatro a seis meses para mantener el efecto clínico. Esto es una vez que se han formado nuevas uniones neuromusculares.
Las indicaciones médicas incluyen todas aquellas patologías que resultan de la hiperfunción muscular y la disfunción autonómica como: blefarospasmo esencial, espasmo hemifacial, síndrome de Meige, mioquimia palpebral, retracción palpebral, entropión espasmódico, bloqueo de la glándula lagrimal, ptosis y asimetría de las cejas. También como procedimiento médico se logra tarsorrafia farmacológica para la protección corneal5,6 y actualmente se invoca en el tratamiento del chalazion. En abril del año 2002 la FDA aprobó la utilización de la toxina botulínica A para el tratamiento cosmético de la zona glabelar14 y desde esa fecha se extendieron las aplicaciones estéticas faciales, sobre todo para el tercio superior, y recientemente en el tercio medio e inferior de la cara (líneas de conejo, pliegues nasolabiales, labio superior y mentón); también está indicada en la parálisis del VI par.15,16 Como fármaco ha demostrado que es seguro. En general, los efectos adversos son pocos frecuentes, leves y pasajeros. Hasta la fecha no se han descrito efectos clínicos irreversibles.6 Sin embargo, se reportan los siguientes efectos adversos:
1) Por uso excesivo o técnica inapropiada: elevación excesiva de la cola de la ceja, ptosis de la ceja y del párpado superior, respuesta exagerada o no respuesta del músculo tratado, así como asimetría facial. Estos efectos pueden ser minimizados con la monitorización de la dosis apropiada y el limitar el uso del fármaco a practicantes bien entrenados en la técnica de administración.
2) Por migración de la toxina: diseminación local a grupo adyacente de músculos, sistemas secretores y sensitivos. Propagación sistémica a órganos y sistemas distantes distribuida por vía vascular o linfática, que tiene efecto en otros músculos ''no blanco'' (lagrimeo persistente después del tratamiento, aunque es raro; cefalea y la diplopía muy raras. Esta última se produce por difusión de la TB a los músculos propios del movimiento de los ojos.17,18
3) Propias de la inyección: dolor, inflamación, sangrado en el sitio de la inyección, equimosis (por lo general, por inyecciones demasiado profundas o equivocada elección de los puntos de inyección de vasos importantes) y/o picor en el área tratada.
Dentro de las contraindicaciones absolutas se plantean: hipersensibilidad conocida a los componentes de la fórmula, así como infección en áreas de la inyección. Las relativas: enfermedad neuromuscular, síndrome de Eaton Lambert, esclerosis lateral amiotrófica, miopatías, neuropatías motoras periféricas, miastenia gravis, aneurismas, falla cardíaca, renal o hepática, tumores cerebropontino, desórdenes mentales con deficiencia intelectual, cáncer, ingesta de fármacos que afectan el tono muscular o el sistema nervioso autónomo, enfermedades inflamatorias de la piel como psoriasis, dermatitis de contacto, eczemas,6 embarazo, lactancia, uso de aminoglucósidos, drogas con actividad neuromuscular como lincosamidas, polimixinas, succinilcolina, sulfato de magnesio, inhibidores de la colinesterasa, bloqueantes despolarizantes similares al curare, tetraciclinas, relajantes musculares penicilamina, quinina y bloqueadores de los canales del calcio, ya que estos pueden potenciar sus efectos.20,21
La toxina botulínica tipo A tiene diferentes nombres comerciales dependiendo de los laboratorios que la produzcan. Botox es producida por Allergan, pioneros en su uso. La versión destinada a la estética se llama Vistabel. Para uso médico igualmente existen otros dos tipos de toxina botulínica: dysport, de los laboratorios Ipsen, y xeomin, de los laboratorios Merz, disponible en Alemania desde julio del 2005. En comparación con los preparados convencionales, xeomin consiste en una neurotóxica monómera con un peso molecular de 150 KD, y presenta una actividad biológica específica mayor. De esta manera, contribuye a un importante desarrollo en la terapia con TB, y permite la aplicación de inyecciones de dosis elevadas, series de inyecciones con intervalos reducidos, así como inyecciones de refuerzo para optimizar la dosis inicial. Estos competidores también han lanzado sus toxinas para usos estéticos:19-21 azzalure, de Ipsen, lanzada al mercado en 2010, y bocoture, de los laboratorios Merz, en enero de 2011. Quizás de las tres, la que mayor diferencia haya marcado sea la última en llegar. La toxina B, destinada al uso médico, se nombra myobloc en Estados Unidos y neurobloc en el resto del mundo.22
En cuanto al almacenamiento, transporte y preparación, es relativamente lábil al calor y es completamente inactivada a 100 ºC durante unos 10 minutos. Sin embargo, no es inactivada ni por la acidez de las secreciones gástricas ni por las enzimas proteolíticas del estómago y del duodeno. Para su almacenamiento se recomienda conservar el vial de botox en frigorífico (2 oC a 8 oC) o en congelador (-5 oC o menos) hasta su uso; esta demostrado que no existen cambios en cuanto a la eficacia o duración de los efectos si se almacena en frigorífico o en congelador. El vial de dysport debe conservarse en frigorífico. Por el contrario, xeomin no necesita frío para su conservación y esto es una auténtica novedad, ya que esta TB no lleva complejos proteínicos, aunque el laboratorio fabricante recomienda en su ficha descriptiva que la temperatura no debe sobrepasar los 25 oC, lo que debería tenerse en cuenta durante su empleo en la época estival. El transporte es muy importante; debe realizarse sin perder la cadena de frío para aquellas TB que lo necesitan, como botox y dysport. Se ha dado el caso de pérdida de eficacia tras un transporte inadecuado.23 Por el contrario, xeomin, sin reconstituir, tiene una vida de 36 meses a temperatura ambiente.
La reconstitución de la TB se realiza diluyendo el vial con solución salina. La medida a utilizar para la dilución depende del área a tratar y los efectos que se quiera lograr, teniendo en cuenta que a mayor dilución mayor diseminación, existe una mayor penetración a los tejidos. No hay unanimidad en el tiempo que debe mediar entre la reconstitución y la aplicación, aunque con botox y dysport se recomienda que no pasen más de 4 a 6 horas.23 Con xeomin, el laboratorio indica que la solución reconstituida puede conservarse en frigorífico entre 2 oC a 8 oC, durante 24 horas, sin sufrir alteraciones.
PROCEDIMIENTO INDICADO POR BIOSEGURIDAD
Para desechar los residuos, los viales sin usar deberán reconstituirse con una cantidad pequeña de agua y después esterilizarse bajo presión alta (autoclave). Como alternativa se enviará a incinerar. Los viales y jeringas usadas, así como los derrames ocurridos, deberán esterilizarse bajo presión alta. Como alternativa se enviarán a incinerar y los residuos de toxina deberán inactivarse usando solución diluida de hidróxido de sodio.4-6,14 Teniendo en cuenta la eficacia y la seguridad de este medicamento, nos dedicamos a realizar este trabajo de actualización o revisión bibliográfica con el objetivo de profundizar en las aplicaciones de la neurotóxica en las afecciones de los anexos oculares. Para la confección de este trabajo se realizó una estrategia de búsqueda bibliográfica y a través de Internet, utilizando distintas bases de datos como Medline, Google, Bireme, PubMed.gov.
APLICACIONES DE LA TOXINA BOTULÍNICA EN LAS AFECCIONES ANEXIALES
BLEFAROSPASMO
El blefarospasmo esencial es una distonía craneal focal bilateral, involuntaria, de presentación variable, de evolución progresiva y de etiología desconocida. Se caracteriza por contracciones espasmódicas, fuertes e involuntarias de los músculos orbiculares del ojo (pretarsal, preseptal y periorbital). Los síntomas suelen iniciarse en la quinta y sexta décadas de la vida y es tres veces más frecuente en mujeres. Puede adoptar aspectos clínicos diferentes: desde un parpadeo espontáneo frecuente, y muchas veces enérgico y prolongado, hasta contracciones clónicas o tónicas de los párpados de intensidad y duración variable, o una mezcla de todos ellos.
Generalmente, la morfología clínica se relaciona con el tiempo de evolución y con la intensidad del proceso.24 En un estadio bien desarrollado de la enfermedad, se puede observar una contracción fluctuante más o menos permanente de la musculatura orbicular de los párpados, que provoca un descenso de las cejas por debajo del borde superior de las órbitas, conocido como signo de Charcot. Se puede acompañar frecuentemente por movimientos distónicos de las cejas y de los músculos paranasales, faciales, masticatorios, labiales, linguales, orales, faríngeos, laríngeos y cervicales. Cuando se asocia con distonía oromandibular, se le conoce como síndrome de Meige.
Se clasifica como primario cuando se presenta como una distonía focal aislada, o en conjunto con otras distonías focales como el síndrome de Meige. Secundario a afecciones oculares como: síndrome de ojo seco, triquiasis, afecciones corneales, entre otras, así como en distonías de condición neurológica como la enfermedad de Parkinson y los tics nerviosos.11,25 Este tipo de distonía impacta negativamente sobre la calidad de vida de los pacientes, ya que eventualmente los pacientes tienen dificultades para leer, ver televisión, conducir un automóvil y realizar otras tareas diarias que dependen de la visión normal y que pueden provocar el cierre completo de los párpados. Un 15 % de estos pacientes pueden presentar ceguera funcional.11,26,27
Existen factores desencadenantes como el estrés, la luz, la lectura, la fatiga, la cafeína o algunos estímulos motores, que condicionan una fluctuación del cuadro. Es común que los pacientes refieran trucos con los que pueden controlar, al menos parcialmente, el problema para abrir los ojos. Inicialmente su curso es fluctuante y luego de dos a tres años se estabiliza.27 Es importante diferenciarla de otras enfermedades a través de una evaluación oftalmológica, como el espasmo hemifacial, la blefarocolisis, la mioquimia palpebral y los tics nerviosos. También hay que descartar la presencia de una patología corneal, el glaucoma u ojo seco.27,28
Entre las opciones de tratamiento se encuentran los colirios para las molestias oculares, los espejuelos, los medicamentos orales (clonazepam, dopamina), la cirugìa (miectomía) y la toxina botulínica, que se ha convertido en el tratamiento de elección del blefarospasmo. Ya en 1988 existían 12 series terapéuticas abiertas y dos de doble-ciego, que demostraron dicha utilidad. En el caso de blefarospasmo, la eficacia supera el 90 %. El intervalo entre dosis es de 3-4 meses. Los métodos de inyección pueden variar de un autor a otro. Jankovic25 utilizó 6,25 unidades por sitio inyectado por vía subcutánea, medial y lateralmente en cada párpado (25 unidades por ojo). Tsai21 utilizó 2,5-5 unidades (en volúmenes de 0,1 cc) en cada uno de los siguientes sitios de cada párpado: las áreas extremas mediales y laterales del párpado superior (área preseptal del orbicular de los ojos) y en las áreas laterales y centrales de los párpados inferiores.
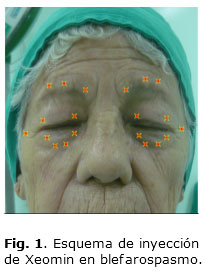
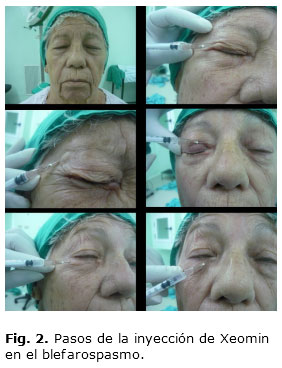
De forma general, la técnica a aplicar es: inyectar en las partes medial y lateral del músculo orbicular del ojo, en el párpado superior y en la región lateral del músculo orbicular del ojo del párpado inferior (Fig. 1 y 2). También pueden inyectarse otros lugares de la región de la ceja, del músculo orbicular y de la región superior de la cara. La dosis inicial recomendada es de 1,25 a 2,5 unidades (0,05 a 0,1 mL) en cada punto de inyección y no deberá ser superior a 25 unidades en cada ojo. La dosificación total no deberá sobrepasar 100 unidades en 12 semanas. Pueden administrarse inyecciones adicionales en el músculo procerus y en otros músculos faciales según el paciente. Aun cuando existan casos que necesiten más de 25 unidades por ojo es dudoso que se obtenga beneficio adicional más allá de 50-75 unidades por ojo.5,28 Los efectos colaterales más frecuentes en estos estudios incluyen la ptosis palpebral (32,3 % en todas las complicaciones), con una incidencia de 10-40 %. Jankovic comunicó ptosis en tan solo un 2,9 %25 de las inyecciones palpebrales, y Dutton en un 7,3 % de todos los tratamientos.
En el estudio realizado por Echeverría y otros se demostró que la dosis de este fármaco en pacientes con blefaroespasmo puede ser completamente diferente. Realizaron una disminución leve pero significativa de la dosis a aplicar a lo largo de un período no lineal. Observaron que el decremento durante los primeros cuatro años y la estabilización posterior mantenían el efecto del fármaco. Ninguno de los pacientes con blefaroespasmo de esta serie desarrolló resistencia significativa a la TBA.29 Estos datos también concuerdan con los de Hsiung y otros,30 quienes aplicaron una disminución de la dosis inicial, del primer al segundo y cuarto años. Esta disminución, que inicialmente explicaron como un afinamiento o ajuste en la dosis mínima necesaria para impedir efectos secundarios, les permitió concluir que no es necesario el mantenimiento de la dosis inicial para conservar los efectos de la toxina.
ESPASMO HEMIFACIAL
Se caracteriza por contracciones repentinas involuntarias, unilaterales y sincrónicas de los músculos inervados por el nervio facial. Dichas contracciones pueden amainar inmediatamente o persistir como una contracción tónica de varios segundos de duración; pueden ocurrir varias veces al día. Las contracciones de los músculos faciales suelen comenzar alrededor del ojo; progresan y avanzan lentamente hacia la parte inferior de la cara incluyendo la musculatura de la mejilla, la boca y la cara, pero siempre unilateral. En muy raras ocasiones se presenta de forma bilateral y asincrónico, y cuando esto ocurre se debe corroborar no estén concomitando con blefarospasmo. Estas persisten durante el sueño. La causa en estos casos puede ser una malformación de las arterias del cuello y por compresión del nervio facial, por lo que puede ser necesaria la evaluación por un neurólogo y con angiorresonancia.
El tratamiento de elección para esta distonía es la TB. Similar al blefarospasmo, la dosis a aplicar es 0,05 a 0,1 mL (5 a 10 U ) de botox por cada punto de inyección, bloqueando todos los músculos afectados. Generalmente se inyecta el músculo orbicular pretarsal del párpado superior, el orbicular pretarsal, preseptal y periorbital del párpado inferior y la región supraciliar. El resto de la musculatura depende de cada paciente individualmente. Aunque no tienen una cura definitiva, el tratamiento de estas personas les devuelve temporalmente una vida normal. Después de 5 a 10 días posteriores al tratamiento comienza a evidenciarse la disminución de los movimientos anormales.5
MIOQUIMIA PALPEBRAL
Es el temblor involuntario y espontáneo, por lo general en el párpado inferior, y es una alteración frecuente pero benigna, cuya mayor incidencia se presenta en adultos jóvenes, aunque prácticamente la totalidad de la población, al margen de la edad, ha presentado o presentará en algún momento de su vida este síntoma.
El experto oftalmólogo del Instituto Mexicano del Seguro Social en Jalisco, Adrián Beltrán Martínez, señaló al respecto que se ha establecido una correlación entre la mioquimia palpebral y el consumo excesivo de café y bebidas con cafeína, como los energizantes. El galeno Mukai añadió, asimismo, otras causas tales como el no dormir lo suficiente y padecer estrés de manera continua y prolongada, que llegan a detonar este síntoma, el cual en la mayoría de los casos tiende a desaparecer en un promedio de tres semanas.18 Se recomienda reducir la ingesta de cafeína, dormir un promedio de seis a ocho horas diarias, no tomar bebidas energizantes y procurar la práctica de alguna actividad física periódica que contribuya a bajar el estrés, que son factores que contribuyen a aminorar el riesgo de presentar temblores en los párpados.
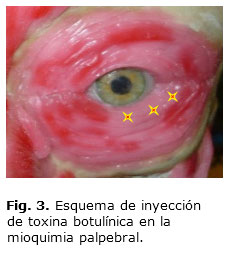
La toxina botulínica también ha dado excelentes resultados en esta patología. Su aplicación produce un bloqueo neuromuscular del orbicular pretarsal inferior, en las zonas medial y lateral, que es donde aparece con mayor frecuencia esta entidad, al aplicar 2 a 3 inyecciones subcutáneo, de 2,5 U de botox. Generalmente es necesaria una sola dosis, siempre que la causa sea eliminada5 (Fig. 3).
ENTROPION ESPASMÓDICO
Es una malposición palpebral responsable de la aparición de conjuntivitis crónicas, queratitis y úlceras corneales, todo esto provocado por el roce de las pestañas con la superficie conjuntival y corneal. Esta entidad se caracteriza por un espasmo del músculo orbicular que aparece tras una irritación ocular o un blefaroespasmo esencial y desaparece al eliminar la causa. Su tratamiento consistía en la corrección quirúrgica; con el advenimiento de la toxina botulínica, los pacientes que no podían recibir tratamiento quirúrgico se vieron favorecidos. Fue demostrado por Winterhoff en su investigación que la TBA es efectiva para el entropión espasmódico.5,32 Otros autores5,31 confirmaron su gran utilidad en el entropión senil y congénito.
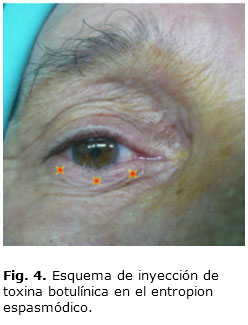
La toxina reconstituida se inyecta por vía subcutánea, encima del músculo orbicular aproximadamente 3-4 mm debajo del margen de la pestaña del párpado inferior, en tres sitios (Fig. 4), con una aguja 30 en una jeringuilla de 1 mL y la dosis utilizada de 5 U botox por punto de inyección. La mayoría de los estudios evalúan a sus pacientes, diario durante una semana, y quincenal durante 6 meses.5
PTOSIS DE LA CEJA
Es el resultado de la migración inferior de la ceja por debajo de su posición natural a nivel del reborde supraorbitario. Causa una apariencia cansada y un pliegue cutáneo del párpado superior aumentado; suele ser más notable a nivel lateral. La valoración del paciente con ptosis de cejas es crucial, especialmente cuando estamos considerando una blefaroplastia, la cual podría empeorar la ptosis de ceja preexistente y produciría una apariencia más cansada y enojada.6,17,18
El tratamiento de los depresores mediales y laterales de la ceja con toxina botulínica tipo A es un procedimiento de mínima invasión para elevar las cejas. Se requiere poco o nulo tiempo para recuperarse del tratamiento; sin embargo, se recomienda que esta técnica de aplicación se utilice solo en el sexo femenino, ya que la elevación de la cola de la ceja puede dar a los pacientes masculinos una apariencia femenina. Esta técnica produce además reducción de las líneas faciales en las áreas glabelar, frontal y periocular, con lo cual se le da una apariencia más natural a la expresión de los pacientes tratados. La técnica a aplicar es la siguiente: se administra la toxina reconstituida con una jeringa de insulina con graduación de 50 X 0,01 mL. Se aplican 20 unidades de toxina botulínica tipo A en la porción superolateral del músculo orbicular de los ojos; 20 a 30 unidades de botox en las áreas glabelar y de la supraceja interna y 10 a 15 unidades de botox en el área de la frente. La aguja se introduce perpendicularmente en la piel hasta la capa muscular.33
Carruthers A y Carruthers J, para evaluar la evolución del tratamiento con toxina botulínica en el área glabelar, utilizaron un recurso donde trazaron una línea en la carúncula para medir la altura de las cejas en mm y en seis puntos de cada fotografía tomada en cada consulta de los pacientes: a) canto externo (15 mm desde la línea pupilar media), b) línea pupilar media, y c) canto interno, con elevación total de la ceja y pico máximo a las 12 semanas. Las cejas permanecieron elevadas hasta 20 semanas después del tratamiento, lo que indica que la elevación completa de las cejas ocurre después de que la toxina botulínica se difunde en la región frontal.3
ASIMETRÍA DE LAS CEJAS
Es muy común, aunque no siempre es percibida por el propio paciente. El objetivo será elevar la ceja más baja. También es un excelente tratamiento complementario a la cirugía si tras la intervención se produjera alguna asimetría. La técnica a aplicar sería la misma empleada en la ptosis de la ceja, siempre que la ceja alta esté bien situada anatómica y estéticamente.
RETRACCIÓN PALPEBRAL
La retracción palpebral se observa en el 90 % de los pacientes con orbitopatía tiroidea. Es el signo más común, tanto en el estadio congestivo agudo como en el crónico o fibrótico. Estos pacientes tienen lagrimeo y fotofobia, relacionados con la queratitis por exposición, que puede llegar a la ulceración y perforación de la córnea en los casos más severos. Ocurre por la hipertonía simpática del músculo de Müller y posteriormente se suman otros mecanismos fisiopatogénicos, como la hiperfunción del complejo recto superior-elevador del párpado superior, secundario a la fibrosis del recto inferior y las adherencias del elevador del párpado superior al músculo orbicular y al septum orbitario.5,34
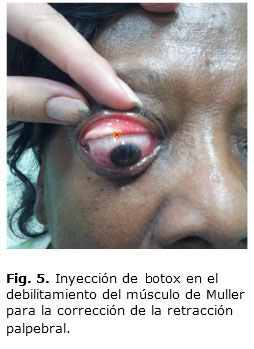
La toxina aplicada se difunde desde el sitio de inyección subcutánea o subconjuntival, hacia el músculo elevador del párpado superior, y causa una parálisis flácida temporal por un período de 4 a 6 meses.35,36 Las dosis recomendadas para la corrección de la retracción ligera y moderada es 5 U (0,1 mL), por vía subcutánea, en la porción central del párpado superior, a 5 mm del borde adherente del tarso, y en el mismo sitio se le aplica 6 U, que puede llegar hasta 15 U (0,12 mL a 0,3 mL) en la severa.5,36 También se realiza el bloqueo del músculo de Muller al evertir el párpado e inyectar subconjuntivalmente en el centro y borde superior del tarso (Fig. 5).
Muchos estudios plantean los resultados satisfactorios que se han obtenido con la TBA, en la corrección de la retracción palpebral y la importancia de este medicamento, como una alternativa terapéutica actual para la retracción palpebral secundaria a la orbitopatía tiroidea, en el período congestivo y durante el hipertiroidismo, en situaciones en las que se contraindica la cirugía y donde las opciones terapéuticas son escasas, sobre todo para los casos más severos.37-39 El estudio realizado por Cáceres38 evaluó los resultados del tratamiento de la retracción con toxina botulínica A, y lo comparó con los obtenidos por medio de la cirugía, en casos con la misma severidad clínica de la retracción. Resultó que la TBA es una alternativa terapéutica para la retracción palpebral ligera y moderada en el período congestivo de la orbitopatía tiroidea.
EL CHALAZIÓN Y EL BLOQUEO DE LA GLÁNDULA LAGRIMAL
El empleo de la toxina botulínica en esta patología está explicado por un posible bloqueo que se realiza a la inervación de la glándula afectada, lo que provocaría una disminución de la producción de estas. Otros de los mecanismos que se invocan es la denervación de las células musculares encargadas en la compresión fisiológica de las glándulas para la siguiente liberación de su contenido. Todas estas hipótesis aún no están bien justificadas con estudios científicos; son pocos los encontrados y muchas las críticas recibidas.
Existen estudios que indican que las glándulas de meibomio son parcialmente inervadas y están controladas por vías colinérgicas parasimpáticas, lo que podría constituir un mecanismo para la disminución de secreción glandular y, por lo tanto, para la resolución del chalazión. El bloqueo que se le realiza a la glándula lagrimal consiste en la aplicación individualizada de 2,5 U hasta 20 U de botox en la propia glándula. Este tratamiento es practicado en pacientes con lagrimeo profuso por exceso de producción, pacientes con buena calidad y cantidad de la película lagrimal y con obstrucción de la vía excretora y tenga contraindicado o no desee recibir tratamiento quirúrgico.5
LÍNEAS DE EXPRESIÓN PERIOCULAR
El proceso de envejecimiento altera el comportamiento de los músculos. La disminución de la agudeza visual, el exceso de piel en los párpados superiores y la ptosis de las cejas favorecen la contracción exagerada de los corrugadores y del músculo frontal respectivamente. Los músculos elevadores de la cara se vuelven progresivamente más débiles, y los depresores, por la disminución de la fuerza antagónica, comienzan a contraerse, lo que favorece el aspecto de cansancio y de tristeza.40,41 Por ser esta área la parte de la anatomía más expuesta al sol, no cabe duda de que la acción perniciosa de los rayos ultravioleta será uno de los factores que, de modo más notorio, influirá negativamente en el envejecimiento de la cara.6 A nivel bioquímico provoca exceso de radicales libres y, de modo visible, la aparición de manchas prematuras o queratosis actínicas, entre otras posibles neoplasias.6 Con el paso del tiempo la grasa subcutánea sufre atrofia y distrofia y el rostro pierde su textura con disminución de los volúmenes, con lo que la geometría plana invade la armonía de las formas juveniles. Las mejillas hundidas y caídas son características de la edad avanzada. Los músculos de la cara se insertan en la piel. Su contracción reiterada a lo largo de los años favorece la aparición de las llamadas arrugas hiperdinámicas. En la piel joven, las arrugas que aparecen con la contracción se recuperan sin dejar señales al relajarse los músculos. A medida que avanza la edad y junto al resto de los factores implicados, la impronta de las arrugas es también notable en reposo. A la pérdida de grasa subcutánea, la menor actividad fibroblástica y la disminución de las fibras de sostén de la dermis, se une la acción gravitatoria, que aumenta la flacidez y la caída de los tejidos blandos del rostro.5 En edades más avanzadas se produce la reabsorción del tejido óseo, que en los casos extremos conlleva una disminución notable del volumen facial.
Las mujeres y los hombres de todas las edades siempre han tenido especial interés de mantener la mirada y su entorno hermoso y de aspecto juvenil. Esta área constituye puntos focales de todo el rostro donde se sintetizan las emociones, los estados de ánimo y los signos del paso del tiempo. Gran número de procedimientos quirúrgicos se aplican con este fin (blefaroplastia, elevación de cejas con dispositivos reabsorbibles, cantopexia, lifting temporal endoscópico, corrección del surco de la ojera con reposición de bolsas grasas o con implantación de grasa o colocación de materiales protésicos).42 Sin embargo, tenemos pacientes que no ameritan procedimientos tan invasivos por ser muy jóvenes o bien por otras circunstancias, o que no desean o no pueden someterse a cirugía (miedo, contraindicación quirúrgica etc.).5
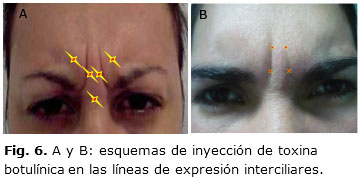
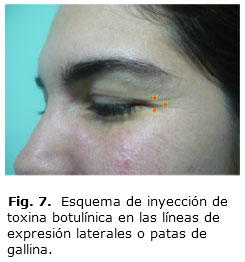
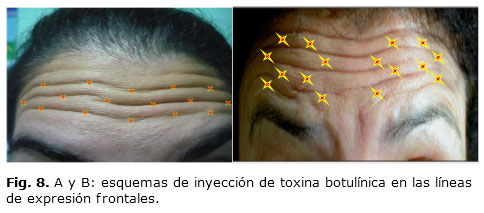
Con la toxina botulínica se logra atenuar y suavizar las arrugas dinámicas del tercio superior facial, pero igualmente permite la posibilidad de eliminar, modificar o mejorar las líneas interciliares, los pliegues de conejo y las patas de gallo, para proporcionar una mirada más viva, teniendo en cuenta siempre el concepto de relajación músculos agonistas–antagonistas. La dosis a aplicar será de 0,05 a 0,1 mL por cada punto de inyección (Fig. 6 y 7). Su corrección de los pliegues frontales es algo más compleja y requiere varias inyecciones a muy bajas dosis en el vientre de las arrugas o en el surco de las arrugas (1 o 0,5 U a intervalos de 1-2 cm)43 (Fig. 8).
TARSORRAFIA QUÍMICA
La tarsorrafia es un procedimento quirúrgico que consiste en la fusión del párpado superior con el inferior. Se trata de una técnica simple que puede ser aplicada sola o asociada a otras cirugías oculoplásticas para el tratamiento de numerosas afecciones como: lagoftalmo, parálisis facial, ectropion, entropion, proptosis, enfermedad tiroidea, entre otras. Esta técnica es comúnmente utilizada en el Servicio de Córnea como terapia coadyuvante en el tratamiento de los defectos corneales persistentes por los beneficios que aporta al evitar el parpadeo.
Con la toxina botulínica se paraliza al músculo elevador del párpado y disminuye el roce del párpado superior, especialmente de su borde libre, sobre el defecto corneal, que favorece la cicatrización.39 El uso de la neurotoxina para esta técnica evita el empleo de otras medidas que disminuyen este roce y que presentan desventajas ante este nuevo tratamiento. El uso de lentes de contacto terapéuticos se ha relacionado con un elevado riesgo de infección microbiana. En cuanto a la tarsorrafia quirúrgica produce alteraciones anatómicas del borde palpebral cuando es revertida, como entropión cicatrizal y distriquiasis, así como dificulta el seguimiento de la lesión.39 En la tarsorrafia química podemos inspeccionar perfectamente la córnea en la lámpara de hendidura mediante elevación manual del párpado superior, lo cual es una clara ventaja. Como técnica se inyectan vía subcutánea 1,5 mL de solución (7,5 U) en la zona medial y en la zona lateral del borde superior de la placa tarsal superior. Se utiliza jeringa de insulina y aguja de 30 g. La toxina botulínica es un fármaco de alto valor terapéutico en patologías de los anexos oculares. Además, constituye una alternativa de tratamiento para aquellos pacientes en los cuales el tratamiento quirúrgico está contraindicado.
Conflictos de intereses
No se declaran por los autores.
REFERENCIAS BIBLIOGRÁFICAS
1. De Maio M, Ofenböck I, Narvaes C. Toxina botulínica: relación entre tipo de paciente y duración del efecto. Cir Plást Iberolatinoam. 2008;34(1):19-24.
2. Bentivoglio AR, Fasano A, Ialongo T, Soleti F, Lo Fermo S, Albanese A. Outcome predictors, efficacy and safety of Botox and Dysport in the long-term treatment of hemifacial spasm. Eur J Neurol. 2009;16:392-8.
3. Carruthers A, Carruthers J. Eyebrow height after botulinum toxin type A to the glabellar. Dermatol Surg. 2007;33(Suppl.):26-31.
4. Brin MF. Basic and clinical aspects of BOTOX. Toxicon. 2009;54:676-82.
5. Garg A, Nassaralla BA, El-Toukhy E, Kaynak-Hekimhan P, Moreker S. Surgical and Medical Management of Pterygium. India: Jaypee Brothers Medical Publishers; 2009. p. 544-70.
6. Martínez GG, Álvarez LA. Toxina Botulínica. En: Toledano FN, Martínez GG, Prada SC, Sanz LA, Mendel JR, Blanco MG. Cirugía palpebral y periocular; 2009. p. 373-408.
7. Tsui JKC, Eisen A, Stoessl AJ, Calne S, Calne DB. Doubleblind study of botulinum toxin in spasmodic torticolis. Lancet. 1986;2:245-7.
8. Jankovic J, Shwartz K, Donovan DT. Botulinum toxin treatment of cranial-cervical dystonia, spsmodic dysphonia, other focal dystonias and hemifacial spasm. J Neurol Neurosurg Psychiatry. 1990;53:633-9.
9. Kranz G, Haubenberger D, Voller B, Psoch M, Schnider P, Auff E, Sycha T. Respective potencies of Botox and Dysport in a human skin model: a randomized, double-blind study. Mov Disord. 2009;24:231-6.
10. Cliff SH, Judodihardjo H, Eltringham E. Different formulations of botulinum toxin type A have different migration characteristics: a double-blind, randomized study. J Cosmet Dermatol. 2008;7:50-4.
11. Albert MD, Miller WJ, Azar TD, Blondi AB. Albert and Jakobiec's Principles and Practice of Ophthalmology. Philadelphia: Saunders Elsevier; 2008;2. p. 2135-40.
12. Alonso-Navarro H, Jiménez-Jiménez FJ, Plaza-Nieto JF, Pilo-de la Fuente B, Navacerrada F, Arroyo-Solera M, et al. Treatment of severe bruxism with botulinum toxin type A. Rev Neurol. 2011;53:73-6.
13. Kranz G, Haubenberger D, Voller B, Psoch M, Schnider P, Auff E, et al. Respective potencies of Botox and Dysport in a human skin model: a randomized, double-blind study. Mov Disord. 2009;24:231-6.
14. Lluis GC, Hernández MG. La toxina botulínica: de enemigo a aliado. Actualid Farmacol Terap. 2008;6(2):105-10.
15. Casado Sánchez C, Martínez Méndez JR. Disección anatómica de la musculatura mímica facial: revisión iconográfica de apoyo a los tratamientos complementarios en rejuvenecimiento facial. Madrid: Cir Plást Iberolatinoamer. 2011;7(1):91-7.
16. Alcolea JM. Actualización sobre aplicaciones de la toxina botulínica es estética facial. Madrid: Cir Plást Iberolatinoam. 2011;37(1):81-3.
17. Wenzel R, Jones D, Borrego A. Comparing two botulinum toxin type A formulations using manufacturers product summaries. J Clin Pharm Ther. 2007;32:387-402.
18. Mukai Y, Kaji R. Use of botulinum neurotoxin therapy. Brain Nerve. 2011;63:775-84.
19. Jewell ML, Monheit GD. An overview of clinical trial data on a new formulation of botulinum neurotoxin type A. Aesthet Surg J. 2009;29(Suppl.):31-3.
20. Monheit G, Cohen J, Reloxin Investigational Group. Long-term safety of repeated administrations of a new formulation of botulinum toxin type A in the treatment of glabellar lines: interim analysis from an open-label extension study. J Am Acad Dermatol. 2009;61:421-5.
21. Tsai CP, Chiu MC, Yen DJ, Guo YC, Y CL, Lee TC. Quantitative assessment of efficacy of dysport (botulinum toxin type A) in the treatment of Idiopathic blepharospasm and hemifacial spasm. Acta Neurol Taiwan. 2005;14:61-8.
22. Pikett A, Mewies M. Serious issues relating to the clinical use of unlicensed botulinum toxin products. J Am Acad Dermatol. 2009;61:149-50.
23. Klein AW. Dilution and storage of Botulinum Toxin. Dermatologic Surg. 1998;11(24):1179-87.
24. Monheit G, Carruthers A, Brandt F, Rand R. A randomized, double-blind, placebo-controlled study of botulinum toxin type A for the treatment of glabellar lines: determination of optimal dose. Dermatologic Surg. 2007;33(1):51.
25. Jankovic J, Leder S, Warner D, Schwartz K. Cervical dystonia: clinical findings and associated movement disorders. Neurology. 1991;41:1088-91.
26. Fahn S, Marsden CD, Calne DB. Dystonia: advances in neurology. New York: Raven Press; 2009.
27. Faucett DC. Essential blepharospasm. In: Yanoff M, Duker JS, eds. Ophthalmology. St. Louis: Mosby Elsevier; 2008. p. 43.
28. Yanoff M, Cameron D. Diseases of the visual system. In: Goldman L, Schafer AI, eds. Cecil Medicine. 24th ed. Philadelphia, Pa: Saunders Elsevier; 2011. p. 86.
29. Echeverría-Urabayen A, Fanjul S, Meseguer E, García-Ruiz Espiga PJ. Evolución de la dosis de toxina botulínica tipo A en distonías craneocervicales. Estudio comparativo a lo largo de ocho años. Rev Neurol. 2004;38:511-3.
30. Hsiung GYR, Das SK, Ranawaya BM, Lafontaine AL, Suchowersky O. Long-term efficacy of botulinum toxin A in treatment of various movement disorders over a 10-year period. Mov Disord. 2002;17:1288-93.
31. Winterhoff J, Köhler S, Laskawi R. Botulinumtoxintherapie beim spastischen Entropium. HNO. 2013;61(7):665-7.
32. Amarendra Deka SP, Saikia S. Botulinum toxin for lower lid entropion correction. India: Bawri Nethralaya. 2011;30(1):40-2.
33. Alcolea JM. Actualización sobre aplicaciones de la toxina botulínica es estética facial. Cir Plást Iberolatinoam. 2011;7(1):81-3.
34. Bartalena L, Tanda M. Graves' Ophthalmopathy. N Engl J Méd. 2009;360:994-1001.
35. Sasim IV, Berendschot TT, van Isterdael C, Mourits MP. Planning health care for patients with Graves' orbitopathy. Graefes Arch Clin Exp Ophthalmol. 2008;1315-21.
36. Costa PG, Saraiva FP, Pereira IC, Monteiro MLR, Matayoshi S. Comparative study of Botox injection treatment for upper eyelid retraction with 6-month follow-up in patients with thyroid eye disease in the congestive or fibrotic stage. Eye. 2008:165-7.
37. Goldberg RA. Advances in surgical rehabilitation in thyroid eye disease. Thyroid. 2008;18(9):989-95.
38. Cáceres TM, Márquez FM, Cáceres TO. Toxina botulínica "A" versus cirugía en la retracción palpebral de la orbitopatía tiroidea. Rev Cubana Oftalmol. 2011;23(2):241-8.
39. Ellis MF, Daniell M. An evaluation of the safety and efficacy of botulinum toxin type A (Botox) when used to produce a protective ptosis. Clin Exp Ophthalmol. 2001;29:394-9.
40. Flores M, Trelles MA. La técnica Face-up: lifting facial mini invasivo con hilos tensores". Cir Plást Iberolatinoam. 2008;34(1):27-39.
41. Trelles MA. Nuevas tecnologías en cirugía plástica-estética. Madrid: Cir Plást Iberolatinoam. 2012;38(3):15-8.
42. Sánchez FAV, Miquenes VX. Carta al director. Estrabismo y toxina botulínica. Arch Soc Esp Oftalmol. 2013;88(7):286-7.
43. Monheit G, Cohen J; Reloxin Investigational Group. Long-term safety of repeated administrations of a new formulation of botulinum toxin type A in the treatment of glabellar lines: interim analysis from an open-label extension study. J Am Acad Dermatol. 2009;61:421-5.
Recibido: 7 de enero de 1916.
Aprobado: 12 de enero de 1916.
Irene Rojas-Rondón. Instituto Cubano de Oftalmología "Ramón Pando Ferrer". Ave. 76 No. 3104 entre 31 y 41 Marianao, La Habana, Cuba. Correo electrónico: iroja@infomed.sld.cu