Introducción
El glaucoma es una neuropatía óptica caracterizada por la pérdida de células ganglionares de la retina (CGR) y sus axones.1 Por ser crónica y progresiva, resulta una causa importante de ceguera en todo el mundo. Por lo tanto, la detección oportuna y el monitoreo continuo es de vital importancia.
Tradicionalmente, el glaucoma se ha diagnosticado mediante la oftalmoscopia, la fotografía del disco óptico y las pruebas de función visual (FV). Sin embargo, estos métodos no reflejan el alcance exacto de la pérdida de CGR, ya que no existe una relación proporcional entre la pérdida de estos y la sensibilidad visual.1) Además, el cambio estructural clínicamente detectable puede preceder el inicio de la pérdida de FV hasta en 5 años.2) Un método preciso para medir la pérdida de CGR permitiría la detección temprana del glaucoma y el monitoreo de su progresión. La mácula ofrece una ventaja teórica sobre otras regiones a este respecto, dado que más del 50 % de todas las CGR están concentradas y dispuestas en capas múltiples en esta localización; además, los cuerpos ganglionares tienen de 10 a 20 veces el diámetro de sus axones, y sus medidas son menos variables que las relacionadas con la cabeza del nervio óptico (ONH) y la capa de fibras nerviosas de la retina (CFNR).1
La miopía es un factor de riesgo independiente para el glaucoma. Varios estudios basados en una gran población que utilizan diferentes definiciones de miopía alta, incluidos el Blue Eye Eye Study, el Beijing Eye Study y Los Angeles Latino Eye Study, han encontrado que los miopes tienen más probabilidades de tener glaucoma, y se observa una relación directamente proporcional con el grado de esta: mientras más elevada la miopía, más riesgo de glaucoma.3,4) El diagnóstico temprano y el manejo en tales pacientes es, por lo tanto, crucial.
El glaucoma afecta el complejo de células ganglionares (CCG) en todos sus componentes: cuerpos celulares, dendritas y axones. De ellos, el árbol dendrítico es el que primero se daña.1 Esta es la razón por la cual el grosor de la célula ganglionar (GCL) y la capa plexiforme interna (IPL) se pueden tener en cuenta como un predictor temprano de los cambios glaucomatosos, junto con el grosor de la CFNR.
En pacientes altamente miopes existe una variación del tamaño de la ONH, así como una variación estructural, dado por: copa poco profunda y grande, inclinación, deformación y palidez del disco, gran índice de ovalidad, media luna o atrofia peripapilar (PPA) e hipoplasia ocasional del disco óptico.3,4,5 En consecuencia, la medición del grosor peripapilar de CFNR es inexacta y, por lo general, es más delgada.5,6 Además, los cambios sutiles del disco óptico no pueden detectarse fácilmente mediante oftalmoscopia o fotografía de disco, por la variabilidad del tamaño y la forma de la ONH.6 Estudios recientes han demostrado que el grosor del CCG -que incluye las tres capas retinianas más internas: CFNR, GCL e IPL, medida mediante tomografía de coherencia óptica (SD-OCT)- ofrece una capacidad de detección de glaucoma comparable o superior a la del grosor peripapilar de CFNR en pacientes altamente miopes.6,7,8,9,10,11
Presentación de casos
Caso 1
Hombre caucásico, de 40 años de edad, miope de -8,00 dioptrías que corrige con lentes de contacto y tiene antecedentes de padre ciego por glaucoma. Al examen oftalmológico se constataron los siguientes datos positivos: agudeza visual mejor corregida (AVMC): 1,0 en ambos ojos; presión intraocular (PIO) con tonómetro de contorno dinámico (Pascal) de 25,1 (Q1) y 24,4 (Q1) mmHg y espesor corneal central (ECC) de 543 y 547 micras en los respectivos ojos. Con lámpara de hendidura, se evidenció la cámara anterior profunda (Van Herick III), así como los cristalinos transparentes.
El examen fundoscópico bajo midriasis con lente aéreo de 90 dioptrías reveló: discos ópticos de tamaño normal, relación de área copa/disco 0,6 y 0,5, con copa elongada vertical de ubicación central para los respectivos ojos. En ambos ojos se visualizó rechazo nasal de vasos, anillo neurorretiniano conservado [se cumple la regla ISNT (inferior- superior-nasal-temporal)], presencia de área extensa de PPA -mayor en el ojo izquierdo-y no se observó defecto de CFNR aparente.
Al examen gonioscópico en posición primaria de la mirada se observó banda de cuerpo ciliar, con numerosos procesos ciliares insertados en trabéculo. Los estudios paraclínicos solicitados fueron: tomografía de coherencia óptica (OCT) y perimetría estándar automatizada Octopus 101-32 (Fig. 1, 2 y 3).
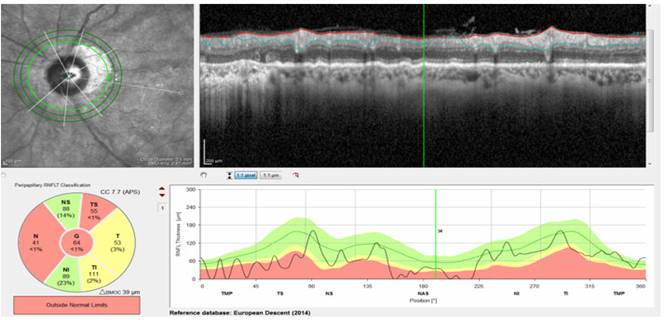
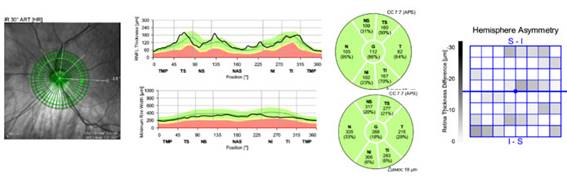
Fig. 1 Ojo izquierdo de paciente miope, con área extensa de atrofia peripapilar. El tomograma muestra error de segmentación, que provoca valores cero en el gráfico de líneas de la capa de fibras nerviosas de la retina, y resultan en mediciones erróneas en el diagrama circular.
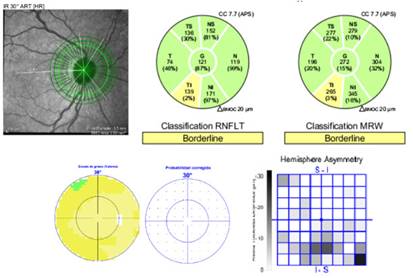
Fig. 2 Correspondencia estructural entre los parámetros: capa de fibras nerviosas de la retina y Open Membrane Bruch-Minimum Rim Width (BMO-MRW). Campo visual Octopus 101-32 normal en el ojo derecho.
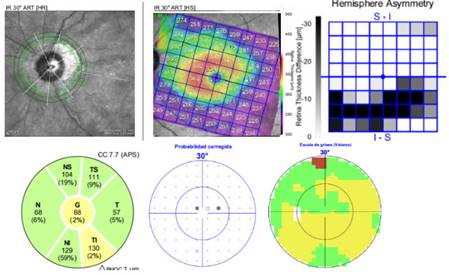
Fig. 3 El mapa de color del grosor de la célula ganglionar del ojo izquierdo muestra muesca y asimetría, clásicas de células ganglionares, a través de la línea media horizontal (efecto “caracol”) que corresponde directamente a la estructura y a los hallazgos funcionales.
La perimetría estática computarizada con el uso de Octopus 101-32 no arrojó resultados confiables (50 % de falsos positivos). Se decidió repetir ambos exámenes al mes. En el caso del OCT, se dilató al paciente con tropicamida 0,5 % (colirio): 1 gota cada 10 minutos, hasta 3 dosis. También se decidió el uso del scan peripapilar de 4,1 mm, con el objetivo de que la PPA quedara fuera del círculo de escáner peripapilar, y se obtuvieron los siguientes resultados:
OD: Pérdida moderada en el diagrama circular de la CFNR y parámetro Open Membrane Bruch-Minimum Rim Width (BMO-MRW). En la figura 2 se visualizan pequeñas áreas locales de asimetría, que no siguen un patrón de arco.
OI: En la figura 3 se observa defecto arciforme inferior en el área del grosor y en la asimetría del hemisferio, que coincide con la afectación del sector temporal inferior de la CFNR peripapilar y el defecto paracentral superior del campo visual.
Se concluye el caso como un glaucoma primario de ángulo abierto en estadio incipiente y se inicia el tratamiento con latanoprost 0,005 % (colirio): 1 gota 9:00 pm. Mantiene seguimiento en consulta cada 6 meses.
Caso 2
Mujer caucásica, de 38 años de edad, miope de -6,00 dioptrías y asmática, con antecedentes familiares de glaucoma por la línea paterna (padre y tíos). Es remitida de su área de salud, con un diagnóstico presuntivo de sospecha de glaucoma.
Al examen oftalmológico se constataron los siguientes datos positivos: AVMC 0,8 y 1,0; PIO (Pascal): 18,2 y 19,4 mmHg y ECC 504 y 508 micras en los respectivos ojos.
La biomicroscopia en lámpara de hendidura reveló cámara anterior de buena profundidad (Van Herick IV); y con el uso de goniolente de 3 espejos (Goldmann) se observó ángulo abierto en 360 grados.
El examen fundoscópico bajo midriasis con lente aéreo de 90 dioptrías reveló en ambos ojos: disco óptico inclinado caracterizado por la presencia de corniza superior, no visualización de la emergencia de los vasos retinianos y zona de coloboma inferior. No fue posible identificar con certeza la relación del área copa/disco.
Los estudios paraclínicos solicitados fueron: SD-OCT Spectralis y perimetría estándar automatizada Octopus 101-32 (Fig. 4 y 5).
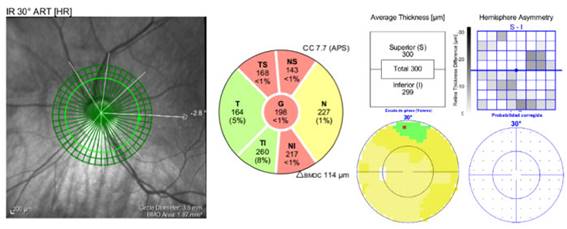
Fig. 4 Pérdida severa de la capa de fibras nerviosas de la retina en el cuadrante temporal superior y eje nasal del ojo izquierdo. El espesor macular no muestra reducción ni adelgazamiento. Campo visual normal.
El ojo derecho no mostró alteraciones estructurales y/o funcionales en los diferentes estudios. Frente a estos dos exámenes contradictorios en el ojo izquierdo comenzamos a reevaluar el caso y a rehacer todos los exámenes anteriores. Esta vez ajustamos manualmente las márgenes del disco, considerando la atrofia peripapilar y la forma oblicua de este. Después del ajuste, el resultado estuvo en concordancia con la medición del grosor macular total y del estudio funcional.
Discusión
El diagnóstico de glaucoma en la alta miopía plantea grandes desafíos para los especialistas en glaucoma, ya que muchos de los discos ópticos de pacientes con esta condición están acompañados de apariencias inclinadas, torsionales, pálidas o atrofia peripapilar.3,4,5) Esto puede conducir a defectos del campo visual pseudoglaucomatosos y dificultad para distinguir la neuropatía glaucomatosa de las anomalías ópticas morfológicas por otras patologías.1
La SD-OCT permite obtener imágenes cuantitativas no invasivas de diferentes estructuras afectadas en el glaucoma para facilitar la detección y el monitoreo de este.5,6,7,8 Actualmente, el parámetro SD-OCT más comúnmente utilizado para las evaluaciones clínicas de glaucoma es la medición del grosor peripapilar CFNR.12,13,14)
Aunque los pacientes altamente miopes tienden a tener espesores parafoveales y perifoveales más delgados,3,4,5 estudios recientes han demostrado que el complejo de células ganglionares ofrece una capacidad de detección de glaucoma comparable o superior al grosor peripapilar de CFNR en pacientes altamente miopes.7,8,9,13,14
En el caso 1, decidimos iniciar el tratamiento, atendiendo a los antecedentes familiares positivos de padre ciego por glaucoma, presencia de cifras elevadas de PIO y una buena correlación estructura-función.
En general, si un paciente tiene una anormalidad clara, por ejemplo, un adelgazamiento focal de CFNR y hay una correspondencia con la exploración macular, pero la FV sigue siendo normal y la PIO es normal, probablemente estableceríamos un monitoreo, para ver si hay progresión. Sin embargo, si ese mismo paciente tiene una presión de 25 ó 26 mm/Hg, como en este caso, iniciaríamos el tratamiento.
La pérdida estructural no es necesariamente glaucoma. Cualquier anomalía estructural debe seguirse en el tiempo y evaluarse para determinar la progresión de esta. Una vez que detectamos un cambio continuo, sabemos que es glaucoma, y luego podemos comenzar a tratarlo, especialmente en pacientes que tienen una medición de PIO y FV normales.
En este paciente, al realizar una comparación interojos y hemisferios, observamos que los cambios eran asimétricos, como es típico del glaucoma leve a moderado.2 Tal correspondencia da mucha más confianza en un diagnóstico de glaucoma. Usar esta métrica es particularmente importante en miopes, que usualmente quedan fuera de las mediciones de la base de datos normativa, porque esta no incluye pacientes con miopía moderada y alta.6
Para hacer el diagnóstico, también nos apoyamos en el nuevo parámetro: BMO-MRW, que puede ser particularmente útil para confirmar la presencia o la ausencia de anormalidades de la CFNR en presencia de patologías superficiales, como las membranas epirretinianas peripapilares (que distorsionan las mediciones de grosor de la CFNR) o nervios ópticos miopes inclinados y atrofia peripapilar severa. Chauhan otros informan que la BMO-MRW es un mejor criterio para detectar el glaucoma temprano que el grosor circunpapilar de CFNR, con una espcificidad y sensibilidad del 95 y el 81 %, respectivamente.15
En el caso 2, después de evaluar la capa de células ganglionares, descubrimos que no había cambios que sugirieran una pérdida de CFNR en este paciente. Es probable que la configuración oblicua del disco óptico y la atrofia peripapilar provocara que las márgenes del disco óptico no se pudieran definir claramente por la SD-OCT y, como consecuencia, la evaluación de CFNR resultara errónea. Esta es la razón por la cual ajustamos manualmente el contorno del disco óptico, y después de hacerlo la CFNR no mostró hallazgos patológicos.
En general, las mediciones de CFNR son un buen parámetro para la discriminación del glaucoma,12,13,14 porque la mayoría de los axones que surgen de las CGR irradian hacia la ONH y no se ven afectados por patologías maculares como la degeneración macular o la retinopatía diabética.14 Sin embargo, la CFNR circumpapilar de pacientes con miopía alta induce una elevada tasa de falsos positivos en el glaucoma.9
El disco óptico de los ojos altamente miopes se asocia con frecuencia a determinadas características que pueden influir en los algoritmos de definición del margen de este.
Estudios recientes han demostrado que la precisión diagnóstica de la medición de CFNR peripapilar en ojos altamente miopes disminuyó significativamente con el SD-OCT.6,8,9,11 Además, la miopía afecta el patrón de distribución del grosor CFNR alrededor del disco óptico, y provoca que los haces de CFNR superotemporal e inferotemporal tiendan a converger temporalmente,6,9,11) lo que conlleva un diagnóstico inexacto de glaucoma por SD-OCT.5,6,8
Otros factores que pueden afectarlo son: el tamaño del disco óptico,16) el aumento de la longitud axial17 y la ubicación del círculo de exploración, incluso colocado automáticamente.5) Chung y Yoo18 demostraron que un círculo posicionado manualmente basado en el contorno de la abertura del canal neural parece ser más adecuado para la medición de CFNR en sujetos con disco miope inclinado.
Todos estos informes anteriores consideraron que las mediciones de grosor de CFNR y ONH mediante una exploración SD-OCT, son vulnerables a errores de medición en ojos con disco inclinado miope.
Por todo lo anterior, especialmente en pacientes miopes, debemos tener en cuenta la evaluación cuidadosa del grosor de la CCG, cuyos resultados son menos propensos a falsos positivos que la CFNR.9
Los estudios sobre la capacidad de diagnóstico de glaucoma del CCG macular en pacientes altamente miopes muestran resultados contradictorios. Shoji y otros19 encontraron que el volumen de la pérdida global de CCG macular mostró un AUROC estadísticamente significativo mejor que el grosor de la CFNR promedio para la detección de glaucoma perimétrico en pacientes altamente miopes. Shin y otros11 demostraron que la capacidad de diagnóstico de la combinación de GCL e IPL (GCIPL) macular no se vio afectado por la inclinación del disco óptico miope en contraste con el grosor temporal de la CFNR y los parámetros ONH. Por otro lado, Sezgin y otros observaron que no había una correlación significativa entre el CCG y la longitud axial en los grupos de miopía moderada y alta.8)
Los diagnósticos incorrectos de glaucoma en estos pacientes conducen a medicamentos o a cirugías innecesarias, y las consecuencias pueden ser de por vida. Incluso, si los pacientes diagnosticados erróneamente se presentan para una segunda opinión, es difícil sugerir que se suspenda el tratamiento porque a menudo faltan registros longitudinales de la PIO, la OCT o las lecturas de campo visual, lo que hace imposible confirmar o descartar la progresión de la enfermedad.
Sin embargo, creemos firmemente que se puede evitar el sobrediagnóstico o el subdiagnóstico mediante el empleo de múltiples modalidades para medir diferentes características anatómicas.
Consideramos muy importante señalar que todas estas técnicas requieren una adecuada interpretación de sus resultados. Aunque la información obtenida a través de estos sea de extraordinario valor, siempre deberán interpretarse como un dato más en el contexto general de la historia clínica del paciente y nunca realizar diagnósticos definitivos basándonos solo en la información aportada por ellos.
La evaluación del CCG conduce a menos errores que la evaluación de la CFNR, particularmente frente a un paciente miope. Sin embargo, se deben considerar varias investigaciones en el intento de emitir un diagnóstico de glaucoma.