Introducción
El carcinoma basocelular (CBC) de los párpados se define como una neoplasia epitelial de baja malignidad, formada por células pluripotenciales que se parecen a las basales, con un estroma fibroso, de localización preferentemente centrofacial. Se caracteriza por lesiones polimorfas bien limitadas, con un borde acordonado, muchas veces pigmentadas.1,2
Este tumor es de lento crecimiento y localmente agresivo, con escaso riesgo de metástasis y muy baja mortalidad. Produce la muerte solo en el 0,1 % de los pacientes. La capacidad de dar metástasis tanto regionales como a distancia, a pesar de ser posible, se ha considerado como extremadamente poco habitual en los tumores palpebrales.3,4 Tiene un origen multifactorial; en el 95 % de los afectados se presenta en personas entre 40-79 años y como promedio el diagnóstico se produce a los 60 años. Por lo general, la lesión está presente muchos meses antes del diagnóstico.5
Macroscópicamente las lesiones pueden ser nodulares, nódulo-ulcerativas, pigmentadas, superficiales, esclerosantes o morfeiformes. La forma nodular es la más frecuente (80 % de los tumores).5
La lesión, en su forma clínica nodular, es por lo general una pápula de bordes regulares, con frecuencia serpentinosos, con una apariencia perlada y con la presencia de telangiectasias. Es la variante más frecuente del carcinoma basal primario. Se trata de un tumor firme y redondeado, con finos vasos de telangiectasia. Su evolución suele ser menos agresiva y más previsible que el resto de las formas clínicas.1,2,3,4,5
El nódulo ulcerativo se presenta con centro deprimido o francamente ulcerado. Puede, o no, estar presente una costra. Es una forma más agresiva que la anterior, en la que aparece una depresión con bordes elevados, duros, acordonados, de superficie brillante y con telangiectasias. Penetra profundamente en la epidermis y en los tejidos adyacentes. Por lo general es una lesión no inflamatoria e indolora, a menos que esté infectada, y puede sangrar con frecuencia si se les rasca.4,5
La forma esclerosante o morfeiforme es un tumor pálido y relativamente plano, sin márgenes aparentes, con comportamiento más agresivo. Puede presentarse en sus inicios como una blefaritis localizada, sin evidencia de masa. Su extensión subclínica es mayor que los márgenes clínicos, por lo que con frecuencia la exéresis es incompleta Se presenta entre el 5-10 % de los portadores de CBC, pero es responsable de la mayoría de los tumores que invaden la órbita. Debe su nombre a que rememora a una placa de morfea. Las lesiones pueden tener un aspecto blanco marfil y semejar una cicatriz.1,2,3,4
La forma clínica, pigmentada, superficial, lineal, así como quística, son variantes menos frecuentes y menos documentadas por los oftalmólogos.3,4
Algunos autores, como Rosner, prefieren clasificar este tipo de tumor como: circunscrito (se corresponde en la clínica con el tipo nodular. Es es el más frecuente y de mejor pronóstico) e infiltrativo (se corresponde con la variedad morfeiforme).4 Como en todos los tumores malignos, un factor importante en el éxito del tratamiento es el diagnóstico temprano de la lesión.
El diagnóstico clínico puede ser desafiante para el médico. En esto influye el pequeño tamaño de la lesión, la variabilidad de la presentación, la poca experiencia del especialista en la identificación de este tipo de lesiones, entre otros factores.3,4
La dermatoscopia facilita el reconocimiento clínico de estos, lo que permite el diagnóstico diferencial con otros tumores de piel benignos o malignos. En el examen con el dermastoscopio, los CBC superficiales muestran finas telangiectasias, erosiones pequeñas, múltiples, así como estructuras que se corresponden con pigmentación dermoepidérmica. La presencia de nichos ovoide excluiría este diagnóstico, mientras que la presencia de vasos arborizantes y de grandes ulceraciones se asocian con la presencia del tipo nodular e infiltrante. En los infiltrantes se ha planteado la existencia de un patrón dermatoscópico, caracterizado por áreas no estructuradas blanco-rojizas brillantes y la presencia de vasos arborescentes de pequeño calibre, con una menor tendencia a presentar ramas en los capilares finos en comparación con lo observado en los nodulares.4,6
La microscopia confocal, nuevo método diagnóstico, revolucionará el mundo de la patología. En estos momentos solo está reservado para el estudio en vivo de los márgenes tumorales laterales, ya que se comprueba su alta sensibilidad y especificidad, no así para el estudio en profundidad de esos tumores, que aún presenta limitaciones para el estudio de la dermis profunda.4
El láser Doppler, la tomografía computarizada, la resonancia magnética, el ultrasonido a 20 MHz y la a tomografía de emisión de positrones, son pruebas para completar el diagnóstico. Permiten precisar la invasión a tejidos blandos, descartar la invasión ósea, delinear el margen tumoral y medir el grosor del tumor.4
El diagnóstico definitivo se realiza por la evaluación histológica de la muestra mediante biopsia escisional. Las formas histológicas determinan la agresividad y el riesgo de recurrencia. El riesgo es menor con las formas nodular y superficial y mayor con las formas con un patrón de crecimiento agresivo (infiltrante, esclerosante y micronodular). Con estas últimas se incrementan las probabilidades de escisión incompleta del tumor. La tasa de escisión incompleta con las formas micronodular e infiltrante oscila entre 33-39 %.3,7,8,9
El tratamiento de elección para CBC periocular es la extirpación quirúrgica. Es una de las técnicas más utilizadas. Tiene la ventaja de poder ser realizada en forma rápida, ser relativamente económica y obtener información histopatológica de control. Pero es un procedimiento invasivo que sacrifica cantidades variables de tejido sano. En las lesiones extensas, su reconstrucción implicaría riesgo para conservar la funciòn palpebral y la estética facial. Esta sería una de sus principales desventajas.1,2,3
Se han descrito diferentes modalidades terapéuticas para el manejo médico del CBC. Entre estas se incluyen: imiquimod tópico, 5-fluorouracilo, terapia fotodinámica, radioterapia, los medicamentos inhibidores de la vía de Hedgehog y los interferones (IFN) intralesional o perilesional.3,4
En este contexto la combinación de los IFNs alfa2b y gamma (HeberFERON) muestra cada vez más relevancia, ya sea en monoterapia o como terapia combinada, en aquellos pacientes no susceptibles de actuaciones quirúrgicas. Se demuestra que presenta bajas tasas de recurrencia, excelente respuesta antitumoral, así como resultados estéticos y funcionales satisfactorios, a pesar de sus inconvenientes.10,11,12,13,14,15
De esta forma, el HeberFERON se ha convertido en una opción válida para los pacientes con diagnóstico de carcinoma basal de los párpados con riesgo quirúrgico e implicaciones estéticas.10,11,12,13,14,15,16
El objetivo de esta investigación fue determinar la respuesta clínica en pacientes con carcinoma basal palpebral tratados con HeberFERON(.
Métodos
Se realizó un estudio descriptivo en pacientes con carcinoma basal palpebral, a quienes se les aplicó HeberFERON( perilesional, de enero del año 2013 a enero de 2015. Se incluyeron 10 pacientes que recibieron HeberFERON( en una dosis de 3,5 x 106 UI/mL, en régimen ambulatorio, en las consultas creadas al efecto. Los pacientes fueron tratados durante 5 semanas y evaluados a las 16 semanas. En caso de respuesta parcial en la quinta semana de tratamiento, se continuó este hasta la octava semana, pero con una frecuencia semanal. Las lesiones de los pacientes fueron fotografiadas y se realizaron mediciones de laboratorio.
Se midieron variables como: edad (según clasificación de la ONU): 19-34, 35-44, 45-59, 60-79 y 80 años y más; sexo (femenino y masculino); color de la piel (blanca y no blanca); localización del tumor (párpado inferior, canto interno, párpado superior y canto externo); fototipo de piel (tipo I, II, III, IV y IV); antecedentes patológicos personales (inmunosupresión, reacción adversa a medicamentos, enfermedades concurrentes, antecedentes patológicos familiares y personales de carcinoma de piel; si y no); tiempo de evolución; tamaño tumoral; estadiaje tumoral (TX, T0, Tis, TI,TIIA, TIIB, TIIIA, TIIIB, TIV); y respuesta clínica al HeberFERON(.
Para los criterios de inclusión se consideraron elegibles todos los pacientes, de uno y otro géneros, con diagnóstico clínico e histológico de CBC o CEC palpebral, de cualquier estadio. Los pacientes para ser incluidos debían cumplir con los siguientes criterios: cumplimiento de los criterios de diagnósticos descritos; con lesiones vírgenes mayores de 1 cm, en las cuales no esté recomendado el tratamiento quirúrgico (por extensión de la lesión o por resultados estéticos posquirúrgicos) o lesiones con exéresis incompleta con tratamiento quirúrgico previo o lesiones recidivantes de cualquier estadio, subtipo clínico y fototipo de piel, con localización palpebral; mayores de 18 años, con voluntariedad explícita para participar del estudio.
La variable de la respuesta al tratamiento se midió mediante el comportamiento clínico e histológico de las lesiones tratadas, la ocurrencia de recidiva tumoral, el tiempo de respuesta clínica y el tiempo hasta la recurrencia. También se realizaron determinaciones por dermatoscopia.
El procedimiento para determinar la respuesta clínica se evaluó al medir el tamaño de la lesión visible, residual y palpable, después de iniciado el tratamiento, siempre por el mismo observador. Semanalmente, hasta la 5ta semana, luego a las 8, 10, 14 y 16 semanas; en esta última se realizó la consulta de evaluación. Para la valoración se tuvieron en cuenta los criterios internacionales propuestos por el Comité de evaluación de Respuesta en tumores sólidos17 (RECIST), mediante la reducción de los diámetros en milímetros de la lesión, medidos por regla milimetrada o lámpara de hendidura.
La respuesta de reducción tumoral, se clasificó en las siguientes categorías:
Respuesta completa (RC): Desaparición total de la lesión.
Respuesta parcial (RP): Reducción de, al menos, el 30 % en el diámetro mayor.
No respuesta (NR): Que puede estar dada por enfermedad estable, progresiva o aparición de una o más lesiones nuevas.
Enfermedad estable: Reducción no suficiente para calificar como respuesta parcial, o incremento insuficiente para calificar como enfermedad progresiva. Enfermedad progresiva: Incremento relativo ≥ 20 % en el diámetro mayor de la lesión única. Incremento absoluto ≥ 5 mm en el diámetro mayor de la lesión única.
La información fue recolectada, la cual se tomó directamente del paciente y de los informes de la biopsia, que fue registrada en un formulario previamente diseñado y confeccionado al efecto por el Centro de Ingeniería Genética y Biotecnología. Posteriormente se creó una base de datos construida en la aplicación EXCEL del sistema operativo WINDOWS 10, donde se automatizó la información en la planilla. El procesamiento de la información se realizó de forma automatizada. Se utilizó el paquete estadístico SPSS versión 22.0 (Statistical Software for Social Sciences; IBM corporation). Para todas las variables del estudio fueron calculadas las frecuencias absolutas y relativas.
Para iniciar la ejecución del protocolo se obtuvo el dictamen del Comité de Ética Institucional. El protocolo cumplió con la Declaración de Helsinki (Principios éticos para las investigaciones médicas en seres humanos, adoptada por la Asamblea Médica Mundial. Asociación Médica Mundial, Tokio 2004).16) Se ajustó a las normas y criterios éticos establecidos en los códigos nacionales e internacionales de ética y las regulaciones legales vigentes en Cuba (Normas de buenas prácticas clínicas en Cuba, CECMED, 2001), así como en la Guía de Buenas Prácticas Clínicas de la Conferencia Internacional de Armonización (ICH) y la Red Panamericana para la Armonización de la Regulación de las Drogas (Pan American Network for Drug Regulatory Harmonization-PANDRH). También recoge la forma de protección de los derechos y el bienestar de los pacientes involucrados, y describe satisfactoriamente los criterios de selección de los pacientes. Antes de ser seleccionados para el estudio clínico, los pacientes dieron su consentimiento informado.
Resultados
En los sujetos que participaron en el estudio el rango de edad osciló entre 30 y 90 años. La mayor frecuencia de pacientes con CBC palpebral se identificó entre los 60 y los 79 años (60,0 %). Predominó el género masculino (60,0 %), los sujetos de piel blanca (90,0 %) y de fototipo de piel tipo I (80,0 %) (Tabla 1).
Tabla 1- Características demográficas de los pacientes estudiados
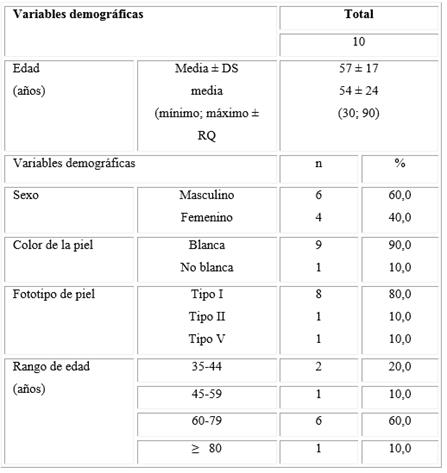
DS: Desviación estándar. RQ: Rango intercuartílico
Los antecedentes personales indican que el 80 % de los pacientes habían tenido previamente un CBC (Tabla 2).
Las características clínicas de las lesiones se muestran en la tabla 3. El tiempo de evolución de las lesiones presenta una mediana de 24 meses con mediana del diámetro mayor de 20 mm, que varía entre 8 y 20 mm, y una mediana del diámetro perpendicular de 10 mm, que varía entre 4 y 20 mm. Las diferentes categorías del estadiaje se comportaron de la manera siguiente: IIA - 30,0 %; IB - 20,0 %; II - 20,0 %; IIIA - 20,0 % y III - 10,0 %. Predominaron las lesiones en el párpado inferior, el subtipo clínico nódulo-ulcerativo, el subtipo histológico sólido y el poco diferenciado con 40, 50, 80 y 60 % de los pacientes estudiados respectivamente. Los basales primarios se presentaron en el 60 % de los investigados.
En la tabla 4 se muestran los resultados de la respuesta clínica donde se observa el 55,6 % de los pacientes con respuesta completa (RC), el 33,3 % con respuesta parcial, (RP) y solo un paciente (11,1 %) tuvo respuesta estable (EE). Se realizó biopsia después del tratamiento a 4 pacientes: dos con RP y uno con NR que no tuvieron respuesta histológica; y uno con respuesta clínica completa y respuesta histológica.
La respuesta global coincide con los porcentajes de la respuesta clínica. En la respuesta objetiva (RO), el 88,9 % de los pacientes mostró RC+RP y solo un paciente presentó EE (11,1 %).
En las tablas 5 y 6 se describen los tiempos hasta la respuesta clínica completa y hasta la respuesta objetiva (RC + RP). Se observó en ambas respuestas que tanto la media como la mediana se encuentran alrededor de las 15 semanas.
Tabla 5- Tiempo en que se alcanza la respuesta clínica completa
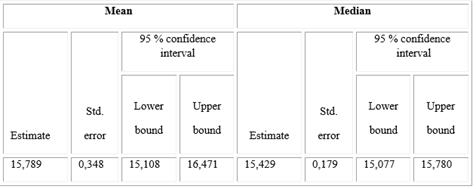
Means and medians for survival time.
Discusión
Al analizar los resultados de la investigación, se estudiaron 10 pacientes. Predominó el rango de edad de 60 a 69 años, el sexo masculino y color de piel blanca. Estos resultados coinciden con toda la bibliografía consultada.1,2,3,4,5,6 Se ha demostrado que este tumor tiene un origen multifactorial; en el 95 % de los afectados se presenta en personas entre 40-79 años y como promedio el diagnóstico se produce a los 60 años. Se ha señalado que el CBC predomina en pacientes del sexo masculino y piel blanca,1,2,3,4 aspecto relacionado con una mayor exposición solar por motivos ocupacionales y sociales.1,2,3,4,5
La mayoría de los casos estudiados presentaron historia de CBC previo, rasgo muy documentado en la literatura relacionada con esta temática. Las personas con piel blanca sugieren un fenotipo genético más susceptible a los efectos carcinogénicos de las radiaciones solares; por lo tanto, mayor riesgo de presentar más de un carcinoma basal de piel durante su vida.2,3,4,5,6)
La mitad de los pacientes presentaron subtipo clínico nódulo-ulcerativo. Estos datos son similares a los de Negrín Caceres y otros18 para CBC avanzados. Sin embargo, el subtipo clínico más abundante que se describe en la literatura es el CBC nodular.(2,3, 4,7)
La forma clínica nódulo-ulcerativa, también denominada ulcus rodens, es una forma más agresiva que la nodular, en la que aparece una depresión o ulceración central, con bordes elevados, duros, acordonados, de superficie brillante y con telangiectasias. Penetra profundamente en la epidermis y en los tejidos adyacentes.
En este estudio más de la mitad de los implicados presentaron tumores primarios y lesiones mayores de 20 mm. Este último resultado coincide con numerosas investigaciones que analizan al CBC de piel avanzado.3,10,11,14
Esta investigación difiere de los resultados de Anasagasti y otros15 en relación con el tipo de tumor, con un 93,8 % de lesiones recidivadas. Este mismo porcentaje con tratamiento quirúrgico previo encuentra en la totalidad de los pacientes una extensión tumoral entre los 1,5 y 12,5 cm, este último resultado similar a este trabajo.
La extensión tumoral se relaciona con numerosos factores; uno de ellos es el retraso en el diagnóstico, muchas veces relacionado con la demora del paciente para acudir a la consulta. Este tipo de tumor es asintomático en el 60-70 % de los pacientes y en sus inicios afecta solamente el componente estético.1,3,4) Numerosos autores reportan en los hombres falta de interés o menor preocupación por su aspecto, por lo que solicitan menos atención médica.3,4,19,20 A pesar de que en el mundo el cáncer de piel con sus variantes, basal y epidermoide, tienen una elevada incidencia, generalmente se requiere de mucho tiempo para que estas lesiones obliguen clínicamente a los pacientes a buscar atención médica especializada.3 El tamaño tumoral constituye uno de los factores pronósticos que indican mayor riesgo de recurrencia: a mayor tamaño mayor riesgo.4
El párpado inferior (PI) fue la localización con mayor número de pacientes, lo que coincide con la mayoría de las investigaciones publicadas.1,2,3,4Pfeiffer y otros8 y Rojas Rondón y otros,3) en sus series de casos de 200 y 178 pacientes estudiados con CBC, encuentran que el 51 y 78,9 % respectivamente de las lesiones se ubican en esta región. El predominio de las lesiones en el párpado inferior pudiera explicarse por las cualidades ópticas de reflexión total de la superficie de la córnea, que proyecta la luz solar hacia este párpado. Otra teoría que se ha señalado es la posible irritación que producen las lágrimas, concentradas en su mayoría en el párpado inferior.1,2,3,4,5
En esta serie la concordancia entre el diagnóstico clínico inicial y el histológico fue del 100 %, resultado que se corresponde con otras publicaciones18,19 que muestran una correlación clínico-histológica alta (71 a 99,67 %).
Más de la mitad los pacientes presentaron basales poco diferenciados. Rojas Rondón y otros3 describen 40,8 % de tumores poco diferenciados, el 31,4 % era moderadamente diferenciado y el 19,7 % para los bien diferenciados. Sin embargo, Ramírez García y otros20 publican el 44,1 % de basales moderadamente diferenciados, el 33 % bien diferenciados y el 22,9 % poco diferenciados.
El conocimiento del grado de diferenciación del tumor es importante. En el párpado y en otras regiones del cuerpo se ha observado que el grado de diferenciación está asociado con el riesgo de recurrencia, pronóstico y con la supervivencia global en los pacientes.3,4,5 La mayoría de los artículos que abordan la temática no analizan el grado de diferenciación. La falta de diferenciación se llama anaplasia, que es un indicador confiable de malignidad. El grado de diferenciación se correlaciona con el grado de malignidad y la velocidad de crecimiento: a menor diferenciación mayor malignidad.3,4,5,7,9
La respuesta clínica objetiva se logró en la mayoría de los pacientes, con una mediana de respuesta de 15 semanas. Estos resultados coinciden con numerosos estudios que aplican este fármaco.10,11,12,13,14 En el año 2017, Lorenzo Anasagasti y otros15 analizaron los resultados de varios ensayos clínicos, donde se estudiaron más de 200 pacientes con el diagnóstico histológico de cáncer de piel no melanoma tratados con la combinación de IFNs en instituciones cubanas de salud en diferentes niveles de atención médica (primario, secundario y terciario). El HeberFERON( fue administrado, peri o intralesional, tres veces por semana, durante tres semanas. Las respuestas clínicas e histológicas fueron evaluadas por RECIST (1.0), tres meses después de finalizado el tratamiento. La formulación promovió un número más rápido y superior de respuestas completas que con IFNs separados (InCarbacel-II estudio). La investigación mostró respuestas completas de 46,7 % en CBC localmente avanzado después de la aplicación. Los pacientes con CBC o carcinoma epidermoide periocular presentaron beneficios del tratamiento con un 71,4 % de respuesta objetiva, con un perfil de seguridad excelente.
Fernández Martori y otros,14 en su serie de 19 pacientes tratados en la atención primaria de salud con 3,5 MUI de la combinación de IFNs, demostró a las 16 semanas de tratamiento una respuesta objetiva de 76 %, con 38 % de respuesta completa. Los autores de la investigación concluyeron que a pesar de la baja dosis empleada en este estudio, la formulación produjo una respuesta favorable en el CBC, clínica e histológica. En el estudio experimental del año 2018 de los autores Negrín Cáceres y otros21 en 7 pacientes con CBC, la respuesta histológica fue del 85,7 % de los investigados después de la aplicación del HeberFERON(.
Otros autores que utilizan los inhibidores de la vía hedgehog reportan resultados similares, lo que constituye una respuesta clínica satisfactoria.22,23,24,25,26) Wong y otros22 demuestran la eficacia de Vismodegib en una serie de 15 pacientes con CBC avanzados. Con una duración de 13 meses y un seguimiento de 3 años demostraron un 67 % (13 pacientes) con respuesta completa, 3 pacientes (20 %) con respuesta parcial y en 2 pacientes la enfermedad estaba en progreso. Sin embargo, aunque en esta investigación no se aborda el tema de la seguridad, reporta interrupción del tratamiento por eventos adversos graves.
Ruiz Salas y otros,26 en una revisión del tratamiento con Vismodegib, en un ensayo clínico fase II a pacientes con carcinoma basal de piel localmente avanzado, demuestran el 20,6 % de respuesta completa y el 22,2 % de respuesta parcial, para una respuesta objetiva de 43 %, en 7,6 meses de seguimiento. Además, reportan el 54 % de respuesta histológica, en los que pudo confirmarse la ausencia de tumor. Sin embargo, las desventajas del medicamento son los eventos adversos moderados y graves que conllevan la interrupción del tratamiento.
El proceder no quirúrgico como el estudiado es recomendable para estos tumores palpebrales tratados, pues en estos existe una mayor densidad de nervios; la dermis se encuentra más cercana al periostio y al músculo, lo que favorece que el tumor desarrolle extensiones laterales y profundas más importantes, factores que requieren una escisión más amplia de la lesión, con mayor riesgo de complicaciones quirúrgicas y de recidiva. Aún en el caso de respuestas parciales, es muy favorable ya que reduce de forma considerable el tumor, lo que permite hacer una cirugía muy sencilla y sin riesgos. Todo esto es de gran importancia, si ademas se considera que el CBC es el cáncer cutáneo no melanoma más común en los seres humanos y representa el 90 % de los tumores malignos de los párpados. Además, los pacientes con CBC o con otras enfermedades crónicas de piel sufren un deterioro de la calidad de vida, en su mayor parte por estigmatización interiorizada y experimentada.27
En la mayoría de los pacientes se logra una buena respuesta clínica al tratamiento con HeberFERON(, por lo que se convierte en una nueva alternativa no quirúrgica.