Introducción
La importancia de un diagnóstico temprano de las lesiones compresivas del nervio óptico no necesita ser recalcada. La descompresión precoz de este o del quiasma puede resultar en una mejora significativa de la función visual, mientras que el diagnóstico erróneo puede ocasionar pérdida visual irreversible, disfunción neurológica o la muerte.1 Desafortunadamente las lesiones compresivas de la vía visual anterior (entendida esta como las porciones intracraneal, intracanalicular, orbital posterior del nervio óptico y el quiasma) no originan edema del disco o manifestaciones sistémicas ni neurológicas. Con el tiempo este tipo de padecimiento produce disminución lenta de la visión con la consiguiente palidez del disco óptico, que es el daño significativo del nervio que impide la recuperación visual, incluso con la descompresión exitosa.2
Las causas de compresión de la vía visual anterior por detrás del globo ocular son variadas. Incluyen tumores benignos y malignos intraorbitarios e intracraneales, lesiones inflamatorias, particularmente de los senos paranasales, osteopetrosis, displasias fibrosas, enfermedad de Paget, fracturas orbitarias, invasión del canal óptico por rabdomiosarcomas, dolicoectasia de vasos intracraneales, enfermedad ocular tiroidea y hemorragias orbitarias (espontáneas, traumáticas, iatrogénicas o asociadas con enfermedades de la órbita, senos paranasales o enfermedades sistémicas). Los meningiomas, tumores hipofisarios y aneurismas son las lesiones comúnmente más identificadas como causa de neuropatía óptica compresiva sin edema del disco.3
La organización de la vía visual anterior da lugar a diferentes patrones de pérdida de visión dependiendo de la toma del nervio óptico: quiasma o el tracto; la relación del quiasma con la hipófisis (normal, cuando se encuentra sobre el diafragma selar; prefijado cuando se encuentra sobre el tubérculo de la silla turca o posfijado cuando se encuentra sobre el dorso de la silla turca); el tamaño del tumor y su ritmo de crecimiento.
El sitio más común de compresión del quiasma es su porción central donde los axones de las células ganglionares de las hemirretinas nasales se decusan, produciendo una hemianopsia bitemporal o un defecto temporal unilateral. La compresión aislada de uno o ambos nervios ópticos en su porción prequiasmática ocurre con menos frecuencia en las lesiones selares y paraselares. Los pacientes se presentan con disminución de la visión, discromatopsia y defecto pupilar aferente relativo del ojo afectado. La pérdida de campo adopta la forma de defectos arciformes o depresión generalizada.4
El tumor característico de la hipófisis es el adenoma (infrecuente en la infancia), su incidencia se incrementa con la edad y puede alcanzar un 30 % en la población mayor.4 Los adenomas de hipófisis constituyen entre el 10 y el 15 % de todos los tumores intracraneales en las cirugías y del 6 al 23 % en las autopsias (la mayoría esporádicos). Comprenden el 20 % de todos los tumores primarios del cerebro y el sistema nervioso central y representan el segundo tipo más identificado por histología en adultos jóvenes (entre 20-34 años de edad) de acuerdo con el Registro Central de Tumores Cerebrales de los Estados Unidos de América.5
Un estudio poblacional en Liege (Bélgica) reportó una prevalencia del 3 al 5 % de veces mayor (1:1064) que la estimada previamente. Estudios de población en Reino Unido, Bélgica, Suiza, Suecia, Irlanda, Finlandia, Malta, Canadá y Argentina han estimado que la prevalencia de los macroadenomas de hipófisis no funcionantes es de 7-41,3 por 100 000 habitantes.1 Con su crecimiento y extensión, más allá de la silla turca, pueden afectar la vía visual, especialmente el quiasma y los nervios craneales oculomotores en el seno cavernoso.6
Los menigiomas intracraneales representan aproximadamente el 20 % de todos los tumores intracraneales. La incidencia ajustada por sexo de este tumor es de 0,9 y 1,92:100 000 para hombres y mujeres, respectivamente, con una incidencia anual de 8/100 000 en los estudios más recientes. Se detectan con más frecuencia en las edades media y tardía de la vida (de hecho, son el 2 al 4 % de los tumores intracraneales primarios en los menores de 20 años de edad). Aparecen de dos a tres veces con más frecuencia en mujeres que en hombres; pudiendo permanecer asintomáticos durante toda la vida y ser descubiertos en las autopsias.7
Los meningiomas del plano esfenoidal o del bulbo olfatorio consiguen comprimir el nervio óptico intraorbital o intracanalicular. Los tumores de esta región crecen hasta alcanzar gran tamaño sin que causen ningún otro síntoma neurológico más que la pérdida lenta y progresiva de la visión. Para comprimir los nervios ópticos en su porción intracraneal, estos tumores deben crecer hacia atrás sobre el plano esfenoidal. Los meningiomas supraselares o del tubérculo selar generalmente causan compresión de quiasma, pero pueden causar compresión unilateral del nervio óptico intracraneal prequiasmático.8 Los meningiomas paraselares o del ala del esfenoide son capaces de provocar neuropatía óptica compresiva, aunque por su localización más lateral habitualmente se presentan con paresias de pares craneales oculomotores (III, IV y VI pares craneales).9
La frecuencia con que ocurren los aneurismas es objeto de numerosos estudios. La mayoría son resultados de autopsias. Al revisar varios artículos se encontró que la prevalencia de los aneurismas saculares intracraneales oscila entre el 0,2 y 9 % con un promedio del 2,4 %. La variación entre los resultados está dada por la distribución y la edad de la población escogida.10 Los aneurismas saculares son anomalías vasculares que provocan protrusión de la pared arterial. Se localizan frecuentemente en la bifurcación de las arterias de la circulación anterior del polígono de Willis.
Algunos estudios reportan una prevalencia mayor de los “no rotos” en mujeres que en hombres con una proporción de 3:1. Aunque son lesiones esporádicas, existe un grupo de enfermedades raras con las que se asocian como son la enfermedad renal poliquística autosómica dominante, el síndrome de Marfán, el síndrome de Ehlers Danlos tipo IV, displasia fibromuscular, enfermedad de moyamoya, sicklemia y malformaciones arteriovenosas cerebrales. Un factor de riesgo importante es la historia familiar. Pacientes con un miembro de la familia afectado tiene un 4 % de riesgo, mientras que si son dos o más los familiares de primer orden aquejados el riesgo sube hasta un 8-10 %.11,12
Los nervios ópticos intracraneales están cerca de la arteria cerebral anterior, comunicante anterior, arteria oftálmica y la porción supraclinoidea de la carótida interna. Los aneurismas de todas estas estructuras vasculares pudieran presentarse como neuropatía óptica compresiva unilateral o síndromes quiasmáticos. Raramente las dilataciones ectásica de las arterias carótidas suelen comprimir el quiasma o los nervios ópticos en su porción intracraneal. En la mayoría de los casos la compresión se manifiesta con la disminución de la visión en estadios tempranos.11,12,13
La caída indolora y lentamente progresiva de la visión debe ser la primera señal de alerta de la compresión del nervio óptico y el quiasma. Estos enfermos pueden tener una agudeza visual normal (o muy cerca de lo normal), pero se quejan de visión borrosa. Los casos con aneurismas, mucoceles, apoplejías hipofisarias y displasia fibrosa acostumbran tener un curso más rápido y a veces con dolor, el cual pudiera ser inicialmente confundido con neuritis óptica.
Los pacientes tienen, en su gran mayoría, algún tipo de defecto del campo visual (descubierto sobre todo cuando se realiza la exploración con perimetría automatizada), pero la naturaleza del defecto per se no sugiere la etiología de la pérdida visual. Pudiera ser detectado cualquier tipo de defecto en el campo visual incluyendo el altitudinal, arciforme, hemianóptico, central, o escotoma cecocentral.
Las manifestaciones más notables de la compresión de la vía visual anterior son la discromatopsia unilateral y el defecto pupilar aferente relativo. Este último es evidente, incluso cuando la visión está mínimamente afectada y da al observador la evidencia inequívoca de que la dificultad visual la causa algo más que un simple error refractivo, catarata incipiente o enfermedad macular mínima.14
Toda vez que un defecto pupilar aferente relativo es detectado en un paciente con un fondo aparentemente normal y que se queja de disminución progresiva de la visión, la compresión de la vía visual debe ser descartada con neuroimágenes al alcance del especialista. La tomografía computarizada y las imágenes por resonancia magnética han mejorado dramáticamente las potencialidades diagnósticas en esta entidad, y cuando son usadas de manera correcta resultan ser la mejor opción diagnóstica en este escenario.15,16
El disco óptico de un paciente con neuropatía óptica compresiva puede aparecer normal o mostrar grado variable de palidez. Casi cualquier defecto campimétrico estaría presente, como se mencionó anteriormente, aunque los hemianópticos o escotomas junctionales en el campo superotemporal del ojo contralateral sugieren con énfasis la etiología compresiva. La naturaleza insidiosa y progresiva del síntoma es el hallazgo crucial del origen compresivo.14,15
Con el continuo avance de las neuroimágenes, incluyendo el uso de sustancias paramagnéticas de contraste como el gadolinium, las técnicas de supresión grasa, angio-resonancia y cortes finos en la tomografía, raramente escapan de lesiones de este tipo. Cuando los estudios de imágenes se seleccionan correctamente, de acuerdo al problema en cuestión, bien realizadas y cuidadosamente interpretadas y aun así no arrojan resultados, la observación (en lugar de la intervención neuroquirúrgica) es la opción más adecuada en el mejor interés del paciente.15,16,17
La tomografía de coherencia óptica (TCO) es una manera objetiva, no invasiva, de evaluar la mácula y el nervio óptico de manera rápida. En la neuropatía óptica compresiva, el TCO es capaz de mostrar el daño estructural del nervio óptico a través de la disminución del grosor de la capa de fibras nerviosas peripapilares o de la disminución del grosor del complejo de células ganglionares (CCG) a nivel macular. Esta última es una medida mucho más exacta al no estar influida por otros elementos presentes a nivel de la cabeza del nervio óptico como son los vasos sanguíneos y además juega un papel predictivo de la recuperación visual después de la cirugía.18,19,20
El tratamiento de las lesiones compresivas de la vía visual anterior debe estar encaminado a la enfermedad en específico y al paciente. Generalmente la compresión puede ser resuelta, ya sea por su remoción quirúrgica o la reducción de su tamaño con tratamiento médico.3,21) El conocimiento de las características clínico-epidemiológicas de los pacientes con lesiones compresivas de la vía visual anterior, en el servicio y en el Instituto Cubano de Oftalmología, permite una mejor orientación para su diagnóstico temprano, lo que conduce a la descompresión con posibilidades incrementadas de recuperación visual y disminución de la discapacidad por esta causa. Además del tratamiento oportuno y precoz de aquellas potencialmente letales. Por ello el objetivo fue determinar las características clínico-epidemiológicas de los pacientes diagnosticados con lesiones compresivas de la vía visual anterior.
Métodos
Se realizó un estudio descriptivo transversal entre mayo 2018 y marzo 2020 con pacientes con lesiones compresivas de la vía visual anterior atendidos en el Servicio de Neuro-oftalmología del Instituto Cubano de Oftalmología “Ramón Pando Ferrer”. La muestra quedó constituida por 41 pacientes que cumplieron con los criterios de inclusión previamente establecidos: pacientes mayores de 15 años de edad y sin limitaciones para realizar estudios de psicofísica y de campo visual y pacientes con diagnóstico de lesión compresiva de la vía visual anterior confirmado con neuroimágenes (tomografía computarizada [TC] y/o imagen por resonancia magnética [IRM] de cráneo y órbitas). Los criterios de exclusión fueron: pacientes con estudios de campo visual y TCO con parámetros de calidad no óptima por cualquier causa o datos incompletos en la historia clínica.
Se obtuvo información de la historia clínica de los pacientes que fueron atendidos en la consulta del Servicio de Neuroftalmología del Instituto Cubano de Oftalmología “Ramón Pando Ferrer” con diagnóstico de lesión compresiva de la vía visual anterior confirmado con neuroimágenes. La localización de la compresión se dividió en órbital, canalicular o intracraneana según afectara las porciones N2, N3 o N4 del nervio óptico, respectivamente o quiasmática cuando afectaba esta porción de la vía visual en el estudio de neuroimágen.
Las lesiones compresivas en el estudio fueron subdivididas según su tipo en tumorales (lesiones sólidas procedentes de cualquier estructura no vascular con relaciones de vecindad con la vía visual anterior) y vasculares (de los propios vasos sanguíneos, aneurismas o dolicidades, o tumores de origen vascular). La etiología de la lesión compresiva se determinó por las características imagenológicas en aquellas presentaciones típicas y mediante estudio anatomopatológico en aquellas en que la primera opción no fue posible.
La agudeza visual mejor corregida (AVMC) se obtuvo mediante refracción ciclopléjica y prueba final en pacientes menores de 38 años de edad y refracción manifiesta en los mayores de 38 años de edad. Se utilizó para ello la cartilla retroiluminada del Early Treatment Diabetic Retinopathy Study (ETDRS), se notó en VAR (resolución del ángulo de visión).
El resultado se clasificó en rangos según la clasificación que establece en su capítulo VII (Enfermedades de los ojos y sus anexos) la Clasificación Internacional y Estadística de Enfermedades y Problemas Relacionados con la Salud de la Organización Mundial de la Salud, también conocida como Clasificación Internacional de Enfermedades (o ICD en inglés) 10.a edición (ICD-10) (The Web´s Free 2020 ICD-10-CM/PCS Medical Coding Reference disponible en: https://www.icd10data.com)
El estudio de campo visual automatizado se realizó en perímetro Octopus 101 (la estrategia se ajustó a la agudeza visual: 32 dinámico para AVMC > 75 VAR y low visión para los pacientes con AVMC ≤ 75 VAR) y se clasificó el defecto encontrado según patrones establecidos (disminución difusa de la sensibilidad, escotoma central, escotoma arciforme, defecto altitudinal, hemianopsia) o ninguno si no tenía afectación del campo visual.
La disminución del grosor del complejo de células ganglionares maculares se determinó mediante tomografía de coherencia óptica en dominio espectral en TCO Cirrus 5000 con protocolo de adquisición macular (cubo macular de 200 x 200) con fijación foveal en ojos con agudeza visual conservada y manual utilizando el ojo sano en ojos con pobre visión.
Resultados
El sexo femenino fue el más representado con 25 pacientes (61,0 %). La edad estuvo entre 16 y 75 años con una media de 55 años. La mayor parte de los sujetos que participaron en el estudio tenían edades comprendidas entre 36 y 55 años (46,3 %). En este rango fueron también las mujeres la mayoría (14 para un 34,2 %).
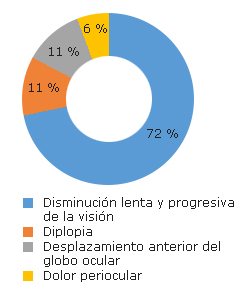
Entre los síntomas referidos estuvieron la disminución lenta y progresiva de la visión, la diplopia, desplazamiento anterior del globo ocular y dolor periocular. La mayor frecuencia la ocupó la disminución de la visión central de manera lenta y progresiva. El dolor periocular fue el menos encontrado (fig. 1).
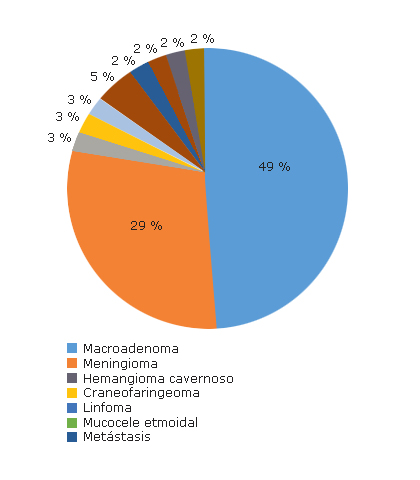
Los signos físicos más encontrados fueron el defecto adquirido de la visión de colores, el defecto pupilar aferente relativo y la palidez del nervio óptico (estuvieron presentes en 36 pacientes de la muestra el primero y segundo, y en 35 el tercero, lo que representó el 87,8 % y 85,4 %, respectivamente). La localización más frecuente fue a nivel del quiasma (33 para el 80,5 %). El resto de las localizaciones no aparecieron particularmente representadas. La mayoría fue tumoral (39 para el 95,1 %) y solo 2 en el período estudiado fueron vasculares, (aquí se incluye un aneurisma y un hemangioma cavernoso de la órbita) (fig. 2).
Solo cinco pacientes estaban en el rango de visión normal, por tanto, el resto tenía algún grado de pérdida visual al diagnóstico; 15 estaban en uno de sus ojos (el de peor visión) dentro lo considerado como baja visión y un número similar en la categoría de cerca de la ceguera (13, el 31,7 %) y ceguera (2, el 4,9 %). Teniendo en cuenta el número de pacientes que estaban en los niveles de baja visión y ceguera, este resultó estadísticamente significativo con un nivel de confianza del 95 % (p = 0,000).
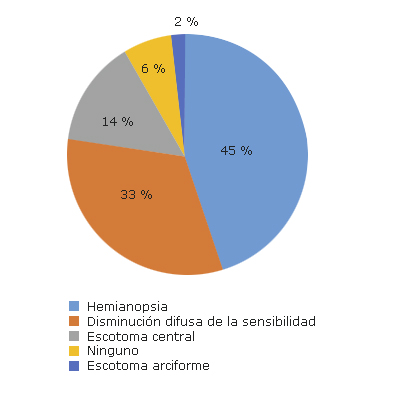
Los defectos de campo visual que más se detectaron fueron los de tipo hemianóptico, 22 pacientes (53,6 %) y la disminución difusa de la sensibilidad retiniana en 16 enfermos (39 %) (fig. 3).
La mayoría de los casos, 38 (92,7 %) presentaba algún grado de disminución del grosor del complejo de células ganglionares-plexiforme interna macular en la TCO.
Discusión
El reporte estadístico de los tumores del cerebro y el sistema nervioso central (SNC) en los Estados Unidos de América (CBTRUS) entre 2011-2015 (publicado en 2018)5 es muy útil para comparar con los resultados del estudio realizado, pues en este se mencionan lesiones, en su mayoría, de origen tumoral originadas en alguna parte del cerebro y sus estructuras. De todos los tumores diagnosticados en Estados Unidos de América en ese período, el 42 % fue en hombres y el 58 % en mujeres. Lo que coincide con los resultados mostrados aquí en cuanto al sexo.
También los tumores no malignos, que fue la mayoría de los reportados en este estudio, se han diagnosticados con mayor frecuencia en mujeres (64,0 %) que en hombres (36,0 %). La incidencia de los localizados en meninges, hipófisis, ducto craneofaringeo y nervios craneales fue también mayor en mujeres y los de meninges tuvieron una incidencia mayor en el sexo femenino (11,54 x 100000) que en el masculino (5,26 x 100000).5 Todo lo anterior coincide con la mayor representación de este sexo en la muestra de estudio.
En cuanto a la edad, el cerebro fue el asiento más común de cánceres en personas de 0-14 años con un promedio anual ajustado para la edad de 5,65 x 100 000 y la causa más usual tanto en hombres como en mujeres, en personas de más de 40 años de edad fueron los tumores cerebrales. En el SNC fue la TCO la causa más común de cáncer con un promedio anual ajustado para la edad de 44,47 x 100 000. En la muestra estudiada el grupo de edad más representado fue el de 35-56 años en el que, según el mencionado reporte (CBTRUS), no son los más frecuentes, lo que no coincide con la presente investigación, aunque no es despreciable su incidencia como se puede observar. La TCO fue la causa más común en hombres y la quinta en mujeres en los Estados Unidos de América en el período 2011-2015.5,22
Este hallazgo también puede obedecer a que, en el servicio del estudio, si bien se presta atención a pacientes pediátricos, estos no son mayoría y solo aquellos que tienen alguna repercusión sobre la vía visual por sus enfermedades neuroquirúrgicas son enviados por sus neurocirujanos pediatras para evaluación. Por lo que este grupo de edad no estuvo particularmente representado en la presente investigación.
Los defectos de campo visual y la disminución de la visión ocurren entre el 9-32 % y 4-16 % de los pacientes con adenomas y otras lesiones compresivas de la vía visual anterior, respectivamente, según los estudios consultados. Aunque otros insisten en que la incidencia actual de estos síntomas es más alta porque los defectos de campo visual y la pérdida sutil de la visión no son siempre identificadas.14,23
Estas últimas afirmaciones coinciden con lo encontrado en este trabajo en que la disminución de la visión central fue el síntoma más referido por los pacientes. La extensión de la pérdida de la agudeza visual y el campo en el momento del diagnóstico varía entre defectos mínimos en el hemicampo temporal hasta la pérdida binocular de la percepción de la luz. Los pacientes pueden aquejar también dificultad para la lectura, cefalea o anormalidades de la visión de color (defecto rojo-verde).24
En la compresión de la vía visual la agudeza visual puede ser normal incluso si está presente un defecto de campo visual, pero es más probable que sea significativa si la pérdida de campo lo es también.25,26 Cuando el defecto de campo visual es similar, los reflejos pupilares serán iguales en ambos ojos, mientras un defecto pupilar aferente relativo (DPAR) estará presente cuando la afectación es asimétrica.14 Los casos estudiados presentaron además de la pérdida de visión, con una alta frecuencia, DPAR y palidez del nervio óptico; muestra el primero de la asimetría en la afectación de la vía y lo segundo del tiempo prolongado de la compresión. La ausencia de síntomas por hiperfunción de hormonas en los macroadenomas no funcionantes de hipófisis (lesiones estas que constituyeron mayoría en este estudio) provoca el retraso su detección Drange y otros estiman un tiempo medio de entre 1,9 ± 2,9 años para el diagnóstico.27
En el reporte CBTRUS, 2011-2015 se refiere como sitio de origen más frecuente de los cánceres del SNC las meninges (el 36,8 % de todos los tumores), con variaciones en su localización (frontal 8,2 %, temporal 6,0 % parietal 3,5 % y occipital 1,0 %). Los meningiomas fueron el más frecuente de los tumores no malignos al constituir 53,1 % de ellos y su incidencia se incrementó con la edad. En la muestra estudiada estos ocupan el segundo lugar en orden de frecuencia después de lo adenomas de hipófisis, lo que obedece lógicamente a la localización de la vía visual anterior y sus relaciones de vecindad.
De hecho, los adenomas de hipófisis constituyeron en el reporte CBTRUS el 16,4 % de todos los tumores cerebrales.5 En esta investigación los macroadenomas de hipófisis ocuparon el primer lugar en orden de frecuencia (48,9 %) diferencia que se atribuye al tamaño de la muestra, mucho menor que la del estudio de referencia y además estar circunscrito, en este caso, a las lesiones que comprimían la vía visual anterior.
Los aneurismas cerebrales son lesiones poco frecuentes, la mayoría se localizan en la circulación anterior (80-85 %), comúnmente en la unión de la arteria carótida interna y la arteria comunicante posterior, el complejo arteria comunicante posterior o la bifurcación de la cerebral media.
La pérdida de visión puede ser el primer signo de un aneurisma que crece de la arteria carótida interna, cerca de su unión con la oftálmica, la arteria hipofisial superior, en su bifurcación terminal o dentro del seno cavernoso con la resultante neuropatía óptica compresiva, escotoma de la unión o hemianopsia bitemporal.28 Estos resultados son congruentes con los encontrados por este estudio en el que solo se presentó en el período una lesión aneurismática, pues la otra lesión de origen vascular fue un hemangioma cavernoso de la órbita.
La mayoría de los tumores que comprimen la vía visual anterior produce síntomas por efecto de masa, cefalea, defecto de campo, oftalmoplegía. Las complicaciones neuroftalmológicas se producen por compresión del tumor sobre el quiasma, el defecto típico es la hemianopsia bitemporal. Drange y otros encontraron el patrón bitemporal en 41 % de casos y en el 33 % unilateral y altitudinal.27 Los diferentes sitios de compresión provocan diferentes patrones de pérdida de campo visual, unilaterales, bilaterales e incluso centrales. El desplazamiento anterior produce escotoma central o defecto de fibras nerviosas del campo.6 Como se puede apreciar estos datos concuerdan con los obtenidos por el presente estudio en que la mayoría de los pacientes tenía algún defecto del campo visual, y fue el de patrón hemianóptico el más encontrado.
La pérdida de la visión como consecuencia de la compresión de la vía visual y su consiguiente atrofia pude llegar a alcanzar valores significativos. Si bien la descompresión temprana puede resultar en una recuperación de la función visual,29 cuando se detecta tardíamente y en la biomicroscopía de polo posterior es visible la atrofia óptica, por lo que esta posibilidad es menos factible. El TCO ha venido a constituir una herramienta útil para emitir pronósticos posquirúrgicos, cuando es detectable un daño establecido de la capa de fibras nerviosas retinianas o el complejo de células ganglionares las probabilidades de recuperación visual, incluso con una adecuada intervención,30 son menores.
En este estudio la presencia de palidez del nervio al fondo de ojo en la mayoría de los casos y la afectación estructural por TCO hacen que el daño de la función visual tenga muchas posibilidades de ser permanente. Es por esto que cobra importancia el encontrar que fue estadísticamente significativo el número de pacientes que al menos en uno de los ojos tenían valores de agudeza visual mejor corregida en los rangos de baja visión y ceguera, más si se tiene en cuenta que a esta limitación se suma la afectación del campo visual presente en el ojo adelfo y aumentan la discapacidad visual. Resultados que coinciden con otros estudios.31
A nivel celular el daño a los axones de las células ganglionares por compresión resulta en un fenómeno de degeneración bidireccional walleriana o anterógrado, degeneración del segmento distal del axón y muerte por apoptosis tardía de la célula ganglionar afectada. Por tanto, la compresión de la vía visual anterior es detectable por el adelgazamiento de la capa de fibras nerviosas retinianas y las células ganglionares con un patrón topográfico específico medible por TCO.32
La medida del complejo de células ganglionares (CCG)-plexiforme interna macular ha mostrado una alta reproducibilidad mejorando la precisión en la evaluación de la atrofia óptica y una fuerte correlación con la disfunción visual.32,33
Varios estudios han evaluado la utilidad de la medida del CCG-plexiforme interna macular en lesiones selares y paraselares y reportan sensibilidad elevada en el diagnóstico temprano de la compresión del nervio óptico. No es por tanto de extrañar que la gran mayoría de los casos estudiados mostraran daño estructural por TCO, sobre todo si se tiene en cuenta que se utilizó como variable la disminución el grosor del complejo de células ganglionares maculares que, como se ha mencionado, tiene alta sensibilidad para su detección haciendo coincidir nuestros resultados con la bibliografía consultada al respecto.33
Se concluye que la mayoría de los pacientes fueron del sexo femenino en edades medias de la vida. Predominaron las lesiones tumorales sobre las vasculares. Los macroadenomas de hipófisis y los meningiomas fueron las etiologías más frecuentes y el sitio de compresión más encontrado fue el quiasma óptico. Se detectó disminución del grosor del complejo de células ganglionares maculares en la tomografía de coherencia óptica de la mayoría de los enfermos.