Introducción
El ojo humano es altamente expuesto a luz de todo tipo de ondas electromagnéticas. La tensión metabólica en la eliminación del daño celular, así como su acumulación, constituyen el mayor estrés oxidativo debido a radiación ultravioleta.
La radiación ultravioleta (UV) y la asociación con salud versan siempre en temas como dermatología y cuidado de la piel; sin embargo, este fenómeno es responsable de la patología más prevalente en el mundo, en cuanto a ceguera reversible se refiere: catarata.1
La fototoxicidad y el daño acumulativo intrínseco por los rayos UV, fueron descritos en asociación con catarata desde el año 2460 a.C. La actualidad del tema centra su importancia en las ondas específicas de rayos UV-B y UV-A.
El espectro de ondas de radiación UV, se consideran en base a la longitud de onda en el campo electromagnético que va desde los 10 a 400 nanómetros (nm). Con especial efecto tóxico ionizante de las ondas por debajo de los 200 nm. La clasificación médica internacional establece tres tipos de ondas de radiación ultravioleta (UV-A, B, C), ultravioleta A con una longitud de onda de 315-400 nm, absorbida por la capa de ozono solamente el 15 %, con penetración cristaliniana hasta 36 % a 320 nm. UV-B longitud de onda 280-315 nm, absorbida en su mayoría por la capa de ozono del 60-70 %, con penetración al cristalino hasta el 2 % a 300 nm, UV-C longitud de onda 100-280 nm, virtualmente absorbida en su totalidad 99,9 % por la capa de ozono y sin penetración al cristalino documentable.1
La importancia del tema radica en el daño foto inducido y acumulable a nivel de las proteínas cristalianianas, a través de los rayos UV, las cuales se dividen en proteínas de bajo peso molecular con compuestos triptófanos y no triptófanos. Las cataratas nucleares son estadísticamente las más abundantes, a su vez, las más asociadas a daño UV. (1
El cristalino es el lente natural del ser humano y el filtro más poderoso. Existen pocos estudios en la literatura acerca de este tema en los que se comenta un solo efecto protector universal que es el uso de lentes polarizados. Develar los mecanismos intrínsecos y asociados permite crear otros medios de protección que favorece la prevención de estos efectos en el desarrollo de las cataratas. El presente trabajo actualiza y pretende documentar el rol y participación de la radiación ultravioleta y las especies reactivas libres de oxígeno en la formación de cataratas.
Rol epigenético de la radiación ultravioleta y estrés oxidativo en la formación de cataratas
Se realiza una revisión de la literatura comprendida del 1ro de mayo del 2021 al 1ro de mayo 2022. Utilizando metabuscadores en inglés y español de: PUBMED, INFOMED, CLINICALKEY, LILACS, EBSCO, SCIELO, PRISMA, UPTODATE.
La presencia del cristalino es tan singular, que en un estudio de pacientes afáquicos,1 el daño sobre la retina aumenta de manera exponente, documentándose el lente intraocular (LIO) como efecto protector en la radiación UV.
El estrés oxidativo es el elemento pivote de la creación de cataratas, al perder la capacidad de eliminar los elementos proteicos dañados (fototóxicos) y acumularlos sin posibilidad de reparación. El proceso de oxido-reducción (REDOX) permite el balance entre la oxidación y antioxidantes. Los agentes antioxidantes inducidos por radiación UV son piruvato y glutatión, disponibles in vivo en concentraciones altas en cristalinos jóvenes.
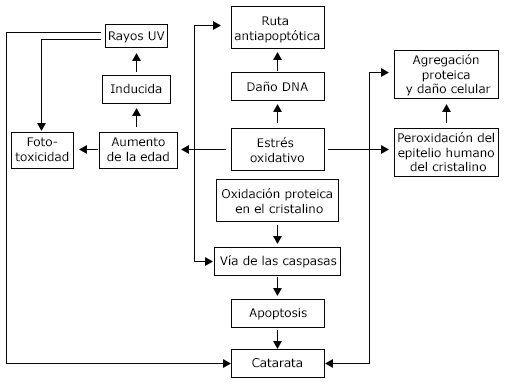
Los agentes protectores son: óxido dismutasa, catalasa, glutatión peroxidasa, con implicación directa en la desregulación y formación de cataratas. Se calcula que por década y existe una pérdida de este material de filtración y protección del 12 %. La desnaturalización de triptófanos se asocia en lentes seniles con aumento de oxidación de xantinas, así como daño mitocondrial a nivel de la cadena respiratoria de hiper-oxidación fosfolipídica, potenciando peroxidación de lípidos, con consecuencia final, formación de cataratas (fig. 1).
Los factores de riesgo para catarata deben estar enfocados al balance REDOX, no sólo clínicos, como lo muestra el estudio de SW Nam y otros,2 quienes, a través de estudio Pentacam, realizaron un screening para cristalinos aparentemente sanos, donde encontraron como factor determinante más notable: el hábito de fumar en relación con la formación con catarata nuclear. La cantidad de actividad de ejercicio por día, menor a 1 hora, asma al tratamiento con corticoesteroides crónicos, deficiencias nutricionales como hierro y suplementos, así como infartos previos al miocardio o cerebrales. Un bajo nivel escolar, alta exposición a actividades al aire libre y ausencia de protección UV ocular, inducen la formación incluso presenil (es decir debajo de los 50 años de edad) en la formación de cataratas nucleares.
A nivel genético la exposición a rayos UV-B, genera un daño epigenético irreversible a nivel de la cadena de DNA, específicamente a nivel de la acetilación y metilación de las histonas.3,4
El daño bioquímico acumulable a nivel de las histonas es considerado el primer insulto ambiental en la formación de cataratas. El potencial inmunomodulador de las células del epitelio del lente humano por sus siglas en inglés HLE-B3, es un blanco terapéutico prometedor, debido a ser la principal línea celular afectada en radiación por UV-B.5
Los estudios en animales permiten el desarrollo de modelos experimentales en la creación de blancos terapéuticos novedosos y funcionales, el estudio propuesto por Mark Babizhayev y otros6 promueve el uso de carnosina y carncinina (N acetil-carnosinina), contiene dipéptidos capaces de interactuar con la peroxidación lipídica activando la formación de estrés oxidativo, provocando agregados proteicos y así la formación de cataratas. La interrupción de esta cascada de formación mediante el uso de este compuesto activo vía tópica ocular, permite elucidar una protección a nivel telomérica es decir en la cadena de DNA, para interrumpir el efecto de radiación UV crónica en los animales y posteriormente en los humanos.6
El proceso reductivo en la cadena telomérica, así como su erosión y acortamiento son reconocidos como eventos prematuros en la formación de la opacidad del cristalino para animales y humanos, incidir vía este mecanismo, constituye un adelanto en la comprensión fisiológica de los mecanismos involucrados en la formación de cataratas.
El sistema REDOX de mayor potencia lenticular es llevado acabo por glutatión (GPX), molécula de alto peso molecular, lo cual permite el control del metabolismo antioxidante a nivel del epitelio del cristalino, pertenece al grupo tiol y su función más destacada es evitar la agregación proteica a este nivel para evitar la opacificación, con 8 isoformas, las más destacadas para los humanos son: GPX1, GPX3, GPX4. Alteraciones congénitas de estas moléculas advierten un daño severo lenticular. GPX4 guarda su mayor asociación como mediador, evitando apoptosis celular y ferroptosis (muerte celular programada en la cadena de hierro).7
Por otro lado, el mecanismo farmacológico de medicamentos anti-edad no ha concretado aún ningún efecto benéfico a largo plazo, por lo que el develamiento de medicinas que han demostrado seguridad y eficacia en el mercado, ya se investigan con nuevos fines terapéuticos. Tal es el caso de la metformina, biguanida utilizada para el control glicémico en padecimientos como diabetes mellitus. Se han descrito efectos no sólo en este campo del saber sino preventivos a nivel de patologías micro y macro vasculares, aumentando la hiper-insulinemia y resistencia a la insulina. Otro potencial efecto observado de este conocido fármaco es la capacidad anti-edad, al reducir los niveles de REDOX y con ello la opacidad del cristalino.8
Este mecanismo propuesto tiene como situación común, el retraso en la inducción de la molécula hidrógeno peroxidasa, implicado de manera directa en la formación de cataratas, la cual tiene como mecanismo de activación cíclico el adenosina aminotransferasa-monofosfato (AMPK), en modelos animales. En ratones, la metformina restaura la vía del flujo autofágico siguiendo la ruta AMPK, seguido de la disminución de la función lisosomal para el blanco en mamíferos rapamicina (mTOR).8
Los modelos que pretenden explicar las distintas formas, asociaciones y manifestaciones a través del medio ambiente y su interacción con el hombre y su salud, constituyen la ciencia epigenética, por lo que brindar soluciones motivadas en caminos ya conocidos, pero no estudiados en otros órganos como lo es el ojo humano, han creado nuevas posibilidades para reducir la ceguera mundial.
Aunado a ello, el mundo de las nano-partículas, estrategias nutricionales y naturales para combatir la formación de cataratas, presentan escenarios de oportunidad con el enlentecimiento en su progresión y formación. A través del uso de vitaminas, las cuales funcionan como antioxidantes directos al ser moduladores directos de REDOX. Abundante y basto conocimiento del tema aporta Andre9 y otros, al exponer que las vitaminas C, E, A, selenio y carotenoides, juegan un papel fundamental para la dieta e ingesta en la aparición de cataratas seniles y su retraso.9,10,11
Seguido a ello, los biomarcadores encontrados a nivel embriológico y en desarrollo del material cristalinianos, permitió identificar niveles alterados (disminuidos) de compuestos como glutatión, glutatión oxidado y glutatión disulfide (GSSG), con participación de interleucina 6 (IL-6), en comparación con los grupos control. Agregando que, a mayor exposición de rayos UV de cualquier tipo, se encuentran altos niveles de radicales libres, que inducen daño directo al cristalino.12
Si bien el daño no intencionado es una consecuencia del desenlace común de opacificación del cristalino, existen -por otro lado- mutaciones a nivel de la solubilidad o inestabilidad, fragmentación de polipéptidos, daño postraduccional y mal plegamiento proteína-proteína. Estudios internacionales de biología molecular, plantean la participación activa de la mutación R14C, la cual aumenta o propicia la formación de la unión disulfide unida a γD-cristalino, con implicación directa la susceptibilidad a radiación UV.13
Un mecanismo poco estudiado, pero con alto potencial con respecto al proceso de REDOX, es la sensibilidad hacia los canales de potasio dependientes de voltaje (Kv3), así como calcio (KCa), con inherencia directa a nivel de la motilidad celular, apoptosis, excitación neuronal, anti-oxidantes e inhibición de oxidación. El modelo in vivo y ex vivo de cataratogenesis, mediante la sustancia depresora de sangre tipo II (BDS-II), pretende elucidar esta ruta oxidativa; con resultados prometedores, el uso farmacológico de BDS-II reduce la opacidad cristalina, de ratones expuestos a oxidación inducida por H2O2 (peróxido de hidrógeno) y selenio, con el mismo blanco terapéutico en común GPX, y expresadas a nivel de los canales Kv3.
El proceso por debajo de esta acción se explica, en que los cambios morfológicos del grupo sulfhídrico o sulfúricos que poseen amino ácidos, es decir metionina y cisteína, se oxidan; a través de un proceso de tiolización (agregado el grupo tiol) con la unión de disulfuro induce la reacción de moléculas de alto peso molecular, con poca solubilidad y como consecuencia la pérdida de la transparencia cristaliniana.14,15
Por otro lado, las investigaciones que versan con respecto al daño del DNA y su asociación con medicina a base de plantas, proponen como candidato responsable de dicha ruta, el oxiresveratrol; el cual pertenece al grupo fito-químico de hidroxistilbenoides, cuyo grupo monomérico de dos anillos aromáticos unidos por un puente de etileno, configuran la estructura más común. En forma orgánica se encuentran en frutas como uvas y maní, por mencionar algunas.
Poseen participación metabólica a nivel de distintos procesos inflamatorios, como lo es la ateroesclerosis, patologías pigmentarias y carcinogénesis; permiten modelos animales que plantean a través de extractos en agua, etanol y etil acetato, promover no solo la acción dañina del DNA en presencia de iones de bronce, sino la generación potencial de especies reactivas libres de oxígeno.16
La actividad celular más importante con respecto al intercambio bioquímico y formación de cataratas empieza a nivel del mediador del epitelio humano del cristalino (HLEC), su progresión y el daño sostenido por H2O2, lleva consecuente a apoptosis.
La agregación de 3 enzimas antioxidantes en HLEC como lo es CAT (catalasa), SOD (superóxido dismutasa) y HO-1 (enzima de hemo degradación), permitió hipotetizar en el modelo de ratones al oxiresveratrol como un potente antioxidante y no sólo eso, sino que hoy en día no existe ningún fármaco aprobado con resultados continuos y consistentes para revertir la opacidad del cristalino. Por lo que esta molécula se destacó al lograr contrarrestar niveles de apoptosis celular medidos in vivo, lo cual plantean un potencial agente farmacológico para analizar.17
La molécula enzimática HO-1 cuyo papel crucial en la protección celular incluye efectos antioxidantes, antiinflamatorios y antiapoptoicos; ya que actúa a nivel de HLEC, protegiendo la agresión sostenida por el estrés oxidativo, ya sea de rayos UV o por H2O2. Esta línea de investigación en caspasas, es motivo de estudio de cientos de centros de referencia internacional para detener la formación de cataratas.17,18
El estrés oxidativo con participación a nivel del retículo endoplásmico en un ambiente hipóxico de intercambio de nutrientes, permite un mal plegamiento proteico así como en su respuesta (UPR), la señalización en la fosforilación vía protein cinasa parecida al retículo endoplásmico (PERK) e inositol cinasa 1 (IRE1), sumado al factor activador transcripcional 6 (ATF6) y regulado por el factor nuclear parecido al eritroide 2 (Nrf-2), proveen un estado de cito-protección.
En un modelo transgénico animal de ratas FVB/N sobre expresaron HO-1 con una mutación TgHO-1 G143H para evidenciar las alteraciones morfológicas en el cristalino inducidas por el estrés oxidativo y la formación de cataratas nucleares. Los resultados obtenidos por PCR tiempo real y Western blot fueron sorprendentes, ya que el borrado de esta enzima condujo a la opacidad nuclear del cristalino valorado al cabo de 10 meses, lo que permite demostrar el papel crucial que juega HO-1 como blanco terapéutico y su mantenimiento en la claridad y transparencia cristalina. Las señales inducidas IRE1, ATF6 y PERK a nivel de HLEC son esenciales en el proceso fosforilativo y con ello la transcripción de UPRs. La homeostasis generada en el retículo endoplásmico por PERK promueve a su vez, la translocación nuclear de Nrf-2, como cito-protector. La deficiencia en el cristalino de HO-1, así como su daño intencionado o proyección para adecuarla como blanco terapéutico, revelan la implicación tan importante en progresión de la opacidad del cristalino (figura 2).18,19,20
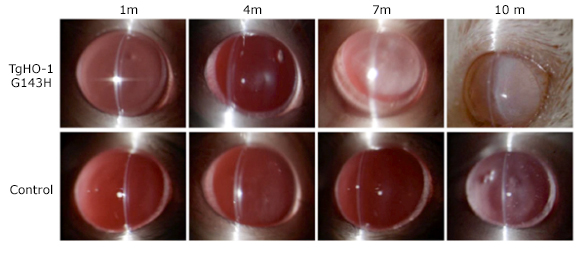
Fig. 2 Cataratas nucleares en ratones con mutación TgHO-1 G143H y grupo control a 10 meses de evolución. (18
Los insultos recibidos a nivel celular, parecen insignificantes; sin embargo, la cronicidad y prolongación de estos estímulos resultan en un daño mayúsculo, al concluir en el desbalance entre la producción y eliminación de las especies reactivas libres de oxígeno. Promover la develación de estos ejes, induce in vitro una esperanza alentadora, para que hoy en día, la cirugía no sea el único medio de resolución.21,22,23,24,25,26,27,28
El avance tecnológico, bioquímico y fisiológico, permitirá promover una solución diferente, por otro concepto distinto de cirugía, para la cura de la entidad más prevalente en el mundo por ceguera reversible: catarata. La prevención en el daño celular y bioquímico debe ser el blanco terapéutico más importante a buscar en la formación de cataratas.