Introducción
La orbitopatía asociada al tiroides (OAT) es un trastorno inflamatorio autoinmune, cuyo origen es la hipersensibilidad celular contra el autoantígeno receptor de la TSH (hormona estimulante de la tiroides) presente en los tejidos blandos orbitarios y periorbitarios. Es la primera causa de afección inflamatoria orbitaria y de exoftalmo en adultos, su incidencia oscila en las consultas de cirugía, entre el 50 y el 60 %.1,2,3) Es la manifestación extratiroidea más frecuente de la enfermedad de Graves (25-85 %), a la cual puede preceder (20 %), acompañar (40 %) o aparecer seis meses después de diagnosticada (20 %).1,4,5 No obstante, también se ha demostrado en hipotiroideos y se ha asociado a tiroiditis de Hashimoto.2,5
Es más habitual en mujeres con una relación 4:1 en comparación a los varones, aunque cursa de manera más grave en los hombres mayores.1) La edad de presentación describe un pico bimodal de incidencia, uno en la quinta década de la vida y otro en la séptima. Por lo general, la afectación es bilateral y asimétrica (85-95 %), pero también puede manifestarse de manera unilateral (5-15 %).4 Además, el 5 % de los pacientes desarrollarán reactivación inflamatoria orbitaria una vez remitido el episodio inicial.2
Los síntomas más comunes son incomodidad (molestia o presión dolorosa) al mover los ojos, lagrimeo, fotofobia, sensación de cuerpo extraño, visión borrosa, y dificultad de enfoque (diplopía). Mientras que los signos más usuales son retracción palpebral, exoftalmo, oftalmoplejía, edema palpebral, edema periorbitario, quemosis, hiperemia, queratopatía y conjuntivitis crónica.2,3,6
Según el curso de la enfermedad puede clasificarse en activa o inactiva.1 A su vez en la fase activa se debe determinar la magnitud de la inflamación (leve, moderada o grave). Esta etapa es autolimitada y suele durar de 18 a 24 meses. En la fase inactiva o crónica predominan los cambios fibróticos, y en ella se debe precisar si hay secuelas o no a nivel de órbita, músculos o párpados. Esta actividad puede ser determinada mediante el examen clínico subjetivo o a través de escalas objetivas como el Clinical Activity Score (CAS).2,4
Las formas graves de OAT aparecen solo en un 4-5 % de los casos, es más frecuentes en pacientes de mayor edad, diabéticos y hombres. El tabaquismo es uno de los factores de riesgo con mayor influencia, y se ha relacionado no solo con variantes más agresivas de la enfermedad sino con menor respuesta al tratamiento y mayor tiempo de duración.4,6 La progresión de la OAT puede generar diversas complicaciones como queratopatía por exposición, miopatía restrictiva y neuropatía óptica compresiva o distiroidea. Esta última complicación es la más grave y afecta aproximadamente del 4-8 % de los pacientes con OAT.
La causa más aceptada es la compresión de los nervios ópticos a nivel del ápex orbitario, por incremento de volumen de la grasa y apiñamiento de los músculos extraoculares engrosados. Con menor frecuencia, la elongación del nervio óptico por el exoftalmo también podría ocasionarla. A pesar de las pruebas clínicas existentes, sigue siendo difícil de diagnosticar, y con un pronóstico que mejora significativamente con la detección y tratamiento precoces.5
Las técnicas de imagen representan un invaluable auxilio para el diagnóstico de la OAT y sus complicaciones. Estas pruebas permiten determinar la extensión de la afectación muscular y su bilateralidad, lo que resulta particularmente útil en los pacientes sin evidencia clínica o de laboratorio de enfermedad tiroidea. Además, y quizás la razón más importante, es identificar la posible compresión del nervio óptico en el ápex orbitario (neuropatía óptica compresiva). En adición, puede indicarse para evaluar la actividad inflamatoria y la respuesta terapéutica.5 Por tanto, un correcto manejo imagenológico es fundamental para garantizar un diagnóstico y tratamiento correctos. Considerando lo expuesto, se efectuó una exhaustiva revisión de la literatura, con el objetivo de actualizar y sistematizar el conocimiento sobre el diagnóstico por imágenes de la OAT.
Métodos
Se realizó una búsqueda sistemática de la literatura científica de las últimas dos décadas, con el uso de las siguientes palabras clave (MeSH): orbitopatía; tiroides; ecografía; tomografía computarizada; resonancia magnética. Se limitó la búsqueda por tipo de diseño (revisiones, estudios descriptivos, analíticos y experimentales, metaanálisis). No se tuvo en cuenta el idioma de la publicación.
Las bases de datos utilizadas fueron: PubMed, Ebsco Host, Lilacs y Science Direct.
Además, se analizaron las ecografías, tomografías computarizadas y resonancias magnéticas de los pacientes diagnosticados con esta enfermedad en el Instituto Cubano de Oftalmología Ramón Pando Ferrer, durante los últimos 10 años.
La información fue resumida para la elaboración del manuscrito final.
Técnicas de imagen empleadas en el estudio de la OAT
Ecografía
La ecografía orbitaria puede resultar de utilidad en el diagnóstico de la OAT. Es una técnica no invasiva que aporta información adicional al examen físico, especialmente, en circunstancias en las que este se encuentra limitado, ya sea por la presencia de dolor ocular, edema, imposibilidad de abrir el párpado o bien cuando el fondo de ojo no se puede efectuar por opacidad en la cámara anterior.1,7
Sus principales ventajas radican en el bajo coste, amplia disponibilidad, ausencia de radiación ionizante y breve tiempo de examen; mientras que la desventaja más importante está dada por su alta variabilidad interobservador en la medición de los músculos. Por otro lado, las únicas contraindicaciones son la sospecha de perforación ocular y la cirugía reciente, ya que la presión inadvertida sobre el globo ocular podría ocasionar una extrusión de su contenido.7) Sin embargo, la calidad de información sobre la órbita posterior y las paredes óseas es significativamente inferior a la que proporcionan la tomografía computarizada y la resonancia magnética.5
Los posibles hallazgos ecográficos5 son:
Tabla 1 Diámetro patológico de los músculos extraoculares en la valoración ecográfica de la OAT
| Músculo | Diámetro patológico |
|---|---|
| Recto medio | > 5,2 mm |
| Recto lateral | > 5,1 mm |
| Recto superior | > 4,8 mm |
| Recto inferior | > 4,4 mm |
*Diferencia > 0,5 mm en el diámetro del mismo músculo en cada órbita.
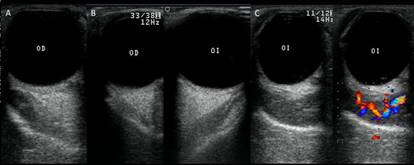
Fig. 1 US de órbitas de pacientes con OAT. A) Corte transversal de órbita derecha, en el cual se aprecia heterogeneidad y aumento del vientre muscular del recto lateral. B) Corte transversal comparativo de ambas órbitas, en el que se demuestra ligero engrosamiento del vientre del músculo recto lateral izquierdo con respecto a su homólogo contralateral. C) Corte transversal de órbita izquierda, en el cual se evidencia disminución de la ecogenicidad, marcado engrosamiento e incremento de la vascularidad del vientre del músculo recto medio.
Ecogenicidad muscular alterada: En fase activa disminución de la ecogenicidad interna por edema, mientras que, en la crónica, tienden a mostrar una ecogenicidad heterogénea y aumentada como consecuencia de la fibrosis (fig. 1).
Incremento del diámetro del complejo nervio óptico-vaina, por aumento del espacio subaracnoideo y del propio nervio óptico, en caso de neuropatía óptica distiroidea.
Dilatación de la vena oftálmica superior en los casos de compresión posterior.
Ecografía Doppler
La ecografía Doppler permite la evaluación de la vasculatura orbitaria, por lo que ha sido empleada para el estudio de las alteraciones hemodinámicas presentes en los pacientes con OAT. Durante la fase activa se ha demostrado aumento en las velocidades e índices de resistencia del flujo en las arterias oftálmica y central de la retina, lo que ha resultado más evidente en los hipertiroideos y se ha relacionado con el proceso infamatorio de origen autoinmune que ocurre en todos los tejidos orbitarios. Asimismo, se ha observado una disminución en la velocidad del flujo de la vena oftálmica superior, debido a estasis venosa por compresión muscular e incremento del edema periorbitario. De hecho, la detección de un flujo inverso o ausente en esta vena se considera un factor de riesgo de neuropatía óptica distiroidea.5,8
En fase crónica, y sobre todo en los pacientes con niveles importantes de fibrosis muscular, se ha evidenciado un incremento de las velocidades venosas, pero tanto en híper, hipo como eutiroideos, lo cual podría ser secundario a una reducción en la distensibilidad y compliance de las paredes venosas, que conllevaría a un aumento de la resistencia vascular periférica.8
Tomografía computarizada (TC)
La TC proporciona una imagen precisa del ápex orbitario, especialmente de las estructuras óseas, por lo que en la OAT se solicita fundamentalmente con fines prequirúrgicos, es decir, para el planeamiento de la cirugía de descompresión orbitaria, pero también puede emplearse como complemento en el diagnóstico de la enfermedad. Tiene como ventajas su disponibilidad, rapidez en la adquisición y la posibilidad de reconstrucción multiplanar.3 El protocolo para órbitas siempre deberá incluir imágenes en plano axial, coronal y sagital, cuyas utilidades se exponen en la tabla 2.5,9
Tabla 2 Utilidad de las proyecciones tomográficas en la OAT
| Proyección | Utilidad |
|---|---|
| Axial | Rectos internos y externos. |
| Coronal | Grado de engrosamiento y compresión del nervio óptico en el vértice orbitario. |
| Sagital | Rectos superiores e inferiores en toda su longitud. |
Los posibles hallazgos tomográficos son:
Exoftalmo (desplazamiento anterior de los globos oculares en la cavidad orbitaria). Por TC se puede determinar en plano axial al cuantificar la distancia perpendicular entre una línea que une las paredes externas de las órbitas (línea intercigomática, trazada en el corte donde los globos oculares presenten su máximo diámetro y sean visibles los cristalinos) y la superficie anterior de cada globo ocular (esclera), la cual no debe exceder los 21 mm, mientras que la diferencia entre ambas medidas no debe superar los 2 mm. El exoftalmo también se puede reconocer cuando más de las 2/3 partes de los globos oculares se desplazan por delante de la línea intercigomática.5
Músculos extraoculares de bordes bien definidos y engrosados de forma bilateral, a expensas de los vientres, con respeto de sus inserciones tendinosas anteriores. La OAT afecta principalmente al vientre muscular en su porción central, y respeta el tendón de inserción a nivel del globo ocular, lo cual le imparte al músculo un aspecto fusiforme comparable a una “botella de coca-cola”. Los más afectados son los rectos inferiores y mediales (75-77 %), seguidos por el complejo recto superior-elevador del párpado superior (50 %). Cualquiera o todos pueden estar engrosados en casi cualquier combinación, pero se plantea que, si solo se evidencia incremento de espesor del recto lateral, se deben considerar otras etiologías como miositis, linfoma y metástasis.1,3,5,9
Por otra parte, en fase activa/inflamatoria puede observarse, tras la administración del contraste yodado endovenoso, un mayor realce de los músculos afectados.5) En la fase inactiva/crónica estos músculos se adelgazan y adquieren apariencia de “cordón”. Además, puede verse hipodensidad central en algunos de los músculos por depósitos o acumulación de glucosaminoglucanos, mucopolisacáridos y linfocitos (fig. 2). De hecho, el hallazgo tomográfico de infiltración grasa focal o irregular en la musculatura extraocular puede ser una pista, desapercibida originalmente, para la enfermedad tiroidea subyacente, y a veces para el radiólogo, la única diferencia entre OAT y pseudotumor.10
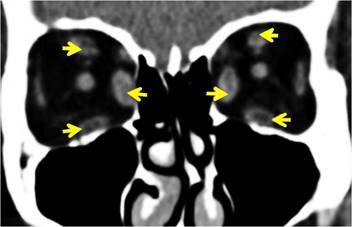
Fig. 2 TC simple de órbitas de paciente con OAT. Imagen de reconstrucción coronal con ventana de partes blandas, en la cual se constata engrosamiento bilateral y simétrico de todos los músculos extraoculares, a excepción de los rectos laterales, con áreas de baja atenuación en su interior (flechas amarillas).
Grasa orbitaria prominente (se mide el espesor del tejido graso entre el músculo recto interno y la lámina papirácea, VN= 2-3 mm). En fase activa/inflamatoria puede mostrar un aspecto «sucio» o heterogéneo con aumento de su atenuación.3,5) En fase inactiva/crónica puede permanecer aumentada con persistencia del exoftalmo.5
Las glándulas lagrimales pueden aparecer agrandadas o prolapsadas por el incremento del volumen del contenido de la órbita.3,5) En fase activa/inflamatoria la densidad glandular es menor, incluso la medida de la densidad de la grasa orbitaria y de la glándula lagrimal, pueden predecir la actividad inflamatoria con una exactitud de un 84,5 %.5
Neuropatía óptica compresiva o distiroidea. Con esta técnica se puede estimar la relación entre la neuropatía y la gravedad del engrosamiento de los músculos extraoculares mediante la aplicación de la escala de Nugent, el índice muscular de Barret y la valoración de la presencia del prolapso de la grasa orbitaria a través de la fisura orbitaria superior mayor de 2 mm. La escala de Nugent es una calificación basada en los hallazgos de imágenes coronales para evaluar el grado de borramiento de la grasa que rodea al nervio óptico, secundario al engrosamiento de los músculos extraoculares en el ápex (tabla 3, fig. 3A).5
Tabla 3 Escala de Nugent
| Borramiento de la grasa perineural | Compresión apical del nervio óptico |
|---|---|
| No borramiento | Grado 0 |
| Borramiento < 25 % | Grado 1 |
| Borramiento 25-50 % | Grado 2 |
| Borramiento > 50 % | Grado 3 |
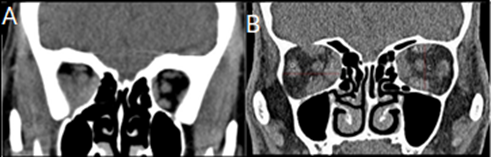
Fig. 3 TC simple de órbitas de pacientes con OAT. A) Imagen de reconstrucción coronal en la cual se observa un engrosamiento de la musculatura extrínseca del lado derecho que borra la grasa perineural en más de un 50 % de la circunferencia orbitaria (grado 3 de la puntuación de Nugent). B) Imagen de reconstrucción coronal en la cual se explica el índice muscular según método de Barret. El índice vertical se calcula mediante la división entre la suma de los diámetros verticales de los rectos superior e inferior (A+B) y la altura de la órbita (C). El índice horizontal se obtiene a partir de la división entre la suma de los diámetros horizontales de los rectos medial y lateral (D+E) y el diámetro horizontal de la órbita (F).
El índice muscular de Barret es un método que correlaciona el grado de engrosamiento de los músculos extraoculares con el desarrollo de neuropatía. Las medidas se obtienen a partir de una proyección coronal, calculando el porcentaje de los diámetros, horizontal y vertical, de la órbita ocupados por los músculos. El mayor de estos dos valores se toma como índice muscular final (fig. 3B).5
Muchos estudios han evaluado los cambios tomográficos asociados a la neuropatía óptica distiroidea con diferentes resultados, pero todos parecen coincidir en que los principales hallazgos cuantificables que la pueden hacer sospechar son el grado de compresión del nervio óptico en el ápex (grado 3) y el aumento del índice de diámetro muscular, especialmente del recto medial.5
Edema palpebral (engrosamiento e hipodensidad del tejido blando preseptal).3
Dilatación de la vena oftálmica superior por dificultad del drenaje venoso en el vértice orbitario, lo que contribuye al exoftalmo.3,5
Cambios óseos, especialmente en la lámina papirácea del etmoides con arqueamiento o remodelación de la misma, como consecuencia de la mayor presión ejercida por el incremento del volumen de los tejidos blandos intraorbitarios.5,11
Resonancia magnética
La resonancia magnética (RM) es superior a la TC en el estudio de los tejidos blandos orbitarios, por su capacidad de caracterizar la señal endomuscular y diferenciar mejor entre las distintas fases de la enfermedad. Además, tiene la ventaja de no irradiar el cristalino, no obstante, el equipo es mucho más costoso y de menor disponibilidad.3
En la OAT, la RM se indica principalmente para evaluar la actividad de la enfermedad, y en casos atípicos para excluir otras afecciones orbitarias.2) En muchos pacientes la actividad no está clínicamente clara, pues tanto la fase activa como la inactiva pueden presentar signos oculares graves, lo que dificulta la toma de decisiones terapéuticas correctas. La RM puede ayudar a diferenciar entre estas fases, y quizás a seleccionar aquellos enfermos que probablemente respondan mejor a la terapia inmunosupresora.12,13,14
La intensidad de señal del músculo más inflamado se correlaciona con el CAS, por lo que, si bien la RM no sustituye a la valoración clínica, su uso aunado se recomienda para establecer el grado de actividad y gravedad de la enfermedad. Al respecto, Vlainich y otros14 demostraron una sensibilidad del 75 % con el uso combinado del CAS y la RM, pero el empleo de US y RM mostró un valor predictivo positivo del 77 % junto a una especificidad del 80 %, lo que sugiere que un medio diagnóstico no reemplaza al otro, sino que la combinación de ellos (US y RM) sería una mejor opción para la evaluación de esta afección.
El protocolo para el estudio de la OAT debe incluir:5
Secuencias potenciadas en T1 y T2 con supresión grasa (STIR) en los planos axial, coronal (perpendicular al eje del nervio óptico) y sagital, con cortes de 3 mm.
Medida del tiempo de relajación (TR) en T2 de los músculos engrosados. Esta cuantificación se hace calculando el valor medio T2, mediante el empleo de un ROI (región de interés) en el músculo más afectado, logrado en una secuencia que utilice múltiples tiempos de eco (TE 20-400 ms) y un TR prolongado (> 3000 ms). Permite obtener de manera objetiva una medida del grado de inflamación.
Ratio de intensidad de señal (SIR). Esta medición se realiza en el plano coronal en imágenes potenciadas en T2 con supresión grasa. Se calcula comparando el TR del músculo recto más inflamado respecto al músculo temporal adyacente. Constituye una medida útil para valorar, durante el seguimiento, la respuesta al tratamiento.
Posibles hallazgos imagenológicos:
Músculos extraoculares engrosados. Las mediciones más sensibles para estimar la afectación muscular son las determinaciones de sus volúmenes y áreas máximas en sección transversal.14) Las imágenes potenciadas en T1 (sin saturación de grasa) son útiles para demostrar cambios fibróticos o degeneración grasa en fases inactivas, en aquellos músculos que no presentan realce con el gadolinio (Gd). La degeneración grasa se identifica como áreas de hiperintensidad de señal en T1 en el músculo infiltrado que se vuelven hipointensas en las secuencias con saturación grasa. Durante la fase activa en esta secuencia los músculos afectados aparecerán isointensos y tras la administración de Gd pueden mostrar un marcado realce.
En las imágenes ponderadas en T2 el comportamiento de señal es variable (fig. 4), pero la presencia de áreas de hiperintensidad puede ser debida al proceso inflamatorio, lo que se ha relacionado con una mejor respuesta al tratamiento corticoide, dado que los músculos edematosos presumiblemente responderían mejor que los fibróticos no edematosos (fig. 5).5
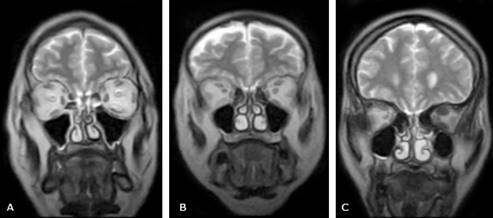
Fig. 4 RM de órbitas de pacientes con OAT. Secuencias coronales ponderadas en T2. A) Se evidencia engrosamiento e incremento de la intensidad de señal endomuscular del recto inferior izquierdo. B) Se aprecia engrosamiento y leve aumento de la intensidad de señal de los músculos rectos laterales e inferior derecho. C) En la órbita izquierda se demuestra engrosamiento del recto inferior y del complejo recto superior-elevador del párpado superior, pero con una intensidad de señal disminuida.
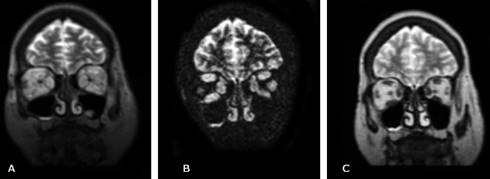
Fig. 5 RM de órbitas de un paciente con OAT. A) Imagen coronal T2 en la cual se identifica engrosamiento y aumento de la intensidad de señal de todos los músculos extraoculares. B) Secuencia coronal STIR, del mismo paciente, en la que los músculos se mantienen brillantes. C) Imagen coronal T2, seis meses después del tratamiento corticoide, en la cual se evidencia una disminución del espesor y la intensidad de señal de todos los músculos extraoculares.
Las secuencias STIR suprimen la señal grasa y permiten una evaluación más adecuada de los tejidos patológicos. La intensidad de señal en STIR se relaciona directamente con el incremento del TR en T2, causado por el aumento del contenido acuoso en los tejidos, y se correlaciona con la actividad inflamatoria en la OAT. Por este motivo, se usa para evaluar la actividad de la enfermedad, teniendo en cuenta la señal endomuscular: activa/aguda (músculos hiperintensos por edema e inflamación), e inactiva/crónica (músculos hipointensos por cambios involutivos secundarios a degeneración y fibrosis). Además, en esta secuencia el SIR, calculado comparando el TR del músculo recto más inflamado respecto al músculo temporal adyacente, discrimina entre pacientes con OAT activa e inactiva con una sensibilidad de un 57,7 % y una especificidad de un 77,5 %. No obstante, en la OAT de larga evolución dicha técnica es menos sensible para valorar los cambios inflamatorios y la actividad clínica.5,14,15)
Compresión del nervio óptico en el ápex orbitario por los músculos engrosados. Se demuestra fácilmente con la RM y se ve claramente en el área del vértice orbitario, lo que proporciona información muy útil al oftalmólogo que considere el empleo de técnicas de descompresión. Esta modalidad de imagen es superior a la TC en la valoración del nervio óptico, porque detecta mejor el borramiento de la grasa apical, secundario a la compresión de dicho nervio en el ápex, y permite una mejor medida de su grosor.5
Infiltración de la grasa orbitaria y de las glándulas lagrimales. Se evalúan mejor mediante la RM, especialmente en secuencias T2.9) La cuantificación de la intensidad de señal de la grasa también puede ser útil para la valoración de la actividad de la enfermedad tiroidea.16) Además, se ha demostrado un aumento del diámetro trasversal axial y coronal de la glándula lagrimal en pacientes con OAT en comparación a controles sanos.5
Por último, y al igual que la TC, permite corroborar el edema palpebral y la dilatación de la vena oftálmica superior.
Por otra parte, en el último quinquenio se ha prestado particular interés al empleo de otras técnicas de RM no convencionales como es el caso de la tecnología de mapeo T1, la cual ha mostrado potencialidades para tipificar los cambios de los músculos extraoculares en esta afección.17) Asimismo, las secuencias de difusión también se han empleado para el estudio de esta enfermedad. En este sentido se ha encontrado asociación entre la difusividad y el grosor de los músculos extraoculares,18 en especial, de los rectos medios.19) Además, estas secuencias pueden ser útiles para discriminar entre pacientes activos e inactivos en fases muy tempranas de la OAT.5
La RM también se ha utilizado para la evaluación de la efectividad de los tratamientos. Particularmente la intensidad de señal y el volumen muscular han mostrado reducciones significativas tras los pulsos de metilprednisolona, lo que refleja la mejoría del proceso inflamatorio.20) Específicamente se ha empleado el SIR, y el área de sección del músculo más inflamado (SI) calculado en las imágenes coronales STIR. Los valores obtenidos se comparan con los previos a la instauración del tratamiento.5
Estudios aún más recientes plantean que el análisis por RM de los parámetros: entropía, uniformidad, asimetría, curtosis y espesor de la musculatura extraocular y la grasa orbitaria puede reflejar las variaciones histopatológicas de los tejidos orbitarios, por lo que podrían ser útiles para monitorizar y predecir la respuesta a los glucocorticoides en esta enfermedad.21
En conclusión, tanto la TC como la RM pueden demostrar los cambios orbitarios característicos de la OAT. En caso de existir dudas sobre el diagnóstico o de necesidad de realizar una descompresión orbitaria, el estudio de elección es la TC. Sin embargo, en caso de existir dudas sobre la actividad de la enfermedad, sospecha de neuropatía distiroidea, y para monitorizar la respuesta al tratamiento, la técnica de elección es la RM. La ecografía sigue siendo de utilidad, en especial, cuando no es posible realizar los exámenes anteriores. El estudio de un paciente con OAT deberá incluir métodos cuantitativos objetivos que permitan valorar la afectación orbitaria, el grado de actividad y la respuesta al tratamiento.
El aporte de las técnicas de imagen para el diagnóstico y seguimiento de la OAT es indiscutible, pero jamás podrá sustituir a la historia clínica detallada y el examen físico minucioso. El médico se equivoca gravemente cuando pretende obviar la importancia del juicio clínico. La omisión de este principio, en el mejor de los casos, sólo conducirá a diagnósticos casuales.














