Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Salud Pública
versión On-line ISSN 1561-3127
Rev Cubana Salud Pública v.33 n.3 Ciudad de La Habana jul.-sep. 2007
REVISIÓN
Experiencias de la terapia antioxidante con Vimang en la atención primaria de salud en Cuba
Experience of antioxidant therapy with Vimang in primary health care in Cuba
Alberto J. Núñez SellésI; Mariela Guevara GarcíaII; Alina Álvarez LeónIII; Gilberto L. Pardo AndreuIV
IDSc., Académico de Mérito ACC, Investigador Titular
IIEspecialista de II Grado en Farmacología, Agregada
IIIEspecialista de I Grado en Inmunología, Agregada
IVInvestigador Auxiliar
RESUMEN
La terapia antioxidante con Vimang en la atención primaria de salud constituye una posible alternativa para el tratamiento eficaz, adyuvante o no, de enfermedades relacionadas con el estrés oxidativo o componentes de dolor e inflamación. Se muestra los resultados de estudios clínicos con Vimang en la atención al adulto mayor, el tratamiento de la displasia de mamas, leve o moderada, y el tratamiento de dermatopatías, a partir de experiencias etnomédicas publicadas con anterioridad. En la atención al adulto mayor (n = 31, tabletas Vimang, 300 mg) mejoró, en ocho de nueve indicadores evaluados de la calidad de vida (Cuestionario de Salud SF-36), la autopercepción del estado de salud de los ancianos; el indicador más significativo fue el dolor corporal. En la terapia de la displasia de mamas (n = 100, tabletas Vimang, 300 mg) se demostró una eficacia mayor al 85 %, con resultados similares o superiores a la vitamina E. En el tratamiento de enfermedades de la piel (n = 590, crema Vimang, 1,2 %), se observó mejoría en 86,8 y 96,7 % de los pacientes tratados por inflamación y dolor, respectivamente, y más del 90 % fueron curados de forma total o parcial. Los resultados más relevantes se obtuvieron en la recuperación del color de la piel en melasma del embarazo y pitiriasis versicolor, (52 pacientes), procesos infecciosos (53 pacientes), micosis (169 pacientes). No se observaron reacciones adversas ni signos de toxicidad durante el tratamiento.
Palabras clave: Vimang, terapia antioxidante, atención primaria, adulto mayor, displasia mamaria, desórdenes de la piel, estudios clínicos, Cuba.
SUMMARY
Antioxidant therapy with Vimang in primary health care is a possible alternative for the effective treatment, either adjuvant or not, of diseases related to oxidative stress, pain and inflammation. The results of clinical studies with Vimang on the elderly, breast dysplasia (mild or moderate) and skin diseases were shown taking into account previously reported ethnomedical experience. On elderly subjects (n=31 , 300mg Vimang tablets), the self perception of their health status improved in 8 of 9 evaluated parameters of life quality, being body pain the most significant (health questionnaire SF-36). In the treatment of breast dysplasia (n=100, 300mg Vimang tablets), the efficacy was over 85%, with similar or higher results than vitamin E. In treating skin diseases (n=590, 1.2% Vimang cream), 86.8% and 96.7% of patients treated because of inflammation and pain improved their condition whereas over 90% of patients completely or partially recovered. The most relevant results were seen in the recovery of skin pigmentation in pregnancy melasme and pitiriasis versicolor (52 patients), infectious processes (53 patients), and mycosis (169 patients). Neither adverse reactions nor toxic signs were observed in the treatment.
Key words: Vimang, antioxidant therapy, primary cae, elderly, breast dysplasia, skin disorders, clinical studies, Cuba.
INTRODUCCIÓN
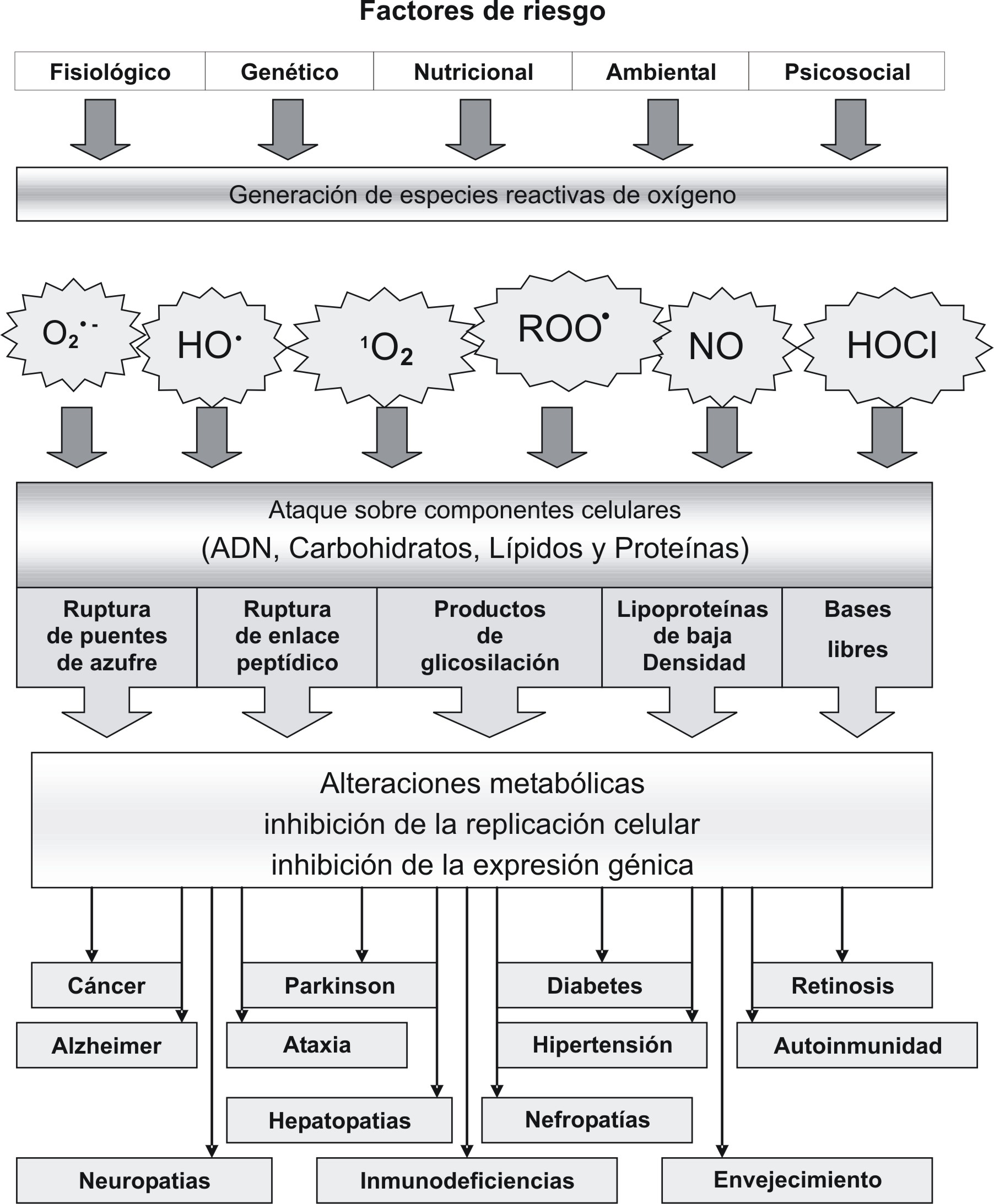
La homeóstasis redox del organismo humano es esencial para mantener un buen estado de salud. Si el balance entre los sistemas oxidantes (generadores de especies reactivas de oxígeno, EROs) y los antioxidantes se desequilibra a favor de los primeros, por la producción excesiva de EROs, el debilitamiento de los sistemas antioxidantes o por ambas causas, se estará en presencia de lo que se conoce como estrés oxidativo. El exceso de EROs promueve un daño oxidativo sobre las biomoléculas (lípidos, proteínas y ADN), dando lugar al inicio de una serie de eventos bioquímicos que pueden conducir a la aparición o agudización de la enfermedad e incluso alterar el desempeño físico o psíquico de una persona supuestamente sana. Una mejor comprensión del efecto del estrés oxidativo sobre la salud humana desde el punto de vista molecular se puede apreciar en la figura 1.
Fig. 1. Aspectos químicos y biológicos del estrés oxidativo. Los factores de riesgo provocan la generación de EROs (O2.-, HO., 1O2, ROO., NO, HOCl) que atacan componentes celulares que producen alteraciones metabólicas, inhibición de la replicación celular e inhibición de la expresión génica vinculados a la fisiopatología de un gran número de enfermedades neurodegenerativas e inmunológicas, así como al proceso de envejecimiento.
En la actualidad se conocen casi 100 enfermedades en las que se ha demostrado la incidencia del estrés oxidativo en su surgimiento y desarrollo.1-10
No obstante, todas las evidencias de la literatura científica sobre la relación entre estrés oxidativo y la progresión de enfermedades, sobre todo crónicas, la administración de productos antioxidantes a los pacientes (la terapia antioxidante) se considera, como suplementaria o de segunda importancia en la metodología terapéutica. Uno de los factores que puede contribuir a ello es el ambiente regulador actual, donde los antioxidantes no se consideran medicamentos, sino suplementos nutricionales o productos naturales para la salud, ya que el estrés oxidativo no se considera una categoría terapéutica. Quizás el mayor mito del estrés oxidativo es su relación con un número tan elevado de enfermedades, lo que hace dudar a las autoridades médicas que la terapia antioxidante, unida a hábitos saludables de vida, sea una vía eficaz para detener o reducir la progresión de estas. Otra razón es que no se ha descrito al estrés oxidativo como enfermedad, ya que no es posible relacionarlo con un síndrome específico como sucede, por ejemplo con las anemias, diabetes, hepatopatías o las hiperlipidemias, por sólo citar algunos ejemplos.
La realidad es que un número cada vez más creciente de ensayos clínicos demuestran la importancia de la terapia antioxidante en enfermedades tales como la preeclampsia en el embarazo,11 artritis,12 prostatitis,13 diabetes,14 queratitis,15 entre otras. Sin embargo, otra realidad es la falta de ensayos clínicos con productos naturales antioxidantes que surgen de la medicina tradicional o práctica etnomédica, donde los recursos financieros para una adecuada investigación preclínica y clínica son escasos o inexistentes. No menos importante, es la práctica generalizada de sólo considerar como válidos aquellos metabolitos aislados de fuentes naturales, con una identidad y pureza similares a los productos de síntesis química. En este sentido, donde los conceptos de las agencias reguladoras occidentales predominan sobre los de la milenaria cultura oriental en la aplicación de la medicina tradicional, con el uso de extractos crudos o mezclas de probada efectividad e inocuidad.
El presente trabajo muestra algunos resultados experimentales y las experiencias de la aplicación de un nuevo producto antioxidante de origen natural, conocido por su marca comercial (Vimang), en la atención primaria de salud, con el objetivo de demostrar los beneficios de la terapia antioxidante, tanto para la mejoría de la calidad de vida de los pacientes, como del tratamiento de algunas enfermedades.
ESTANDARIZACÍON, COMPOSICIÓN QUÍMICA Y PRODUCCIÓN DEL EXTRACTO DE CORTEZA DEL ÁRBOL DE MANGO
El extracto de la corteza del árbol de mango (en lo adelante ECAM) se obtiene a partir de la corteza fresca de 16 variedades de mango ampliamente distribuidas en Cuba, con un impacto ambiental muy bajo. Los árboles no resultan dañados por la recolección de la corteza y esto se puede repetir cada 2 ó 4 años, según la variedad, de acuerdo con estudios de campo realizados entre 1994 y 2004.16 En la práctica etnomédica, el ECAM es un extracto acuoso, que contiene 2 % de sólidos totales, el que se utiliza directamente para administración oral o la fabricación de ungüento hidrófilo o para formulaciones en etanol 95 % (aprox. 1 %, aplicación tópica; aproximadamente 2 %, enema rectal). En la práctica industrial, el ECAM es un polvo pardo homogéneo, con un tamaño de partícula entre 30 y 60 µm, que funde con descomposición entre 215 y 218oC. El ECAM industrial se utiliza como principio activo en la industria farmacéutica cubana para producir tabletas y cápsulas (300 mg), jarabe saborizado (5 %) y crema (1,2 %). Otras formas farmacéuticas, tales como supositorio (100 mg), óvulo vaginal (50 mg) y el ámpula inyectable (80 mg) se encuentran en fase de desarrollo y deberán estar disponibles entre 2007 y 2008. Todas estas formulaciones están registradas bajo la marca comercial Vimang y su propiedad intelectual se encuentra protegida mediante patente.17 No obstante, la disponibilidad es aún menor que la demanda, razón por la que el Centro de Química Farmacéutica, bajo la indicación del Ministerio de Salud Pública y con el apoyo de varios gobiernos provinciales, acometió la transferencia de tecnología y el desarrollo de formulaciones del ECAM para la producción local bajo la marca Vimang-MNT, lo que comprendió el extracto acuoso 2 %, jarabe 5 %, ungüento hidrófilo 1,2 % y la infusión. Dichas producciones locales están disponibles en la actualidad en Guantánamo, Santiago de Cuba, Granma, Holguín, Camagüey, Sancti Spiritus, Villa Clara y Pinar del Río, debidamente registradas ante las autoridades reguladoras cubanas de salud, y se acometen los trabajos en Ciudad de La Habana, Matanzas y Ciego de Avila. Esta disponibilidad de las formulaciones Vimang y Vimang-MNT es lo que permite su accesibilidad por el sistema de atención primaria de salud para su empleo en la terapia antioxidante de una manera extendida.
La composición química del ECAM, tanto orgánica como inorgánica, muestra que su componente mayoritario es la mangiferina (MF), una xantona glicosilada, y tiene una concentración de calcio y selenio adecuada a las dosis diarias recomendadas para alimentos.18,19 Se han identificado también polifenoles (ácido gálico y derivados), flavonoles (catequina, epicatequina y quercetina), terpenoides biológicamente activos (ß-elemeno, ß-selineno, a-guaieno, hinesol y ß-eudesmol), fitoesteroles (ß-sitoesterol y ß-campesterol), azúcares libres (galactosa, glucosa, arabinosa y fructosa), polialcoholes (sorbitol, xilitol y mioinositol) y ácidos grasos, de los cuales más del 60 % son poliinsaturados (oleico y linoleico).20 Otros elementos importantes presentes en el ECAM, además del calcio y el selenio, son el cobre y el zinc, cuya participación en procesos de la cascada inflamatoria e inmunoreguladora han sido descritos en la literatura de una forma amplia.21
Los estudios de composición e ingeniería química descritos con anterioridad permitieron establecer una tecnología a escala industrial, con parámetros físico-químicos de control de calidad que han permitido estandarizar la producción de ECAM de acuerdo a las normas reguladoras nacionales e internacionales más exigentes.22
ESTUDIOS ETNOMÉDICOS DEL EXTRACTO DE CORTEZA DEL ÁRBOL DE MANGO
El ECAM ha sido utilizado tradicionalmente en la medicina natural en muchos países para el tratamiento de la menopausia, diarrea, sífilis, diabetes, escabiosis, infecciones cutáneas, anemia, entre otras, según se registra en la Base de Datos de Productos Naturales Napralert (Univ. Illinois, EE.UU.),23 y su uso reconocido desde hace más de 200 años. El empleo del ECAM en Cuba ha sido documentado en más de 7 mil pacientes por el Centro de Química Farmacéutica, a partir de la experiencia del Laboratorio de Medicina Verde, 100 y Ojo de Agua, Municipio Arroyo Naranjo, La Habana, durante los últimos 10 años,24 con énfasis en los pacientes diagnosticados con neoplasias malignas en instituciones del Sistema Nacional de Salud.25 Los estudios experimentales iniciales, mediante ensayos en líneas de células tumorales in vitro, demostraron que el ECAM no tuvo efecto citotóxico sobre estas células.26 Sin embargo, más del 95 % de los pacientes neoplásicos tratados con ECAM (2 286 pacientes) mostraron una mejoría significativa en términos de indicadores que miden la calidad de vida (apetito, peso corporal, independencia para la vida diaria y otros), el dolor y la inflamación se redujeron de manera mucho más significativa y varios marcadores hemoquímicos fueron mejorados durante el tiempo de tratamiento (6-12 meses), se destacó el incremento de hemoglobina y la reducción de transaminasa.24 El tratamiento, por lo general, consiste en la administración oral de 30 mL del ECAM acuoso (2,5 g de material vegetal seco), 3-4 veces al día; el enema rectal del ECAM, formulación al 2 % en etanol 95 % del ECAM, 3 mL, 3 veces al día; y la aplicación alterna en la localización del tumor de una loción tópica del ECAM, formulación al 1 % en etanol 95 % o de ungüento hidrófilo, 1,2 %, 3-4 veces al día.
Otros resultados relevantes fueron en diabetes mellitus, donde más del 60 % de los pacientes (408) redujeron la dosis de insulina en 20 UI después de 6 meses de tratamiento oral con el ECAM, de la misma forma descrita con anterioridad. El 80 % de los pacientes con hiperplasia benigna de próstata (826 pacientes) mejoraron la retención de orina de forma significativa después de 3 meses de tratamiento con ECAM, por vía oral y rectal, con las mismas formulaciones descritas con anterioridad. El 95 % de los pacientes con diferentes tipos de dermatitis (1 297 pacientes) mejoraron los síntomas de forma significativa, después de 1 semana de tratamiento con un tratamiento tópico alterno con ECAM (loción y ungüento hidrófilo), 3-4 veces al día. El 87 % de los pacientes tratados con Lupus erythematosus (675 pacientes) mejoraron de forma significativa los indicadores de calidad de vida después del primer mes de tratamiento con ECAM (administración oral y tópica, de forma similar a lo descrito con anterioridad).
Los resultados de la práctica etnomédica con el uso del ECAM condujo a la decisión de realizar un diseño experimental, que permitiese hallar las certezas científicas para su empleo en la práctica médica, cuyos resultados han sido publicados recientemente.27 Lo más importante ahora es lograr la difusión y aplicación del vmang como parte de la terapia antioxidante en la atención primaria de salud, dentro del Sistema Nacional de Salud de la República de Cuba, para lo cual se muestran 3 ejemplos de estudios llevados a cabo entre los años 2000 y 2005.
ESTUDIOS DE TERAPIA ANTIOXIDANTE CON VIMANG EN ATENCIÓN PRIMARIA DE SALUD
Geriatría
Se realizó un estudio clínico en la ciudad de Camagüey con un grupo de adultos mayores de 65 años, aparentemente sanos, con el objetivo de medir el efecto de la terapia antioxidante con Vimang en diferentes indicadores de la calidad de vida, para lo cual se evaluaron también diferentes marcadores del estrés oxidativo en sangre.28 El estudio se realizó durante dos meses y se administró a los sujetos una tableta Vimang, 300 mg, tres veces al día, media hora antes de las comidas. Se determinaron ocho indicadores del estrés oxidativo en sangre y nueve de calidad de vida (Cuestionario de Salud SF-36) a los tiempos 0, 15, 30 y 60 días, cuyos resultados se muestran en la tabla y figura 2, respectivamente.
Tabla. Efecto de la edad y la suplementación con Vimang sobre el estado antioxidante sérico y la calidad de vida del adulto mayor en un estudio clínico de atención primaria de salud, policlínico Camagüey. Los valores representan la media de tres réplicas ± desviación estándar
| Variable del estado | Jóvenes | Adultos no | Adultos suplementados (t = días) | ||
| t=15 | t=30 | t=60 | |||
| Glutatión total | 451,1 ± 19,5 | 446,6 ± 17,2 | 474,5 ± 15,3 | 452,5 ± 19,1 | 462,3 ± 23,0 |
| GSH (ng/mL) | 440,8 ± 19,5 | 430,7 ± 10,4 | 461,9 ± 11,9 | 440,1 ± 13,7 | 449,2 ± 15,8 |
| GSSG (ng/mL) | 10,3 ± 2,2 | 16,00 ± 2,1 a* | 12,6 ± 1,8 b* | 12,4 ± 2,1 b* | 13,1 ± 1,1 b* |
| [ 2GSSG/(GSH+ 2GSSG)]x100 | 4,5 ± 1,1 | 6,9 ± 1,0 a* | 5,2 ± 0,9 b* | 5,3 ± 0,8 b* | 5,5 ± 1,0 b* |
| Actividad SOD (U/mL/min) | 5,6 ± 1,1 | 3,8 ± 0,4 a* | 10,1 ± 0,5 b** | 7,1 ± 0,3 b** | 7,0 ± 0,4 b** |
| CTA (mmol de Trolox/L) | 1,3 ± 0,1 | 1,0 ± 0,1 a** | 1,4 ± 0,04 b** | 1,4 ± 0,1 b** | 1,6 ± 0,1 b** |
| SRAT (µmol de MDA/L) | 3,6 ± 0,1 | 4,7 ± 0,3 a** | 3,5 ± 0,1b ** | 3,2 ± 0,2 b** | 2,7 ± 0,1 b** |
| Potencial de peroxidación | 14,9 ± 1,0 | 14,7 ± 0,6 | 15,1 ± 0,4 | 14,7 ± 0,7 | 14,7 ± 0,6 |
Glutatión total: GSH + GSSG, GSH: Glutatión reducido, GSSG: Glutatión oxidado, SOD: Superóxido dismutasa, CTA: Capacidad Total Antioxidante, SRAT: Sustancias Reactivas al Acido tiobarbitúrico, MDA: Malonildialdehído, a: representa diferencias significativas entre el grupo de jóvenes y el de adultos no suplementados, b: representa diferencias significativas entre el grupo de adultos no suplementados y el de adultos suplementados, * p < 0,05; ** p < 0,01.
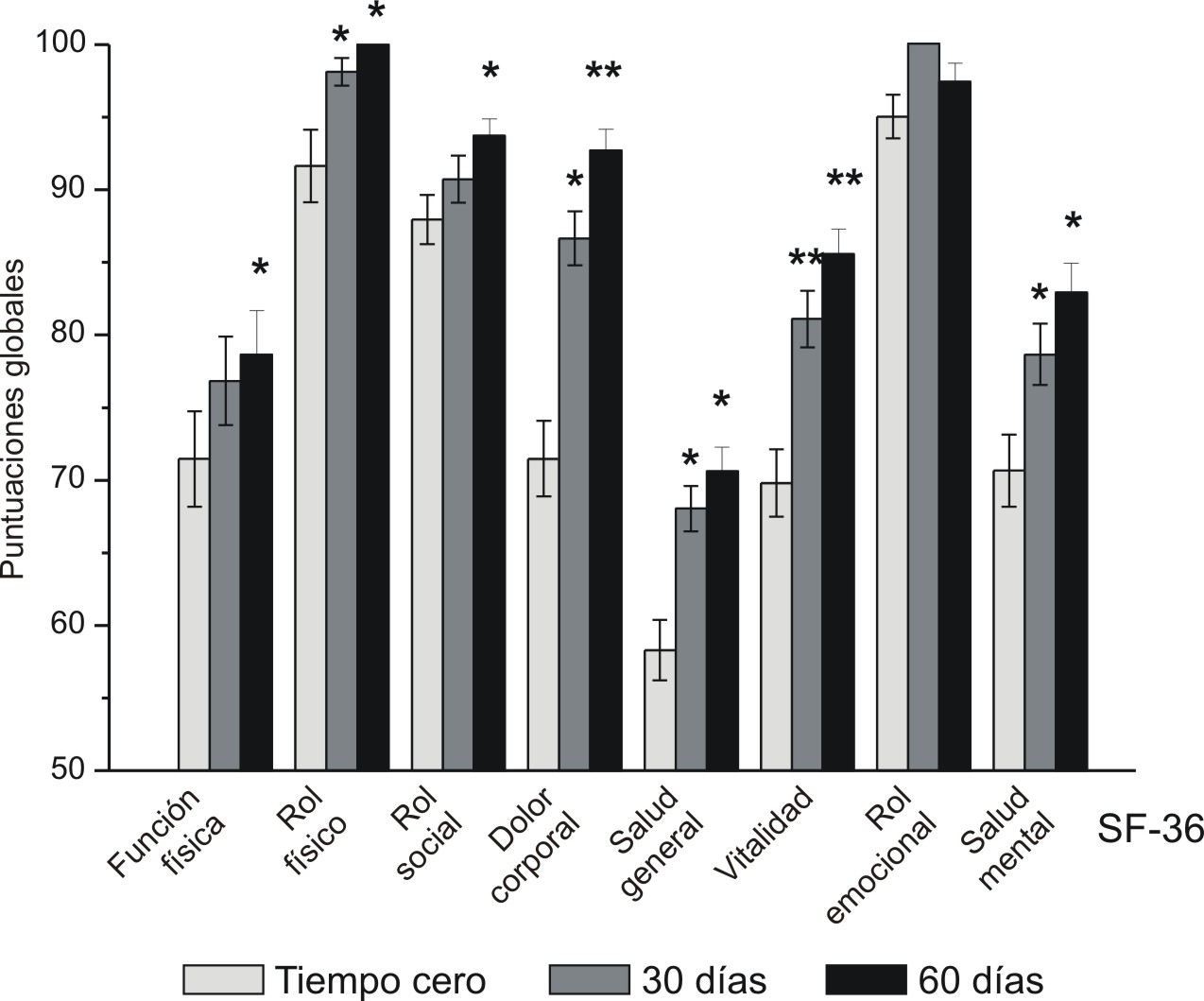
*p < 0,05; **p < 0,01 con relación al tiempo cero.
Los valores representan la media de tres réplicas ± desviación estándar.
Fig. 2. Influencia de la terapia antioxidante con tabletas Vimang, 300 mg (3 tabletas diarias), sobre los indicadores evaluados del "cuestionario de salud SF-36" en el adulto mayor (n=31), con edades superiores a 65 años, en un estudio clínico controlado en atención primaria de salud (Ciudad de Camagüey). Los análisis se realizaron en los tiempos cero, 30 y 60 días.
La terapia antioxidante con Vimang incrementó, de forma significativa, las concentraciones de superóxido dismutasa y la capacidad total antioxidante sérica, con la disminución de las sustancias reactivas al ácido tiobarbitúrico y las concentraciones de glutatión oxidado. Resultó muy significativo que los indicadores redox del grupo de adultos tratados con Vimang alcanzaron valores similares a los del grupo de jóvenes (edad promedio: 30 años) que se utilizó como control. En términos de calidad de vida, la terapia con Vimang mejoró la autopercepción del estado de salud de los adultos suplementados. Ocho de nueve indicadores evaluados de la calidad de vida resultaron mejorados al final del estudio, pero el más significativo fue el de dolor corporal, cuya mejoría significativa empezó a observarse a los 15 días del tratamiento.27
Displasia de mamas
Se condujo un estudio clínico en el municipio Santiago de Cuba, Hospital General de Santiago de Cuba, con un grupo de mujeres con el diagnóstico de displasia de mamas de carácter leve a moderado. La muestra se dividió en dos grupos: 1. Vitamina E, 500 U diarias, y 2. Vimang, 300 mg, 3 tabletas diarias. El objetivo fue evaluar el efecto de la terapia antioxidante con Vimang en comparación con la vitamina E, durante 3 meses.29 Las pacientes se evaluaron a los tiempos 0, 30, 60 y 90 días, mediante el examen clínico de las mamas y encuestas. Los resultados demostraron que la evolución del grupo tratado con Vimang fue significativamente mejor que el grupo tratado con vitamina E, en relación con la desaparición y/o disminución del área con tendencia nodular, lo que probablemente está asociado a una mayor efectividad antioxidante del extracto natural. Resultados experimentales preclínicos demostraron que el Vimang fue más efectivo que algunos antioxidantes reconocidos como las vitaminas C y E y el ß-caroteno, en la inhibición de la peroxidación lipídica y la protección al daño oxidativo.30
Afecciones de la piel
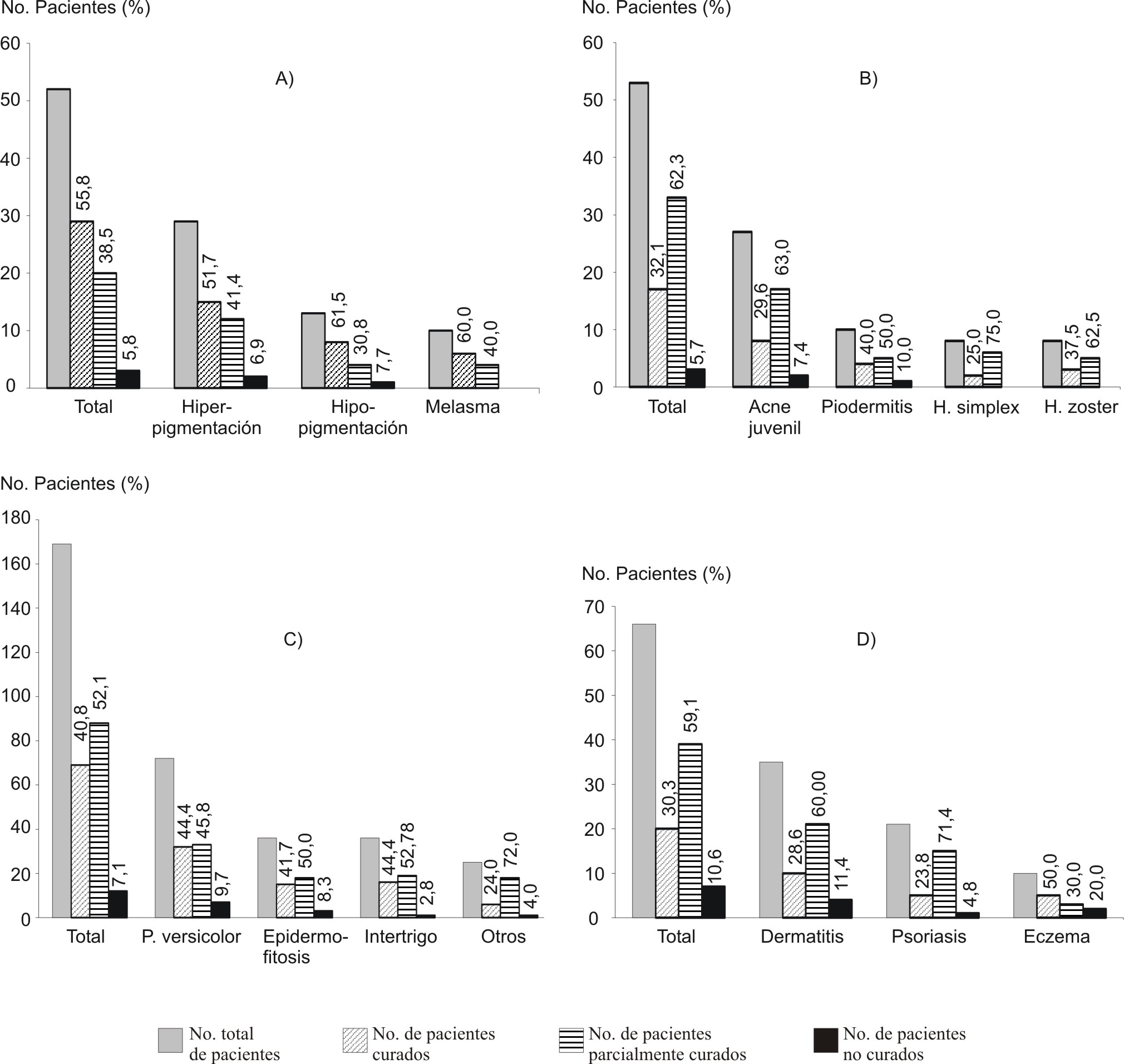
Se ejecutó un estudio de la crema Vimang (1,2 %) en 590 pacientes de 20 consultorios de médicos de familia, Policlínico Elpidio Berovides, Rpto. San Agustín, La Habana, con el objetivo de evaluar su eficacia en el tratamiento de diversas afecciones de la piel, vinculados a síntomas de dolor e inflamación. El tratamiento consistió en dos aplicaciones diarias de la crema en las zonas afectadas de la piel durante períodos de tratamiento que oscilaron entre 7 y 90 días. El tiempo de duración del ensayo fue de 6 meses.31 Algunos de los resultados más significativos fueron los siguientes:
-
El 86,8 y 96,7 % de los pacientes tratados mejoraron, de forma significativa, los síntomas de inflamación y dolor, respectivamente, en períodos de tratamiento que oscilaron entre 7 y 90 días según el desorden de la piel o la localización del dolor.
-
Más del 90 % de los pacientes fueron curados de forma total o parcial. Los resultados más relevantes se obtuvieron en la recuperación del color de la piel en melasma del embarazo y pitiriasis versicolor, (52 pacientes), procesos infecciosos (53 pacientes), micosis (169 pacientes) y dermatitis atópica (35 pacientes).
- Se observó desaparición de los síntomas en siete pacientes con lesiones severas de herpes zoster en períodos entre siete y diez días.32
Este último resultado implicó la evaluación experimental del efecto anti-viral del ECAM en líneas de cultivo celulares de herpes simplex (HSV-1 y HSV-2).33 Se demostró el efecto anti-viral del ECAM ante HSV-1, no así ante HSV-2, lo que concuerda con resultados registrados en la literatura.34
En la figura 3 se muestran estos resultados, entre otros.
B. Procesos infecciosos (n=53). C. Micosis (n=169). D. Desórdenes de la piel de probable origen inmunológico (n=66).
Fig. 3. Influencia de la terapia antioxidante con crema Vimang 1,2 % (2 aplicaciones diarias) sobre desórdenes de la piel con componentes de inflamación y dolor (n=340) en un estudio clínico controlado en atención primaria de salud, policlínico "Elpidio Berovides", San Agustín, La Habana. A. Pigmentación de la piel (n=52).
En los estudios clínicos descritos con anterioridad, sólo se observó una complicación en el tratamiento concomitante del pie diabético (enrojecimiento de la piel) con la aplicación tópica de corticoesteroides (triamcinolona o clobetazol), sin que pudiera llegarse a considerar una reacción adversa. No obstante, se recomendó evitar el tratamiento concomitante tópico del pie diabético con corticoesteroides y crema Vimang. No se observaron reacciones adversas, ni signos de toxicidad, en ninguno de los estudios descritos con anterioridad, lo cual corroboró los resultados experimentales de la experimentación toxicológica preclínica,35-41 que clasifican al Vimang como no tóxico por vía oral y tópica. Algunos efectos observados en un grupo reducido de pacientes fueron el incremento del apetito, aumento de la frecuencia de deposiciones fecales y la eliminación de constipación, los que no tuvieron una frecuencia de aparición significativa. Estos resultados permitieron confirmar la seguridad del consumo del Vimang por vía oral y tópica para seres humanos (Garrido G, García G. Study of termal, ophtalmic, rectal and vaginal irritability caused by Mangifera indica L. extract (QF-808). Memorias X Congreso Latinoamericano de Toxicología; 1998. p. 120; La Habana , Cuba).
CONSIDERACIONES FINALES
Teniendo en cuenta la efectividad demostrada por el Vimang en el tratamiento y/o prevención de enfermedades humanas asociadas al estrés oxidativo, inflamación y dolor, sustentada por el estudio de mecanismos moleculares, rigurosos modelos in vitro-in vivo y ensayos preclínicos exigidos por las autoridades reguladoras, se propone a la comunidad médica cubana un mayor acercamiento a estas formulaciones, de origen 100 % natural, para su empleo en la atención primaria de salud. Lo resultados científicos acumuladas durante más de 10 años de investigación y desarrollo de las formulaciones Vimang, recogidas en más de 50 publicaciones de amplia circulación internacional, convierten a esta línea de productos en una atractiva opción terapéutica.
REFERENCIAS BIBLIOGRÁFICAS
1. Thomasset SC, Berry DP, Garcea G, Marczylo T, Steward WP, Gescher AJ. Dietary polyphenolic phytochemicals promising cancer chemopreventive agents in humans? A review of their clinical properties. Int J Cancer. 2007;120:451-8.
2. Miller NJ, Johnston JD, Collis CS, Rice Evans C. Serum total antioxidant activity after myocardial infarction. Ann Clin Biochem. 1997;34:85-90.
3. O'Brien SF, Watts GF, Powrie JK, Shaw KM. Lipids, lypoproteins, antioxidants and glomerular and tubular dysfunction in type I diabetes. Diabetes Res Clin Pract. 1996;32:81-90.
4. Heliovaara M, Knekt P, Aho K, Aaran RK. Serum antioxidants and risk of rheumatoid arthritis. Ann Rheum Dis. 1994;53:51-3.
5. Sharma RK, Agarwal A. Role of ROS in male infertility. Urology. 1996;48:835-50.
6. Ebadi M, Srinivasan SK , Baxi MD. Oxidative stress and antioxidant therapy in Parkinson's disease. Prog Neurobiol. 1996;48:1-19.
7. Portal BC , Richard MJ, Faure HS, Hadjian AJ. Altered antioxidant status and increased lipid peroxidation in children with cystic fibrosis. Am J Clin Nutr. 1995;61:843-7.
8. Cutter RC, Rodríguez H, editors. Critical reviews of oxidative stress and aging. V I & II. London ( UK ): World Scientific;2002.
9. Halliwell B. Oxidative stress and neurodegeneration: where are we now? J Neurochem. 2006; 97:1634-58.
10. Schulz JB, Lindenau J, Seyfried J, Dichgans J. Glutathione, oxidative stress and neurodegeneration. Eur J Biochem. 2000;267:4904-11.
11. Rahman I, Tomasi A. 2nd International Meeting on Free Radicals in Health and Disease. The role of oxidants and antioxidants in the regulation of chronic diseases, may 8-12, 2002, Istanbul, Turkey. Free Radic Res. 2003;37:349-54.
12. Matyska-Piekarska E, Luszczewski A, Lacki J, Wawer I. The role of oxidative stress in the etiopathogenesis of rheumatoid artritis. Postepy Hig Med Dosw (Online). 2006;60:617-23.
13. Pasqualotto FF, Sharma RK, Agarwal A, Nelson DR. Seminal oxidative stress in chronic prostatitis patients. Urology. 2000;55:881-5.
14. Manzella D, Barbieri M, Ragno E, Paolisso G. Chronic administration of pharmacological doses of vitamin E improves the cardiac autonomic nervous system in patients with type 2 diabetes. Am J Clin Nutr. 2001;73:1052-7.
15. Vertugno M, Maino A, Cardia G, Quarante GM. A randomised, double masked, clinical trial of a high dose of vitamin A and vitamin E supplementation after photorefractive keratectomy. Br J Ophtalmol. 2001;85:537-9.
16. Amaro González D, Páez Betancourt E, Núñez Sellés AJ. Evaluación preliminar del impacto de la recolección de la corteza del árbol de mango ( Mangifera indica L.) sobre el estado de las plantaciones. La Habana, Cuba: Centro de Química Farmacéutica;2004 Dic. Informe No.: CQF/28-012-04.
17. Nuñez Sellés AJ, Páez Betancourt E, Amaro González D, Acosta Esquijarosa J, inventores. Composiciones farmacéuticas a partir del extracto de Mangifera indica L.(Mango). Patente Cubana No. 1814. 2002.
18. Núñez Sellés AJ, Vélez Castro HT, Agüero Agüero J, González González J. Isolation and quantitative analysis of phenolic constituents, free sugars, and polyols from mango (Mangifera indica L.) stem bark aqueous decoction used in Cuba as nutritional supplement. J Agric Food Chem. 2002;50:762-6.
19. Núñez Sellés AJ, Durruthy Rodríguez MD, Rodríguez Balseiro E, Nieto González L. Comparison of major and trace elements concentrations in sixteen varieties of Cuban mango stem bark (Mangifera indica L.). J Agric Food Chem. In press 2007.
20. Núñez Sellés AJ. Antioxidants Theraphy: Myth or Reality? J Braz Chem Soc. 2005;16:699-710.
21. Beck MA. Nutritional-induced oxidative stress. Effect on viral disease. Am J Clin Nutr. 2000; 72:1676S-81S.
22. Amaro González D, Acosta Esquijarosa J, Hernández Gutiérrez N, Gago Álvarez A. Montaje, escalado e introducción de la tecnología de producción de ECAM (Mangifera indica L.) a escala de 2 000 litros . La Habana, Cuba: Centro de Química Farmacéutica; 1998. Informe No.: CQF/15-003-98.
23. Napralert Database; University of Illinois: Chicago, IL, EE. UU. [serie en internet]. [citado ]. Disponible en: http:// www.ag. uiuc.edu/ ffh/napra.html Available by subscription in: http://stneasy.cas.org .
24. Guevara García M, González Laime S, Álvarez León A, Riaño Montalvo A. Uso etnomédico de la corteza de Mangifera indica L. en Cuba. Rev Cubana Plant Med. 2004;9:1-5.
25. Tamayo D, Mari E, Guevara M, Garrido G. Vimang as natural antioxidant supplementation in patients with malignant tumors. Minerva Médica. 2001;92:95-7.
26. Rodeiro I, Cancino L, Gonzalez JE, Morffi J. Evaluation of the genotoxic potential of Mangifera indica L. extract (Vimang), a new natural product with antioxidant activity. Food Chem Toxicol. 2006;44(10):1707-13.
27. Núñez Sellés AJ, Delgado Hernández R, Garrido Garrido G, García Rivera D. The paradox of natural products as pharmaceuticals. Experimental evidences of a mango stem bark extract. Pharmacol Res. In press 2007.
28. Pardo Andreu GL, Philip SJn, Riaño A, Sánchez C. Natural extract from stem bark of Mangifera indica L. (Vimang) protects against serum oxidative stress related with age in elderly humans. Arch Med Res. 2006;37:158-64.
29. Ricardo J, Ferrer M, Perdomo D, Lemus Z. Aplicación de tabletas Vimang en el tratamiento de pacientes con displasias mamarias. Medisan. 2005 (Memorias del II Congreso Internacional de Farmacología, Santiago de Cuba, Diciembre 1-3, 2005).
30. Martínez Sánchez G, Re L, Giuliani A, Núñez Sellés AJ. Protective effects of Mangifera indica L. extract, mangiferin,
and selected antioxidants against TPA-induced biomolecules oxidation and peritoneal macrophage activation in mice. Pharmacol Res. 2000;42:565-73.
31. Guevara M, Garrido G, Rodríguez PC, Riaño A. Evolución de algunas afecciones dermatológicas de alta incidencia en la atención primaria de salud tratadas con una crema antioxidante y antiinflamatoria de origen natural obtenida a partir de la corteza de Mangifera indica L. (Vimang). Acta Farmac Bonaerense. In press 2007.
32. Alvarez A, Guevara M, Riaño A, Garrido G. Eficacia del tratamiento con extracto de corteza de Mangifera indica L. (Vimang) (crema 1,2 % y tabletas 150 mg) sobre el herpes zoster. Presentación de un caso. Rev Cub Farm. 2002;36: 170-72.
33. Carballo López MT, Echemendia Arana O, García Torres M, Bolaños G. Estudio antiviral in vitro de un extracto de Mangifera indica L. frente al herpes simple tipo 1. Rev Cub Farm. 2002;36:71-2.
34. Guha S, Ghosal S, Chattopaday U. Antitumor, immunomodulatory and anti-HIV effect of mangiferin, a naturally occurring glucosylxanthone. Chemother (Basel). 1996;42:443-51.
35. Gámez R, Más R, Arruzazabala ML, Noa M. Estudio de toxicidad por dosis única oral del Vimang en ratas Sprague Dawley y ratones OF-1. La Habana, Cuba: Centro de Productos Naturales;2001.
36. Gámez R, Más R, Arruzazabala ML, Noa M. Estudio de toxicidad por dosis única intraperitoneal del Vimang en ratas Sprague Dawley y ratones OF-1. La Habana, Cuba: Centro de Productos Naturales;2001.
37. Gámez R, Más R, Noa M, Menéndez R, et al. Estudio de la toxicidad sub-crónica oral (90 días) del Vimang en ratas Sprague Dawley y ratones OF-1. La Habana, Cuba: Centro de Productos Naturales;2002.
38. Gámez R, Más R, Noa M, Menéndez R, et al. Estudio de la toxicidad crónica oral (180 días) del Vimang en ratas Sprague Dawley. La Habana, Cuba: Centro de Productos Naturales;2003.
39. Cancino L, Leiva A, Garrido G, Cossio M, et al. Vimang: Los efectos antigenotóxico y modulador de las enzimas glutatión peroxidasa y glutatión-S-transferasa. Rev Cub Invest Biomed. 2001;20:48-53.
40. Rodeiro I. Estudio genotóxico del extracto acuoso de Mangifera indica L. (Vimang) en linfocitos humanos de sangre periférica. La Habana, Cuba: Centro de Química Farmacéutica. 2005. Informe No.: CQF/14-006-07.
41. Morffi J. Evaluación genotóxica del extracto acuoso de Mangifera indica L. (Vimang) en linfocitos humanos[tesis]. La Habana, Cuba: Centro de Química Farmacéutica;2006.
Recibido: 23 de febrero de 2007.
Aprobado: 20 de marzo de 2007.
Alberto J. Núñez Sellés. Ave 21 y 200, Atabey, Apdo. 16042. La Habana 1160, Cuba. Tel. (537) 2085104, e-mails: alberto.nunez@cqf.sld.cu , mariela.guevara@cqf.sld.cu, alina.alvarez@cqf.sld.cu, gilberto.pardo@cqf.sld.cu
Centro de Química Farmacéutica