Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Salud Pública
versión impresa ISSN 0864-3466
Rev Cubana Salud Pública vol.40 no.3 Ciudad de La Habana jul.-set. 2014
INVESTIGACIÓN
Aerobacterias en las unidades de cuidado intensivo del Hospital Universitario "Fernando Troconis", Colombia
Air bacteria existing in the intensive care units of "Fernando Troconis" university hospital in Colombia
MSc. Andrés Vélez-Pereira, MSc. Yiniva Camargo Caicedo
Grupo de Investigación en Modelación de Sistemas Ambientales, Universidad del Magdalena. Santa Marta, Colombia.
RESUMEN
Introducción: las infecciones nosocomiales se consideran un importante problema de salud. Los agentes patógenos frecuentemente responsables de estas infecciones son Pseudomonas spp. y Staphylococcus spp., patógenos que pueden estar presente en los bioaerosoles en hospitales.
Objetivo: valorar la presencia de aerobacterias en las unidades de cuidado intensivo del Hospital Universitario "Fernando Troconis", Colombia.
Métodos: se recolectaron muestras de aire por triplicado en las dos estaciones de monitoreo ubicadas en las unidades de cuidados intensivos para adultos, pediátrica y neonatal, respectivamente. Se empleó para ello un impactador de cascada provisto con agar manitol salado para la recolección de aerobacterias Staphylococcus spp. y agar pseudomona para Pseudomonas spp. Las muestras recolectadas se incubaron a 37 °C durante 48 horas. Se aplicó análisis de varianza jerarquizado para determinar la influencia del género, estación y unidad sobre la concentración de aerobacterias.
Resultados: la máxima concentración obtenida fue 979,9 ± 31,3 UFC/m3 y el máximo valor promedio 277 ± 59,2 UFC/m3. La concentración de Staphylococcus spp. sobrepasó a la de Pseudomonas spp. La unidad con mayor concentración de aerobacterias fue la de adulto, seguida por la neonatal y pediátrica. Los aerosoles respirables representaron el 65 % en relación con los aerosoles sedimentables y se registraron mayores concentraciones de aerobacterias respirables Staphylococcus spp. (71,5 %) comparadas con Pseudomonas spp. (64,6 %).
Conclusiones: la concentración de aerobacterias en las unidades de cuidados intensivos es alta, con un alto porcentaje de aerosoles respirables, lo que incrementa la probabilidad de que los pacientes asistidos contraigan infecciones nosocomiales por aerobacterias.
ABSTRACT
Introduction: nosocomial infections are considered to be significant health problems. The most frequent pathogenic agents responsible for this are Pseudomonas spp. and Staphylococcus spp which can be present in bioaerosols in hospitals.
Objective: to assess the presence of airborne bacteria in intensive care unit of "Fernando Troconis" university hospital in Colombia.
Methods: samples were collected in triplicate at the two monitoring stations located in each of the three intensive care units of the hospital (adult, pediatric and neonatal), using cascade impactor with selective agars: mannitol salt for Staphylococcus spp. and pseudomona agar for Pseudomonas spp. The collected samples were incubated at 37 °C for 48 hours. A hierarchical variance analysis was applied to determine the influence of factors such as gender, monitoring station and unit on the concentration of airborne bacteria concentration.
Results: the highest concentration was 979.9 ± 31.3 CFU/m3 and the maximum average value was 277 ± 59.2 CFU/m3. Staphylococcus spp. concentration exceeded that of Pseudomonas spp. The intensive care unit with the highest concentration was the adult one, followed by the neonatal and the pediatric ones. Breathable aerosols accounted for 65 % compared with settleable aerosols, and higher concentration of breathable Staphylococcus spp. airborne bacteria (71.5 %) compared with Pseudomonas spp. (64.6 %).
Conclusions: airborne bacteria concentration in the intensive care units was high, with significant percentage of breathable aerosols. All this increases the probabilities for the assisted patients to catch nosocomial infections caused by airborne bacteria.
INTRODUCCIÓN
Las condiciones de salubridad existentes en una unidad de asistencia médica influyen directamente sobre el riesgo inherente de adquirir una infección nosocomial (IN), relacionadas consecuentemente con el aumento de los índices de morbilidad y mortalidad de los pacientes asistidos. En este sentido las IN se consideran un importante problema de salud y un motivo de preocupación e interés por parte de las instituciones y organizaciones de este sector a escala mundial,1 por las implicaciones económicas, sociales y humanas que se establecen con la adquisición de la enfermedad.
Generalmente las IN se relacionan con microorganismos multirresistentes presentes en superficies, instrumentos e incluso en el aire ambiente de los centros hospitalarios, lo que dificulta la aplicación de tratamientos efectivos para contrarrestar los efectos adversos del microrganismo, que se traduce en mayores tiempos de hospitalización y aumento de los costos en comparación con las infecciones causadas por cepas sensibles.2-4
En la actualidad muchas investigaciones se han enfocado en establecer las vías más probables y frecuentes entre la fuente contaminante portadora del microrganismo y el paciente,5-7 establecer el riesgo asociado a los microrganismos identificados en las unidades,8-10 realizar análisis estadísticos retrospectivos de las infecciones desarrolladas y considerar variables tales como edad, sexo, enfermedad, entre otros, que permitan establecer la predominancia e incidencia de los agentes patógenos presentes en las infecciones registradas,11-13 o simplemente realizar análisis de multirresistividad a los antibióticos.14-18
No obstante algunas investigaciones a nivel internacional19-23 se han enfocado en el estudio de los aerosoles bacterianos presentes en las diversas unidades de un centro de asistencia médica, justificado en las condiciones favorables que presentan los ambientes intramural para la suspensión y transporte de los microorganismos en el aire en forma de aerosoles biológicos.
La presencia de aerobacterias en el aire de las unidades médicas reviste gran importancia, puesto que el aire se puede convertir en una ruta rápida de transmisión entre las potenciales fuentes y hospederos presentes en la unidad, tales como pacientes, personal médico, equipos, entre otros, lo que denota mayor relevancia en las unidades de asistencia enfocadas en atender a pacientes con enfermedades crónicas como cáncer, pacientes inmunodeprimidos como portadores del VIH, pacientes con trasplante, entre otros, o personas con complicaciones severas en su estado de salud que requieren una intervención masiva para su tratamiento como son las salas de cirugía y unidades de cuidados intensivos (UCI).
Los microrganismos más frecuentes en el desarrollo de infecciones nosocomiales son Pseudomonas spp. y Staphylococcus spp. y se estudian Pseudomonas aeruginosa. y Staphylococcus aureus como las especies más representativas de cada género, respectivamente,24,25 asociado como agentes patógenos de un alto número de casos de IN en las UCI de diversos centros de salud.
Generalmente, la aplicación no controlada de antibióticos de amplio espectro en los pacientes que se encuentran en las UCI, por el desconocimiento inmediato del lugar de la infección, el agente infeccioso y su respuesta a un grupo de antibióticos, favorecen el desarrollo de multirresistencia bacteriana y predisponen a infecciones por patógenos oportunistas.24 En el caso particular de las UCI, los estudios de este tipo permiten, de manera conjunta con la sintomatología del paciente, identificar el posible agente causante de la IN con un mayor grado de precisión, para agilizar la aplicación de un adecuado tratamiento que reduzca el tiempo de hospitalización y la aparición de la multirresistencia y aumente las probabilidades de una respuesta favorable al tratamiento médico aplicado.
Establecer medidas adecuadas y efectivas para disminuir la presencia de aerosoles bacterianos resulta una actividad compleja en el momento de ejecutar y verificar la eficiencia. No obstante, se han generado programas de seguimiento y vigilancia de las concentraciones presentes, que permite en una primera instancia inferir las condiciones de salubridad en las que se enmarca la unidad, al tiempo que se establece una menor probabilidad de ocurrencia de una IN; y en una segunda instancia, la identificación de los microrganismos más frecuentes que permitirá en conjunto con la sintomatología del paciente, disminuir el uso de antibióticos de amplio espectro.
Para el caso puntual de las UCI del Hospital Universitario "Fernando Troconis"(HUFT) se registran en los cultivos biológicos obtenidos de pacientes ingresados a las diferentes unidades, que el 39 % corresponde a Staphylococcus aereus, seguido por Staphylococcus xylosus con el 20 %, Staphylococcus lentus con 14 % y 23 % de especies sin identificar. Mientras que para el caso de los gramnegativos, para Pseudomona aeruginosa 11% y Pseudomona luteola con 8 %; dado el escaso control del sistema de vigilancia epidemiológica, no se precisa mayor información y se pone de manifiesto la necesidad de valorar la concentración de estos organismos en el aire.
En este sentido, el presente trabajo registra los resultados de valorar la concentración de aerobacterias presentes en el ambiente de las UCI del HUFT, para los géneros bacterianos Staphylococcus spp. y Pseudomonas spp. frecuentemente asociados como agentes patógenos multirresistente causantes de IN.
MÉTODOS
ÁREA DE ESTUDIO
El área de estudio de esta investigación corresponde a UCI del HUFT ubicado en el Distrito de Santa Marta, Colombia. Las instalaciones de este hospital tienen tres UCI clasificadas de acuerdo con la edad del paciente: la primera, atiende al personal joven y adulto UCI adulto (UCIA), la segunda destinada a la atención de niños UCI pediátrica (UCIP), y la última se especializa en el cuidado de neonatos UCI neonatal (UCIN).
DISEÑO DEL MUESTREO
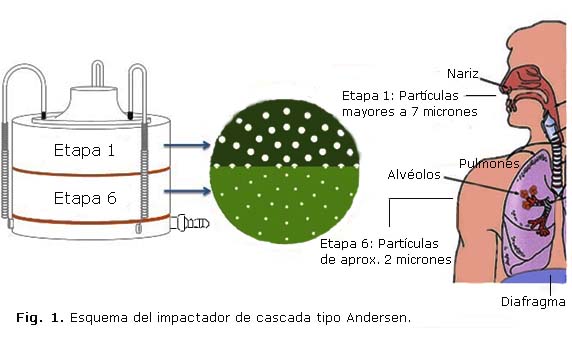
En cada UCI se localizaron dos estaciones de monitoreo (estación 1: S1 y estación 2: S2), ubicadas en el eje central de la unidad de forma equidistante del eje transversal, y en puntos aislados de la influencia de corrientes de aire del sistema de ventilación artificial de la unidad, así como de posibles fuentes o focos emisores de aerobacterias. La recolección de aerobacterias se realizó mediante un impactador de cascada integrado de dos etapas, para partículas viables Serie 10-800 y marca Tisch Environmental Inc. (EE. UU.), diseñado para simular el aparato respitarorio humano y que retiene en la primera etapa del equipo las particulas sedimentables por gravedad y que no ingresan al sistema respiratorio humano, mientras que en la etapa 6, retiene las particulas que pueden llegar a los alveolos pulmonares del humano (Fig. 1). El impactador se ubicó a una altura de 1,5 m sobre el nivel del suelo (altura proporcionada por un trípode), operado a un caudal constante de 28,3 L/min de aire, verificado mediante un manómetro de presión diferencial Capsuhelic marca Dwyer serie RM (UK) acoplado al sistema.
La toma de la muestra se efectuó durante cinco campañas de muestreo iniciadas el 15 de diciembre de 2009 hasta el 17 de abril de 2010 con una lectura cada 15 días. En cada campaña de monitoreo se realizaron tres ensayos para cada estación en las tres unidades, en las que se colocaron simultáneamente en las dos etapas del equipo cajas petri con agar manitol salado para la recolección de aerobacterias Staphylococcus spp. y agar pseudomonas con suplemento de cefatolina, ácido fusídico, cetrimide (CFC), para la recolección de aerobacterias Pseudomonas spp.; se ubicaron así seis cajas para cada estación/muestreo-medio, 12 muestras por unidad/muestreo-medio, 36 cajas/muestreo-medio. En total, durante el desarrollo de las cinco campañas de muestreos se recolectaron 360 muestras.
El tiempo de colecta se obtuvo a partir de la revisión de la literatura y ajustado con los resultados de la campaña de premuestreo, donde se realizaron ensayos a tres tiempos diferentes: 2, 5 y 10 min, lo que permitió establecer un tiempo óptimo de 5 min justificado en los criterios estadísticos de los límites de detección de la concentración (máximos y mínimos) y la precisión de los resultados en cuanto a la replicabilidad y baja dispersión de los datos.
ASEGURAMIENTO DE CALIDAD Y CONTROL DE LAS MUESTRAS
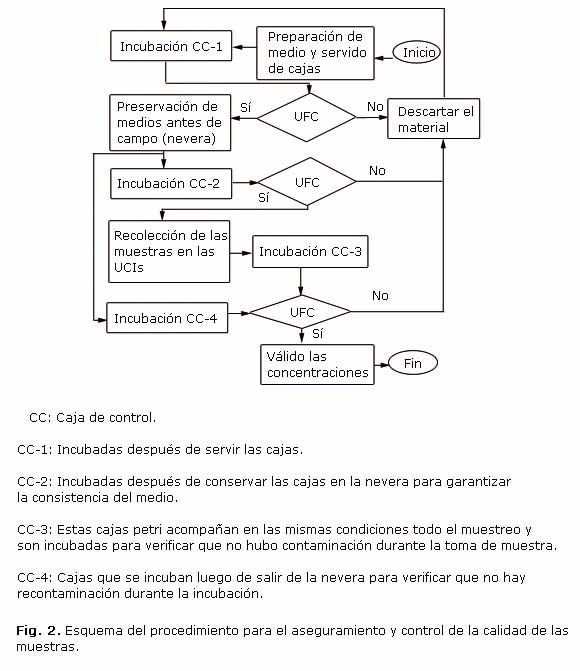
Para garantizar la calidad de las muestras y verificar que durante la realización de las campañas de muestreo no hubiera alteración por contaminación durante la manipulación del material, desde la preparación del medio hasta la exposición en campo, se elaboró un protocolo de calidad y control resumido en la figura 2.
El procedimiento consistió en preparar cajas adicionales que se incubaron al finalizar cada fase del proceso u etapa para verificar la ausencia de crecimiento que permitiera validar la esterilidad del proceso o la validez de la concentración.
Adicional a estas condiciones de calidad y control en el desarrollo de las campañas de muestreo, se empleó película plástica o vinipel para evitar que las cajas estuviesen expuesta directamente a una contaminación exterior, asimismo, una vez tomada la muestra, las cajas petri se sellaron con cinta parafinada para permitir que los microrganismos respiraran e impedir el paso de partículas u otros patógeno que contaminasen la muestra.
Por último, el equipo de muestreo se esterilizaba, entre el cambio de cada caja petri, por desinfección con alcohol y choque térmico mediante flameo, para garantizar que no quedaran microrganismos en las superficies del equipo de la colecta inmediatamente anterior.
ANÁLISIS DE LAS MUESTRAS
Posterior a la recolección de las muestras en cada estación de monitoreo, estas se incubaron a 37 ºC durante 48 h., pasado este tiempo se efectúo el recuento de aerobacterias por caja petri utilizando el contador de colonia marca LEICA (Alemania). Las cepas colectadas en los medios se verificaron mediante la aplicación de pruebas rápidas de coagulasa para Staphylococcus spp. y oxidasa para Pseudomonas spp.
Los datos obtenidos en el laboratorio se introdujeron en una hoja de cálculo EXCEL, en la que se realizaron las operaciones para determinar la concentración de aerobacterias por género estudiado en función de la unidad, estación, etapa y réplica, a partir de la siguiente expresión matemática:
UFC/volaire
Donde
UFC: unidades formadoras de colonia.
Volaire: volumen del aire bombeado expresado en m3.
El volumen de la muestra se calculó como el producto entre el caudal de bombeo de aire y el tiempo de muestreo; el registró del volumen total de aire muestreado fue de 141,5 L.
ANÁLISIS DE LOS RESULTADOS
Las concentraciones registradas en cada una de las réplicas (muestra por tripicado) se promediaron aritméticamente por etapas, (se sumaron las concentraciones reportadas en la etapa 1 y se dividieron entre 3, lo mismo para la etapa 6, y el resultado de la suma de los promedios en las etapas correspondió a la concentración por campaña de monitoreo-UCI aplicando la expresión matemática siguiente:
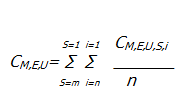
Donde
C: concentración de genero bactariano (ej: Staphulococcus spp.).
M: campaña de monitoreo (ej: campaña 1).
E: estación de muestreo en la unidad (ej: estación 1).
U: unidad de cuidado intensivo (ej: UCIA, UCIP, UCIN).
S: etapa del equipo (ej: etapa 1 o etapa 6).
i: Réplica en la M,E,U,S de un medio específico (ej: replica 1).
Para el promedio general de las concentraciones por estación y UCI, se calculó el promedio geométrico de las concentraciones por campaña.
Los resultados se analizaron en función de la concentración registrada utilizando como variables posibles de incidencia en la respuesta, la UCI y la estación. Por tanto, el análisis estadístico realizado a los datos se ajustó a un análisis de varianza jerarquizado; el anidamiento de las variables se realizó teniendo en cuenta la independencia o dependencia entre ellas, por consiguiente, el primer factor es la UCI (factor independiente entre las unidades), el segundo factor es la estación de monitoreo (factor dependiente según la unidad en la que se encuentre), el siguiente factor es la campaña de muestreo (factor independiente entre sí, puesto que las condiciones en las que se realizó cada campaña de muestreo no eran idénticas o similares entre ellas), por último, se estableció el género como el último factor de anidamiento. En la figura 3 se resume esquemáticamente el diseño experimental. A partir de esta información se estableció la influencia de cada nivel o factor de anidamiento en las concentraciones registradas.
RESULTADOS
CONCENTRACIÓN DE AEROBACTERIAS
Los resultados obtenidos demostraron que la UCI con mayor concentración promedio de aerobacterias fue la UCIA, seguida de la UCIN y de la UCIP. A partir del análisis de las concentraciones máximas encontradas por género bacteriano, se pudo inferir que la UCIA presentó la mayor concentración de Staphylococcus spp., seguida por la UCIP y de la UCIN.
Para el caso de Pseudomonas spp., nuevamente la UCIA fue la que registró los mayores valores promedio, seguida por la UCIN y la UCIP. El orden decreciente de la concentración en función del género bacteriano es consistente con el establecido de forma general, por lo que se declaró a la UCIA para ambas situaciones, como la unidad con mayor concentración de aerobacterias (tabla).
En general, la máxima concentración registrada a lo largo de las campañas de muestreo fue de 979,9 ± 31,3 UFC/m3 en UCIP-S2, mientras que el valor mínimo lo compartieron la UCIP-S2 y UCIN-S1 con una concentración de 2,3 ± 1,5 UFC/m3. Una vez analizadas las concentraciones máximas obtenidas en función del microrganismo colectado, se pudo establecer que la concentración máxima de Staphylococcus spp. la presentó la UCIA-S1 (412,25 ± 56,3 UFC/m3), mientras que para el caso de la Pseudomonas spp., la máxima concentración la registró la UCIN-S2 (979,9 ± 31,3 UFC/m3).
En general, se pudo señalar al Staphylococcus spp. como la aerobacteria predominante a lo largo de las campañas de muestreo, representado por el 73,3 % del total de muestras colectadas, demostrado en la 1ra., 2da. y 5ta. campaña, con porcentajes superiores al 90 %; analizadas las concentraciones obtenidas por estación de muestreo en cada unidad, se observó que para el caso de la UCIA y UCIN la S2 presentó mayor concentración con 53 % del total de aerobacterias recolectadas mientras que para el caso de la UCIP la mayor concentración la presentó la S1 con un aproximado del 60 % del total de las muestras colectadas en esta unidad.
DISTRIBUCIÓN PORCENTUAL DE AEROBACTERIAS SEGÙN SU DIÁMETRO AERODINÁMICO
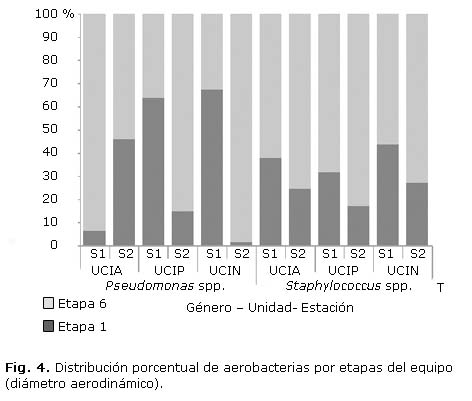
En forma global se observó un mayor porcentaje de aerosoles bacterianos de diámetro aerodinámico respirable (68,5 %), mientras que las aerobacterias sedimentables alcanzaron el 31,5 %. De igual forma, los datos arrojaron un predominio de aerobacterias respirables para el género de Staphylococcus spp. (71,5 %), por lo que superó el porcentaje registrado para el género Pseudomonas spp. (64,6 %). No obstante, los porcentajes encontrados en las dos etapas del equipo para el género Staphylococcus spp. permanecieron menos variables a lo largo de las estaciones de cada unidad, mientras que para las Pseudomonas spp. se observó una fluctuación mayor en las proporciones recolectadas en las etapas del equipo con variaciones entre las UCIs e inclusive entre las estaciones (figura 4).
Si se analiza ahora la distribución del diámetro aerodinámico en función de la unidad, la UCIA delimitó un predominio de aerobacterias respirables correspondientes a la etapa 6 del equipo (70,2 %), mientras que para el caso de UCIP y UCIN la discrepancia entre los diámetros fue menor con un promedio de 66,11% de aerobacterias respirable (etapa 6 del equipo) en la UCIN y 62,33 % de aerobacterias respirables en la UCIP (etapa 6 del equipo).
ANÁLISIS ESTADÍSTICO
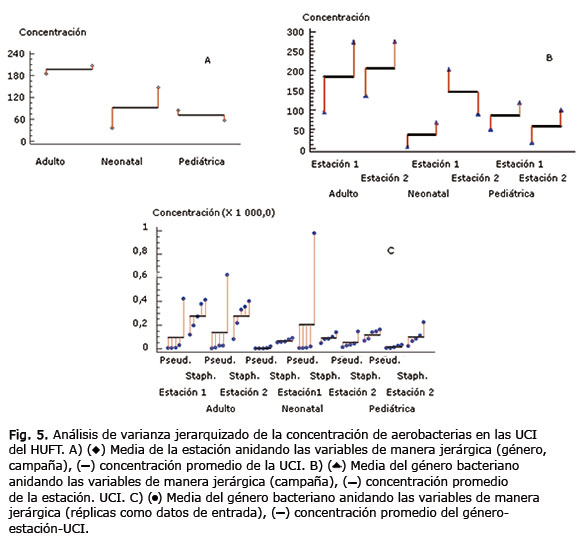
Los resultados del análisis estadístico manifestaron una influencia mínima de la UCI en la varianza de las concentraciones registradas, no obstante, su porcentaje de influencia no fue mayor de 10 % con similitud entre las UCIP y la UCIN, por lo que conformaron un grupo homogéneo (figura 5A). Lo anterior se ratificó mediante la comparación del valor de p obtenido para las UCI (0,0489) con el valor de p crítico (0,05), que reveló una diferencia significativa entre el grupo homogéneo de la UCIP y la UCIN con la UCIA para un nivel de confianza de 95 %. Por otro lado, la influencia que tuvo la estación de monitoreo en la varianza de la concentración fue nula o escasa, demostrado en la figura 5B; pese a esto el valor de p (0,4192) obtenido de los datos superó el valor de p crítico, por lo que se ratifica que no hubo una influencia significativa de las estaciones en la varianza de la concentración de las UCI con una confianza del 95 %. No obstante, si se analiza de manera particular el caso de la UCIN se puede comprobar la posible existencia de una diferencia significativa entre las estaciones de monitoreo.
Por último, si se analiza la influencia de los géneros bacterianos estudiados sobre la varianza de la concentración registrada (figura 5C), el valor de p (0,1085) ratificó la ausencia de efecto significativo con un nivel de confianza del 95 %. No obstante, si se analiza el porcentaje en peso de la influencia que ejerció el género bacteriano (3,4 %), se puede afirmar que tuvo una mayor influencia sobre la concentración que la que ejerció la estación de muestreo en la UCI; esto se puede atribuir al hecho de que los géneros son linealmente independientes, mientras que las estaciones no lo son (Fig. 5).
DISCUSIÓN
CONCENTRACIÓN DE AEROBACTERIAS
Los estudios detallados de aerobacterias en ambientes hospitalarios son escasos en la literatura, aunque entre los que se han realizado se puede mencionar el efectuado por Jaffal y otros que publican concentraciones superiores a 7 000 UFC/m3 de aire en salas de hospital en Emiratos Árabes Unidos.23 Por otro lado, se encuentra concentraciones de aerobacterias en hospitales con valores entre 10 y 1 000 UFC/m3,20,21 que registran los valores promedios de las tres unidades entre el límite inferior y medio del establecido por los investigadores y encuentran las concentraciones promedios de Pseudomonas cercanas al límite inferior mientras la de Staphylococcus spp. se desplaza al valor central del rango.
Obbard y Fang establecen que la concentración de aerobacterias en las salas de los hospitales fluctúa entre los 42 y 325 UFC/m3,22 valores con los que coinciden los encontrados en este estudio, no obstante, se observaron valores máximos que superaron ampliamente este rango; para el caso de los Staphylococcus spp. los valores tendieron al límite superior exceptuando la UCIN, que se acercó al límite inferior; entretanto, para los promedios de Pseudomonas spp. la UCIA registró valores ubicados en el eje central de rango, mientras que los de la UCIN y UCIP se localizaron cercanos al extremo inferior. En general, las concentraciones encontradas en este estudio son cercanas a las obtenidas por diferentes investigadores.26 Para el caso del referente europeo las concentraciones de bacterias en el aire se registran entre las 10 y 100 UFC/m3, datos similares a los presentados para un hospital en Illinois, EE. UU.20
Puntualizando las comparaciones de la concentración de aerobacterias en UCI, Li y Hou publican una máxima concentración de 156 UFC/m3 y una media aproximada de 82,16 UFC/m3 para la UCIP,20 en general, los promedios de Staphylococcus spp. superan los valores establecidos, mientras que los valores medios de Pseudomonas spp. se ubican por debajo de ese nivel, situación que se repite con los valores pico, puesto que el valor máximo de Staphylococcus spp. para la UCIP supera el valor establecido, entretanto los valor de Pseudomonas spp. se ajustan al nivel.
De igual forma, estos autores encuentran concentraciones de aerobacterias en una UCIN en un máximo de 129,0 UFC/m3 y una media de 53,2 UFC/m3,13 y notifican que los valores promedio de Staphylococcus spp. al igual que en la UCIP superan el valor referente, no obstante, la diferencia entre este valor referente y el obtenido no es tan amplia como la encontrada en la UCIP. Los valores medios registrados en este estudio para la concentración de Pseudomonas spp. se ajustaron, al igual que en el caso de la UCIP en la S1 de esta unidad, por debajo de los valores empleados como referentes, mientras que para el caso de la S2 superaron en una amplia diferencia el valor referente establecido. Para el caso puntual del valor máximo notificado para ambos géneros estudiados, se sobrepasaron las concentraciones establecidas y se encontró una mayor diferencia para el caso de Pseudomonas spp.
Ki Youn y otros publican la presencia de 116 UFC/m3 de Staphylococcus spp., 27 UFC/m3 de Micrococcus spp., 15 UFC/m3 de Corynebacterium spp., 18 UFC/m3 de Bacillus spp., 3 UFC/m3 de Enterococcus spp., 3 UFC/m3 de Streptococcus spp., 2 UFC/m3 de Enterobacteriaceae spp., 2 UFC/m3 de E-coli spp., y 1 UFC/m3 de Klebsiella spp., en el estudio realizado en la unidad de cuidado intensivo.19
Una de las primeras directrices con respecto a la concentración de aerobacterias se propuso en 1946, sugiriendo no más de 0,1-20 UFC/pies3 que deberían crecer en 24 h en los quirófanos.26 The American Conference of Governmental Industrial Hygienists (ACGIH, sigla en inglés) sugiere normas provisionales de exposición basada en las concentraciones de bacterias y hongos cultivables que recomiendan menos de 100 UFC/m3 como concentración aceptable,27 pero estas directrices fueron derogadas desde 1999.28
Sin embargo, la mayoría de estas directrices se basan en la concentración de aerosoles biológicos, sin tener en cuenta los efectos sobre la salud humana.29 Además, la mayoría de los estudios han propuesto umbrales de concentración de aerosoles biológicos basados en la recolección de microrganismos sobre cultivos enriquecidos con agar.30,31 No obstante, organizaciones como la OTAN y la OMS coinciden en que hay una necesidad de desarrollar métodos más precisos y robustos para la caracterización de aerosoles biológicos32,33 y fundamentan que muchas enfermedades asociadas a los aerosoles biológicos no dependen de la infección para inducir adversos efectos sobre la salud, es importante cuantificar todas las células microbianas que están suspendidas en el aire, así como diferenciar entre aquellas que son metabólicamente activas, las que son cultivables y las que no son viables.34
DISTRIBUCIÓN PORCENTUAL DE AEROBACTERIAS SEGÙN SU DIÁMETRO AERODINÁMICO
Los resultados analizados en función de la distribución porcentual de aerobacterias en el equipo (respirables - etapa 6 y sedimentables etapa 1), fueron igualmente consistentes con lo planteado por Li y Hou.20 Las concentraciones encontradas se ubicaron en el límite superior e incluso superaron el rango publicado por los autores (40 al 80 %); esta situación incrementa la preocupación por la concentración relativamente baja de aerobacterias en las unidades, lo que acentúa el riesgo de infección por inhalación por la alta predominancia de particulas respirables.
De igual, forma los resultados en cuanto a la distribución de la concentración en las etapas del impactador en función de los géneros, permitió inferir que la baja concentración de aerosoles Pseudomonas spp. registrada se puede deber al hecho de que muchas de estas son de diámetros aerodinámicos sedimentables, lo que genera un tiempo de vida media en el aire mucho inferior al que presentan las aerobacterias de diámetros aerodinámicos de nivel respirables (Fig. 4).
Ki Youn y otros,19 registran que las aerobacterias respirables son detectadas en el 50 % de la concentración total en comparación con las otras áreas del hospital en que son monitoreadas, como es el caso del lobby principal, sala de cirugía y laboratorio biomédico.
El porcentaje respirable del total de las aerobacterias identificadas en la UCI,19 se distribuye de la siguiente manera: 69,82 % de Staphylococcus spp., 74,00 % de Micrococcus spp., 73,33 % de Corynebacterium spp., 72,22 % de Bacillus spp., 100 % de Enterococcus spp., 100 % de Streptococcus spp., 100 % de Enterobacteriaceae spp., 100 % de E-coli spp., y 100 % UFC/m3 de Klebsiella spp.19
Finalmente, la concentración de aerobacterias encontrada supera los concentraciones presentadas por otros estudios aerobiológicos en hospitales; las mayores concentraciones promedio se registran en la UCIA, seguido de la UCIN y UCIP que presentan valores muy similares; según el género, los Staphylococcus spp. representan el mayor porcentaje del total colectado, situación que se acentúa si se tiene en cuenta que un alto porcentaje de la concentración de aerobacterias corresponde a aerosoles respirables que aumentan los tiempo de residencia en el aire de los microrganismos, traducido en una mayor probabilidad de contraer infecciones nosocomiales por bacterias presentes en las unidades.
Agradecimientos
Los autores expresan sus agradecimientos a la Fundación MAPFRE y a Universidad del Magdalena por la financiación de este proyecto, al ingeniero Tomás Bolaño Ortiz por su gestión administrativa, al auxiliar de investigación Antonio Álvarez Mancilla por su colaboración y, en especial a la Ingeniera Sandra Rocío Balaguera Rincones por su esfuerzo permanente y dedicación.
REFERENCIAS BIBLIOGRÁFICAS
1. El-Gilanya AH, Abdel-Wahab F, Ghoneim M, M. Khashab, . Abdel-Hady D. Nosocomial infection surveillance in an Egyptian neonatal intensive care unit. J Hospital Infection. 2013;83:196-9.
2. Laupland KB, Niven DJ, Fick GH, Kirkpatrick AW, Grant V. Cost and outcomes of nosocomial bloodstream infections complicating major traumatic injury. J Hospital Infection. 2010;76:296-9.
3. Sánchez-Velázquez LD, Ponce de León Rosales S, Rangel Frausto MS. The Burden of Nosocomial Infection in the Intensive Care Unit: Effects on Organ Failure, Mortality and Costs. A Nested Case-Control Study. Arch Medical Res. 2006;37:3705.
4. Cosgrove SE, Keith SK, Eliopoulous GM, Carmeli Y. Health and Economic Outcomes of the Emergence of Third-Generation Cephalosporin Resistance in Enterobacteral Species. Arch Intern Med. 2002;162:185-90.
5. Guillet M, Jean-Ralph Z, Marc-Olivier T, Grandin L, Carbonnelle E, Join-Lambert O, et al. Horizontal transmission of Streptococcus pneumoniae in the surgical ward: A rare source of nosocomial wound infection. Amer J Infection Control. 2012;40-1:71-2.
6. Chipchase L, Schabrun S. Healthcare equipment as a source of nosocomial infection: a systematic review. J Hospital Infection. 2006;63:239-45.
7. Wagenlehner FME, Loibl E, Vogel H, Naber KG. Incidence of nosocomial urinary tract infections on a surgical intensive care unit and implications for management. Internat J Antimicrobial Agents. 2006;28S:S86-S90.
8. Chaberny IF, Ruseva E, Sohr D, Buchholz S, Ganser A, Mattner F, Gastmeier P. Surveillance with successful reduction of central line-associated bloodstream infections among neutropenic patients with hematologic or oncologic malignancies. Ann Hematol. 2009;88:90712.
9. Agarwal R, Gupta D, Ray P, Aggarwal AN, Jindal SK. Epidemiology, risk factors and outcome of nosocomial infections in a Respiratory Intensive Care Unit in North India. J Infection. 2006;53:98-105.
10. Lopez-Ferrera A, Matamoros-Aguijar M. Nosocomial infection at the pediatric intensive care unit. Relationship between risk factors and incidence. Rev Med Post Unah. 2002;7(3):273-8.
11. Ramírez Zaldívar M, Fernández Chelala B, Cruz Portelles A, Jardines González E, Bermúdez Aguilera Y. Comportamiento de las infecciones nosocomiales en Unidad de Cuidados Intensivos en un quinquenio (2005-2009). Medisur. 2011;9(5):40-6.
12. Rebolledo RH, Ballestero DR, Gutierrez JLB, Aguilera CT, Zubillaga SG, Garcia MB. Infeccion nosocomial y del sitio quirúrgico en un hospital de tercer nivel (2002-2005). Actas Urológicas Españolas. 2006;30(9):905-12.
13. Doig CJ, Laupland KV, Zygun DA, Davies HD, Church DL, Louie TJ. Incidence and Risk Factors for Acquiring Nosocomial Urinary Tract Infection in the Critically Ill. J Critical Care. 2002;17(1):50-7.
14. López-Pueyo MJ, Barcenilla-Gaite F, Amaya-Villar R, Garnacho-Montero J. Multirresistencia antibiótica en unidades de críticos. Med Intensiva. 2011;35(1):41-53.
15. Stefani S, Campanile F, Bongiorno D, Borbone S. Hospital-associated methicillin-resistant Staphylococcus aureus (HA-MRSA) in Italy. Ann Clin Microbiol Antimicrobials. 2009;8(22):1-10.
16. Gibbs S, Gandara A, Mota LC, Flores C, Perez HR, Green CF. Isolation of Staphylococcus aureus and antibiotic-resistant Staphylococcus aureus from residential indoor bioaerosols. Envirom Health Perspec. 2006;114(12):1859-64.
17. Sostarich AM, Zolldann D, Haefner H, Luetticken R, Schulze-Roebecke R, Lemmen SW. Impact of Multiresistance of Gram-negative Bacteria in Bloodstream Infection on Mortality Rates and Length of Stay. Clin Epidemiol Study. 2006;36:315.
18. Knauer A, Fladerer P, Strempfl C, Krause R, Wenisch C. Effect of hospitalization and antimicrobial therapy on antimicrobial resistance of colonizing Staphylococcus epidermidis. Wien Klin Wochenschr. 2004;116(14):48994.
19. Ki Youn K, Yoon Shin K, Daekeun K. Distribution Characteristics of Airborne Bacteria and Fungi in the General Hospitals of Korea. Industrial Health. 2010;48:236-43.
20. Li CS, Hou PA. Bioaerosol characteristics in hospital clean rooms. Science Total Environm. 2005;305(1-3):16976.
21. Pastuszka JS, Marchwiñska-Wyrwa E, Wlaz A. Bacterial Aerosol in Silesian Hospitals: Preliminary Results. Polish J Environm Studies. 2005;14(6):883-90.
22. Obbard JP, Fang LS. Airborne Concentrations of Bacteria in a Hospital Environment in Singapore. Water, Air, Soil Poll. 2003;144(1-4):33341.
23. Jaffal AA, Nsanze H, Bener A, Ameen AS, Banat IM, Mogheth AA. Hospital airborne microbial pollution in a desert country. Environm Internat. 1997;23:16772.
24. Wilson MS, Otth CL, Medina GS, Otth LR, Fernández HJ, Arce M, et al. Genotipos de Staphylococcus aureus con fenotipo meticilino resistente, aislados de pacientes del Hospital Base de Valdivia. Rev Méd Chile. 2007;135:596-601.
25. Lebeque YP, Morris HJQ, Cálas NV. Infecciones nosocominales: incidencia de Pseudomonas aeruginosa. Rev Cubana Med. 2006 [citado 14 May 2013];45(1). Disponible en: http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S0034 -75232006000100005&lng=es&nrm=iso
26. Topley WWC. The bacteriology of air. In: Wilson GS, Miles AA editors. Principles of bacteriology and immunity. Baltimore: The Williams and Wilkins Company, Topley and Wilson's; 1955. p. 2270-83.
27. American Conference of Industrial Hygienists. Guidelines for the assessment of bioaerosols in the indoor environment. American Conference of Governmental Industrial Hygienists Bioaerosol Committee. Cincinnati, OH: ACGIH; 1989.
28. Hernandez MT, Fabian MP, Miller SL, Reponen T. Ambient bioaerosol índices for indoor air quality assessments of flood reclamation. Aerosol Science. 2005;36:763-83.
29. Rao C, Burge HA, Chang JCS. Review of quantitative standards and guidelines for fungi in indoor air. J Air Waste Manag Ass. 1996;46:899-908.
30. Robertson LD. Monitoring viable fungal and bacterial bioaerosol concentrations to identify acceptable levels for common indoor environments. Indoor Built Environm. 1997;1997(6):295-300.
31. Reponen T, Nevalainen A, Jantunen M, Pellikka M, Kalliokoski P. Normal range criteria for indoor air bacteria and fungal spores in subarctic climate. Indoor Air. 1992;2(1):26-31.
32. Maroni M, Axelrad R, Bacaloni A. NATO´s efforts to set indoor air quality guidelines and standards. American Industrial Hygiene Association J. 1995;56:499-508.
33. World Health Organization. Indoor air quality: biological contaminants: report on a WHO meeting, Rautavaara, 29 August2 September 1988. Copenhagen: WHO, Regional Office for Europe; 1988.
34. Hernandez M, Miller SL, Landfear DW, Macher JM. A combined fluorochrome method for quantization of metabolically active and inactive airborne bacteria. Aerosol Science Technol. 1999;30(6):145-60.
Recibido: 13 de julio de 2013.
Aprobado: 11 de febrero de 2014.
Andrés Vélez Pereira. Universidad del Magdalena y Fundación MAPFRE. Santa Marta, Colombia.
Dirección electrónica: ing.andresvelez@gmail.com