Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista de Protección Vegetal
versión On-line ISSN 2224-4697
Rev. Protección Veg. v.22 n.2 La Habana Mayo-ago. 2007
COMUNICACIÓN CORTA
ESTABILIDAD DE LA CEPA IMI SD 187 de Pochonia chlamydosporia var. catenulata EN MEDIO SÓLIDO
STABILITY OF IMI SD 187 Pochonia chlamydosporia var. catenulata STRAIN ON SOLID MEDIUM
Belkis Peteira*, Ivania Esteves**, Nivian Montes de Oca*** y L. Hidalgo-Díaz****
*Grupo de Fitopatología, ***Dirección Calidad, ****Grupo Plagas Agrícolas, División de Protección de Plantas, Centro Nacional de Sanidad Agropecuaria (CENSA), Apartado 10, San José de las Lajas, La Habana, Cuba. Correo electrónico: bpeteira@censa.edu.cu;** Nematode Interactions Unit, Rothamsted Research, Harpenden, Herts AL5 2JQ, UK.
RESUMEN
Un aspecto importante en el desarrollo de un microorganismo como agente potencial de control biológico es disponer de un método de conservación adecuado para la cepa seleccionada, sin afectación de sus características. Entre los métodos más usados se encuentra los subcultivos seriados. El objetivo de este trabajo fue evaluar el efecto de esta práctica sobre la cepa IMI SD 187 del hongo nematofago Pochonia chlamydosporia var. catenulata, a través del comportamiento de las enzimas proteasas. El estudio se desarrolló en medio sólido, a través de la medición del halo de degradación de la gelatina adicionada al medio, el crecimiento del hongo y el indicador Actividad Proteasa (AP), a diferentes días post inoculación. Se demostró que este método de conservación de cepas no afectó la producción de las proteasas, lo cual reafirma la robustez de la cepa analizada.
Palabras clave: proteasas; medio sólido; Pochonia chlamydosporia.
ABSTRACT
A safe conservation method not affecting the strain characteristics is essential for developing any microorganism as a potential biological agent. The serial subculture is one of the most used methods. The aim of this work was to find out the effect of this practice on protease production by the strain IMI SD 187 of the nematophagous fungus Pochonia chlamydosporia var. catenulata. The study was carried out on solid medium by measuring the gelatine degradation halo, the fungal growth and the PA indicator (protease activity) at different days after inoculation. Adverse effects of serial subculture on protease production by the strain studied were not observed confirming the robustness of this strain.
Key words: proteases; solid medium; Pochonia chlamydosporia.
Disponer de un método adecuado para la conservación de cepas promisorias es uno de los aspectos más importantes para el desarrollo de un candidato a agente de control biológico (ACB). En la literatura se informan diferentes variantes como los subcultivos seriados, la liofilización y el empleo de aceites en el medio de cultivo (10,11,13).
El subcultivo es un método sencillo y utilizado tradicionalmente para la conservación de microorga-nismos. Sin embargo, el empleo de esta alternativa para la conservación pudiera traer como resultado la pérdida de ciertas características originales en la cepa, cambios morfológicos, alteraciones en los componentes de la pared celular y pérdida o atenuación de la virulencia (2). Estos efectos indeseados se incrementan con el número de subcultivos (6).
Se han informado cepas de hongos que no han experimentado cambios en sucesivos subcultivos (3), por lo que parece ser que los estudios de estabilidad deben realizarse de manera específica para cada ACB e, incluso, la cepa en cuestión, ya que se conoce que en algunos casos, ciertos medios de cultivo pueden proveerlo de una óptima patogenicidad y virulencia, influir en la germinación y en el crecimiento micelial (5).
Para la selección de un método de conservación adecuado se precisa de herramientas que permitan realizar un monitoreo periódico de la estabilidad genética, requerimiento imprescindible para el éxito en el desarrollo de un producto comercial y para el registro del ACB. Tradicionalmente este monitoreo se basa en el estudio en el tiempo de la morfología; aspectos de la patogenicidad y efectividad de la cepa.
El análisis del comportamiento de las enzimas involucradas en el proceso infeccioso y el uso de marcadores moleculares han sido empleados para la selección de cepas de microorganismos con un efecto beneficioso para el hombre, pero en la actualidad constituyen herramientas importantes a tener en cuenta para el chequeo no solo de la estabilidad genética, sino también de la pureza del inóculo a emplear en la producción masiva del ACB.
El objetivo de este trabajo fue evaluar el efecto de subcultivos seriados en Pochonia chlamydosporia var. catenulata, cepa IMI SD 187, a través del comportamiento de enzimas hidrolíticas relacionadas con el proceso de infección, especialmente de las proteasas, secretadas en medio sólido suplementado con gelatina.
Los subcultivos de la cepa IMI 2 (2 subcultivos), IMI 40 (40 subcultivos), IMI 60 (60 subcultivos) y IMI 100 (100 subcultivos) se realizaron sobre medio Agar harina de maíz, en el Centro Nacional de Sanidad Agropecuaria (CENSA), según la metodología descrita por Montes de Oca et al. (7), los cuales se mantuvieron a 28ºC, en oscuridad y subcultivados en medio fresco, antes de ser empleados.
Para la evaluación de la producción de proteasas los diferentes subcultivos del hongo fueron sembrados en medio basal sólido constituido por: 0.03% NaCl; 0.03% MgSO4 x 7 H2O; 0.03% K2HPO4; 0.02% de extracto de levadura (14), suplementado con gelatina al 0.2% y con azul de tripano al 0.03%. El medio se solidificó con agar, al 15%. El colorante fue preparado en forma de solución acuosa a concentración mayor, la cual fue esterilizada con filtro milliporo 0.2um, antes de ser adicionada al medio, previamente esterilizado, quedando a una concentración de 0.03%. De igual forma se procedió con la gelatina. Las placas Petri de 9cm de diámetro, con medio sólido, se inocularon con un disco de 5mm de diámetro extraídos de la periferia de la colonia pura de P. chlamydosporia var. catenulata e incubadas a la oscuridad a 28ºC. En cada tratamiento se realizaron tres réplicas.
Como control se incluyó el medio basal con y sin gelatina. Las observaciones se realizaron a los 3, 5 y 7 días después de la inoculación y se evaluó el diámetro de la colonia (dc) y del halo de degradación (dhg), para con ellos calcular el indicador AP (Actividad Proteasa) (8), donde:
AP = dhg / dc.
El diseño del experimento fue completamente aleatorizado. Todos los datos fueron comparados a través de un Análisis de Varianza Simple y la Prueba de Rangos Múltiples de Duncan, utilizando el programa SAS (12).
En el parámetro diámetro de la colonia al tercer día de la evaluación, no se encontró diferencias significativas entre los subcultivos estudiados (Fig. 1). En las evaluaciones correspondientes al quinto y séptimo días se observó el mismo comportamiento.
Con relación a la formación del halo de degradación de la gelatina a los tres días se observaron diferencias significativas del segundo subcultivo (IMI 2), respecto a los dos siguientes, pero no respecto al subcultivo número 100 (Fig. 2). Al parecer pudiera haber un pequeño efecto de detrimento que posteriormente es superado en el subcultivo mayor. Esta tendencia se manifestó de igual forma para los días quinto y séptimo. Este efecto fue informado anteriormente para la cepa en estudio, argumentándose que pudiera deberse a una capacidad mayor de absorción de nutrientes del subcultivo menor y la necesidad de un período de adaptación a las nuevas condiciones de cultivo del subcultivo mayor (9).
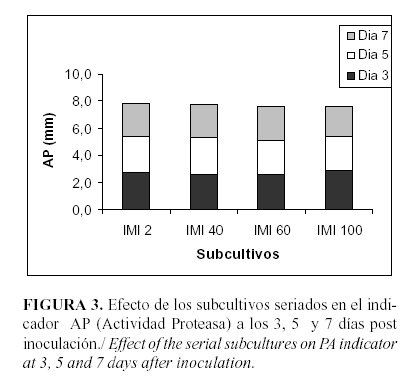
El análisis de varianza para los resultados obtenidos con el indicador AP no mostró diferencias estadísticamente significativas para ninguno de los días analizados, ni para los subcultivos estudiados (Fig. 3).
Existen referencias sobre la conservación de la virulencia para cepas de Paecilomyces farinosus después de 15 subcultivos seriados (4) y de hasta 98 pases sucesivos para Verticillium lecanii (3). Brownbridge et al. (1) ensayaron en Beauveria bassiana hasta 15 subcultivos con idénticos resultados. Recientemente, Vandenberg y Cantone (15) informaron, para una cepa de Paecilomyces fumosoroseus, que 30 transferencias sucesivas no produjeron alteraciones en su patogenicidad. Por otra parte, existen informes sobre la pérdida de patogenicidad en algunas cepas de B. bassiana y Metarhizium anisopliae (1,10,5).
Los resultados aparentemente contradictorios en este tema han ayudado para evidenciar la considerable variación inter e intra específica que existe respecto a los subcultivos sucesivos y su efecto sobre la estabilidad genética y la virulencia. Según Brownbridge et al. (1), la variabilidad en los resultados de diferentes autores pudiera deberse a las diferentes metodologías empleadas en los estudios y al uso de medios enriquecidos, que pueden conllevar a la atenuación por producir mutaciones al azar.
En el caso de Pochonia y especialmente para la cepa IMI SD 187, Montes de Oca et al. (7) realizaron estudios preliminares en algunos indicadores importantes para el hongo como ACB, en los mismos subcultivos analizados en este experimento y de igual forma no encontraron atenuación en la virulencia al comparar el subcultivo 2 con los correspondientes a los 40, 60, 80 y 100 pases sucesivos. En esta ocasión, este grupo empleó el ensayo API ZYM y llegó a la conclusión de que los niveles de producción de enzimas analizados fueron similares para los subcultivos antes mencionados. Posteriormente, Peteira et al. (9), utilizando los mismos materiales, dirigieron la atención hacia las enzimas relacionadas con el proceso infeccioso de Pochonia chlamydosporia sobre huevos de Meloidogyne incognita (Proteínas totales, proteasas, quitinasas, lipasas y esterasas) en medio líquido, obteniendo resultados similares.
El empleo del medio sólido es más simple y menos costoso que los ensayos de determinación de actividad enzimática y de API ZYM, efectuados para Pochonia con anterioridad. En este caso no se recomienda analizar solamente un día de la dinámica, teniendo en cuenta que el objetivo fue monitorear las diferencias entre los subcultivos. Los presentes resultados concuerdan con los planteamientos de Park et al. (8) en cuanto a la necesidad de realizar, al menos, tres evaluaciones en el tiempo, del parámetro analizado.
Esta es una técnica sencilla y económica que puede ser aplicada como rutina para apoyar el control de la calidad durante el proceso de producción, como una primera aproximación para la solución del problema (si las enzimas proteasas son importantes en el ACB que se esté estudiando). Su aplicación está de acuerdo con los bajos insumos conque, por lo general, cuentan los países en vías de desarrollo enfrascados en la producción de un ACB. Como una segunda alternativa se pudiera emplear el método de las tiras de API ZYM y por último la determinación de actividades específicas, método más seguro y exacto, pero a la vez el más costoso de los tres analizados.
En este estudio, se constató, que la práctica de los subcultivos seriados como método de conservación no afecta la expresión de las enzimas proteasas relacionadas con el proceso de infección hasta el subcultivo 100. Los resultados obtenidos muestran que la cepa IMI SD 187 es lo suficientemente robusta y estable como para permitir un número significativo de transferencias sucesivas sobre medio artificial empobrecido, lo cual tiene un impacto directo en el proceso de producción y en la conservación de la cepa original, debido a que el método de subcultivos seriados es uno de los más económicos y accesibles a todo tipo de laboratorio que se dedique a la producción masiva del ACB.
REFERENCIAS
1. Brownbridge M, Costa S, Jaronski ST. Effects of in vitro passage of Beauveria bassiana on virulence to Bemisia argentifolii. J Invert Pathol. 2001;77:280-283.
2. Ferreti R de L, Moraes CB. Viability, morphological characteristics and dimorphic ability of fungi preserved by different methods. Rev Iberoam Micol. 2001;18:191-196.
3. Hall RA. Effect of repeated sub culturing on agar and passing through insect host on pathogenesis, morphology and growth rate of Verticillium lecanii. J Invert Pathol. 1980;36:216-222.
4. Hayden TP, Bidochka MJ, Khachatourians GG. Entomopathogenicity of several fungi toward the English grain aphid (Homoptera: Aphididae) and enhancement of virulence with host passage of Paecilomyces farinosus. J Econ Entomol. 1992;85:58-64.
5. Ibrahim L, Butt TM, Jenkinson P. Effect of artificial culture media on germination, growth, virulence and surface properties of the entomopathogenic hyphomycete Metarhizium anisopliae. Mycol Res. 2002;106(6):705-715.
6. Jenkins NE, Grzywacz D. Quality control of fungal and viral biocontrol agents-assurance of product performance. Biocontrol Sci and Technol. 2000;10:753-777.
7. Montes de Oca Nivian, Arévalo Jersys, Acosta Nerdys, Peteira Belkis, Hidalgo-Díaz L, Kerry B. Estabilidad de la cepa IMI SD 187 de Pochonia chlamydosporia var. catenulata (Kamyscho ex Barron y Onions) Zare y W. Gams. Parte I. Indicadores morfológicos, productivos y patogénicos. Rev Protección Veg. 2005;20(2):93-101.
8. Park JO, Hargreaves JR, McConville EJ, Stirling GR, Ghisalberti EL, Sivasithamparam K. Production of leucinostatins and nematicidal activity of Australian isolates of Paecilomyces lilacinus (Thom) Samson. Letters in Applied Microbiology. 2004;(38):271-276.
9. Peteira Belkis, Estevez Ivania, Atkins S, Hidalgo-Díaz L, Montes de Oca Nivian, Kerry B. Estabilidad de la cepa IMI SD 187 de Pochonia chlamydosporia var. catenulata (Kamyscho ex Barron y Onions) Zare y W. Gams. Parte II. Indicadores bioquímicos. Rev Protección Veg. 2005,20(2):102-109.
10.Quesada - Moraga E, Vey A. Intra-specific variation in virulence and in vitro production of macromolecular toxins active against locust among Beauveria bassiana strains and effects of in vivo and in vitro passage on these factors. Biocontrol Sci and Technol. 2003;13(3):323-340.
11.Ryan MJ, Jeffries P, Bridge PD, Smith D. Developing cryopreservation protocols to secure fungal gene function. Cryoletters. 2001;22(2):115-124.
12.SAS. Statistical Analysis System, Release 8.02. SAS Institute Inc, Cary, North Caroline, USA; 2001.
13.Singh SK, Upadhyay RC, Kamal S, Tiwari M. Mushroom cryopreservation and its effect on survival, yield and genetic stability. Cryoletters. 2004; 25(1):23-32.
14.Tikhonov VE, Lopez-Llorca L V, Salinas J, Jansson HB. Purification and characterization of chitinases from the nematophagous fungi Verticillium chlamydosporium and V. suchlasporium. Fungal Gen and Biol. 2002;35:67-78.
15.Vandenberg JD, Cantone FA. Effect of serial transfer of three strains of Paecilomyces fumosoroseus on growth in vitro, virulence and host specificity. J Invert Pathol. 2004;85:40-45.
(Recibido 22-9-2006; Aceptado 20-10-2006)